Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Stress léger chronique imprévisible chez les rats basé sur la médecine mongole
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit un modèle de stress léger chronique imprévisible (CUMS) pour la dépression basé sur la théorie médicale mongole, ainsi que des méthodes de validation des tests comportementaux.
Résumé
La dépression est un trouble affectif répandu et constitue l’une des principales causes d’invalidité dans le monde. Les limites des interventions pharmacologiques actuelles contribuent au lourd fardeau sanitaire attribué à cette maladie. Il est urgent de mieux comprendre les mécanismes sous-jacents de la dépression, ce qui rend les modèles précliniques à potentiel translationnel très précieux. La médecine mongole, un sous-ensemble de la médecine traditionnelle, postule que l’apparition de la maladie est étroitement liée à l’équilibre du vent, de la bile et des mucosités. Dans cette étude, nous introduisons un protocole pour la méthode du stress léger chronique imprévisible (CUMS) chez le rat. Dans ce cadre, les rats sont soumis à une série de facteurs de stress fluctuants et légers pour induire un phénotype semblable à celui de la dépression, imitant la pathogenèse de la dépression humaine. Les tests comportementaux utilisés dans ce protocole comprennent le test de préférence de saccharose (SPT), indiquant l’anhédonie, un symptôme central de la dépression ; le test en champ ouvert (OFT), qui mesure les niveaux d’anxiété ; et le test du labyrinthe aquatique de Morris (MWM), qui évalue la mémoire spatiale et les capacités d’apprentissage. La méthode CUMS démontre la capacité d’induire une anhédonie et de provoquer des déficits comportementaux à long terme. De plus, ce protocole est plus aligné sur la théorie médicale mongole que d’autres modèles animaux conçus pour susciter un comportement semblable à la dépression. Le développement de ce modèle animal et les recherches ultérieures fournissent une base solide pour de futures études innovantes dans le domaine de la médecine mongole.
Introduction
Le trouble dépressif majeur (TDM) est une maladie mentale répandue, se classant au troisième rang des causes d’invalidité dans le monde et affectant plus de 300 millions de personnes1,2,3. On estime notamment qu’au moins la moitié des personnes touchées ne reçoivent pas de traitement adéquat4. Compte tenu de cette lacune, les modèles animaux constituent un outil crucial pour étudier l’étiologie de la dépression. À ce jour, il existe plus de 20 modèles animaux différents pour la dépression5. Parmi ceux-ci, le modèle de stress léger imprévisible chronique (CUMS), affiné par Paul Winer en 1987, est le plus fréquemment utilisé6. Le modèle CUMS part du principe que l’exposition des rongeurs à un large éventail de facteurs de stress socio-environnementaux entraîne des symptômes tels que l’anxiété, la tension et la dépression. La méthodologie consiste à exposer les animaux à divers facteurs de stress légers pendant plusieurs semaines, aboutissant à une série de modifications comportementales, notamment l’anhédonie et les comportements dépressifs7,8. Ces changements s’accompagnent de changements dans les profils endocriniens et de neurotransmetteurs, tels qu’une réduction de la 5-HT9,10. Ces résultats reflètent étroitement ceux observés chez les humains diagnostiqués avec un TDM, validant ainsi l’utilité du modèle. Le modèle CUMS est particulièrement apprécié pour son efficacité dans l’évaluation des antidépresseurs, manifestant des niveaux élevés de validité superficielle, structurelle et prédictive11,12. Contrairement à d’autres modèles, le CUMS est sensible aux effets de l’administration chronique d’antidépresseurs monoaminergiques. Par exemple, il a été démontré que les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) tels que le citalopram, la paroxétine et la fluoxétine préviennent et inversent l’anhédonie dans des conditions de stress chronique12,13. De plus, de nouveaux antidépresseurs à action rapide, tels que la kétamine, ont également démontré leur efficacité dans ce modèle14,15. En revanche, d’autres tests comme le test de nage forcée (FST) et le test de suspension de la queue (TST) sont moins fiables pour modéliser les changements de comportement à long terme, reflétant souvent des adaptations au stress aigu plutôt que des symptômes persistants de dépression16. Ces caractéristiques soulignent la validité robuste du modèle CUMS dans la recherche sur la dépression. L’une des caractéristiques les plus saillantes du modèle CUMS, reconnu pour sa grande fiabilité dans les études classiques, est l’anhédonie, c’est-à-dire l’incapacité d’éprouver du plaisir ou de l’intérêt pour les activités quotidiennes17,18. Ce phénomène est couramment évalué à l’aide de tests de préférence pour le saccharose, et il a été démontré que de nombreux antidépresseurs inversent la réduction de la consommation de saccharose. Plusieurs autres paramètres sont également couramment utilisés dans la littérature CUMS, y compris le test en champ ouvert (OFT), qui évalue le comportement moteur volontaire, les tendances exploratoires et la tension, évaluant ainsi la gravité de la dépression19. D’autres tests tels que le labyrinthe élevé plus (EPM) évaluent les comportements anxiogènes, le test du labyrinthe aquatique Morris (MWM) examine le fonctionnement cognitif20, et le TSF évalue la susceptibilité aux émotions négatives et au désespoir comportemental20. De plus, la majorité des facteurs de stress qui affectent les humains sont de nature sociale. Les personnes ayant des relations sociales sous-optimales, caractérisées par des activités sociales, des réseaux et un soutien limités, courent un risque accru de contracter diverses maladies21,22. Cela est également pertinent dans le cas des rongeurs, qui sont des animaux sociaux vivant en groupe. Par exemple, les rats qui sont logés en isolement présentent des caractéristiques de ce qu’on appelle le syndrome d’isolement, qui induit un stress social et accélère l’apparition de la dépression23.
La médecine mongole, une branche importante de la médecine chinoise, postule que l’apparition de la maladie est une interaction complexe entre des facteurs intrinsèques et externes. Ces facteurs externes, appelés les quatre conditions auxiliaires, englobent le changement climatique, l’alimentation, le mode de vie et les événements soudains tels que les infections, les incidents surprenants et les troubles psychologiques. Le processus de la maladie est conceptualisé comme une interaction continue entre trois éléments, appelés les trois types d’homors, et les sept constituants corporels, de concert avec lesquatre conditions auxiliaires. La médecine mongole soutient que le corps humain fonctionne comme une entité intégrée, maintenue par un équilibre relatif entre les trois homors. Une perturbation de cet équilibre est considérée comme un précurseur de la maladie24. Étant donné le rôle central de l’expérimentation animale dans le rapprochement entre la médecine traditionnelle et la médecine moderne, il est crucial de développer des modèles animaux pertinents pour la recherche dans le domaine de la médecine mongole. En conséquence, nous avons utilisé une méthodologie d’isolement de 28 jours couplée à CUMS pour simuler ces facteurs de stress physiologiques et psychologiques. Nous avons sélectionné neuf facteurs de stress imprévisibles spécifiques et avons cherché à étayer cette méthode de modélisation à travers la théorie des trois homors de la médecine mongole. L’établissement d’un modèle animal robuste est fondamental pour faire progresser la recherche fondamentale en médecine mongole et contribuera de manière significative à ses études fondamentales.
Protocole
Les protocoles expérimentaux ont reçu l’approbation du Comité d’éthique des soins de l’expérimentation animale de l’Université de médecine de Mongolie intérieure (YKD202301172) et ont adhéré aux directives des National Institutes of Health en matière de soins et d’éthique des animaux. Le numéro de licence de notre centre animalier est le NO.110324230102364187. Vingt-quatre rats Sprague-Dawley mâles (SD), âgés de 8 semaines chacun (200 g ± 20 g), ont été acquis et logés dans un environnement contrôlé à une température de 22 °C ± 2 °C et à un taux d’humidité de 55 % ± 15 %. Nourrissez les rats avec un régime d’entretien pour rongeurs et de l’eau pure avec des épis de maïs pour la litière. Les rats ont été soumis à un cycle lumière/obscurité de 12 h/12 h pendant 1 semaine avant l’expérimentation.
1. Mise en place du modèle de rat CUMS
- Groupement
- Divisez les 24 rats au hasard en 2 groupes : le groupe témoin (CON), qui ne sera pas exposé à l’isolement ou au stress, et le groupe modèle (MOD). Chaque groupe contient 12 rats.
- Hébergez les rats dans des cages standard de 55 cm x 40 cm x 20 cm, avec 6 rats par cage. Conservez l’affectation de la cage tout au long de la période d’acclimatation, sauf indication contraire.
- Remplissez chaque cage d’élevage avec de la litière fraîche et remplacez-la deux fois par semaine.
- Effectuez une période d’acclimatation de 1 semaine. Laissez les rats avoir un accès illimité à la nourriture et à l’eau, sauf pendant l’application du stresseur CUMS. Maintenez un environnement constant avec une température de 22°C ± 2°C, une humidité de 55% ± 15% et un cycle lumière/obscurité de 12 h/12 h de 08h00 à 20h00, sauf indication contraire.
- Avant de commencer l’expérience, manipulez les rats quotidiennement pour les acclimater au chercheur et minimiser le stress supplémentaire pendant la phase expérimentale.
- Isolement avec stress léger chronique imprévisible
- Placez simultanément les groupes MOD et CON dans des pièces séparées. Hébergez les rats du groupe MOD individuellement, tout en gardant les rats du groupe CON ensemble. Maintenez toutes les autres conditions constantes.
- Mettre en œuvre un régime de stresseur de 28 jours25. Pour prévenir l’accoutumance et assurer l’imprévisibilité des facteurs de stress, administrez un facteur de stress aléatoire par jour, en évitant d’utiliser le même facteur de stress pendant des jours consécutifs.
- Appliquez au hasard l’un des neuf facteurs de stress suivants 26,27 à des jours différents : privation d’eau24 h, privation de nourriture 24 h, rembourrage humide, inclinaison de la cage, inversion du cycle lumière/obscurité, exposition au froid à 4 °C, exposition à la chaleur à 45 °C, serrage de la queue pendant 1 min ou agitation pendant 15 min à 160 tr/min. La conception spécifique est décrite dans le tableau 1.
- Pendant l’application du facteur de stress, limitez l’accès à la nourriture et à l’eau au groupe MOD jusqu’à ce que le stress soit terminé, sauf pendant l’inversion du cycle lumière/obscurité. Le groupe CON n’était pas tenu de restreindre l’eau et l’alimentation.
- Méthodes de stress
- Amorcez l’expérience en appliquant des stimuli de dépression en conjonction avec un isolement de 28 jours à tous les rats, à l’exception du groupe témoin. Hébergez ces rats dans des cages individuelles. Voir le tableau 2 pour les affections liées aux stimuli de la dépression.
- Pour effectuer la méthode de serrage de la queue, fixez la queue d’un rat du groupe MOD en serrant la queue avec un trombone standard à une distance de 1 à 2 cm de la racine de la queue du rat. Mesurez le temps de serrage pendant une durée de 1 min (n = 12).
- Dans la méthode de privation d’eau, retenez l’eau d’un rat du groupe MOD en retirant sa bouteille d’eau et enregistrez-la pendant 24 heures.
REMARQUE : L’heure du début de la privation d’eau a été enregistrée afin que l’heure de fin puisse être calculée avec précision ; Le comportement des rats au cours de cette période a été observé, y compris l’activité, l’appétit et l’état mental. - Dans la méthode de privation de nourriture, retenir la nourriture d’un rat du groupe MOD et enregistrer pendant 24 heures.
REMARQUE : Enregistrez l’heure à laquelle la privation de nourriture commence afin que l’heure de fin puisse être calculée avec précision ; s’assurer que les rats sont correctement hydratés pendant cette période ; et observer le comportement des rats pendant cette période, y compris l’activité et l’état mental, etc. - Pour une stimulation par le froid à 4 °C, placez un rat du groupe MOD dans un seau d’eau froide et enregistrez pendant 5 min. Assurez-vous que la température de l’eau reste constante tout au long du test. À la fin de l’expérience, séchez le rat à l’aide d’un souffleur et remettez-le dans sa cage d’origine.
REMARQUE : Maintenez la température de l’eau froide à 4 °C à l’aide d’un thermomètre et de glaçons pour réguler la température de l’eau lorsqu’elle augmente. L’eau doit être changée régulièrement pour s’assurer que la qualité de l’eau est propre et que la température est constante. Lors de la natation, tous les membres et troncs des rats doivent être immergés dans de l’eau froide à l’exception de la tête. La profondeur de l’eau doit être supérieure à la longueur du corps du rat pour éviter que le rat ne saute hors de l’eau en raison du contact avec le fond du seau. - Pour administrer un stress thermique de 45 °C, placez un rat du groupe MOD dans un incubateur et enregistrez-le pendant 5 minutes, en veillant à ce que la température reste stable tout au long de l’essai.
- Dans l’inversion du cycle lumière-obscurité, enveloppez la cage dans un tissu noir pendant 1 h pour simuler l’obscurité diurne. Par la suite, illuminez la cage pendant 12 h pendant la nuit pour imiter la lumière du jour. Notez le comportement du rat, sa consommation de nourriture et d’eau et ses habitudes de sommeil pendant 24 heures.
- Pour l’expérience de rembourrage humide, introduire 200 mL d’eau dans une cage contenant 100 g de rembourrage. Hébergez un rat du groupe MOD dans la cage humide et enregistrez le comportement des rats soumis au stress de la litière humide, y compris l’activité, l’appétit, la consommation d’eau, etc. Observez s’il n’y a pas de comportements anormaux ou de réactions inconfortables, comme l’état de la peau et des poils des rats, qui peuvent être causés par le rembourrage humide, et enregistrez-les à temps pour une analyse ultérieure pendant 24 heures. Après le test, séchez le rat à l’aide d’un souffleur et remettez-le dans une cage avec des copeaux de bois frais.
- Dans la méthode de l’inclinaison de la cage, placez un rat du groupe MOD dans une cage inclinée à un angle de 45° contre un mur et enregistrez pendant 24 h. Utilisez la structure du cadre de la cage pour ajuster l’angle et fixer la cage en place.
REMARQUE : Calculez le temps du début à la fin et observez le comportement des rats pendant la période d’inclinaison de la cage, y compris l’activité, l’appétit et l’état mental, et assurez-vous que l’angle de la cage inclinée est correctement réglé et reste stable pour assurer la précision et la reproductibilité de l’expérience. - Pour une agitation à grande vitesse, placez un rat du groupe MOD dans un agitateur mécanique réglé à 160 tr/min et enregistrez le rat pendant 15 min. Des méthodes de test comportemental sont ensuite utilisées pour évaluer la réussite de l’établissement du modèle.
- Après avoir appliqué des facteurs de stress, déplacez les cages de groupe MOD de la salle CUMS vers la salle d’hébergement. Pendant la période d’exposition au stress de 4 semaines, maintenez le groupe CON dans sa cage domestique située dans la pièce de logement.
- Précautions pendant les expériences
- Transférez les cages du groupe MOD dans la salle d’hébergement générale après avoir appliqué le facteur de stress dans la salle CUMS.
- Suivi des animaux pendant la modélisation CUMS
- Lors du serrage de la queue, l’animal est susceptible de se débattre en raison de la stimulation induite. Tout au long de cette période, surveillez en permanence la pince. S’il se déloge, mettez la minuterie en pause, réappliquez la pince, puis reprenez la minuterie pendant 1 min.
- N’imposez pas simultanément la privation d’eau et les facteurs de stress de la litière humide.
REMARQUE : Le fait d’éviter l’imposition simultanée d’un rembourrage humide et d’une privation d’eau aide à maintenir l’intégrité expérimentale, à réduire les variables confusionnelles et à promouvoir le bien-être des animaux. - La température corporelle de l’animal et la température ambiante de l’animal peuvent augmenter la température de l’eau pendant la baignade en eau froide. Par conséquent, ajustez en ajoutant de l’eau glacée ou des glaçons pour maintenir une température de l’eau constante.
- Observez les rats à des intervalles de 30 minutes pendant l’application des facteurs de stress, sauf pendant l’inversion diurne. Portez une attention particulière aux signes de détresse inhabituelle, tels que les frissons, la léthargie ou le manque de mouvement. Si de tels symptômes sont observés, en particulier une hypothermie potentielle pendant une baignade à 4 °C en eau froide et une litière humide, retirez immédiatement le rat du facteur de stress.
REMARQUE : Retirer les animaux de l’étude lorsqu’ils ont des problèmes de santé, tels qu’une infection, un traumatisme grave, des comportements agressifs, une mobilité anormale, etc.,Les conditions de retrait des animaux de l’étude tournent généralement autour de la protection de leur santé et de leur sécurité tout en assurant l’intégrité des résultats de l’expérience. - Effectuez des inspections quotidiennes pour détecter des plaies ou d’autres anomalies physiques ou comportementales chez chaque rat. Si des anomalies sont observées, consultez le vétérinaire du laboratoire pour déterminer si le rat doit être exclu de l’expérience.
- Pesez chaque rat tous les 3 jours. Si un animal perd plus de 20 % de son poids corporel de base avant l’alimentation, il doit être exclu de l’expérience.
2. Tests comportementaux
- Pour commencer, administrez les stimuli de la dépression en conjonction avec l’isolement pendant 28 jours à tous les rats, à l’exception du groupe témoin. Hébergez les rats dans des cages individuelles. Reportez-vous au tableau 2 pour plus de détails sur les conditions des stimuli de dépression.
- Pour l’essai en plein champ, divisez une boîte noire en 25 sections carrées de surface égale. Installez un système d’analyse de suivi vidéo dans la boîte. Placez le rat dans le carré central et surveillez ses activités horizontales et verticales pendant une durée de 5 min.
REMARQUE : Les dimensions de la boîte sont de 500 mm x 500 mm x 300 mm. Les données d’activité seront recueillies à l’aide du système de suivi vidéo pour évaluer les comportements liés à l’anxiété chez les rongeurs lorsqu’ils sont exposés à un nouvel environnement. - Par la suite, comptez le nombre de carrés parcourus par le rat, à l’aide de toutes les pattes, pour quantifier l’activité horizontale. Comptez les cas de station debout et de toilettage comme indicateurs d’activité verticale. Après chaque test, désinfectez la boîte avec de l’alcool à 75 % afin d’éliminer toute odeur résiduelle de rat pour les tests ultérieurs.
- Ensuite, l’anhédonie est évaluée par le test de préférence en saccharose. Placez deux bouteilles sur le couvercle de la cage : la bouteille A contient de l’eau pure, tandis que la bouteille B contient une solution de saccharose à 1 %. Permettre l’accès ad libitum aux deux solutions pour le rat. Pesez les bouteilles avant et après la consommation pour calculer les taux de préférence pour le saccharose de 60 minutes les jours 0, 7, 14, 21 et 28. La formule est la suivante :
Consommation de saccharose =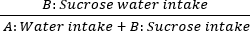 × 100%
× 100% - Pour mesurer la mémoire spatiale et les capacités d’apprentissage, utilisez le test du labyrinthe aquatique de Morris. Divisez la piscine en quatre quadrants, en les numérotant de un à quatre. Placez une plate-forme de repos immergée à 1 cm sous la surface de l’eau dans le troisième quadrant.
- Introduisez du lait dans la piscine pour augmenter l’opacité de l’eau et maintenir une température de l’eau d’environ 23 °C tout au long de la procédure expérimentale.
- Placez chaque rat dans différents quadrants du labyrinthe, ce qui leur permet de localiser la plate-forme cachée pendant 120 secondes. Les rats doivent s’appuyer sur la mémoire spatiale et les compétences d’apprentissage pour se souvenir de l’emplacement de la plate-forme. Une fois qu’ils connaissent l’emplacement de la plate-forme, ils peuvent nager directement jusqu’à celle-ci. Enregistrez le temps de latence à l’aide du système de suivi vidéo du labyrinthe d’eau Morris.
- Placez le rat à un endroit fixe dans la piscine. Si l’objet ne parvient pas à localiser la plate-forme cachée dans un délai de 120 s, enregistrez la latence sur 120 s.
- Enfin, retirez la plate-forme cachée, remettez le rat dans l’eau et notez le nombre de franchissements de zones sur une période de 120 s.
3. Analyse statistique
- Pour évaluer les différences significatives dans les paramètres biochimiques, utilisez l’analyse de variance à un facteur (ANOVA) suivie du test post hoc de Duncan. Présentez les données sous forme d’erreur type moyenne ± et considérez une valeur p inférieure à 0,05 comme statistiquement significative.
Résultats
Résultats des tests comportementaux dans le modèle de dépression chez le rat induit par CUMS
Pour corroborer l’efficacité de la procédure CUMS pour induire des comportements de type dépression, un contrôle de manipulation a été effectué. Des rats Sprague-Dawley mâles (SD) ont été répartis au hasard dans le groupe MOD ou CON pendant une période de 4 semaines, comme indiqué à l’étape 1.2.3. Par la suite, les rats ont été sacrifiés et leur hippocampe a été complètement disséq...
Discussion
La dépression est un trouble mental caractérisé par des symptômes tels que la mauvaise humeur, le manque de plaisir et une baissed’énergie. Dans le domaine de la recherche sur la dépression, l’établissement d’un modèle animal fiable est crucial pour faire progresser les interventions thérapeutiques. Parmi les différents modèles animaux, le modèle CUMS est particulièrement remarquable pour sa grande fiabilité, sa validité et sa congruence avec les caractéristiques de la dépre...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous sommes reconnaissants pour l’instrumentation et le laboratoire fournis par la faculté de médecine mongole de l’Université de médecine de Mongolie intérieure, en Chine. Cette étude a reçu le soutien financier de la Fondation nationale des sciences naturelles de Chine (subvention n° 81760762) et du projet de l’Université médicale de Mongolie intérieure de Chine (subvention n° 100). YKD2022MS074), et le projet de recherche scientifique de l’enseignement supérieur en Mongolie intérieure, en Chine (subvention n°. NJZY22661) et le projet de fonds ouverts du Laboratoire clé de médecine chinoise et mongole dans la région autonome de Mongolie intérieure, Chine (subvention n°. MYX2023-K07).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tube | service Biotechnology Co., Ltd | EP-150-M | |
| 1000 µL Pipette | service Biotechnology Co., Ltd | IC021198160223 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | IC012395160823 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | TP-10 | |
| 1250 µL pipette tip | service Biotechnology Co., Ltd | TP-1250 | |
| 2 mL centrifuge tube | service Biotechnology Co., Ltd | EP-200-M | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | TP-200 | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | IC021029160323 | |
| 300 µL Multi-Channel Pipette | service Biotechnology Co., Ltd | IC091006161022 | |
| 50 µL Pipette | service Biotechnology Co., Ltd | DS35110 | |
| Automatic plate washing machine | rayto Life Sciences Co., Ltd | RT-3100 | |
| Benchtop High-Speed Freezing Centrifuge | dalong construction Co., Ltd | D3024R | |
| electronic balance | Mettler Toledo International Trade (Shanghai) Co., Ltd | ME203E/02 | |
| Electrothermal blast drying oven | Labotery Experimental Instrument Equipment Co., Ltd | GEL-70 | |
| Enzyme Label Detector | BioTeK Co., Ltd | Epoch | |
| High Speed Tissue Grinder | service Biotechnology Co., Ltd | KZ- -F -F | |
| Horizontal Freezer | Mellow Group Co., Ltd | BCD-318AT | |
| Laboratory Ultrapure Water Machine | Jinan Aiken Environmental Protection Technology Co., Ltd | AK-RO-C2 | |
| Morris water maze video trail analysing system | Tai Meng Tech Co., Ltd | WMT-200 | |
| Rat 5-HT ELISA Kit | Lian Ke bio Co., Ltd,China | 96T/48T | |
| SPF grade Sprague Dawley (SD) rats | SPF (Beijing) Biotechnology Co | SCXK(JING)2019-0010 | |
| Sprague Dawley rats | Beijing Biotechnology Co., Ltd, China | SCXK (JING) 2019-0010 | |
| Vertical Refrigerated Display Cabinet | Xingx Group Co., Ltd | LSC-316C | |
| video tracking system | Tai Meng Tech Co., Ltd | ZH-ZFT | |
| vortex mixer | Servicebio technology Co., Ltd | MV-100 |
Références
- Alqurashi, G. K., et al. The impact of chronic unpredictable mild stress-induced depression on spatial, recognition and reference memory tasks in mice: Behavioral and histological study. Behav Sci. 12 (6), 166 (2022).
- Yu, S., Wang, L., Jing, X., Wang, Y., An, C. Features of gut microbiota and short-chain fatty acids in patients with first-episode depression and their relationship with the clinical symptoms. Front Psychol. 14, 1088268 (2023).
- Duda, P., Hajka, D., Wójcicka, O., Rakus, D., Gizak, A. Gsk3β: A master player in depressive disorder pathogenesis and treatment responsiveness. Cells. 9 (3), 727 (2020).
- Correia, A. S., Vale, N. Tryptophan metabolism in depression: A narrative review with a focus on serotonin and kynurenine pathways. Int J Mol Sci. 23 (15), 8493 (2022).
- Hao, Y., Ge, H., Sun, M., Gao, Y. Selecting an appropriate animal model of depression. Int J Mol Sci. 20 (19), 4827 (2019).
- Willner, P., Towell, A., Sampson, D., Sophokleous, S., Muscat, R. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant. Psychopharmacology (Berl). 93 (3), 358-364 (1987).
- Nakase, S., Kitayama, I., Soya, H., Hamanaka, K., Nomura, J. Increased expression of magnocellular arginine vasopressin mrna in paraventricular nucleus of stress-induced depression-model rats. Life Sci. 63 (1), 23-31 (1998).
- Wu, X., et al. Involvement of kynurenine pathway between inflammation and glutamate in the underlying etiopathology of cums-induced depression mouse model. BMC Neurosci. 23 (1), 62 (2022).
- Zhang, C., et al. Minocycline ameliorates depressive behaviors and neuro-immune dysfunction induced by chronic unpredictable mild stress in the rat. Behav Brain Res. 356, 348-357 (2019).
- Ma, J., Wang, R., Chen, Y., Wang, Z., Dong, Y. 5-HT attenuates chronic stress-induced cognitive impairment in mice through intestinal flora disruption. J Neuroinflammation. 20 (1), 23 (2023).
- Nollet, M. Models of depression: Unpredictable chronic mild stress in mice. Curr Protoc. 1 (8), e208 (2021).
- Becker, M., Pinhasov, A., Ornoy, A. Animal models of depression: What can they teach us about the human disease. Diagnostics (Basel). 11 (1), 123 (2021).
- Petkovic, A., Chaudhury, D. Encore: Behavioural animal models of stress, depression and mood disorders. Front Behav Neurosci. 16, 931964 (2022).
- Okine, T., Shepard, R., Lemanski, E., Coutellier, L. Sex differences in the sustained effects of ketamine on resilience to chronic stress. Front Behav Neurosci. 14, 581360 (2020).
- Fitzgerald, P. J., et al. Sex- and stress-dependent effects of a single injection of ketamine on open field and forced swim behavior. Stress. 24 (6), 857-865 (2021).
- Doron, R., Burstein, O. The unpredictable chronic mild stress protocol for inducing anhedonia in mice. J Vis Exp. (140), e58184 (2018).
- De Vry, J., Schreiber, R. The chronic mild stress depression model: Future developments from a drug discovery perspective. Psychopharmacology (Berl). 134 (4), 349-350 (1997).
- Tong, J., et al. Antidepressant effect of helicid in chronic unpredictable mild stress model in rats. Int Immunopharmacol. 67, 13-21 (2019).
- Liu, H., et al. Tnf signaling pathway-mediated microglial activation in the pfc underlies acute paradoxical sleep deprivation-induced anxiety-like behaviors in mice. Brain Behav Immun. 100, 254-266 (2022).
- He, L. W., et al. Optimization of food deprivation and sucrose preference test in sd rat model undergoing chronic unpredictable mild stress. Animal Model Exp Med. 3 (1), 69-78 (2020).
- Ma, W., Wu, B., Gao, X., Zhong, R. Association between frailty and cognitive function in older chinese people: A moderated mediation of social relationships and depressive symptoms. J Affect Disord. 316, 223-232 (2022).
- Geng, C., et al. Systematic impacts of chronic unpredictable mild stress on metabolomics in rats. Sci Rep. 10 (1), 700 (2020).
- Holmes, T. H., Rahe, R. H. The social readjustment rating scale. J Psychosom Res. 11 (2), 213-218 (1967).
- Zhang, M., et al. Shuxie-1 decoction alleviated cums -induced liver injury via il-6/jak2/stat3 signaling. Front Pharmacol. 13, 848355 (2022).
- Antoniuk, S., Bijata, M., Ponimaskin, E., Wlodarczyk, J. Chronic unpredictable mild stress for modeling depression in rodents: Meta-analysis of model reliability. Neurosci Biobehav Rev. 99, 101-116 (2019).
- Hu, C., et al. Re-evaluation of the interrelationships among the behavioral tests in rats exposed to chronic unpredictable mild stress. PLoS One. 12 (9), e0185129 (2017).
- Li, Y., et al. Increased hippocampal fissure width is a sensitive indicator of rat hippocampal atrophy. Brain Res Bull. 137, 91-97 (2018).
- Hu, R. L. B. G., et al. Effects of the Mongolian medicine Zadi-5 on monoamine neurotransmitters in the brain of rats with chronic stress depression model. Info Traditional Chinese Med. 34 (06), 5-8 (2017).
- Zhou, Y., Cong, Y., Liu, H. Folic acid ameliorates depression-like behaviour in a rat model of chronic unpredictable mild stress. BMC Neurosci. 21 (1), 1 (2020).
- Zhuang, Y., Zeng, R., Liu, X., Yang, L., Chan, Z. Neoagaro-oligosaccharides ameliorate chronic restraint stress-induced depression by increasing 5-ht and bdnf in the brain and remodeling the gut microbiota of mice. Mar Drugs. 20 (11), 725 (2022).
- Socała, K., et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacol Res. 172, 105840 (2021).
- Song, J., Kim, Y. K. Animal models for the study of depressive disorder. CNS Neurosci Ther. 27 (6), 633-642 (2021).
- Abelaira, H. M., Réus, G. Z., Quevedo, J. Animal models as tools to study the pathophysiology of depression. Braz J Psychiatry. 35 Suppl 2, S112-S120 (2013).
- Strekalova, T., et al. Chronic mild stress paradigm as a rat model of depression: Facts, artifacts, and future perspectives. Psychopharmacology (Berl). 239 (3), 663-693 (2022).
- Markov, D. D. Sucrose preference test as a measure of anhedonic behavior in a chronic unpredictable mild stress model of depression: Outstanding issues. Brain Sci. 12 (10), 1287 (2022).
- Czéh, B., Fuchs, E., Wiborg, O., Simon, M. Animal models of major depression and their clinical implications. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 64, 293-310 (2016).
- Gururajan, A., Reif, A., Cryan, J. F., Slattery, D. A. The future of rodent models in depression research. Nat Rev Neurosci. 20 (11), 686-701 (2019).
- Markov, D. D., Novosadova, E. V. Chronic unpredictable mild stress model of depression: Possible sources of poor reproducibility and latent variables. Biology (Basel). 11 (11), 1621 (2022).
- Willner, P. The chronic mild stress (cms) model of depression: History, evaluation and usage. Neurobiol Stress. 6, 78-93 (2017).
- Lages, Y. V. M., Rossi, A. D., Krahe, T. E., Landeira-Fernandez, J. Effect of chronic unpredictable mild stress on the expression profile of serotonin receptors in rats and mice: A meta-analysis. Neurosci Biobehav Rev. 124, 78-88 (2021).
- Willner, P., et al. Validation of chronic mild stress in the wistar-kyoto rat as an animal model of treatment-resistant depression. Behavioural Pharmacology. 30 (2 and 3), 239-250 (2019).
- Slattery, D. A., Cryan, J. F. Modelling depression in animals: At the interface of reward and stress pathways. Psychopharmacology (Berl). 234 (9-10), 1451-1465 (2017).
- Sterley, T. L., et al. Social transmission and buffering of synaptic changes after stress. Nat Neurosci. 21 (3), 393-403 (2018).
- Brechbühl, J., et al. Mouse alarm pheromone shares structural similarity with predator scents. Proc Natl Acad Sci U S A. 110 (12), 4762-4767 (2013).
- Beck, R. C., Self, J. L., Carter, D. J. Sucrose preference thresholds for satiated and water-deprived rats. Psychol Rep. 16, 901-905 (1965).
- Hawkins, P., Golledge, H. D. R. The 9 to 5 rodent - time for change? Scientific and animal welfare implications of circadian and light effects on laboratory mice and rats. J Neurosci Methods. 300, 20-25 (2018).
- Daut, R. A., Ravenel, J. R., Watkins, L. R., Maier, S. F., Fonken, L. K. The behavioral and neurochemical effects of an inescapable stressor are time of day dependent. Stress. 23 (4), 405-416 (2020).
- Hu, R. L. B. G., et al. Experimental research on nutmeg wuwei pills against of depression model rats behavior and hippocampus monoamine neurotransmitters. Chinese J Exp Traditional Medical Formulae. 21 (11), 146-149 (2015).
- Hu, R. L. B. G., et al. Effects of Rou kou Wuwei Pill on the learning and memory abilities and the expression of BDNF and TrkB in hippocampus of depression rats. Chinese J Traditional Chines Med Pro. 32 (8), 3797-3800 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon