Spectroscopie infrarouge
Vue d'ensemble
Source : Vy M. Dong et Zhiwei Chen, Department of Chemistry, University of California, Irvine, CA
Cette expérience démontrera l’utilisation de la spectroscopie infrarouge (IR) (également connu sous le nom la spectroscopie vibrationnelle) afin d’élucider l’identité d’un composé inconnu en identifiant le cycle actuel. Spectres IR seront obtenus sur un spectromètre IR à l’aide de la réflexion totale atténuée technique d’échantillonnage (RTA) auprès d’un échantillon pur de l’inconnu.
Principles
Une liaison covalente entre deux atomes peut être considérée comme deux objets avec masses m1 et m2 qui sont reliés avec un ressort. Naturellement, cette obligation s’étend et compresse avec une certaine fréquence vibratoire. Cette fréquence 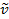 est donnée par l’équation 1, où k est la constante de force du ressort, c est la vitesse de la lumière et µ est la masse réduite (équation 2). La fréquence est généralement mesurée en nombres d’ondes, qui sont exprimées en centimètres inverses (cm-1).
est donnée par l’équation 1, où k est la constante de force du ressort, c est la vitesse de la lumière et µ est la masse réduite (équation 2). La fréquence est généralement mesurée en nombres d’ondes, qui sont exprimées en centimètres inverses (cm-1).
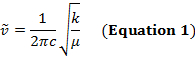
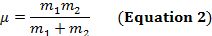
De l’équation 1, la fréquence est proportionnelle à la force du ressort et inversement proportionnelle à la masse des objets. Ainsi, C-H, N-H et les liaisons O-H ont plus élevé qui s’étend de fréquences que C-C et les liaisons C-O, comme l’hydrogène est un atome de lumière. Doubles et triples liaisons peut être considérés comme des ressorts plus forts, donc une double liaison C-O a une fréquence plus élevée qui s’étend à une liaison simple de C-O. La lumière infrarouge est un rayonnement électromagnétique avec des longueurs d’onde allant de 700 nm et 1 mm, ce qui concorde avec les forces de liaison relatif. Quand une molécule absorbe la lumière infrarouge avec une fréquence égale à la fréquence de vibration naturelle d’une liaison covalente, l’énergie du rayonnement produit une augmentation de l’amplitude de la vibration de la liaison. Si l’électronégativité (tendance à attirer les électrons) des deux atomes dans une liaison covalente sont très différents, une séparation de charge se produit qui se traduit par un moment dipolaire. Par exemple, dans une double liaison C-O (un groupe carbonyle), les électrons passent plus de temps autour de l’atome d’oxygène que l’atome de carbone, l’oxygène étant plus électronégatif que le carbone. Par conséquent, il y a un moment dipolaire net, ce qui entraîne une charge partielle négative sur l’oxygène et une charge partielle positive sur le carbone. En revanche, un alcyne symétrique n’a pas un moment dipolaire net parce que les deux moments dipolaires individuels de chaque côté s’annulent mutuellement. L’intensité de l’absorption infrarouge est proportionnelle à la variation du moment dipolaire lorsque le cautionnement s’étend ou compresse. Par conséquent, un tronçon de groupement carbonyle montrera une bande intense dans l’IR et un alcyne interne symétrique montrera un petit, si pas invisible, bande d’élongation de la liaison triple C-C (Figure 1). Le tableau 1 montre certaines fréquences d’absorption caractéristique. La figure 2 montre le spectre infrarouge d’un ester de Hantzsch. Remarquez le pic à 3 343 cm-1 pour la liaison simple N-H et un pic à 1 695 cm-1 pour les groupes carbonyles. Dans cette expérience, la technique d’échantillonnage de RTA est utilisée, où la lumière infrarouge réfléchit l’échantillon qui est en contact avec un cristal de RTA plusieurs fois. En général, les matériaux avec un indice de réfraction élevé sont utilisés, comme le séléniure de zinc et de germanium. Cette méthode permet d’examiner directement les analytes solide ou liquide, sans plus de préparation.
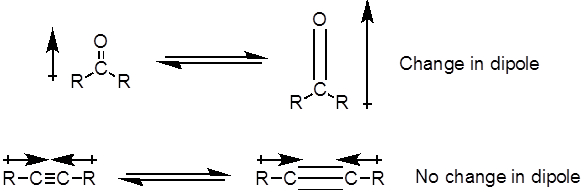
Figure 1. Schéma montrant la C–O double et C-C triple liaison étendues et le changement de moment dipolaire résultant.
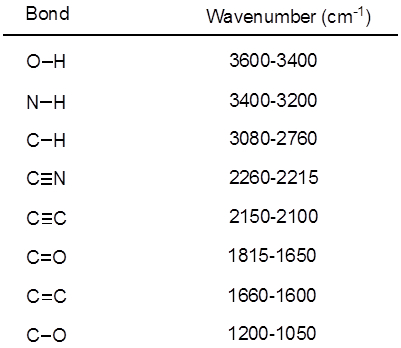
Le tableau 1. Fréquences de IR caractéristiques des liaisons covalentes présents dans les molécules organiques.
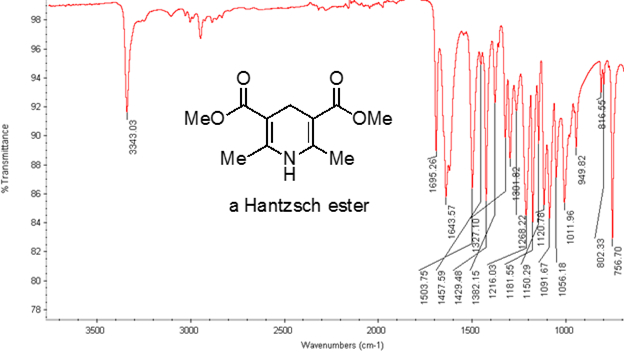
La figure 2. Spectre infrarouge d’un ester de Hantzsch.
Procédure
- Allumez le spectromètre IR et laissez-le se réchauffer.
- Obtenir un échantillon inconnu de l’instructeur et enregistrer la lettre et l’apparence de l’échantillon.
- Recueillir un éventail de fond.
- À l’aide d’une spatule métallique, placez une petite quantité d’échantillon en vertu de la sonde.
- Tourner la sonde jusqu'à ce qu’il s’enclenche.
- Enregistrer le spectre infrarouge de l’échantillon inconnu.
- Spectre de répéter si nécessaire pour obtenir une bonne qualité.
- Enregistrer les fréquences d’absorption indicatives des groupes fonctionnels présents.
- Nettoyer la sonde avec de l’acétone.
- Désactiver le spectromètre.
- Analyser le spectre obtenu. La figure 3 montre les candidats possibles pour l’échantillon inconnu. Indiquer l’identification probable de l’échantillon inconnu.

La figure 3. Diagramme illustrant l’identité possible de l’inconnu.
Résultats
Tableau 2 : apparence et fréquences observées pour IR des composés énumérés dans La figure 3.
| Numéro composé | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Apparence | liquide clair | solide blanc | liquide clair | liquide clair | liquide clair | liquide clair | liquide jaune | solide blanc | solide blanc | liquide clair |
| Fréquences observées (cm-1) | 1691, 1601, 1450, 1368, 1266 |
2773, 2730, 1713, 1591, 1576 |
2940, 2867, 1717, 1422, 1347 |
3026, 2948, 2920, 1605, 1496 |
2928, 2853, 1450, 904, 852 |
3926, 3315, 2959, 2120, 1461 |
3623, 3429, 3354, 2904, 1601 |
3408, 3384, 3087, 1596, 1496 |
3226, 2966, 1598, 1474, 1238 |
3340, 2959, 2861, 1468, 1460 |
Applications et Résumé
Dans cette expérience, nous avons démontré comment identifier un échantillon inconnu basé sur son spectre IR caractéristique. Différents groupes fonctionnels donnent différentes fréquences d’élongation, qui permet l’identification des groupes fonctionnels présents.
Comme indiqué dans cette expérience, spectroscopie infrarouge est un outil utile pour le chimiste organicien identifier et caractériser une molécule. En plus de la chimie organique, spectroscopie IR a des applications utiles dans d’autres domaines. Dans l’industrie pharmaceutique, cette technique est utilisée pour l’analyse quantitative et qualitative de la drogue. En sciences de l’alimentation, spectroscopie infrarouge est utilisée pour étudier les huiles et les graisses. Enfin, la spectroscopie infrarouge est utilisée pour mesurer la composition des gaz à effet de serre, c'est-à-dire, CO2, CO, CH4et N2O dans les efforts pour comprendre les changements climatiques.
Passer à...
Vidéos de cette collection:

Now Playing
Spectroscopie infrarouge
Organic Chemistry II
215.3K Vues

Nettoyage de la verrerie
Organic Chemistry II
123.7K Vues

Substitution nucléophile
Organic Chemistry II
99.6K Vues

Agents reducteurs
Organic Chemistry II
43.1K Vues

Réaction de Grignard
Organic Chemistry II
149.1K Vues

Titrage du n-butyllithium
Organic Chemistry II
48.0K Vues

Appareil de Dean-Stark
Organic Chemistry II
100.6K Vues

Ozonolyse des alcènes
Organic Chemistry II
67.1K Vues

Organocatalyse
Organic Chemistry II
16.9K Vues

Réaction de couplage catalysé au palladium
Organic Chemistry II
34.5K Vues

Synthèse en phase solide
Organic Chemistry II
41.1K Vues

Hydrogénation
Organic Chemistry II
49.6K Vues

Polymérisation
Organic Chemistry II
94.4K Vues

Point de fusion
Organic Chemistry II
150.0K Vues

Polarimètre
Organic Chemistry II
100.1K Vues