A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת מטריצות תלונה לכימות התכווצות נייד
In This Article
Summary
בסרטון הזה, אנחנו מדגימים את ניסיוני בטכניקות בשימוש לפברק תואם, תאי המטריצה (ECM) מצעים מצופה מתאים תרבית תאים, ואשר ניתנים במיקרוסקופ כוח המתיחה והתבוננות ההשפעות של קשיחות ECM על התנהגות התא.
Abstract
הסדרת הידבקות הסלולר מטריקס תאית (ECM) חיונית נדידת תאים שיפוץ ECM. הידבקויות מרחק הם מכלולים macromolecular כי בני הזוג cytoskeleton כויץ F-אקטין ECM. חיבור זה מאפשר שידור של כוחות מכניים תאיים על פני קרום התא למצע הבסיסי. מחקר שנערך לאחרונה הוכיח את תכונות מכניות של ECM להסדיר הידבקות מוקד ו-F-אקטין מורפולוגיה, כמו גם תהליכים פיזיולוגיים רבים, כולל התמיינות תאים, חלוקה, הפצה והגירה. לפיכך, השימוש מצעים תרבית תאים הפכה שיטה נפוצה יותר ויותר בדיוק מלאה לווסת ECM תכונות מכניות.
כדי לכמת את כוחות המתיחה על הידבקויות מוקד בתא חסיד, מצעים תואם משמשים בשילוב עם הדמיה ברזולוציה גבוהה וטכניקות חישוביות בתוך שיטה מיקרוסקופית המכונה כוח המתיחה (TFM). טכניקה זו מתבססת על מדידות של עוצמת הכיוון המקומית של דפורמציות המצע המושרה על ידי התכווצות הסלולר. בשילוב עם מיקרוסקופ פלואורסצנטי ברזולוציה גבוהה של החלבונים המתויגים fluorescently, ניתן לתאם ארגון שיפוץ cytoskeletal עם כוחות המתיחה.
כאן אנו מציגים את פרוטוקול הניסוי מפורט להכנת דו מימדי, מטריצות תואם לצורך יצירת מצע תרבית תאים עם קשיחות, מאופיין היטב מכני מתכונן, אשר מתאים למדידת התכווצות הסלולר. פרוטוקולים אלה כוללים ייצור של הידרוג polyacrylamide, ציפוי של חלבונים ECM על ג'ל כזה, תאים ציפוי על ג'לים, ברזולוציה גבוהה מיקרוסקופיה confocal באמצעות תא זלוף. בנוסף, אנו מספקים מדגם מייצג של נתונים הוכחת המיקום ואת העוצמה של הכוחות באמצעות הסלולר מצוטט בפרוטוקולים TFM.
Protocol
1. הפעלת משטח coverslip
- Coverslips (# 1.5, 22x40 מ"מ) מנקים באמצעות סדרה של שוטף סבון אתנול פרוטוקול שתואר קודם לכן (ווטרמן, סטורר, 1998) כדי לנקות ולהסיר את האבק.
- Coverslips מקום מתלה נירוסטה מחזיק, כגון coverslips כי הם מרווחים מזה לא נוגע.
- במנדף כימי קטר (nitrile כפפות ומשקפי מגן מומלץ), לדלל כוח מלא 3-aminopropyltrimethoxysilane ב isopropanol ריכוז סופי של 2% (2ml silane / 100 מ"ל isopropanol) כדי למלא צלחת זכוכית מרובע (~ 350ml נפח). בשל תגובתיות עם פלסטיק, השתמש פסטר זכוכית פיפטה ליישם 3-aminopropyltrimethoxysilane את isopropanol.
- מלא coverslips לטבול מ 1.2 לתוך פתרון זה עבור 10 דקות תוך בחישה בעדינות על צלחת מוסיפים את מכסה המנוע קטר.
- לשטוף coverslips ידי טבילה ב DDH 2 O (4 חילופי מים). אפשר 10 דקות זמן השריה לחילופי הסופי, עם ערבוב. אמינו-silane פתרונות המכיל צריך להיות מסולק כמו פסולת מסוכנת.
- Coverslips יבש בתוך אינקובטור בטמפרטורה חמימה (~ 37 מעלות צלזיוס) במשך 10 דקות בסביבת אבק חינם.
- מצננים לטמפרטורת החדר.
- ב למכסה המנוע קטר, coverslips לטבול בתמיסה glutaraldehyde 1% DDH 2 O בכלי זכוכית מרובע על צלחת ומערבבים במשך 30 דקות.
- שטפי על ידי 3 חילופי DDH 2 O למשך 10 דקות לכל החליפין, עם ערבוב. השלך glutaraldehyde כמו פסולת מסוכנת.
- יבש בטמפרטורת החדר, מכסים בנייר אלומיניום, כדי למנוע אבק דבק coverslips.
- אחסנו במקום יבש, הרחק מהאבק, עד 2 חודשים.
2. הכנת polyacrylamide (PAA) ג'ל
- הכינו מלאי של פתרונות לערבב acrylamide / bis-acrylamide מ acrylamide 40% ו -2% bis-acrylamide, בעקבות טבלה 1. אנו שומרים על מספר פתרונות המניות מותאמים ג'לים PAA של קשיחות שונות; דוגמאות מפורטות בטבלה 1 ו -2. פתרונות במלאי יכולים להישמר במשך מספר שנים, כל עוד הם נשמרים בתוך בקבוק חשוך בשעה 4 ג
- פתרונות עבודה המכיל את הריכוזים הרצוי הסופי של acrylamide / bis-acrylamide מתקבלים פתרונות המניות. לדוגמה, אנו מכינים פתרון עבודה של 7.5% acrylamide/0.10% bis-acrylamide ב DDH 2 O להכנת 2.8kPa ג'לים PAA.
- פתרון דגה acrylamide בתא ואקום עבור 20 דקות, כדי להפחית את החמצן בתוך התמיסה אשר מונע פילמור PAA.
- הכן 10% persulfate אמוניום (APS) פתרון (0.5g/5mL). השתמש מניות הפועלים טריים תוך 3 ימים. לחלופין, אפשר להקפיא מניות לשמש במועדים מאוחר יותר.
- בעוד acrylamide הוא degassing, לנגב כוס 1x3 "שקופיות מיקרוסקופ עם גשם-X מוחה נמרצות כדי להחליק משטח זכוכית הידרופובי. להסרת עודף גשם-X, למחוק שקופיות זכוכית עם Kimwipe לח. שקופיות הזכוכית מניחים בצד, מכוסה.
- הסר פתרון acrylamide מתא ואקום ולהוסיף חרוזי ניאון (1% לפי נפח, 5 μl לפתרון עובד המפורטים טבלה 1). הוסף 0.75μl TEMED ו -2.5 APS 10% μl, אשר תיזום פילמור הג'ל. מערבבים היטב על ידי pipetting עבור ~ 5 שניות, כדי למזער את ההקדמה של בועות,
- החל 10-12 μl של הפתרון acrylamide להחליק מיקרוסקופ הידרופובי (מוכן בשלב 2.4) והמקום מופעל coverslip 22x40mm על גבי אגל. הפתרון צריך ג'ל coverslip מעיל כולו. להחליק את כל הבועות שעלולים להופיע בתוך הפתרון. אפשר את הפתרון ג'ל כדי לפלמר בטמפרטורת החדר למשך 10 דקות ~.
- השלמת פילמור ניתן להעריך על ידי פתרון היפוך עובד הנותרים בצינור microcentrifuge. כמו כן, ג'ל polymerized עלול להינתק קצוות coverslip. מיד לאחר פילמור מאקרוסקופיים הוא ציין, להפריד את coverslip משקופית הזכוכית. משתמש קצה קנס של פינצטה או קצה סכין גילוח, להסיר בזהירות coverslip, מצורף עם ג'ל, משטח המיקרוסקופ שקופיות ג'ל לטבול DDH 2 O, לשמור על הידרציה.
3. צימוד תאי המטריצה (ECM) חלבונים הג'ל PAA
שלוש שיטות שונות שניתן להשתמש בהם כדי לצרף חלבון ECM או על פני השטח העליון של ג'ל PAA (3.1 ו -3.2) או שילוב של חלבון ECM בתוך נפח ג'ל (3.3). כאן, אנו דנים צימוד של פיברונקטין כדי ג'לים PAA לתוצאות בצפיפות משטח ליגנד כי הוא שווה ערך לסכום adsorbed על זכוכית לאחר דגירה עם 10 מיקרוגרם / מ"ל פיברונקטין פתרון לשעה 1. שיקולים בבחירת שיטת מפורטים בדיון.
- Cross-linking חלבון ECM אל פני השטח ג'ל PAA ידי Sulfo-SANPAH אמינים הריאקטיבי על חלבונים מחוברים קוולנטית אל פני השטח ג'ל PAA ידי heterobifunctional צולבות מקשר Sulfo-SANPAH
- הכן 40 aliquots עובד μl של Sulfo-SANPAH ידי המסת S ulfo-SANPAH אבקת sulfoxide דימתיל anhydrous (DMSO) (20 מ"ג לכל μl Sulfo-SANPAH). מניות פלאש להקפיא בחנקן נוזלי חנות ב -80 ° C לשימוש מאוחר יותר.
- הסר DDH 2 O מפני השטח ג'ל באמצעות הצנטריפוגה coverslip (<2sec). הימנע ייבוש ג'ל.
- מדולל Sulfo-SANPAH-DMSO aliquots ב DDH 2 O (2mg/ml, pH 7) מיד לפני השימוש בג'ל מעיל פני השטח (~ 200 μl). שים לב התגובה מחצית חיים של Sulfo-SANPAH קצר (~ 5 דק ') בטמפרטורת החדר במים, ולכן השלבים צריך להיעשות בקצב מהיר.
- לחשוף משטח ג'ל לאור UV בתנור צולבות מקשר UV (8W, 254 ננומטר אורך גל במרחק של 2-3 ס"מ 1.5 דקות). Sulfo-SANPAH ישתנה צבע כתום וחום.
- טובלים UV שטופלו coverslips בכוס עם טרי DDH 2 O ולהסיר עודפי מים מפני השטח ג'ל באמצעות הצנטריפוגה coverslip (<2sec).
- פיפטה ~ 50 μL של פיברונקטין 1mg/ml קר (FN) (ב PBS, pH 7.4) על Parafilm במיכל צלחת פטרי. היפוך coverslip על גבי ירידה FN, לצד הג'ל חשופים FN.
- להגיב בטמפרטורת החדר למשך 1-2 שעות או 4 ° C למשך הלילה.
- Coverslips מקום 6 ס"מ רקמה המכילה כלי תרבות PBS (pH 7.4), מספיק כדי לכסות coverslip, בתנאים סטריליים במנדף בתרבית רקמה.
- לשטוף בהרחבה שוטף מספר (3-5) של PBS (pH 7.4), בתנאים סטריליים.
- לעקר את coverslips על ידי שימוש במנדף מנורה קוטל חידקים בתרבית רקמה למשך 30 דקות.
- דגירה coverslips בתקשורת תא 30-45 דקות לפני תאים ציפוי.
- Cross-linking ECM אל פני השטח ג'ל PAA ידי מימה הידרזין קבוצות על פחמימות וחלבונים הם מצמידים את חמצון הג'ל באמצעות מימה הידרזין.
- הכן ג'ל polyacrylamide כמתואר בסעיף 2.
- המקום PAA coverslips ג'ל בצלחת פטרי מפלסטיק במנדף קטר וכפפות באמצעות פיפטה כ 1 מ"ל של מימה הידרזין חי על פני השטח של כל ג'ל PAA ו דגירה של לפחות שעתיים, אך לא יותר מ 24 שעות
- הוסף DDH 2 O כדי בצלחת פטרי; הסר פתרון הידרזין מימה ועושה כמו פסולת מסוכנת.
- הוספת חומצה אצטית 5% עד צלחת פטרי לטבול coverslip. מכסים דגירה במשך שעה אחת.
- הסר את חומצה אצטית ולשטוף עם DDH 2 O. דגירה ב DDH 2 O למשך שעה אחת. Coverslips מופעלים כעת מוכן לחצות הקישור חמצון פיברונקטין (FN).
- מדולל 10 μl של 1 מ"ג / מ"ל פתרון FN ב 940 μl של 50 חיץ נתרן אצטט מ"מ (pH 4.5) בצינור חשוך צנטריפוגות מיקרו, מה שהופך ריכוז סופי של 10 מיקרוגרם / מ"ל.
- הפוך את המניות של נתרן 20X meta-periodate ידי הוספת 80 מ"ג של נתרן מטא periodate ל 1 מ"ל של נתרן אצטט חיץ 50 מ"מ (pH 4.5).
- הוסף 50 μl של נתרן 20X meta-periodate מניות לפתרון FN שהוכנו 3.2.6, ריכוז כזה עובד הסופי 10 מיקרוגרם / מ"ל FN ו - 4 מיקרוגרם / מ"ל נתרן מטא periodate. דגירה בצינור חשוך בטמפרטורת החדר למשך 30 דקות.
- הסרת עודפי DDH 2 O מפני השטח ג'ל מופעל שהוכנו 3.2.5 באמצעות הצנטריפוגה coverslip (<2 שניות). הימנע ייבוש ג'ל.
- Pipet ~ 500 μl של פתרון FN על משטח ג'ל מופעל דגירה עבור 1 שעה בטמפרטורת החדר.
- המקום coverslips במאכלים המכילים PBS (pH 7.4), מספיק כדי לכסות coverslip.
- לשטוף בהרחבה שוטף מספר (3-5) של PBS (pH 7.4).
- לעקר את coverslips על ידי שימוש במנדף מנורה קוטל חידקים בתרבית רקמה למשך 30 דקות.
- דגירה coverslips בתקשורת תא 30-45 דקות לפני תאים ציפוי.
- נטיה גורפת של חלבון ECM ב PAA ג'ל ידי Acryloyl-X, אסתר succinimidyl פרוטוקול זה נעשה לפני 2.5. אמינים הריאקטיבי על חלבונים מצמידים את מונומר acrylamide עם NHS אסתר כימיה ואז שיתוף polymerized לתוך חלק הארי של הג'ל PAA.
- המצומד ECM חלבון של הבחירה Acryloyl-X לפי הוראות היצרן. פתרונות במלאי של החלבון מצומדות צריך להיות מאוחסן ב 4 ° C.
- חישוב נפח של פתרון PAA עובד נדרש ייצור ג'ל (למשל 10 UL לכל coverslip).
- הפחת 50 μL (נפח של 10% למשל) של מים מהסכום המפורטים מתכון הפתרון עובד טבלה 1 ליזום פילמור.
- הסר נפח מחושב 3.3.2 ולהוסיף ECM / Acryloyl-X פתרון נפח של 10%. (לדוגמא: 1 μL של ECM / Acryloyl-X כדי μL 9 של פתרון PAA). צעד זה צריך להתבצע במהירות, כמו ג'ל הוא polymerizing.
- צעדים השלם 2.6 ו 2.7 כפי שתואר קודם לכן.
- לשטוף בהרחבה שוטף מספר (3-5) של PBS (pH 7.4), בתנאים סטריליים.
- לעקר את coverslips על ידי שימוש במנדף מנורה קוטל חידקים בתרבית רקמה למשך 30 דקות.
- דגירה coverslips בתקשורת תא 30-45 דקות לפני תאים ציפוי.
צעדים אלה נערכות לאחר התאים כבר מותר להפיץ על מצע ECM מצופים בג'ל (~ 6-12 שעות). כדי להרכיב את תא confocal הדמיה (RC-30WA), כדאי להתייעץ באתר מכשירים וורנר להדרכה.
- תא מדיה חם 0.5% או 0.25% טריפסין לטעון לתוך 5 מ"ל או 10 מ"ל במזרק.
- טען coverslip 22x30mm על בעל coverslip לראש מכשירים וורנר confocal הדמיה קאמרית (RC-30WA) באמצעות גריז ואקום כדי לשמור על coverslip במקום.
- המקום תא להרכיב אטם גומי על גבי coverslip, המאפשר גישה כניסת וגם צינורות פוליאתילן לשקע. זה יאפשר מרווח של בין 150-1000 מיקרומטר coverslip העליון ואת coverslip ג'ל מצופה 22x40mm, בהתאם לגודל של אטם בשימוש.
- טען מזרקים על צינור היניקה, באמצעות ערכת מחבר, ולבדוק כי התקשורת זורם דרך צינורות אל coverslip למעלה ובועות לא ניכרים קווי הזרימה.
- למרוח משחה על בסיס ואקום קאמרית ג'ל מצופה לטעון coverslip 22x40mm, התא כלפי מעלה. החל התקשורת חם לתאים.
- Coverslip למעלה המקום מחזיק על בסיס קאמרית, עם לשכת אטם המפריד אותה coverslip ג'ל מצופה. ודא סיכות איתור בתוך הבסיס קאמרית לשבת בתוך חורים איתור ב coverslip העליון.
- החל את פלייט לחץ לבסיס קאמרית להשתמש ברגים פלייט לחץ על בורג ולאבטח את פלייט לחץ.
- בדוק את זרימת התקשורת באמצעות צינורות ו קאמרית לפקח על כל ההדלפות הפוטנציאל בתוך חדר ולסלק כל מדיה ללא אזורי על פני התא. הערה: באמצעות מחט מד קטן לצייר ואקום קל בזמן יציקת עם התקשורת יכול לסייע במיגור התקשורת ללא אזורי.
- החל את תא הדמיה confocal למתאם שלב נמצא בתוך מחזיק מיקרוסקופ הדמיה.
- תמונה fluorescently שכותרתו חלבון חרוזי ניאון מוטבע בתוך מצע ג'ל על מיקרוסקופ פלואורסצנטי confocal.
- כדי להשיג תמונה של עמדות חרוז unstrained בתוך הג'ל, perfuse טריפסין לנתק הידבקויות הסלולר מתוך הג'ל, לקחת תמונה של חרוזי ניאון בתחום ההדמיה שבו התא דבק. השוואה של עמדות חרוז מתוח unstrained מאפשרת כימות של עקירה תחת מצע ג'ל התכווצות.
נציג תוצאות:
פרוטוקול לעיל מתאר את הליך הניסוי להכנת תואם ג'לים PAA ללימוד contractility התא מתוארת באיור 1. משטח ג'ל שהושגו עם פרוטוקול זה הוא שטוח יחסית וחלק, עם חרוזי ניאון מוטבע באופן שווה על פני (איור 2 א).
אם מדידת התכווצות ג'ל במיקום של הידבקויות מוקד, הדמיה של התא (איור 3A) משטח ג'ל (איור 3B) צריך להיעשות על המטוס אופטי confocal של הידבקויות מוקד. התכווצות של ג'ל ניתן דמיינו ידי עקירה של חרוזי ניאון מוטבע (איור 3B) על פני ג'ל כאשר תאים חסיד (מתוחים) לעומת מנותקת (unstrained). השימוש אלגוריתמים חישוביים יכול להניב המתיחה מדגיש הקשורים עקירה חרוז מודולוס אלסטיות המקביל ג'ל (איור 3C ו 3D) (Sabass et al. 2008). אם הדמיה מתרחש עמוק בתוך הג'ל, אז התקות חרוז יהיה קטן ולא מייצג של כוחות המתיחה המופעל על הידבקויות מוקד.
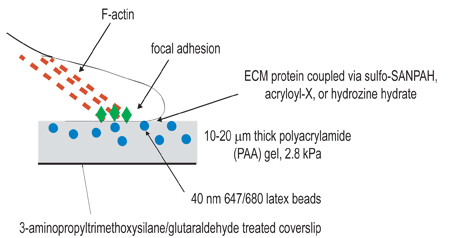
באיור 1. איור סכמטי של הגדרת הניסוי. המטרה הכללית של הליך זה היא ליצור מטריצות תואם לצורך לימוד התכווצות הסלולר. השלב הראשון של הליך הניסוי היא להפעיל coverslips על ידי טיפול amino-silane/glutaraldehyde לצורך עיגון ג'לים polymerized. הצעד השני הוא לפלמר ג'ל polyacrylamide, המכיל חרוזי ניאון, על coverslip הופעל. השלב השלישי כולל את כימי cross-linking של ליגנד תאיים על פני השטח של הג'ל polyacrylamide, באמצעות אחת משלוש שיטות צימוד רשום בשלב 3. תאים הם מצופה אז על הג'ל ואיפשר לדבוק ולהתפשט. תחת התכווצות הסלולר פעיל, חרוזים מוטבע הג'ל לעקור.

איור 2. פרוסת confocal אופטי של המשטח העליון של PAA ג'ל, כמו דמיינו ידי (א) חרוזי ניאון 40nm מוטבע בתוך ג'ל ו (ב) immunofluorescence פיברונקטין.

איור 3. תוצאה נציג לצורך הניסוי כוח המתיחה. (א) הידבקויות מיקוד בתא אוסטאוסרקומה U2OS האדם מarked על ידי ה-GFP-paxillin ו (ב) עמדות של חרוזי ניאון מוטבע הג'ל PAA הבסיסית הידבקויות מוקד של מתח (ירוק) ו unstrained (אדום) מדינות. החצים מצביעים על דוגמאות של עקירה חרוז. (ג) מתח גרירה וקטורים (ד ') המפה המתאימה חום בהיקף של המתיחה מדגיש נגזר התכווצות של ג'ל, באמצעות אלגוריתמים חישוביים (Sabass et al. 2008). בר סולם = 5 מיקרומטר.
טבלה 1:
דוגמה במלאי ועבודה PAA פתרונות (נתונים בטבלה 1 הושג הראשון Yeung et. Al. ואישר באופן עצמאי במעבדה שלנו.)
| במלאי פתרון PAA | ||||
| שאר מודולוס של PAA ג'ל (אבא) | 230 | 2833 | 8640 | 16344 |
| 40% Acrylamide (מ"ל) | 1.25 | 3.12 | 2.34 | 2.50 |
| 2% Bis-Acrylamide (מ"ל) | 0.50 | 0.83 | 1.88 | 0.60 |
| מים (מ"ל) | 3.25 | 1.04 | 0.78 | 1. 90 |
| סה"כ נפח (מ"ל): | 5 | 5 | 5 | 5 |
| עבודה פתרון PAA | ||||
| במלאי פתרון משומשים (אבא) | 230 | 2833 | 8640 | 16344 |
| פתרון נפח במלאי (μL) | 150 | 150 | 200 | 300 |
| מים (μL) | 341.75 | 341.75 | 291.75 | 191.75 |
| חרוזים (μL) | 5 | 5 | 5 | 5 |
| TEMED (μL) | 0.75 | 0.75 | 0.75 | 0.75 |
| APS 10% (μL) | 2.5 | 2.5 | 2.5 | 2.5 |
| הנפח הכולל (μL): | 500 | 500 | 500 | 500 |
| Acrylamide הסופי% | 3 | 7.5 | 7.5 | 12 |
| % סופי Bis-Acrylamide | 0.06 | 0.1 | 0.3 | 0.15 |
טבלה 2:
שאר מודולוס של PAA מצעים של acrylamide הסופי שונים bis-acrylamide באחוזים
| 12% Acrylamide | 7.5% Acrylamide | |||
| Bis-% Acrylamide | שאר מודולוס (אבא) | Bis-% Acrylamide | שאר מודולוס (אבא) | |
| 0.145 | 16344 | 0.01 | 689 | |
| 0.28 | 30067 | 0.03 | 1535 | |
| 0.45 | 34263 | 0.05 | 2286 | |
| 0.55 | 42375 | 0.075 | 2833 | |
| 0.575 | 50873 | 0.1 | 4069 | |
| 0.6 | 55293 | 0.2 | 5356 | |
| 0.3 | 8640 | |||
| 5% Acrylamide | 3% Acrylamide | |||
| Bis-% Acrylamide | שאר מודולוס (אבא) | Bis-% Acrylamide | שאר מודולוס (אבא) | |
| 0.05 | 430 | 0.02 | 1.3 | |
| 0.075 | 600 | 0.04 | 54 | |
| 0.1 | 1431 | |||
Discussion
ההליך המתואר כאן להתקנה של מיקרוסקופ כוח המתיחה (TFM) ניסוי, יחד עם יישום שגרת מעקב חישובית (Sabass et al., 2008), מאפשרת כימות של כוחות הסלולר עם רזולוציה מיקרון בקנה מידה מרחביים. כדי לייעל את פרוטוקול הניסוי, חיוני ליצירת מצע ג'ל טהור ואחיד עם ציפוי אחיד של ליגנד ECM. אנו ?...
Disclosures
Acknowledgements
אנו מודים במעבדה של אולריך שוורץ עבור תוכנת מעקב חישובית המשמש כימות של כוחות המתיחה הסלולר (Sabass et al. 2008). עבודה זו נתמכה על ידי פרס בורוז קריירה Wellcome ופרס פיוניר NIH של מנהל (DP10D00354) כדי ML Gardel רפואי המדען השירות הלאומי לחקר פרס (5 T32 GM07281) חורף SP.
Materials
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
References
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved