Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücresel Daralma miktarının Şikayet Matrisler hazırlanması
Bu Makalede
Özet
Bu video, hücre kültürü için uygun, uyumlu, ekstrasellüler matriks (ECM) kaplanmamış maddeler imal etmek için kullanılan deneysel teknikler göstermek ve çekiş gücü mikroskopi için uygun ve hücre davranışı üzerindeki etkilerinin gözlenmesi ECM sertlik.
Özet
Ekstrasellüler matriks (ECM) hücresel adezyon düzenlenmesi, hücre göçü ve ECM yeniden şekillenme için esastır. Odak yapışıklıklar makromoleküler meclisleri olduğunu çift ECM kontraktil F-aktin hücre iskeletinin. Bu bağlantı, hücre zarından substrate altında yatan, hücre içi mekanik güçlerin iletim sağlar. Son çalışmalar, ECM mekanik özellikleri, fokal adezyon ve F-aktin morfolojisi yanı sıra, hücre farklılaşması, bölünmesi, çoğalması ve göçü de dahil olmak üzere çok sayıda fizyolojik süreçleri düzenleyen göstermiştir. Böylece, hücre kültürü yüzeylerin kullanımı tam olarak kontrol ve ECM mekanik özellikleri modüle giderek daha yaygın bir yöntem haline gelmiştir.
Yapışık bir hücrede fokal yapışıklıklar çekiş kuvvetleri ölçmek için bir yöntem olarak adlandırılan çekim gücü mikroskobu (TFM) yüksek çözünürlüklü görüntüleme ve hesaplama teknikleri ile birlikte, uyumlu substratlar kullanılır. Bu teknik, hücresel daralma sonucu substrat deformasyonların yerel büyüklüğü ve yönü ölçümleri dayanmaktadır. Floresan etiketli proteinlerin yüksek çözünürlüklü floresan mikroskobu ile birlikte, sitoskeletal organizasyon ve yeniden yapılanma çekiş güçleri ile ilişkilendirilmesi mümkün.
Burada iki boyutlu hücresel daralma ölçmek için uygun bir iyi karakterize, ayarlanabilir mekanik sertlik, bir hücre kültürü substrat yaratma amaçlı, uyumlu matrislerin hazırlanması için ayrıntılı bir deney protokolünde mevcut. Bu protokoller poliakrilamid hidrojeller imalat, kaplama gibi jeller ECM proteinleri, jeller kaplama hücreleri, ve perfüzyon odasının kullanarak yüksek çözünürlüklü konfokal mikroskopi içerir. Buna ek olarak, veri atıf TFM protokolleri kullanarak hücresel güçlerinin konumu ve büyüklüğü gösteren temsili bir örnek sağlar.
Protokol
1. Lamel yüzey etkinleştirilmesi
- Lamelleri (# 1.5, 22x40 mm), temiz ve toz kaldırmak için, daha önce açıklanan bir protokol (Waterman-Storer, 1998) ve etanol sabunla yıkar bir dizi kullanılarak temizlenebilir.
- Paslanmaz çelik tutucu raf yerleştirin lamelleri, öyle ki lamelleri arayla ve değmiyor.
- Kimyasal davlumbaz (nitril eldiven ve gözlük önerilir), kare bir cam tabak (~ 350ml hacmi) doldurmak için nihai bir konsantrasyon için% 2 (2ml silan / 100 ml izopropanol) 3-isopropanol aminopropyltrimethoxysilane tam güç sulandırmak. Plastik ile reaktivite nedeniyle, izopropanol 3-aminopropyltrimethoxysilane uygulamak için bir cam Pasteur pipet kullanın.
- 1.2 'den tam 10 dakika için bu çözüm içine batırmayın lamelleri, davlumbaz bir heyecan plaka üzerinde yavaşça karıştırarak ederken.
- GKD 2 O (4 borsaları su) daldırma lamelleri yıkayın. 10 dakika karıştırma, son alışverişi için zaman iliklerine izin verin. Amino-silan içeren solüsyonlar, tehlikeli atık olarak bertaraf edilmelidir.
- Inkübatör Kuru lamelleri sıcak sıcaklığında (~ 37 ° C), tozsuz bir ortamda 10 dakika.
- Oda sıcaklığında soğutun.
- Davlumbaz, kare bir cam tabak içinde GKD 2 O% 1 glutaraldehid çözüm batırmayın lamelleri, 30 dakika boyunca plaka karıştırın .
- Karıştırma ile GKD 2 O 3 borsaları, döviz başına 10 dakika yıkayın. Glutaraldehid ile tehlikeli atık olarak bertaraf edin.
- Toz lamelleri yapışmasını önlemek için alüminyum folyo ile kaplanmış, oda sıcaklığında kurutun.
- 2 ay kadar tozdan uzak, kuru bir yerde saklayın.
2. Poliakrilamid Hazırlama (PAA) jel
- Tablo 1,% 40 Akrilamid ve% 2 bis-akrilamid, akrilamid / bis-akrilamid karışımı stok çözümleri hazırlayın. Biz farklı sertlik PAA jeller için optimize edilmiş çok sayıda hisse senedi çözümler korumak; örnekler Tablo 1 ve 2'de listelenmiştir. Stok çözeltiler 4 C'de karanlık bir şişe içinde tutulur sürece, birkaç yıl boyunca muhafaza edilebilir
- Çalışma çözümler akrilamid / bis-akrilamid son istenilen konsantrasyonları içeren stok çözeltileri elde edilir. Örneğin, biz 2.8kPa PAA jeller yapmak için çalışan bir çözüm GKD 2 O% 7.5 acrylamide/0.10% bis-akrilamid hazırlar.
- Degas akrilamid çözümü için bir vakum odasında 20 dakika, PAA polimerizasyon engelleyen çözüm içindeki oksijeni azaltmak için.
- % 10 amonyum persülfat (APS) solüsyonu (0.5g/5mL) hazırlayın. 3 gün içinde yeni bir çalışma stok kullanın. Alternatif olarak, hisse senetleri, daha sonraki tarihlerde kullanılmak üzere dondurularak muhafaza edilebilir.
- Akrilamid gaz alma iken, cam slayt yüzeyini hidrofobik yapmak şiddetle Yağmur-X mendil ile bir 1x3 "mikroskop cam slayt silin. Kapalı, kenara, nemli Kimwipe cam slayt silin. Set cam slayt aşırı Yağmur-X kaldırmak için.
- Akrilamid çözüm vakum odasından çıkarın ve floresan boncuk eklemek (hacimce% 1, Tablo 1'de yer alan çalışma çözümü için 5 ul). 0.75μl TEMED ekleyin ve jel polimerizasyonu başlatır 2.5 ul% 10 APS. Baloncuklar tanıtımı en aza indirmek için ~ 5 saniye boyunca pipetleme iyice karıştırınız.
- Damlacık üstüne 22x40mm lamel aktif hidrofobik mikroskop lamı (adım 2.4 hazırlanan) ve yer akrilamid çözüm 10-12 ul uygulayın. Jel tüm çözüm kat lamel gerekir. Çözümü içinde ortaya çıkabilecek herhangi bir kabarcıkları yumuşatır. ~ 10 dakika süreyle oda sıcaklığında polimerize jel solüsyonu izin verin.
- Polimerizasyon tamamlanması mikrosantrifüj tüp tersini kalan çalışma çözümü ile tespit edilebilir. Ayrıca, polimerize jel lamel kenarları uzak çekin. Makroskopik polimerizasyon görülmektedir hemen sonra, cam slayt lamel ayırın. Ince uçlu bir cımbız ya da jilet kenarı kullanarak, hidrasyon korumak için dikkatli bir şekilde, GKD 2 O mikroskop lamı yüzey ve batırmayın jel, jel takılı lamel kaldırmak.
3. PAA jel ekstrasellüler matriks (ECM) proteinleri Kaplin
PAA jel üst yüzey (3.1 ve 3.2) veya jel hacmi (3.3) içinde ECM protein içeren ya ECM protein eklemek için üç ayrı yöntem kullanılabilir. Burada, inkübasyondan sonra 1 saat süreyle 10 mg / ml fibronektin çözüm cam üzerine adsorbe miktarına eşdeğer bir yüzey ligand yoğunluğu sonucu PAA jeller fibronektin kaplin tartışmak. Tartışmaya bir yöntem seçiminde dikkat edilmesi gereken noktalar ayrıntılı olarak açıklanmıştır.
- Cross-bağlayan proteinler üzerinde Sulfo SANPAH Reaktif aminler PAA jel yüzey ECM protein kovalent çapraz bağlayıcı heterobifunctional Sulfo-SANPAH PAA jel yüzeye bağlı.
- S çözme Sulfo-SANPAH 40 ul çalışma alikotları hazırlayın susuz dimetil sülfoksit ulfo SANPAH tozu (DMSO) (ul Sulfo-SANPAH başına 20 mg). -80 Az sıvı azot ve mağaza Flash dondurma stokları ° C daha sonra kullanmak için.
- GKD 2 O bir lamel spinner (<2sn) kullanarak jel yüzeyden çıkarın. Jel kurutma kaçının.
- Kullanımdan hemen önce kat jel yüzey (~ 200 ul) GKD 2 O (2mg/ml pH 7) Sulfo-SANPAH-DMSO alikotları sulandırınız. Sulfo-SANPAH reaktivite yarılanma ömrü oda sıcaklığında su (~ 5 dk) kısa olduğunu unutmayın; bu nedenle, bu adımları hızlı bir şekilde yapılmalıdır.
- UV çapraz bağlayıcı fırında (1.5 dakika süreyle 2-3 santim mesafe 8W, 254 nm dalga boyu) UV ışığı jel yüzey Açığa. Sulfo-SANPAH turuncu ve kahverengi renk değişikliği.
- Dip UV-tedavi taze GKD 2 O ile beher lamelleri ve lamel spinner (<2sn) kullanarak jel yüzey aşırı su çıkarmak.
- Pipet ~ Parafilm Petri kabı kapta soğuk 1mg/ml Fibronektin (FN) (PBS, pH 7.4) 50 mcL. FN damla üst lamel haricindekileri, jel tarafı FN maruz.
- 4 ° C gecede 1-2 saat veya oda sıcaklığında reaksiyona girer.
- PBS (pH 7.4) içeren 6 cm doku kültürü yemekleri Yeri lamelleri, yeterli doku kültürü kaput steril koşullar altında, lamel kapsayacak.
- PBS (pH 7.4) steril koşullar altında birkaç yıkar (3-5), iyice yıkayın.
- 30 dakika süreyle doku kültürü kaput antiseptik lamba kullanımı lamelleri sterilize edin.
- Kaplama hücrelerine önce 30-45 dakika süreyle cep medya lamelleri inkübe edin.
- Çapraz bağlantı ECM okside proteinler üzerinde hidrazin hidrat Karbonhidrat gruplar tarafından PAA jel yüzey ve hidrazin hidrat ile jel akuple.
- 2. bölümünde açıklandığı gibi poliakrilamid jeller hazırlayın.
- Davlumbaz plastik Petri kabı ve eldiven kullanarak yerleştirin PAA jel lamelleri her PAA jel ve inkübe yüzeye en az iki saat süreyle, yaklaşık 1 ml sulandırılmamış hidrazin hidrat pipet, ama 24 saatten daha uzun
- Petri kabı GKD 2 O, hidrazin hidrat çözüm çıkarın ve tehlikeli atık olarak imha ediniz .
- Lamel batırmayın Petri kabı% 5 asetik asit ekleyin. Kapak ve bir saat süreyle inkübe edin.
- Asetik asit çıkarın ve GKD 2 O. ile yıkayın GKD 2 O bir saat süreyle inkübe edin. Lamelleri artık etkin ve çapraz bağ Fibronektin (FN) okside hazırız.
- Son bir 10 mg / ml konsantrasyon, 10 ul 940 ul karanlık bir mikro santrifüj tüpüne 50 mM sodyum asetat tamponu (pH 4.5) 1 mg / ml FN çözüm sulandırınız.
- 50 mM sodyum asetat tamponu (pH 4.5) 1 ml 80 mg sodyum meta-periyodat ekleyerek 20X sodyum meta-periyodat stok olun.
- Meta-periyodat stok 20X sodyum 50 ul 3.2.6 hazırlanan FN çözümü, bu son çalışma konsantrasyonu 10 mcg / ml FN ve 4 mg / ml sodyum meta-periyodat. 30 dakika boyunca oda sıcaklığında karanlık bir tüp içinde inkübe edin.
- Lamel spinner (<2 sn) kullanarak 3.2.5 hazırlanan jel yüzey aktif fazla GKD 2 O çıkarın. Jel kurutma kaçının.
- Pipetleyin ~ FN çözümü üzerine oda sıcaklığında 1 saat boyunca aktif jel yüzey ve inkübe 500 ul.
- PBS (pH 7.4) içeren yemekler Yeri lamelleri, lamel kapağı için yeterli.
- PBS birkaç yıkar (3-5) (pH 7.4) ile iyice yıkayın.
- 30 dakika süreyle doku kültürü kaput antiseptik lamba kullanımı lamelleri sterilize edin.
- Kaplama hücrelerine önce 30-45 dakika süreyle cep medya lamelleri inkübe edin.
- Toplu konjugasyon akriloil-X PAA jel ECM protein, succinimidyl ester Bu protokol 2.5 önce yapılır. Proteinlerin reaktif aminler NHS ester, kimya ile bir akrilamid monomer birleştiğinde ve sonra PAA jel dökme içine ko-polimerize.
- Akriloil-X, üreticinin talimatlarına göre tercih Konjugat ECM protein. Stok çözümler konjuge protein 4 saklanmalıdır ° C
- PAA jel fabrikasyon (örneğin lamel ortalama 10 uL) için gerekli çalışma çözeltisi hacmi hesaplayın.
- Tablo 1'de çalışma çözüm tarifi listelenen miktar su (örneğin% 10 hacmi) 50 mcL çıkarma ve polimerizasyon başlatabilir.
- 3.3.2 'de hesaplanan ses çıkarın ve% 10 hacim ECM / akriloil-X çözümü eklemek. (Örneğin 1 mcL PAA 9 mcL ECM / akriloil-X). Jel polimerize Bu adım, hızla yapılmalıdır.
- 2.6 ve 2.7 adımları tamamlayın daha önce açıklandığı gibi.
- PBS (pH 7.4) steril koşullar altında birkaç yıkar (3-5), iyice yıkayın.
- 30 dakika süreyle doku kültürü kaput antiseptik lamba kullanımı lamelleri sterilize edin.
- Kaplama hücrelerine önce 30-45 dakika süreyle cep medya lamelleri inkübe edin.
Bu adımlar, hücreleri ECM-kaplı jel substrat (~ 6-12 saat) yayılmasına izin edildikten sonra yapılır. Konfokal görüntüleme odası (RC-30WA) bir araya getirmek için, rehberlik için Warner Instruments web sitesine bakın yararlı.
- Sıcak hücre medya ve% 0,5 veya% 0.25 tripsin ve yük 5ml veya 10ml şırınga içine.
- Lamel yerinde tutmak için vakum yağ kullanarak bir Warner Instruments konfokal görüntüleme odası (RC-30WA) Top lamel sahibinin üzerine bir 22x30mm lamel yükleyin.
- Giriş ve çıkış polietilen boru erişim sağlayan, lamel üstüne kauçuk conta oluşturan bir odaya yerleştirin. Bu üst lamel ve kullanılan conta boyutuna bağlı olarak jel kaplı 22x40mm lamel, 150-1000 mm arasında bir boşluk sağlayacaktır.
- Konektörü kiti ve medya tüp yoluyla ve Top lamel üzerine akar ve hava kabarcığı akış hatları belirgin olduğunu kontrol yoluyla giriş boru üzerine Yük şırıngalar,.
- Odasının taban ve hücre tarafı kadar yük jel kaplı 22x40mm lamel üzerine vakum gres yağı uygulayın. Sıcak medya hücrelere uygulayın.
- Odası Conta jel kaplı lamel ayıran oda tabanına yerleştirin lamel tutucu,. Odanın tabanı içinde Konumlandırılması Pins Top lamel Konumlandırılması Delik içinde oturup emin olun.
- Basınç odasının tabanına Plaka uygulayın ve vida ve Basınç Plaka güvenli Basınç Plaka Anahtarı.
- Odanın içinde herhangi bir olası sızıntıları izlemek için tüp ve oda ile medya akışını kontrol edin ve hücre yüzeyinde herhangi bir medya-serbest bölgeler ortadan kaldırmak için. Not: medya ile beslerken hafif bir vakum çekmek için küçük bir iğne kullanarak, medya-serbest bölgeler ortadan kaldırmaya yardımcı olabilir.
- Görüntüleme için bir mikroskop sahibi içinde yer alan Sahne Adaptörü konfokal görüntüleme odasının uygulayın.
- Resim floresan etiketli konfokal bir floresan mikroskop jel substrat içinde gömülü protein ve floresan boncuk.
- Jel içinde yapmacıksız boncuk bir görüntü elde etmek için, jel hücresel yapışıklıklar ayırmak için tripsin serpmek ve floresan boncuklar hücre yapıştırılmış aynı görüntüleme alanında bir görüntü çekmek. Gergin ve yapmacıksız boncuk pozisyonların karşılaştırılması daralma altında jel substrat deplasman ölçümü için izin verir.
Temsilcisi Sonuçlar:
Yukarıdaki protokol hücre kontraktilite çalışmak için uyumlu PAA jeller hazırlamak için deneysel prosedürü açıklar ve Şekil 1'de gösterilmiştir. Bu protokol ile elde edilen jel yüzeyi boyunca eşit gömülü floresan boncuk (Şekil 2A), nispeten düz ve pürüzsüz.
, Odak yapışıklıklar konumu, hücre görüntüleme (Şekil 3A) ve jel yüzey (Şekil 3B) jel daralma, odak yapışıklıkların konfokal optik düzlemde ölçüm yapılması gerekir. Hücreleri yapışık (gergin) karşı müstakil (yapmacıksız) bir jel daralma gömülü floresan boncuk deplasman (Şekil 3B) jel yüzeyi ile görülebilmesi. Hesaplama algoritmaları kullanmak jel boncuk deplasman ve buna karşılık gelen elastik modülü (Şekil 3C ve 3D) (Sabass ve ark, 2008) ile ilişkili çekiş vurguluyor verebilmesidir. Görüntüleme jel içinde derin bir yer alırsa, o zaman boncuk değiştirmeler odak yapışıklıklar uygulanan çekiş güçleri temsilcisi küçük olmalıdır ve olacaktır.
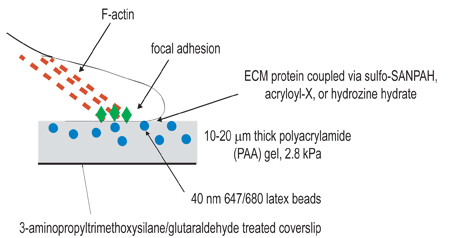
Şekil 1 deney düzeneği şematik gösterimi. Bu prosedürün genel amacı, hücresel daralma eğitim amaçlı uyumlu matrisler oluşturmak için. Deneysel işlemin polimerize jeller ankraj amaçlı amino-silane/glutaraldehyde tedavisi lamelleri etkinleştirmek için ilk adım. İkinci adım, aktif lamel üzerine, floresan boncuklar içeren bir poliakrilamid jel polimerize. Üçüncü adım, kimyasal içerir çapraz bağlayarak, 3. adımda listelenen üç kaplin teknikleri birini kullanarak, poliakrilamid jel yüzey ekstrasellüler ligand. Hücreler daha sonra, jel üzerine kaplama ve yapışır ve yaymak için izin verilir. Aktif hücresel daralma altında, jel gömülü boncuk yerinden.

Şekil 2 PAA jel üst yüzeyi Optik konfokal dilim gibi (A) floresan 40nm jel içinde gömülü boncuk ve (B) fibronektin immünofloresan tarafından görüntülendi.

Şekil 3 bir çekiş kuvveti deney için Temsilci sonucu. (A) bir insan osteosarkom U2OS hücre Odak yapışıklıklar mGFP-paxillin ve (B), gergin (yeşil) ve yapmacıksız (kırmızı) odak yapışıklıklar altında yatan PAA jel gömülü floresan boncuk pozisyonları arked. Oklar boncuk yerinden örnekler göstermektedir. (C) Çekiş stres vektörler ve çekiş (D.) karşılık gelen ısı ölçekli harita hesaplama algoritmaları kullanarak (Sabass ve ark, 2008), jel daralma türetilen vurguluyor. Ölçek çubuğu = 5 mm.
Tablo 1:
Örnek Stok ve PAA Çözümleri (Tablo 1 Veri Yeung ve ark. Arkadaşlarının elde edilen ilk ve bağımsız bizim laboratuar olarak teyit edildi. )
| Stok PAA Çözümü | ||||
| PAA Gel Kayma Modülü (Pa) | 230 | 2833 | 8640 | 16344 |
| % 40 Akrilamid (mL) | 1,25 | 3,12 | 2,34 | 2,50 |
| % 2 Bis-Akrilamid (mL) | 0,50 | 0,83 | 1,88 | 0,60 |
| Su (ml) | 3,25 | 1,04 | 0,78 | 1. 90 |
| Toplam Hacim (ml): | 5 | 5 | 5 | 5 |
| Çalışma PAA Çözümü | ||||
| Stok Çözüm İkinci el (Pa) | 230 | 2833 | 8640 | 16344 |
| Stok Çözüm Cilt (mcL) | 150 | 150 | 200 | 300 |
| Su (mcL) | 341,75 | 341,75 | 291,75 | 191,75 |
| Boncuk (mcL) | 5 | 5 | 5 | 5 |
| TEMED (mcL) | 0,75 | 0,75 | 0,75 | 0,75 |
| % 10 APS (mcL) | 2,5 | 2,5 | 2,5 | 2,5 |
| Toplam Hacim (mcL): | 500 | 500 | 500 | 500 |
| Final Akrilamid% | 3 | 7,5 | 7,5 | 12 |
| Final Bis-Akrilamid% | 0,06 | 0,1 | 0,3 | 0,15 |
Tablo 2:
PAA yüzeylerde çeşitli nihai Akrilamid ve bis-akrilamid yüzdelerini Shear Modülü
| 12% Akrilamid | 7.5% Akrilamid | |||
| % Bis-Akrilamid | Kayma Modülü (Pa) | % Bis-Akrilamid | Kayma Modülü (Pa) | |
| 0,145 | 16344 | 0,01 | 689 | |
| 0,28 | 30067 | 0,03 | 1535 | |
| 0,45 | 34263 | 0,05 | 2286 | |
| 0,55 | 42375 | 0,075 | 2833 | |
| 0,575 | 50873 | 0,1 | 4069 | |
| 0,6 | 55293 | 0,2 | 5356 | |
| 0,3 | 8640 | |||
| 5% Akrilamid | 3% Akrilamid | |||
| % Bis-Akrilamid | Kayma Modülü (Pa) | % Bis-Akrilamid | Kayma Modülü (Pa) | |
| 0,05 | 430 | 0,02 | 1,3 | |
| 0,075 | 600 | 0,04 | 54 | |
| 0,1 | 1431 | |||
Tartışmalar
Bu prosedür, hesaplama izleme rutinleri (Sabass ve ark, 2008) uygulanması ile birlikte, kurulum için bir çekim gücü mikroskobu (TFM) deneyi burada açıklanan mikron ölçekli mekansal çözünürlüğe sahip cep güçlerinin ölçümü için izin verir . Deney protokolünde optimize etmek için, ECM ligand tekdüze kaplama ile saf ve düzgün bir jel substrat oluşturmak için kritik öneme sahiptir. Aşağıda potansiyel tuzaklar tartışın:
Üniform Olmayan Jel Yüzey veya Te...
Açıklamalar
Teşekkürler
Ulrich Schwarz laboratuar hücresel çekiş güçleri ölçümü (Sabass ve ark, 2008) kullanılan hesaplama izleme yazılımı için teşekkür ederiz. Bu çalışma, bir Burroughs Wellcome Kariyer Ödülü ve ML Gardel ve Tıp Scientist Ulusal Araştırma Hizmet Ödülü (5 T32 GM07281) SP Kış NIH Müdürü Pioneer Ödülü (DP10D00354) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
Referanslar
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır