A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ampliPHOX איתור Colorimetric על ה-DNA microarray לשפעת
In This Article
Summary
ampliPHOX טכנולוגיית זיהוי colorimetric מוצג כחלופה זולה גילוי הקרינה עבור microarrays. בהתבסס על photopolymerization, ampliPHOX מייצר נקודות פולימר מוצק לעין עירומה רק כמה דקות. תוצאות הם צילמו אז לפרש באופן אוטומטי עם חבילת תוכנה פשוטה אך רבת עוצמה.
Abstract
Microarrays DNA התפתחו כמו כלי רב עוצמה לצורך זיהוי הפתוגן. 1-5 למשל, דוגמאות רבות של היכולת סוג נגיף שפעת תת הוכחו. 6-11 זיהוי subtyping של שפעת על microarrays DNA יש יישומים הן לציבור בריאות המרפאה לגילוי מוקדם, התערבות מהירה, למזער את ההשפעה של מגיפת שפעת. הקרינה מסורתית כיום זיהוי הנפוץ ביותר שיטת microarray. עם זאת, ככל שהטכנולוגיה מתקדמת לקראת microarray לשימוש קליני, 1 להחליף מכשור יקר עם טכנולוגיית זיהוי עלות נמוכה מפגין תכונות ביצועים דומים הקרינה יעשה מבחני microarray אטרקטיבי יותר וחסכונית.
הטכנולוגיה colorimetric ampliPHOX זיהוי מיועד יישומי מחקר, יש מגבלה של גילוי בתוך סדר גודל אחד של הקרינה המסורתית 11, עם יתרון העיקרי להיות העלות המשוערת של פי עשרה כלי נמוך בהשוואה סורקים microarray confocal נדרש הקרינה microarray זיהוי. יתרון נוסף הוא הקומפקטיות של המכשיר אשר מאפשר ניידות וגמישות, בניגוד מכשירים פלואורסצנטי המסורתית. בגלל הטכנולוגיה פילמור הוא לא ליניארי מטבעם כמו גילוי הקרינה, לעומת זאת, היא המתאימה ביותר עבור יישומים צפיפות נמוכה microarray שבו כן / לא לענות על נוכחות של רצף מסוים הוא הרצוי, כגון מערכי זיהוי הפתוגן. כיום הצפיפות במקום מקסימלית תואם זיהוי ampliPHOX הוא ~ 1800 נקודות / מערך. בגלל המגבלות צפיפות נקודה, microarrays צפיפות גבוהה יותר אינם מתאימים לאיתור ampliPHOX.
כאן, אנו מציגים טכנולוגיה ampliPHOX זיהוי colorimetric כשיטה הגברה אות על microarray צפיפות נמוכה פיתחה לגילוי ואפיון של נגיפי שפעת (FluChip). אף על פי פרוטוקול זה משתמש FluChip (microarray DNA) כיישום אחד ספציפי של ampliPHOX איתור, כל microarray שילוב היעד biotinylated ניתן שכותרתו זוהה באופן דומה. העיצוב microarray ו biotinylation יעד להישבות הם באחריות המשתמש. ברגע היעד biotinylated כבר שנתפסו על המערך, איתור ampliPHOX יכול להתבצע על ידי תיוג הראשון עם מערך המצומד streptavidin-תווית (ampliTAG). לאחר חשיפה לאור באמצעות Reader ampliPHOX, מכשיר פילמור של פתרון מונומר (ampliPHY) מתרחשת רק אזורים המכילים ampliTAG שכותרתו מטרות. הפולימר שנוצר יכול להיות מוכתם לאחר מכן עם פתרון רעיל כדי לשפר בניגוד חזותי, ואחריו הדמיה וניתוח באמצעות חבילת תוכנה פשוטה (ampliVIEW). Assay FluChip כולו ממדגם בלתי חילוץ לתוצאות יכול להתבצע על 6 שעות, הפעולות הגילוי ampliPHOX שתוארו לעיל ניתן להשלים כ -30 דקות.
Protocol
1. לדוגמא הגברה באמצעות RT-PCR
- תמצית רנ"א נגיפי מחומר קליני או נגיפי לבודד באמצעות MinElute ספין Qiagen ערכת וירוס בשיתוף עם פלטפורמה QIAcube אוטומטיות גרעין מיצוי חומצה. עקירות מבוצעות על דגימה 200 μl עם נפח elution הסופי של μl 60. תמציות חנות ב -70 ° C או נמוכה לשימוש מאוחר יותר.
- באזור החופשי תבנית, להכין את תערובת RT-PCR מאסטר על הקרח על פי פרוטוקול של היצרן. כדי לשלב ביוטין במהלך RT-PCR, שימוש בתערובת dNTP biotinylated במקום היצרן סיפק לערבב dNTP. עלות באמצעות תערובת dNTP biotinylated הוא פחות מ 1 $ USD / assay. שיטות חלופיות ההתאגדות ביוטין כגון שימוש פריימר biotinylated יכול לשמש גם. הוסף פריימר מתערבב בריכוזים הסופי של 1.0 מיקרומטר עבור שפעת A, 1.0 מיקרומטר עבור שפעת B, ו - 0.14 מיקרומטר על הבקרה הפנימית. שפעת ערכה פריימר מגביר את הגן מטריצה קטע (1032 מוצר NT) ואת ערכת שפעת תחל ב מגביר קטע הלא מבניים גן (811 מוצר NT). כל קבוצה פריימר FluChip מכיל פריימר עם קבוצת phosphoryl '5 כדי להקל על דור ה-DNA גדילי יחיד באמצעות עיכול אנזימטי עם exonuclease למבדה הבאים PCR. המוצר שהתקבל תקועים אחד דורש פעמים הכלאה קצר בהרבה המקבילה גדילי כפול משמעותית מקצרת את זמן assay הכוללת. תערובת מוכנה מראש של primers אלה, כמו גם תבנית RNA פנימית מלאה זמינים InDevR לחוקרים המעוניינים על בסיס מוגבל.
- בקצרה מערבולת ולהפיץ 18 μl של האב לתוך תערובת דק דופן צינורות PCR.
- העברת צינורות על הקרח לאזור עבודה מתאימה בנוסף התבנית, ולהוסיף 2 תבנית μl אל צינור כל תגובה.
- העברת צינורות PCR כדי Cycler תרמית, ולהפעיל את פרופיל תרמית הבאים: שעתוק לאחור על 50 מעלות צלזיוס למשך 30 דקות, איון אנזים / הפעלה ב 95 מעלות צלזיוס למשך 15 דקות, 40 מחזורי PCR של 95 מעלות צלזיוס למשך 30 שניות, 55 ° C עבור ה -30, ו - 72 מעלות צלזיוס במשך 1 דקות, וכן הרחבה סופית ב 72 מעלות צלזיוס למשך 10 דקות.
2. הכלאה של RT-PCR מוצרים microarrays צפיפות נמוכה
- על מנת להפיק DNA גדילי יחיד עבור הכלאה FluChip, להכין את התערובת עיכול אנזימטי על ידי שילוב של 1.0 למבדה μl exonuclease האנזים, 2.2 μl של למאגר התגובה הנלווה, ו 0.8 μl מים nuclease חינם. כמויות אלה הן למדגם יחיד, אך ניתן לשנותם פשוט על המספר הכולל של הדגימות להתעכל. הסר דגימות Cycler תרמי להוסיף 4 μl של התערובת מוכנה התגובה לכל לעכל את גדיל פוספורילציה של המוצר PCR. חזור דגימות Cycler תרמי התוכנית Cycler תרמית 37 מעלות צלזיוס למשך 15 דקות ואחריו 95 מעלות צלזיוס למשך 10 דקות כדי להשלים עיכול אנזימטי ופיצול צעדים חום.
- Microarrays שפעת אישית בשימוש מודפסות בשקופיות אלדהיד פונקציונליות זכוכית על ידי אפלייד microarrays Inc (בטמפה, AZ). 5'-amino רצפים ללכוד הסתיים משולבים עם חיץ אכון אופטימיזציה מודפס בריכוז סופי של 20 מיקרומטר (למעט רצף הבקרה החיובית אשר בנוסף יש שינוי 3'-ביוטין, והוא הבחין בריכוז הסופי של 500 ננומטר) . ללא מגע תצפית השיטה משמשת, בקוטר נקודה אופטימלית של 300 מיקרומטר מרכז אל מרכז המגרש 700 מיקרומטר.
- הסר microarrays מתיבת אחסון להחיל לשימוש יחיד בארות הכלאה סביב microarrays על ידי הסרת סדין מגן לחיצה בחוזקה מסביב היטב.
- המקום שקופיות לפח לשטוף המכילה 110 מ"ל של מים מטוהרים במשך 5 דקות לשטוף מראש הכלאה באמצעות שייקר מסלולית בסל"ד 60-90. יבש בעדינות את המערך על ידי נגיעה מגב רקמות לשפת הבאר ומאפשר למים להיות רשע משם.
- שלב 22 μl של הצפת הכלאה 2x עם כל המוצרים מקוטעת ssDNA, ו 40 pipet μl של פתרונות הכלאה לתוך בארות microarray.
- אפשר שקופיות להכליא בתא לחות סגור למשך 60 דקות.
- הסר את השקופיות מן החדר לחות, בקצרה לשטוף מערכים עם שטפי הצפת D בבקבוק לשטוף לפני הצבת למעמד שקופיות. בדרך כלל נפח שטיפה של שטפי הצפת D הוא 2 מ"ל לכל המערך. שקופית המקום מדף המכיל שקופיות סל כביסה המכילה 110 מ"ל לשטוף הצפת המקום א סל על מסלולית שייקר בסל"ד 60-90 דקה 1.
- הסר מתלה שקופיות הצפת לשטוף, בקצרה לשטוף עם שטפי הצפת D, החלק העברת מתלה לסל המכיל מאגר B לשטוף, ולנער בסל"ד 60-90 במשך 5 דקות.
- יבש בעדינות את המערך בכל שקופית, שקופיות מקום יבש בתא לחות לקראת השלבים ampliPHOX Colorimetric איתור.
3. ampliPHOX: תיוג המוצר הכלאה שבבי כיול עם ampliTAG
- לשלב 10 μl של ampliTAG, 20 μl של חיץ ampliTAG 2x, ו - 10 μl של מים מטוהרים עבור כל מערך להיות מעובד. כרכים מגיב וניתן לשנותם פשוט על המספר הכולל של הדגימות. הקפד להכין תערובת תיוג מספיק כדי להסביר את כל מערכי המדגם מערכי כיול הצורך. מספר שבבי כיול צורך תלוי אם אתה מבצע כיול מלא (עבור מכשיר חדש, או הרבה החדשה של ריאגנטים), או פשוט לבדוק את המכשיר. עבור כיול מלא, 3 שבבי כיול צריך להיות מתויג, ואת לבדיקה מגיב, רק שבב יחיד כיול צריך להיות מתויג. שים לב לפני מערכי כיול מסומנים, הם צריכים לעבור שלב טרום הכלאה הכביסה אשר תוארה בעבר עבור מערכי שפעת.
- העברת 40 μl של תערובת תווית למערך כל ולאפשר תיוג התגובה להמשיך בתא לחות סגור במשך 5 דקות.
- מיד לשטוף מערכים עם שטפי הצפת D בבקבוק לשטוף לפני הצבת שקופיות במעמד שקופיות. העברת מתלה לפח המכיל 110 מ"ל של שטפי הצפת C, לנער בסל"ד 60-90 במשך 5 דקות.
- שימוש סל לשטוף שני, מלא מים מטוהרים, לבצע שלוש מטבלים ברציפות מים קצרה כדי להסיר שאריות מלח. יבש מערכי בעדינות על ידי נגיעה מגב רקמות לקצה את הבארות.
- Microarrays כיום שכותרתו כראוי עם ampliTAG, והיתר של הליך זיהוי ampliPHOX יכול להתבצע. Photoactivation הדמיה של מערכי שכותרתו אמורה להסתיים בתוך 24 שעות, ומערכים נוספים ניתן לאחסן בתיבת שקופית כהה עד לשימוש.
4. ampliPHOX: כיול, הגברה אות, הדמיה
- הפעל ampliPHOX הקורא ולהבטיח תוכנה ampliVIEW מוכן photoactivation.
- קבע את זמן photoactivation אופטימלי באמצעות שבבי כיול. בנוסף במבוא קצר העוקב, הליך זה הוא התווה גם במדריך מבצע ampliPHOX בפירוט. שבבי כיול מכילים סדרה של דילולים של רצף בקרה biotinylated כי מנוצלים כדי לייעל את הרגישות של assay, במטרה למקסם את מספר השורות של השבב כיול המייצרים איתות חיובי כפי שנקבע על ידי התוכנה.
- הסר ampliPHY מ 4 ° C, לאפשר לחמם לטמפרטורת החדר, והמערבולת בקצרה לערבב. 3 Pipet μl של ampliPHY משפר לתוך הבקבוקון ampliPHY, והמערבולת ביסודיות במשך 10 שניות.
- באופן שווה להעביר 40 μl של פתרון ampliPHY לתוך microarray היטב המכיל את ampliTAG שכותרתו מערך, להבטיח כי בועות לא נוכחים. סגור את הבקבוקון ampliPHY בין כל יישום. הכנס את השקופית microarray למפרץ photoactivation של הקורא ampliPHOX.
- עבור מערך הכיול הראשונה, להשתמש photoactivation ברירת המחדל זמן בתיבת 'זמן' בלוח השמאלי של התוכנה, ולחץ על 'התחל' הירוק כפתור כדי להפעיל את photoactivation. לאחר השלמת, הסר את מערך ולשטוף עם מים מטוהרים להסיר ampliPHY עודף. נקה היווצרות פולימר על כמה נקודות צריך עכשיו להיות גלוי.
- אפשר כתמים פולימר להתייבש במשך 2 דקות, ולאחר מכן להפיץ שתי טיפות ampliRED על מערך ולאפשר מכתים להמשיך במשך 2 דקות.
- בשלב הבא, במהירות microarray לשטוף עם מים מטוהרים ויבש עם רקמות לנגב.
- הכנס microarray לתוך המפרץ הדמיה של Reader ampliPHOX, ולחץ על כפתור 'תמונה לכידה חדש' בכרטיסייה הדמיה. צילמו פעם, להתאים את היבול ולשמור את התמונה.
- בכרטיסיה ניתוח, בחר את שבב כיול מסכה על כפתור 'מיקום אוטומטי "כדי להתחיל את הניתוח. התוכנה באופן אוטומטי לייצר "שיא סיכום 'מציג את תוצאות לכימות. בהתבסס על תוצאות אלו, בזמן photoactivation מותאם על ידי 10 שניות עבור מערך הכיול השני, הנוהל חזר.
- לאחר זמן photoactivation האופטימלי נקבע, מערכי המדגם יכול להיות מעובד באמצעות הגברה אות באותו פרוטוקול הדמיה המשמש מערכי כיול.
- ברגע שהתמונה כבשו עבור מערכי המדגם, מסכה עבור פריסת מערך מסוים שלך כגון הפריסה שפעת מערך המתואר כאן יכול להיות תוכנה created.The ampliVIEW הוא מסוגל לבצע ניתוח תמונת אוטומטיות להפקת התוצאות שפעת subtyping עבור כל דגימה.
5. נציג תוצאות:
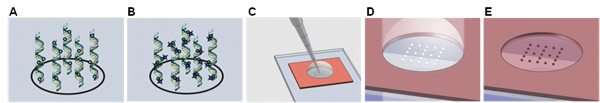
באיור 1. איור סכמטי של שיטת זיהוי ampliPHOX colorimetric. (א) ה-DNA היעד Biotinylated הוא הכלאה לזהות כל אחד במערך, ו - (ב) שכותרתו עם ampliTAG. (ג) פתרון ampliPHY הוא הוסיף אז, (ד) חשיפה לאור כדי ליצור פולימר כתמים נראים לעין. (ה) נקודות הפולימר נוצר מוכתמות לאחר מכן עם צבע רעיל כדי לשפר את החדות.
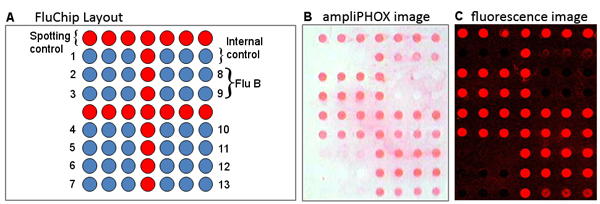
איור 2. (א) שפעת פריסת microarray צפיפות נמוכה. רצפים 1-7 ו - 10-13 שפעת היעד, רצפים 8, 9 היעד שפעת B. (B) ampliPHOX ו (ג) תמונות הקרינה של 2009 הרומן H1N1 ("שפעת החזירים") הדגימה מראה את דפוס זיהוי זהה על ידי שני שיטות.
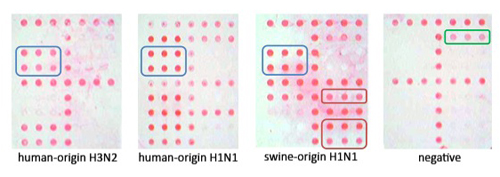
איור 3. משמאל לימין, תמונות מייצג ampliPHOX לשפעת H3N2, מוצא האדם, H1N1, H1N1 2009 רומן (החזירים המוצא), ו טיפוס שלילי. כל 3 תת מראים דפוסים ברורים ויזואלית במערך. שימו לב שלילית שרק הבקרה הפנימית MS2 נתפסת, המציין את ההגברה RT-PCR לא היה עצור.
Discussion
הטכנולוגיה colorimetric ampliPHOX זיהוי המוצגת כאן היא אלטרנטיבה מהירה, זולה זיהוי צבע פלואורסצנטי יחיד עבור יישומים microarray צפיפות נמוכה. מוצג באופן סכמטי באיור 1, עיקרון הזיהוי מבוסס על שימוש של תווית photoinitiator (1B). בנוכחות פתרון מונומר המכילים (1C), חשיפה לאור גורמת photoiniti...
Disclosures
Acknowledgements
InDevR מודה NIH / NIAID U01AI070276 ו R43AI077112 למימון עבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב / ציוד | יצרן | קטלוג # | תגובות |
|---|---|---|---|
| Qiagen ספין MinElute וירוס Kit | Qiagen | 57704 | יחידה 60 μl elution |
| QIAcube | Qiagen | 9001292 | אופציונלי |
| ABI 9800 Fast Cycler תרמי | Applied Biosystems | 4441166 | |
| Qiagen OneStep RT-PCR ערכת | Qiagen | 210210 | ערכת dNTPs לא בשימוש |
| מאגר אכון 2x | InDevR בע"מ | MI-5007 | |
| מערבבים Biotinylated dNTP | InDevR בע"מ | MI-5009 | |
| Lambda exonuclease | Epicentre ביוטכנולוגיות | LE032K | 2500 U, 10U/μl |
| FluChip תערובת פריימר | InDevR | N / A | שאינם זמינים עדיין למכירה |
| Orbital שאכר | Madell טכנולוגיה | ZD-9556-A | |
| לשטוף בינס | InDevR בע"מ | MI-4002 | |
| לשטוף Racks | InDevR בע"מ | MI-4003 | |
| הכלאה 2x הצפת | InDevR בע"מ | MI-5004 | |
| כיול Chips | InDevR בע"מ | AP-5006 | |
| לשטוף Buffers AD | InDevR בע"מ | MI-5005 | |
| ampliRED | InDevR בע"מ | AP-5004 | |
| ampliTAG | InDevR בע"מ | AP-5001 | |
| 2x ampliTAG הצפת | InDevR בע"מ | AP-5002 | |
| ampliPHY, משפר ampliPHY | InDevR בע"מ | AP-5003 |
References
- Kumar, R. M. The Widely Used Diagnostics "DNA-Microarray"-A Review. Amer J Inf Dis. 5, 207-218 (2009).
- Miller, M. B., Tang, Y. W. Basic Concepts of Microarrays and Potential Applications in Clinical Microbiology. Clin Microbiol Rev. 22, 611-633 (2009).
- Mikhailovich, V., Gryadunov, D., Kolchinsky, A., Makarov, A. A., Zasedatelev, A. DNA microarrays in the clinic: infectious diseases. BioEssays. 30, 673-682 (2008).
- Call, D. R. Challenges and opportunities for pathogen detection using DNA microarrays. Crit Rev Microbiol. 31, 91-99 (2005).
- Raoult, D., Fournier, P. E., Drancourt, M. What does the future hold for clinical microbiology. Nat Rev Microbiol. 2, 151-159 (2004).
- Dawson, E. D., Rowlen, K. L., Wang, Q., Tao, Y. J. MChip: A Single Gene Diagnostic for Influenza A. Influenza: Molecular Virology. , (2010).
- Gall, A., Hoffman, B., Harder, T., Grund, C., Ehricht, R., Beer, M. Rapid hemagglutinin subtyping and pathotyping of avian influenza viruses by a DNA microarray. J Virol Meth. 160, 200-205 (2009).
- Townsend, M. B., Dawson, E. D., Mehlmann, M., Smagala, J. A., Dankbar, D. M., Moore, C. L., Smith, C. B., Cox, N. J. FluChip: Experimental evaluation of a diagnostic influenza microarray. J Clin Microbiol. 44, 2863-2871 (2006).
- Wang, Z., Daum, L. T., Vora, G. J., Metzgar, D., Walter, E. A., Canas, L. C., Malanosky, A. P., Lin, B., Stenger, D. A. Identifying influenza viruses with resequencing arrays. Emerg Inf Dis. 12, 638-646 (2006).
- Kessler, N., Ferraris, O., Palmer, K., Marsh, W., Steel, A. Use of the DNA Flow-Thru Chip, a three-dimensional biochip, for typing and subtyping of influenza viruses. J Clin Microbiol. 42, 2173-2185 (2004).
- Kuck, L. R., Taylor, A. W. Photopolymerization as an innovative detection technique for low-density microarrays. Biotechniques. 45, 179-186 (2008).
- Avens, H. J., Bowman, C. N. Development of fluorescent polymerization-based signal amplification for sensitive and non-enzymatic biodetection in antibody arrays. Acta Biomat. 6, 83-89 (2010).
- Sikes, H. D., Jenison, R., Bowman, C. N. Antigen detection using polymerization-based amplification. Lab on a Chip. 9, 653-656 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved