Method Article
הערכה של ספיגת nanoparticle ב גידולים בזמן אמת באמצעות הדמיה Intravital
In This Article
Summary
אנו מציגים גישה חדשנית לכמת לוקליזציה nanoparticle ב vasculature של גידולים xenografted אנושי באמצעות דינמי, בזמן אמת הדמיה intravital במודל העובר העופות.
Abstract
טכנולוגיות הדמיה נוכחית הגידול, כגון אולטראסאונד, MRI, PET ו-CT, אינם מסוגלים להניב תמונות ברזולוציה גבוהה להערכת ספיגת nanoparticle בגידולים ברמה המיקרוסקופית 1,2,3, המדגיש את התועלת של מודל xenograft מתאים שבו לבצע ניתוחים ספיגת מפורט. כאן, אנו משתמשים ברזולוציה גבוהה הדמיה intravital להעריך ספיגת nanoparticle ב xenografts סרטניים אנושיים במודל שונה, העובר פגז פחות עוף. המודל עובר העוף במיוחד היטב מתאים אלה מנתח vivo משום שהוא תומך צמיחה של גידולים אנושיים, הוא זול יחסית ואינו דורש הרדמה או ניתוח 4,5. תאים סרטניים בצורה מלאה xenografts vascularized בתוך 7 ימים, כאשר מושתלים לתוך קרום chorioallantoic (רמ"א) 6. גידולים וכתוצאה מכך הם דמיינו ידי הדמיה לא פולשנית בזמן אמת, ברזולוציה גבוהה אשר יכול להישמר לתקופה של עד 72 שעות עם מעט השפעה על המארח או מערכות גידול. חלקיקים עם מגוון רחב של גדלים ניסוחים מנוהל דיסטלי אל הגידול ניתן דמיינו לכמת כמו זרימת הם דרך מחזור הדם, extravasate מ vasculature הגידול דולפים, ולצבור באתר הגידול. אנו מתארים כאן את הניתוח של חלקיקים שמקורם וירוס פסיפס Cowpea (CPMV) מעוטרת קרוב אינפרא אדום צבעי ניאון ו / או פולימרים פוליאתילן גליקול (PEG) 7, 8, 9,10,11. עם עירוי לוריד, חלקיקים אלה הם הפנימו במהירות ויראלי ידי לתאי אנדותל, וכתוצאה מכך תיוג גלובלית של vasculature הן מחוץ ובתוך 7,12 הגידול. PEGylation של חלקיקים נגיפיים מגביר פלזמה שלהם זמן מחצית החיים, מרחיב את זמנם במחזור הדם, ובסופו של דבר משפר את הצטברות שלהם בגידולים באמצעות חדירות משופרת (EPR) אצירת אפקט 7, 10,11. השיעור וההיקף של הצטברות של חלקיקים הגידול נמדד לאורך זמן באמצעות תוכנת ניתוח התמונה. טכניקה זו מספקת שיטה הן לחזות ולכמת הדינמיקה nanoparticle בגידולים אנושיים.
Protocol
1. הרכבה של הגידול לתוך CAM העובר העופות
- הכן פגז פחות עוברי תרנגולת מופרית כפי שתואר 8.
- ביום 9 של ההתפתחות העוברית, להרכיב מיקרו הזרקה באמצעות מחט 18-מד מחובר על מזרק 1 מ"ל. לחתוך 5-6 ס"מ חתיכת צינור Tygon (1 / 32 "קוטר פנימי, 3 / 32" קוטר חיצוני, 1 / 32 "עובי דופן) בזהירות להכניס שפוע של מחט לתוך צינורות. כ 4-5 ס"מ של צינורות צריך להאריך מקצה המחט (איור 1 א).
- מלאו את המזרק צינורות עם ההשעיה התא. לאחר מכן, הכנס מחט זכוכית microinjection בסוף בצינור ובזהירות להסיר בועות אוויר.
- הזרק יום 9 עוברי (איור 1b) תחת בהיקף דיסקציה עם המאייר עם 10,000-100,000 תאים סרטניים כמו בולוס בתוך CAM (איור 1 ג'). לאט לאט ובזהירות להזריק תאים להבטיח כי המחט נמצאת במקום הנכון עבור התאים לצורה בולוס גלוי בתוך CAM. תאים לטפטף על פני השטח CAM ניתן לנקות באמצעות המוליך Kimwipe או אחר.
- חזור אל העוברים באינקובטור humidified ב 38 ° C לחות על 60% ולאפשר הגידול לגדול vascularize (עד 7 ימים).
2. הכנה של חלקיקים
- כדי להכין שכותרתו fluorescently חלקיקים CPMV עבור הזרקה לתוך העובר עוף; לדלל את חלקיקים נגיפיים (מסונתז כמו 8 ב-PBS, pH 7.4, ריכוז של 100 מיקרוגרם תערובת / ml וורטקס היטב לפני השימוש ו צנטריפוגות במשך דקה אחת כדי להסיר. אגרגטים. Sonication יכול להיות גם שימושי, תלוי conjugates ומידת צבירה. מניות של CPMVs שכותרתו fluorescently יציבים במשך שנה לפחות 1 כאשר מאוחסנים 4 ° C בחושך. בדוק מניות מעת לעת על ידי הצבת כמה טיפות לשקופית זכוכית בדיקת הקרינה. במיקרוסקופ אלקטרונים הילוכים (TEM) יכול לשמש גם כדי לקבוע אם חלקיקים נותרו על כנן לאחר הצמידה.
- בקצרה, אחד מיקרוגרם של חלקיקים נגיפיים (נפח סופי של μl 2) ניתן להוסיף רשתות נחושת מצופה. לאחר מכן, הוסף נפח שווה של אצטט uranyl 2% למשך דקה 1 על מיקרוסקופ אלקטרונים (פיליפס EM 410).
3. הזרקה תוך ורידי של חלקיקים נגיפיים fluorescently שכותרתו
- ביום 16, להרכיב מיקרו ההזרקה כפי שתואר לעיל. צייר את העוצמה הרצויה של nanoparticle ויראלית דרך צינורות לתוך המזרק (> 200 μL). בזהירות להסיר את כל בועות האוויר. הכנס זכוכית מחט microinjection בסוף הצינור. ודא כי המחט היא עוד והצרות ככל האפשר (איור 2 א). אם המחט היא בוטה מדי, הוא לא יוכל לחדור מבעד האאקטודרם ו ייכשל לחדור אל הספינה. אם המחט היא חדה מדי, טיפ תקרוס כאשר חודר לרקמות.
- להזריק לווריד 100 μl של 1 מ"ג / מ"ל והעמסת dextran (MW 70,000 דא, Invitrogen) לתוך העובר הנושאת גידול דיסטלי מאתר הרצוי להיות דמיינו (איור 3d). Cannulation מוצלח של וריד CAM ניכר ידי ניקוי הדם בנתיב הזרימה הזרקה (איור 2b). הערכת כלי דם דליפה 1 שעה לאחר ההזרקה.
- להזריק לווריד 50 μl של 1 מ"ג / מ"ל פתרון של CPMV-Alexa פלואוריד 647 (CPMV AF-647) או PEGylated CPMV-Alexa פלואוריד 647 (CPMV-PEG-AF 647) לעוברי המכיל גידולים עם כלי דם דליפה דיסטלי מהאתר הרצוי להיות דמיינו.
- תמונה גידולים מיד וכל שעה לאחר ההזרקה באמצעות בוחן Zeiss Z1 מיקרוסקופ זקוף מצויד בדיסק Yokogawa ספינינג, Hamamatsu ImagEM 9100-12 EM-CCD המצלמה.
4. בזמן אמת הדמיה intravital
- כדי להרכיב את יחידת ההדמיה העובר, למרוח שכבה דקה של שומן ואקום סביב היקף של הנמל הדמיה על החלק התחתון של המכסה של יחידת ההדמיה העובר, ובכושר 18 מ"מ זכוכית coverslip על הנמל.
- מקם את העובר כך coverslip יכסה את האזור הרצוי עבור הדמיה. לאט לאט להוריד את המכסה עד coverslip רק יוצר קשר עם העובר, ולאחר מכן להבריג את המכסה על היחידה כדי להחזיקו במקום (איור 2 ג).
- מוסיפים מים מחוממת 37 מעלות צלזיוס ליחידה העובר הדמיה מחוץ מאכל המכיל את העובר, ולאחר מכן למקם את היחידה כולה על הבמה של מיקרוסקופ confocal זקוף עם תא סביבתיים בתוך equilibrated עד 37 ° C.
- מיקום הדמיה היחידה המכילה את העובר תחת מיקרוסקופ פלואורסצנטי ספינינג דיסק confocal (2e איור). יחידת הדמיה תחזיק את העובר במקום לשמור את שדה הראיה קבוע בעת לכידת תמונות, המאפשרת גם תלת מימדי ערימות Z ו - זמן לשגות תמונות כדי ליפול בפח. אנו לרכוש ולנתח תלת ממדי זמן לשגות תמונות באמצעות פרקין אלמר של (לשעבר אימפרוביזציה) Volocity חבילת תוכנה (איור 3a). לרכוש ברזולוציה גבוהה תלת ממדי ערימה של הגידול ואת כלי הדם שמסביב לדמיין detaileד מנתח מבניים בזמן נקודות ספציפיות. רוכשת תלת ממדי ערימות בזמן נקודות קבוע למפות השינויים המבניים המפורטים בכלי הדם של הגידול. גידולים תמונה כל שעה לאחר ההזרקה.
- לכמת את ספיגת של חלקיקים נגיפיים על ידי חישוב ממוצע אלקסה פלואוריד (AF) 647 אות בתוך אזורים נבחרים הגידול או את התוכנה stroma (שאינם סרטניים באזור) באמצעות תמונה quantitation כגון Volocity (פרקין אלמר). הגידול יחס stroma היה מחושב על ידי חלוקת אומר AF 647 אות בגידול מעל האות כלומר 647 AF ב stroma. יחס הגידול / stroma גבוה יותר מאשר 1 מציין כי nanoparticle הוא נלקח על ידי הגידול.
5. נציג התוצאות:
בדוגמה המתוארת כאן, אנו מזריקים HT-29 בתאי סרטן המעי הגס כדי ליצור בולוס כ 1mm בגודל בתוך CAM של 9 יום עוברי תרנגולת (איור 1b). לאחר חיסון, העוברים היו בתרבית למשך 7 ימים בתוך חממה humidified להתיר הגידול כלי דם מספקת (איור 1 ג'). עוברים היו מוזרק לווריד עם משקל מולקולרי נמוך dextran לאשר כלי דם סרטניים, גידולים היו דמיינו תחת מיקרוסקופ AxioExaminer Z1 Zeiss זקופה (איור 2).
לאחר עירוי לוריד של CPMV AF-647 או CPMV-PEG-AF 647 חלקיקים (איור 3 א ו - ב), ברזולוציה גבוהה חשף בזמן אמת confocal הדמיה (2e איור) כי הן CPMV CPMV ו-PEG חלקיקים שכותרתו במהירות vasculature כולו, אבל את ספיגת של CPMV-PEG על ידי הגידול היה כ 3 פעמים גבוה יותר מאשר CPMV לאחר 12 שעות (איור 3 א). ספיגת הגידול היחסי של חלקיקים נקבע באמצעות ניתוח התמונה תוכנה (Volocity מן פרקין אלמר). אזורים של עניין נבחרו ומחוצה הגידול (בתא סטרומה) ואת עוצמת הקרינה הממוצע של כל אחד נקבע. נתונים מבוטא יחס הגידול / stroma.
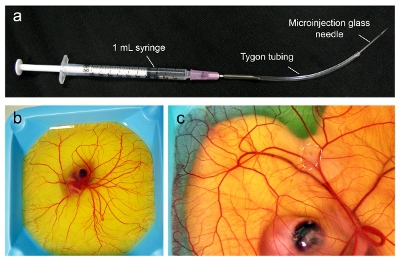
באיור 1. Microinjection של גידולים תוך CAM של העובר העופות. (א) מנגנון microinjection מורכב מן הרכיבים כפי שצוין. (ב) עוברי העופות ביום 9 מוכנים להיות מחוסן עם הגידול כאשר CAM התפשט לכסות את כל פני השטח. (ג) בשעה 16 יום, הגידול יהיה גדלו עד 1 ס"מ קוטר (קו מקווקו) והוא מוכן להזרקה עם חלקיקים.
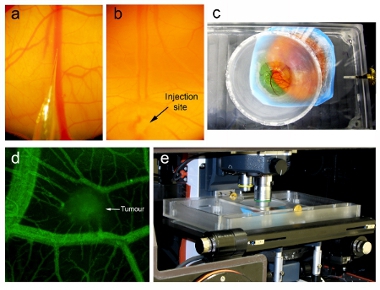
איור 2. הזרקה Nanoparticle הדמיה intravital. הזרקה תחת מיקרוסקופ לנתיחה מראה (א) את קצה המחט microinjector מוכן להיות מוזרק לווריד CAM ו (ב) את המחט microinjector המוחדרת לווריד (מסומן בחץ) חלקיקים מוזרק זרימת הדם (ראו ידי ניקוי של דם). (ג) העובר המכיל יחידת דימות עם העופות coverslip interfaced ישירות עם רמ"א. (ד) לפני הזרקת nanoparticle, כלי הדם הגידול הוערכה באמצעות הדמיה intravital לאחר ההזרקה של והעמסת dextran. (ה) יחידת ההדמיה העובר המכיל את מיקומו על הבמה של מיקרוסקופ confocal זקוף בתוך קבוצת בטמפרטורה מוסדר המתחם עד 37 ° C.
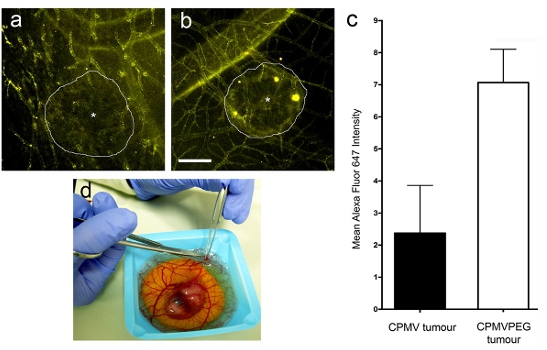
איור 3. להדמיה Intravital של ספיגת nanoparticle בגידולים אנושיים. גידולים הם דמיינו 7 שעות לאחר ההזרקה של (א) CPMV-AF647 ו (ב) CPMV-PEG-AF647. ד) כריתה של הגידול מעובר העופות לניתוח שלאחר מכן.
Discussion
קרום chorioallantoic (רמ"א) של העובר העופות הוא מודל שימושי כדי להעריך את הדינמיקה של כלי הדם והפרמקוקינטיקה של גידולים אנושיים. המבנה והמיקום של CAM מאפשרת רכישת תמונה באיכות גבוהה מתאים של סוגים רבים של סרטן xenografts ללא ניתוחים פולשניים. יתר על כן, הגידול xenografts סרטן מושתלים לתוך קרום chorioallantoic להיות vascularized בתוך 7 ימים, המציע מהיר, אמצעי זול למחצה תפוקה גבוהה כדי להעריך את הצטברות של חלקיקים רקמת הגידול. מאז xenografts סרטן מושתל CAM של פגז פחות עוברי תרנגולת נגישים ברזולוציה גבוהה אופטיקה של מיקרוסקופ epifluorescence או confocal זקוף, מידע הקשרי ובזמן לגבי ספיגת nanoparticle ב vasculature הגידול ניתן להשיג בקלות. Xenografts סרטן במודל זה נוטים לגדול רוחבית לאורך CAM, וכתוצאה מכך גידולים גדולים תוך שמירה על פחות מ -200 מ 'עומק. זה עושה להם טוב במיוחד מתאים הדמיה intravital כי מיקרוסקופים epifluorescence רגיל יכול למעשה לחדור את המסה הגידול כולו. לעומת זאת, גידולים מושתל או אתרי שטחית או orthotopic בתוך העכבר להתרבות בשלושה ממדים, ולכן קשה למקם במדויק חלקיקים עמוק בתוך גידולים אלו על ידי טכניקות פולשנית. אנחנו צריכים לנצל את המודל הזה כדי להעריך את ספיגת הנקודות, ליפוזומים הקוונטים, תחמוצת ברזל חלקיקים במספר xenografts הגידול האנושי, המדגיש את פוטנציאל עבור דגם זה להיות מתאים לניתוח vivo של מגוון רחב של ניסוחים nanoparticle.
Disclosures
Acknowledgements
מחקר זה נתמך על ידי CCSRI גרנט # 700537 ו CIHR גרנט # 84535 כדי JDL NIH ו / NCI מענק # CA120711 ו-01A1-01A1 CA120711 ל AZ. כל הניסויים בוצעו בהתאם לתקנות והנחיות טיפול בבעלי חיים מוסדיים השתמש ועדת באוניברסיטת קליפורניה בסן דייגו, טיפול בבעלי חיים ושימוש באוניברסיטת מערב אונטריו.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב שם / ציוד | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| ביצים מופרות וליבורנו | המדרגה פריי ג `, סנט ג'ייקובס | N / A | |
| Dremel רוטרי כלי | Dremel | אפשר להשתמש בכל דגם | |
| Dremel גלגלי החיתוך לא. 36 | Dremel | 409 | |
| ספורטסמן האצ' | ברי היל | 1550HA | |
| ספורטסמן חממה | ברי היל | 1502EA | |
| אתנול | 70% (כרך / כרך) | ||
| פוליסטירן לשקול סירות | VWR | 12577-01 | |
| כיכר פטרי מנות | Simport, VWR | 25378-115 | |
| Rubbermaid גומי מיכל עם מכסה | Guillevin | RH3-228-00-BLU | חורים שנקדחו לתוך הצדדים |
| אנכי פיפטה חולץ | דוד Kopf מכשירים | דגם 720 | הגדרות: 16.3 (דוד) ו - 2.3 (סולנואיד) |
נתרן בורוסיליקט צינורות זכוכית נימי | סאטר Instrument | BF100-58-10 | (OD, 1.0 מ"מ; מזהה 0.58 מ"מ; 10 ס"מ אורך) |
| 1X Dulbecco של הנשר השתנה בינוני (DMEM) | Invitrogen | 11995073 | |
| Dulbecco של | Invitrogen | 14190250 | pH 7.4 |
| פוספט שנאגרו מלוחים (D-PBS) (1X), נוזל | |||
| טריפסין, 0.05% (1X) עם EDTA 4Na, נוזל | Invitrogen | 25300054 | |
| סרום שור עוברית | Invitrogen | 12483-020 | מחממים להשבית |
| Hemocytometer | האוסר מדעי, VWR | 15170-090 | |
| סרכזת | Eppendorf דגם 5810R | 5811 000.010 | |
| פיין נקודות מלקחיים | VWR | 25607-856 | |
| Tygon R-3603 צינורות | VWR | 63009-983 | 50 מטר (קוטר פנימי 1/32-inch, קוטר חיצוני 3/32-inch, עובי דופן 1/32-inch |
| המזרק מחטים זריקות 18-מד מחטים | BD | 305195 | קופסא של 100 |
| 1 מזרקים מ"ל זריקות | BD | 309602 | קופסא של 100 |
| סיבים אופטיים מיקרוסקופ המאייר | Amscope | HL250-AY | 150W |
| kimwipes | VWR | 10805-905 | |
| V. זרעים unguiculata (קליפורניה שחור עיניים לא. 5) | Burpee | 51771A | |
| צמיחה אורות מקורה | SunLite, אספקה של הגנן | ||
| Methyl-PEO4-NHS אסתר | לנקב | PI22341 | |
| MPEG-NHS, PEG succinimidyl אסתר, MW 2000 | NANOCS | PEG1-0002 | |
| אלקסה פלואוריד 647 חומצה carboxylic (succinimidyl אסתר) | Invitrogen | A20006 | |
| אורגון גרין 488 אסתר succinimidyl * 6-האיזומר * | Invitrogen | O-6149 | |
| Sulfoxide דימתיל (DMSO) | סיגמא | D8418 | |
| Dibasic monohydrogen פוספט | סיגמא | 379980 | K2HPO4 (עבור חיץ phopshate) |
| Monobasic dihydrogen פוספט | P5655 | KH2PO4 (עבור חיץ phopshate) | |
| Superose 6 גודל הדרה עמודה | GE Healthcare מדעי החיים | 17-0673-01 | |
| אקטע Explorer 100 כרומטוגרף | GE Amersham Pharmacia | WS-AKTA100 | |
| אקטע ערכת תזרים גבוה | GE Healthcare מדעי החיים | 18-1154-85 | |
| סוכרוז | סיגמא | S0389 | |
| Ultracentrifuge | Beckman | ||
| SW 28 Ti הרוטור | Beckman | 342204 | Swing דלי |
| 50.2 Ti הרוטור | Beckman | 337901 | זווית קבועה |
| Amicon Ultra-15 יחידות סינון צנטריפוגלי | Millipore | UFC910008 | 100 kDa מנותקים |
| Gradient לשעבר | Biorad | ||
| dextran, והעמסת, 70,000 מגוואט, anionic | Invitrogen | D1823 | |
| ספינינג מיקרוסקופ פלואורסצנטי confocal דיסק | מניין; Yokogawa CSU 10, Yokogawa | N / A | |
| מיקרוסקופ Epifluorescence רחב בתחום | מניין; Zeiss Axio בוחן, Zeiss | N / A | |
| Hamamatsu ImagEM 9100-12 EM-CCD המצלמה | מניין; Hamamatsu | N / A | |
| המתחם טמפרטורה יחידת המיקרוסקופ | Precision פלסטיקה | N / A | |
| אבק גריז | VWR | 59344-055 | |
| זכוכית עגול coverslips לא. 1 (18 מ"מ) | VWR | 16004-300 | |
| Volocity תוכנה | פרקין אלמר | ||
| צ'יק המתחם העובר | מנהג מפוברק | ||
| עדין מספריים | VWR | 25608-203 | |
| פורמלין | Bioshop | FOR201.500 | השתמש ב fumehood |
| חיתוך אופטימלי | פישר; רקמות Tek | 1437365 | |
| טמפרטורה (אוקטובר) | |||
| תבניות פלסטיק | דיג | 22-038217 | |
| VWR VistaVision HistoBond דבק שקופיות | VWR | 16004-406 | |
| להאריך זהב עם DAPI | Invitrogen | P36931 | |
| להבי פנויה עבור cryostat | דיג | 12-634-2 | |
| Cryostat | לייקה CM 3050 S | 14047033518 |
References
- Halin, C., Mora, J. R., Sumen, C., von Andrian, U. H. In vivo imaging of lymphocyte trafficking. Annu Rev Cell Dev Biol. 21, 581-603 (2005).
- Judenhofer, M. S. Simultaneous PET-MRI: a new approach for functional and morphological imaging. Nat Med. 14, 459-465 (2008).
- Weissleder, R., Pittet, M. J. Imaging in the era of molecular oncology. Nature. 452, 580-589 (2008).
- Chambers, A. F., Ling, V. Selection for experimental metastatic ability of heterologous tumor cells in the chick embryo after DNA-mediated transfer. Cancer Res. 44, 3970-3975 (1984).
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clin Exp Metastasis. 22, 225-236 (2005).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer cell. 13, 221-234 (2008).
- Lewis, J. D. Viral nanoparticles as tools for intravital vascular imaging. Nature medicine. 12, 354-360 (2006).
- Leong, H. S. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature protocols. 5, 1406-1417 (2010).
- Chatterji, A. New addresses on an addressable virus nanoblock; uniquely reactive Lys residues on cowpea mosaic virus. Chemistry & biology. 11, 855-863 (2004).
- Brunel, F. M. Hydrazone ligation strategy to assemble multifunctional viral nanoparticles for cell imaging and tumor targeting. Nano letters. 10, 1093-1097 (2010).
- Steinmetz, N. F., Manchester, M. PEGylated viral nanoparticles for biomedicine: the impact of PEG chain length on VNP cell interactions in vitro and ex vivo. Biomacromolecules. 10, 784-792 (2009).
- Steinmetz, N. F., Cho, C. F., Ablack, A., Lewis, J. D., Manchester, M. CPMV nanoparticles target surface vimentin on cancer cells. Nanomedicine. , (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved