Method Article
Avaliação de Captação de nanopartículas em tumores em tempo real usando imagens intravital
Neste Artigo
Resumo
Nós apresentamos uma nova abordagem para quantificar a localização das nanopartículas na vasculatura de tumores humanos xenografted utilizando dinâmicas, imagens em tempo real intravital em um modelo embrião aviária.
Resumo
As tecnologias atuais para a imagem latente do tumor, como ultra-som, ressonância magnética, PET e CT, são incapazes de produzir imagens de alta resolução para a avaliação da absorção de nanopartículas em tumores em nível microscópico 1,2,3, destacando a utilidade de um modelo adequado xenoenxerto em que para realizar análises detalhadas captação. Aqui, usamos imagens de alta resolução intravital para avaliar a absorção de nanopartículas em humanos xenoenxertos tumor em um modelo de embriões modificados, shell-less frango. O modelo de embrião de galinha é particularmente bem adequada para esses análise in vivo porque ele suporta o crescimento de tumores humanos, é relativamente barato e não requer cirurgia anestesiados ou 4,5. Células tumorais forma xenoenxertos totalmente vascularizado dentro de 7 dias quando implantados na membrana corioalantóide (CAM) 6. Os tumores resultantes são visualizadas por não-invasivos de imagem em tempo real, de alta resolução que pode ser mantido por até 72 horas, com pouco impacto sobre o host ou sistemas de tumor. Nanopartículas com uma ampla gama de tamanhos e formulações administradas distal ao tumor podem ser visualizados e quantificados como elas fluem através da corrente sanguínea, extravasamento de vascularização tumoral com vazamentos, e se acumulam no local do tumor. Descrevemos aqui a análise de nanopartículas de derivados do vírus do mosaico do caupi (CPMV) decorado com infravermelho próximo corantes fluorescentes e / ou polímeros de polietileno glicol (PEG) 7, 8, 9,10,11. Após a administração intravenosa, essas nanopartículas virais são rapidamente internalizados pelas células endoteliais, resultando em rotulagem global da vasculatura tanto fora como dentro do tumor 7,12. PEGylation das nanopartículas viral aumenta sua meia-vida plasmática, estende seu tempo na circulação, e, finalmente, aumenta a sua acumulação nos tumores através da permeabilidade aumentada e efeito de retenção (EPR) 7, 10,11. A taxa ea extensão da acumulação de nanopartículas em um tumor é medido ao longo do tempo usando o software de análise de imagem. Esta técnica fornece um método para tanto visualizar e quantificar a dinâmica de nanopartículas em tumores humanos.
Protocolo
1. Inoculação do tumor em CAM embrião aviária
- Prepare shell-less embriões de galinha fertilizados, conforme descrito 8.
- No dia 9 do desenvolvimento embrionário, montar uma micro-injector utilizando uma agulha de calibre 18 conectada em uma seringa mL. Corte um pedaço 5-6 polegadas de tubo Tygon (1 / 32 "de diâmetro interior, 3 / 32" de diâmetro externo, 1 / 32 "a espessura da parede) e insira cuidadosamente bisel da agulha na tubulação. Aproximadamente 4-5 polegadas da tubulação deve estendem desde a ponta da agulha (Figura 1a).
- Encha a seringa e tubo com suspensão de células. Em seguida, insira uma agulha de vidro microinjeção no final da tubulação e remova cuidadosamente as bolhas de ar.
- Injetar Dia 9 embriões (Figura 1b), sob um escopo dissecção com um iluminador com 10.000-100.000 células do câncer como um bolo dentro do CAM (Figura 1c). Lentamente injetar células e cuidadosamente garantir que a agulha está no lugar correto para as células para formar um bolo visível dentro da CAM. Células que por gotejamento sobre a superfície CAM podem ser limpos utilizando aplicador Kimwipe ou outros.
- Retorno embriões para incubadora umidificada a 38 ° C com umidade de 60% e permitir que o tumor cresça e irrigar (até 7 dias).
2. Preparação de nanopartículas
- Para preparar nanopartículas fluorescente etiquetado CPMV para injecção no embrião de galinha; diluir as nanopartículas viral (sintetizado como 8 em PBS, pH 7,4, a uma concentração de 100 mg / ml mistura Vortex bem antes de usar e centrifugar por um minuto para remover qualquer. agregados Sonication. também pode ser útil dependendo conjugados e grau de agregação. Stocks de CPMVs fluorescente etiquetado são estáveis por pelo menos 1 ano quando armazenado a 4 ° C no escuro. Verifique periodicamente ações, colocando algumas gotas numa lâmina de vidro e verificação de fluorescência. microscopia eletrônica de transmissão (TEM) também pode ser usado para determinar se as partículas permaneceram intactas após conjugação.
- Resumidamente, um micrograma de nanopartículas viral (em um volume final de 2 mL) podem ser adicionados às redes de cobre revestido. Em seguida, adicione um volume igual de acetato de uranila 2% durante 1 minuto, microscópio eletrônico (Philips EM 410).
3. Injeção intravenosa de fluorescência marcado com nanopartículas viral
- No dia 16, montar micro-injector, como descrito acima. Elaborar volume desejado de nanopartículas viral através do tubo para dentro da seringa (> mL 200). Remova cuidadosamente as bolhas de ar. Inserir a agulha de vidro microinjeção no final da tubulação. Assegurar que a agulha é tão longo e afilado possível (Figura 2a). Se a agulha estiver muito fechado, não será capaz de perfurar o ectoderma e deixará de penetrar no navio. Se a agulha estiver muito acentuado, a ponta entrará em colapso ao penetrar tecidos.
- Por via intravenosa injetar 100 ml de 1 mg / ml de fluoresceína dextran (70.000 MW Da, Invitrogen) em embrião tendo tumor distal do site desejado a ser visualizado (Figura 3d). Canulação da veia CAM sucesso é evidente pela clearing de sangue no caminho do fluxo da injeção (Figura 2b). Avaliar vascular 1 hora após a injeção de vazamento.
- Por via intravenosa injetar 50 ul de 1 mg / ml de solução de CPMV-Alexa Fluor 647 (CPMV AF-647) ou peguilado CPMV-Alexa Fluor 647 (CPMV-PEG-AF 647) em embriões com tumores com vazamento vascular distal do site desejado ser visualizados.
- Tumores imagem imediatamente ea cada hora após a injeção usando uma Zeiss Examiner Z1 microscópio vertical equipado com um disco giratório Yokogawa, Hamamatsu Imagem 9100-12 câmera EM-CCD.
4. Em tempo real de imagens intravital
- Para montar a unidade de imagem do embrião, aplique uma fina camada de graxa de vácuo em torno da circunferência do porto de imagem na parte inferior da tampa da unidade de imagem do embrião, e se encaixam uma lamela de vidro 18 milímetros para o porto.
- Posição do embrião de tal forma que a lamela vai cobrir a área desejada para a imagem latente. Lentamente abaixe a tampa até que a lamínula só faz contato com o embrião, e então parafuso a tampa sobre a unidade para segurá-la no lugar (Figura 2c).
- Adicione a água aquecida a 37 ° C para a unidade de imagem do embrião fora do prato contendo o embrião, e em seguida, coloque a unidade inteira para o palco de um microscópio confocal na vertical com o interior da câmara ambiental equilibrado a 37 ° C.
- Unidade de posição da imagem contendo o embrião sob o Spinning microscópio de fluorescência confocal de disco (Figura 2e). A unidade de imagem irá realizar o embrião no lugar e manter o campo de visão, enquanto a captura de imagens fixas, permitindo a ambas as pilhas tridimensionais Z e lapso de tempo que as imagens sejam capturadas. Nós adquirir e analisar tridimensional lapso de tempo imagens usando Perkin Elmer (anteriormente Improvisation) Pacote de software Volocity (Figura 3a). Adquirir uma alta resolução tridimensional pilha do tumor e vascularização em torno de visualizar detailed análises estruturais específicas em tempo de pontos. Adquirir tridimensional pilhas em intervalos regulares de tempo, aponta para mapa detalhado mudanças estruturais na vasculatura tumoral. Tumores de imagem a cada hora após a injeção.
- Quantificar a absorção de nanopartículas viral através do cálculo da média Alexa Fluor (AF) 647 sinal dentro de regiões selecionadas no tumor ou no estroma software quantificação (não-tumorais área) usando a imagem como Volocity (Perkin Elmer). O tumor de estroma proporção foi calculada dividindo a média AF 647 sinal no tumor sobre a média AF 647 sinal no estroma. A relação tumor / estroma maior que 1 indica que as nanopartículas está sendo tomada pelo tumor.
5. Resultados representativos:
No exemplo aqui descrito, injetamos HT-29 células de câncer de cólon para formar um bolo de aproximadamente 1 milímetro de tamanho dentro da CAM de embriões dia 9 de frango (Figura 1b). Após a inoculação, os embriões foram cultivados por 7 dias em uma incubadora umidificada para permitir o crescimento do tumor suficiente e vascularização (Figura 1c). Embriões foram injetados por via intravenosa com um baixo peso molecular dextran para confirmar a vascularização do tumor, e os tumores foram visualizadas ao microscópio Zeiss Z1 AxioExaminer vertical (Figura 2d).
Após a administração intravenosa de CPMV AF-647 ou CPMV-PEG-AF 647 nanopartículas (Figura 3a e b), de alta resolução em tempo real confocal de imagem (Figura 2e) revelou que tanto CPMV e CPMV-PEG nanopartículas rapidamente rotulados toda a vasculatura, mas a captação de CPMV-PEG pelo tumor foi de aproximadamente 3 vezes superior CPMV após 12 horas (Figura 3). A captação tumoral relativa de nanopartículas foi determinada utilizando software de análise de imagem (Volocity da Perkin Elmer). Regiões de interesse foram selecionados dentro e fora do tumor (no compartimento estromal) ea intensidade média de fluorescência de cada um era determinado. Os dados são expressos como tumor / estroma ratio.
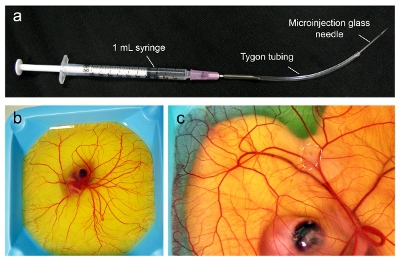
Figura 1. Microinjeção de tumores no CAM de um embrião aviária. (A) O aparelho microinjeção é montado a partir dos componentes, como indicado. (B) os embriões das aves no dia 9 está pronto para ser inoculado com tumor quando o CAM tem se espalhado para cobrir toda a superfície. (C) No dia 16, o tumor terá crescido a até 1 cm de diâmetro (linha pontilhada) e está pronto para a injecção com nanopartículas.
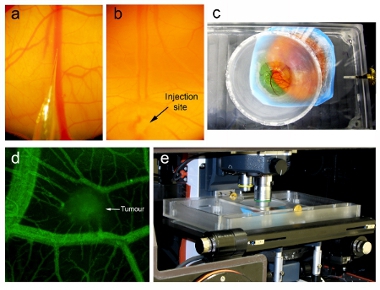
Figura 2. Injeção de nanopartículas e imagem intravital. Injeção sob um microscópio de dissecação mostrando (a) a ponta da agulha microinjetor pronto para ser injetado na veia CAM e (b) a agulha microinjetor introduzida na veia (indicado pela seta) e nanopartículas injetadas no fluxo de sangue (visto limpando de sangue). (C) da unidade de imagem contendo embrião aviária com a lamela interface diretamente com o CAM. (D) Antes da injeção de nanopartículas, vascularização do tumor é avaliada através de imagens intravital após a injeção de fluoresceína dextran. (E) da unidade de imagem contendo o embrião posicionado no palco de um microscópio confocal na vertical dentro de uma temperatura regulada a clausura a 37 ° C.
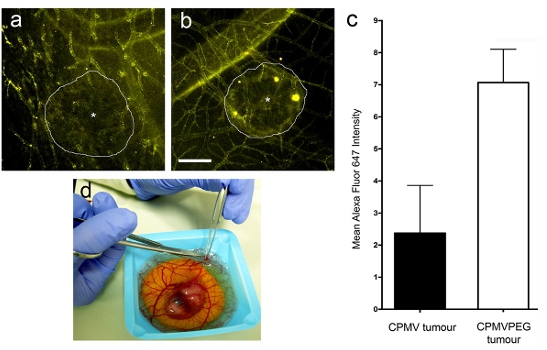
Figura 3. Visualização intravital da captação de nanopartículas em tumores humanos. Tumores são visualizados sete horas após a injeção de (a) CPMV-AF647 e (b) CPMV-PEG-AF647. d) Excisão de tumor de embrião de aves para análise posterior.
Discussão
A membrana corioalantóide (CAM) do embrião aviária é um modelo útil para avaliar a dinâmica vascular e farmacocinética de tumores humanos. A estrutura ea posição do CAM permite a aquisição de imagem de alta qualidade e acomoda de muitos tipos de câncer xenoenxertos sem procedimentos cirúrgicos invasivos. Além disso, xenotransplantes tumorais do câncer implantados na membrana corioalantóide tornar vascularizado dentro de 7 dias, oferecendo um meio rápido, barato e semi-high-throughput para avaliar o acúmulo de nanopartículas no tecido tumoral. Desde xenoenxertos câncer implantado no CAM de embriões shell-less de frango são acessíveis para as ópticas de alta resolução de um microscópio de epifluorescência, na posição vertical ou confocal, a informação contextual e temporal em relação a captação de nanopartículas na vasculatura do tumor pode ser facilmente obtida. Xenoenxerto de câncer neste modelo tendem a crescer lateralmente através da CAM, resultando em tumores que são grandes, permanecendo menos de 200 m de profundidade. Isso os torna particularmente adequado para geração de imagens intravital por causa de epifluorescência microscópios padrão pode penetrar eficazmente a massa do tumor inteiro. Em contraste, os tumores implantados em ambos os sítios superficiais ou ortotópico dentro do rato proliferam em três dimensões, o que torna difícil localizar com precisão as nanopartículas profunda dentro desses tumores por técnicas não invasivas. Nós utilizamos este modelo para avaliar a aceitação de pontos quânticos, lipossomas, nanopartículas de óxido de ferro e em um número de xenotransplantes tumorais humanos, destacando o potencial para este modelo a ser apropriado para o análise in vivo de uma ampla gama de formulações de nanopartículas.
Divulgações
Agradecimentos
Este estudo foi apoiado por CCSRI Grant # 700537 e Grant CIHR # 84535 para JDL e NIH / NCI conceder # CA120711-01A1-01A1 e CA120711 a AZ. Todos os experimentos foram realizados em conformidade com as normas e diretrizes do Animal Care Use Institucional e Comitê da Universidade da Califórnia em San Diego, Animal Care e Uso da Universidade de Western Ontario.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome reagente / Equipamentos | Companhia | Número Catálogo | Comentários |
|---|---|---|---|
| Ovos fertilizados leghorn | Frey `s Hatchery, St. Jacobs | N / A | |
| Ferramenta rotativa Dremel | Dremel | Pode ser usado qualquer modelo | |
| Rodas de corte Dremel não. 36 | Dremel | 409 | |
| Sportsman nascedouro | Berry Hill | 1550HA | |
| Sportsman incubadora | Berry Hill | 1502EA | |
| Etanol | 70% (vol / vol) | ||
| Poliestireno pesar barcos | VWR | 12577-01 | |
| Pratos quadrados Petri | Simport, VWR | 25378-115 | |
| Rubbermaid recipiente com tampa de borracha | Guillevin | RH3-228-00-BLU | furos em lados |
| Vertical pipeta extrator | David Kopf Instruments | modelo 720 | Settings: 16,3 (aquecedor) e 2,3 (solenóide) |
Sódio tubos de vidro de borosilicato capilar | Instrumento Sutter | BF100-58-10 | (OD, 1,0 mm; ID 0,58 milímetros; de 10 cm comprimento) |
| Modificado 1X Dulbecco Eagle Medium (DMEM) | Invitrogen | 11995073 | |
| Dulbecco | Invitrogen | 14190250 | pH 7,4 |
| Tampão fosfato (D-PBS) (1X), líquido | |||
| Tripsina, 0,05% (1X) com EDTA 4NA, líquido | Invitrogen | 25300054 | |
| Soro fetal bovino | Invitrogen | 12483-020 | Calor inativar |
| Hemocitômetro | Hausser Scientific, VWR | 15170-090 | |
| Centrifugador | Eppendorf modelo 5810R | 5811 000.010 | |
| De ponta fina forceps | VWR | 25607-856 | |
| Tygon R-3603 tubulação | VWR | 63009-983 | 50 pés (diâmetro interno 1/32-inch, diâmetro externo 3/32-inch, espessura da parede 1/32-inch |
| Agulhas hipodérmicas para injectáveis calibre 18 agulhas | BD | 305195 | Caixa de 100 |
| 1 ml seringas para injectáveis | BD | 309602 | Caixa de 100 |
| Iluminador de fibra óptica de microscópio | Amscope | HL250-AY | 150W |
| kimwipes | VWR | 10805-905 | |
| Sementes de V. unguiculata (California preto olho-no. 5) | Burpee | 51771A | |
| Indoor luzes crescimento | SunLite, Abastecimento jardineiro | ||
| Metil-éster PEO4-NHS | Perfurar | PI22341 | |
| MPEG-NHS, PEG succinimidyl éster, MW 2000 | NANOCS | PEG1-0002 | |
| Alexa Fluor 647 ácido carboxílico (succinimidyl éster) | Invitrogen | A20006 | |
| Oregon Verde 488 éster succinimidyl * 6-isômero * | Invitrogen | O-6149 | |
| Dimetilsulfóxido (DMSO) | Sigma | D8418 | |
| Dibásico monohydrogen fosfato | Sigma | 379980 | K2HPO4 (para buffer phopshate) |
| Monobásico dihidrogenofosfato | P5655 | KH2PO4 (para buffer phopshate) | |
| Superose 6 coluna de tamanho-exclusão | GE Healthcare ciências da vida | 17-0673-01 | |
| AKTA Explorador 100 Cromatógrafo | GE Amersham Pharmacia | WS-AKTA100 | |
| AKTA kit de alto fluxo | GE Healthcare ciências da vida | 18-1154-85 | |
| Sacarose | Sigma | S0389 | |
| Ultracentrífuga | Beckman | ||
| SW 28 Ti rotor | Beckman | 342204 | Balde balanço |
| 50,2 Ti rotor | Beckman | 337901 | Ângulo fixo |
| Amicon Ultra-15 Centrífuga Unidades Filtro | Millipore | UFC910008 | 100 kDa cortado |
| Gradiente de ex- | Biorad | ||
| dextran, fluoresceína, 70.000 MW, aniônicos | Invitrogen | D1823 | |
| Spinning microscópio de fluorescência confocal de disco | Quorum; Yokogawa CSU 10, Yokogawa | N / A | |
| Microscópio de campo amplo de epifluorescência | Quorum; Zeiss Axio Examiner, Zeiss | N / A | |
| Hamamatsu Imagem 9100-12 câmera EM-CCD | Quorum; Hamamatsu | N / A | |
| Unidade de temperatura do compartimento para microscópio | Plásticos de Precisão | N / A | |
| Graxa de vácuo | VWR | 59344-055 | |
| Lamínulas de vidro circulares não. 1 (18 mm) | VWR | 16004-300 | |
| Software Volocity | Perkin Elmer | ||
| Pinto gabinete embrião | fabricados sob medida | ||
| Tesoura delicada | VWR | 25608-203 | |
| Formalina | Bioshop | FOR201.500 | Uso em fumehood |
| Corte ideal | Fisher; Tissue Tek | 1437365 | |
| Temperatura (OCT) | |||
| Moldes de plástico | Pescador | 22-038217 | |
| VWR VistaVision HistoBond Adhesive Slides | VWR | 16004-406 | |
| Prolongar a ouro com DAPI | Invitrogen | P36931 | |
| Lâminas descartáveis para criostato | Pescador | 12-634-2 | |
| Criostato | Leica CM 3050 S | 14047033518 |
Referências
- Halin, C., Mora, J. R., Sumen, C., von Andrian, U. H. In vivo imaging of lymphocyte trafficking. Annu Rev Cell Dev Biol. 21, 581-603 (2005).
- Judenhofer, M. S. Simultaneous PET-MRI: a new approach for functional and morphological imaging. Nat Med. 14, 459-465 (2008).
- Weissleder, R., Pittet, M. J. Imaging in the era of molecular oncology. Nature. 452, 580-589 (2008).
- Chambers, A. F., Ling, V. Selection for experimental metastatic ability of heterologous tumor cells in the chick embryo after DNA-mediated transfer. Cancer Res. 44, 3970-3975 (1984).
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clin Exp Metastasis. 22, 225-236 (2005).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer cell. 13, 221-234 (2008).
- Lewis, J. D. Viral nanoparticles as tools for intravital vascular imaging. Nature medicine. 12, 354-360 (2006).
- Leong, H. S. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature protocols. 5, 1406-1417 (2010).
- Chatterji, A. New addresses on an addressable virus nanoblock; uniquely reactive Lys residues on cowpea mosaic virus. Chemistry & biology. 11, 855-863 (2004).
- Brunel, F. M. Hydrazone ligation strategy to assemble multifunctional viral nanoparticles for cell imaging and tumor targeting. Nano letters. 10, 1093-1097 (2010).
- Steinmetz, N. F., Manchester, M. PEGylated viral nanoparticles for biomedicine: the impact of PEG chain length on VNP cell interactions in vitro and ex vivo. Biomacromolecules. 10, 784-792 (2009).
- Steinmetz, N. F., Cho, C. F., Ablack, A., Lewis, J. D., Manchester, M. CPMV nanoparticles target surface vimentin on cancer cells. Nanomedicine. , (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados