Method Article
הביצית Microinjection עכבר, הבשלה ו Ploidy הערכה
In This Article
Summary
ביציות נוטים aneuploidy בשל טעויות הפרדה כרומוזום במהלך ההבשלה meiotic. ביצים Aneuploid יכול לגרום לבעיות פוריות הפלות או הפרעות התפתחותיות כמו תסמונת דאון. כאן אנו מתארים שיטות להציג חומרים הבחירה לתוך ביציות ושיטות מחקר התבגרות meiotic ולהעריך ploidy.
Abstract
טעויות הפרדה כרומוזום להוביל תאים aneuploid. בתאים סומטיים, aneuploidy קשורה לסרטן אך הגמטות, aneuploidy מוביל, הפלות פוריות או הפרעות התפתחותיות כמו תסמונת דאון. הגמטות הפלואידים טופס באמצעות מינים ספציפיים תוכניות התפתחותיות, כי הם מצמידים את המיוזה. החלוקה meiotic הראשון (MI) היא ייחודית כי המיוזה chromatids אחותה להישאר מחובר בזמן כרומוזומים הומולוגיים הם נפרדים. מסיבות לא מובנות לגמרי, חלוקה זו reductional נוטה שגיאות הוא הנפוץ יותר את מקור aneuploidy מאשר טעויות מיוזה II (MII) או יותר טעויות 1,2 המיוזה זכר.
אצל יונקים, ביציות מעצר בבית prophase אמ"ן עם שלפוחית גדולה נבטי שלם (GV; הגרעין) ורק קורות חיים המיוזה כאשר הם מקבלים רמזים הביוץ. לאחר המיוזה קורות חיים, ביציות MI שלם לעבור חלוקת התא סימטרית, לעצור שוב metaphase של MII. ביצים לא להשלים MII עד שהם מופרית על ידי הזרע. ביציות גם יכול לעבור התבגרות meiotic באמצעות הוקמה בשנת תנאים במבחנה תרבות 3. בגלל דור של מוטנטים עכבר מהונדס גנטי ו במיקוד יקר יכול לקחת פרקי זמן ארוכים, מניפולציה של גמטות נשים במבחנה היא אסטרטגיה חסכוני יותר חוסך זמן.
כאן אנו מתארים שיטות לבודד prophase, נעצר ביציות מעכברים עבור microinjection. כל חומר הבחירה עשויה להיות מוחדר הביצית, אלא בגלל meiotically-המוסמכת ביציות שותקות transcriptionally Crna 4,5, ולא דנ"א, חייב להיות מוזרק ללימודי ביטוי חוץ רחמי. כדי להעריך ploidy, אנו מתארים התנאים שלנו ב ההבשלה חוץ גופית של ביציות לביצים MII. מבחינה היסטורית, כרומוזום הפצת טכניקות המשמשות ספירת כרומוזום מספר 6. שיטה זו מאתגרת מבחינה טכנית מוגבלת רק לזיהוי hyperploidies. כאן אנו מתארים שיטה כדי לקבוע תת ו hyperploidies באמצעות ביצים שלמות 7-8. שיטה זו משתמשת monastrol, מעכב kinesin-5, אשר קורסת ציר דו קוטבית לתוך ציר monopolar 9 כרומוזומים ובכך להפריד כזה kinetochores אדם יכול בקלות להיות מזוהה וספר באמצעות נסיוב אנטי CREST אוטואימוניות. בגלל שיטה זו מבוצעת ביצים שלמות, הכרומוזומים לא הולכים לאיבוד בשל טעות של המפעיל.
Protocol
1. הביצית עכבר אוסף
- כדי למקסם את מספר הזקיקים antral מבודד כל עכבר, intraperitoneally להזריק נקבות עכברים בוגרים מינית (אנו משתמשים 6 שבועות בן CF-1 עכברים מן הארלן) עם 5 IU של נסיוב סוסה בהריון של גונדוטרופין (PMSG).
- הכן את אוסף בינוני (ממ / PVP) (3 מ"ל / עכבר) על ידי הוספת milrinone עד 2.5 מיקרומטר וחם אותו 37 ° C. Milrinone הוא מעכב phosphodiesterase המקיימת מעצר meiotic פעם ביציות יוסרו זקיקים. לחילופין, 3-isobutyl-1-methylxanthine (IBMX) (0.2 מ"מ) או dibutyryl-monophosphate מחזורי אדנוזין (dbcAMP) (100 מיקרוגרם / מ"ל) יכול לשמש. הכן את המדיום התרבות ידי הוספת גלוטמין (1 מ"מ) milrinone (2.5 מיקרומטר) ל 1 מ"ל של CZB ולאפשר לו לאזן בחממה במשך שעה לפחות. הגדרת microdrops של כל צלחת פטרי עם שכבת שמן מינרלי. המנה CZB מושם לתוך החממה בעוד צלחת ממ / PVP נשאר בחוץ בשקופית חם. אוסף אחרים בינוני תרבות כי הם זמינים מסחרית (M2 ו M16 מן התקשורת מיוחדים או סיגמא) גם בשימוש שגרתי.
- כ 48 שעות לאחר PMSG תחול, להקריב את העכבר באמצעות CO 2 הרגעה בעקבות נקע בצוואר הרחם, השחלות לנתח ולהכניס אותם לתוך watchglass המכיל מראש חימם ממ / PVP + milrinone (ממ / PVP + M).
- באמצעות מזרק אינסולין 1 מ"ל, לעגן את השחלות כדי בצלחת ולשחרר את זקיקי antral על ידי ניקוב אותם מספר פעמים עם מד-27 (או תפירה) מחטים כי הם מהודקים יחד.
- בעוד להביט דרך מיקרוסקופ לנתיחה, לאסוף קומולוס-הביצית מתחמי באמצעות הפה המופעלים פיפטה מזכוכית. זה עוזר לי מיקרוסקופ עם הרבה ניגודיות. לחלופין, המדיום המכיל את רקמות תאים ניתן pipetted על מכסה של צלחת פטרי מפלסטיק. רק לאסוף גדול, זקיקי antral ולא קטן מראש antral זקיקים או ביציות הערומים. אסף פעם, כדי להעביר את מתחמי microdrop של ממ / PVP + M זה בשקופית חם תחת שמן.
- בעזרת פיפטה קטנה (מעט גדול יותר מאשר קוטר של הביצית), פיפטה במעלה ובמורד מתחמי לנתק את התאים קומולוס. מעבירים את ביציות הערומים עם טפטפת לתוך microdrop גדול של CZB + milrinone (CZB + M) ומקום בחממה.
- אפשר ביציות להתאושש במשך שעות לפחות 1 בחממה לפני מניפולציה.
2. הביצית microinjection
- הפוך את pipettes הזרקת ידי משיכת בורוסיליקט זכוכית צינור נימי ב חולץ מכני. אנו משתמשים Flaming-micropipette חולץ בראון (דגם P-97) עם ההגדרות הבאות: P = 500, חום = 300, משוך = 150, לוול ךיב = 100, זמן = 150.
- הכינו את הפלטפורמה microinjection ידי הצבת ירידה של 5 μl ממ / PVP + M קרוב ככל האפשר לירידה 0.5 μl של חומר הזרקה של בחירה (למשל siRNA, קרנה, oligonucleotide morpholino, וכו ') בשקופית 1-גם תא זה יש את תא התקשורת יוסרו. מכסים עם שמן מינרלי מקום על הבמה מיקרוסקופ (איור 1).
- מקום ההזרקה pipettes מחזיק לתוך מחזיקי ואת המיקום לתוך ירידה של ממ / PVP + M. הפעל את הטנקים חנקן המחוברים picoinjector ואנטי רטט השולחן. פתח את קצה פיפטה את הזריקה בעדינות על ידי הקשה עליו מפני פיפטה מחזיקה בעוד ממלא אותו בינוני. אם הפתח גדול מדי, המדיום יעברו פנימה והחוצה במהירות המחט יהרוג את התא. Pipettes עם קטן מדי של פתיחת לעתים קרובות להדביק בקלות.
- העברת ביציות (10/05) מן החממה עד טיפת ממ / PVP M + על הרציף. לפני הזרקה, ההתקנה picoinjector. אנו משתמשים בפרמטרים הבאים על picoinjector שלנו (דגם PLI-100 מהרווארד Apparatus): PBal = 2.5-3.5 psi, PInj = 7.8 psi, PClear = 10-12 psi, זמן = -3. התוצאה היא נפח זריקה של PL 5-10.
- בעוד לחיצה שקוף, להעביר את המזרק עד טיפת חומר מילוי. להחזיר אותו טיפה הבינוני.
- השתמש פיפטה מחזיקה ללכוד הביצית וליישר את מחט הזריקה, הביצית ו פיפטה מחזיק לאורך ציר ה-x.
- תחת הגדלה גבוהה, לקדם את פיפטה הזרקה באמצעות הביצית להיות זהיר, כדי למנוע את הגרעין. לאחר הממברנה הפלסמטית היא פירסינג, לחץ להזריק. לאחר ההזרקה, למשוך את המחט. שחרור הביצית וחזור. לאחר כל ביציות מוזרקים, להחזיר אותם בחממה. תחזיק ב CZB + M בסכום הרצוי של זמן; הפעם תלוי במטרה הניסוי (כלומר siRNA ו מציאה morpholino (עד 24 שעות), overexpression (3-12 שעות)). שים לב incubations יותר מ 24 שעות תתפשר התבגרות meiotic.
3. הביצית הבשלה
- לאחר דגירה לשטוף את ביציות באמצעות מספר טיפות של CZB (בינוני התבגרות) והעברה microdrop של המדיום התבגרות תחת שמן מקום בחממה.
- אפשר 16 שעות עבור t הבשלה מלאה o metaphase של המיוזה השנייה.
4. Ploidy ניתוח
- הכן CZB + monastrol (100 מיקרומטר) ומקום 750 μl לתוך הבאר של צלחת איבר תרבות כי יש מים בטבעת החיצונית.
- לשטוף ביצים באמצעות מספר טיפות של CZB + monastrol ולהעביר אותם לתוך צלחת התרבית איברים. מקום בחממה עבור ח 1
- תקן את הביצים על ידי העברת אותם watchglass המכיל paraformaldehyde 2% PBS למשך 20 דקות בטמפרטורת החדר. העברת לתוך watchglass אחר עם חסימת פתרון. מנה זו ניתן לאחסן על 4 מעלות צלזיוס עד מעובד.
- העברה פתרון permeabilization (PBS + 0.3% + BSA TritonX-100 0.1% + 0.02% NaN 3) ב watchglass במשך 15 דקות בטמפרטורת החדר. יש לשטוף באמצעות כמויות גדולות של מספר חסימת פתרון (PBS + 0.3% + 0.01 BSA Tween-20 + NaN 0.02% 3).
- שאר ההליך מבוצע על מכסה של צלחת 96-היטב בתא humidified בטמפרטורת החדר המוגן מן האור. טיפות (~ 25 μl) ממוקמים בתוך החריצים מעגלית. העברת ביצים לחסימת פתרון במשך 15 דקות.
- כדי תווית centromeres, ביצים להעביר ירידה של פתרון חסימת המכיל CREST אנטי סרום בשעה 01:40. דגירה של לפחות 1 ח לשטוף באמצעות 3 טיפות של תמיסת חסימה, דוגרים 15 דקות כל אחד.
- העברת ביצים ירידה של פתרון חסימת המכיל Cy5 או Alexa-פלואוריד-594-מצומדות אנטי אנושי IgG (1:200) ו דגירה עבור 1h. חזור על הצעדים לעיל כביסה למעט השלב האחרון, כולל Sytox הירוק (1:5,000) בפתרון חסימת לזהות כרומוזומים. הר ב μl 5 של Vectashield. כדי למנוע ריסוק של הביצים, לשים 4 נקודות קטנה של וזלין בפינות היכן coverslip יהיה. מניחים coverslip על גבי חותמת עם לק. חנות בתוך קופסת שקופיות על 4 מעלות צלזיוס עד עיבוד באמצעות מיקרוסקופיה confocal.
- בעוד הדמיה עם מטרה 100x, ללכוד 0.4 מיקרומטר צעדים במישור-Z ואת התמונה של האזור כולו ציר metaphase. הרוזן centromeres באמצעות תוכנת הדמיה כגון תמונה J (NIH).
5. נציג תוצאות:
איור 2 הוא השלכה Z-מביצית euploid. בשלב metaphase של MII, ביצים euploid עכבר מכילים 20 זוגות של כרומוזומים, ולכן יש 40 centromeres. מדי פעם הכרומוזומים להיכשל להפיץ למרות הטיפול monastrol. מצב זה מקשה על ספירת centromeres אמין ולכן אנו לא כוללים את הביצים הניתוחים שלנו. מדי פעם, יכול להיות אתגר כדי לקבוע אם CREST-immunoreactive "כתם" היא 1 או 2 centromeres. שימוש בתוכניות כגון J תמונה שימושית כי אפשר לנתח כל Z-סעיף תוך הקפדה לציין את הכיוון של כרומוזומים, מספר סעיפים בו "כתם" היא לאתר את עוצמת הפיקסל "נקודות" יש. בהתאם שבו ציר meiotic ממוקם ביחס לגוף קוטב, אזורים של DNA יכולים לחפוף אלה דגימות לא צריך להיכלל בניתוח.
Unmanipulated, בביצים הביוץ vivo מעכברים reproductively צעירים יש שיעור נמוך של aneuploidy (~ 1-2%). עם זאת, מסיבות לא מובנות, microinjection ובשיטות חוץ גופית ההתבגרות יכולים להגדיל את זה כלפי מעלה בשיעור של 10%. לכן, זה קריטי, כי ביציות לשלוט מוזרק כלולים בכל מחקר microinjection.

באיור 1. צלחת Microinjection להגדיר. שקופית קאמרית עם 5 טיפות של μl ממ / PVP + M מעל 0.5μl טיפות של תמיסת ההזרקה. מכסים עם שמן מינרלי. בדוגמה זו יש 3 טיפות 3 פתרונות הזרקה שונים והחלק את יושב על הבמה של מיקרוסקופ. משמאל את המחט microinjection וימינה הוא פיפטה מחזיקה. שים לב שיש השתקפות של מחזיקי מחט.
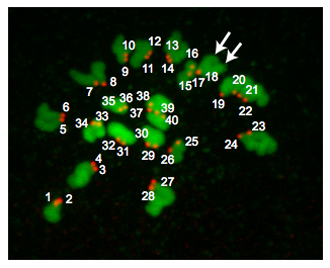
איור 2. Ploidy התוצאות. Z-השלכה של ביצה euploid II metaphase. DNA הוא בצבע ירוק kinetochores נצבעים באדום. החיצים מצביעים על 2 זרועות chromatid ברורים המעידים כי kinetochores (# 17 ו # 18) חופפים. ביצים עכבר Euploid מכילים 20 זוגות kinetochore (40 בסך הכל "נקודות"). ביצה aneuploid היה להכיל כל וריאציה על המספר הזה. אם הליך זה נערכו על ביציות metaphase MI, יהיו 40 זוגות kinetochore (80 בסך הכל "נקודות").
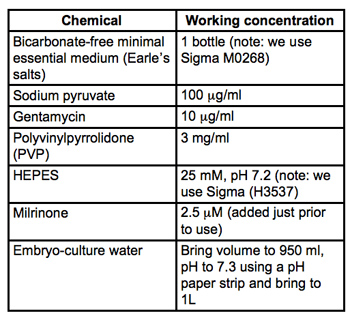
טבלה 1. מתכון בינוני איסוף microinjection (ממ / PVP + M). כל החומרים העובר תרבות כיתה ו מבית סיגמא אולדריץ. סנן לעקר דרך 0.22μm מסננים PVDF (אנו משתמשים Stericups Milipore) ולאחסן ב 4 ° C.
iles/ftp_upload/2851/2851table2.jpg "alt =" טבלה 2 "/>
טבלה 2. מתכון בינוני CZB. כל החומרים העובר תרבות כיתה ו מבית סיגמא אולדריץ. סנן לעקר דרך 0.22μm מסננים PVDF (אנו משתמשים Stericups Milipore) ולאחסן ב 4 ° C.
Discussion
Microinjection של ביציות היא שיטה חזקה ללמוד המנגנונים המווסתים התבגרות meiotic 10,11, 12, 13. שיטה זו מספקת דרך חסכונית לבחון השערות לפני ביצוע ההשקעה הגדולה בפיתוח מודלים עכבר מהונדס ממוקד. אוסף הביצית וטכניקות microinjection דורשים זמן רב יותר מאשר הורים נהלים ביולוגיה אופייני התא. מכשולים ספציפיים עם אוסף לעיתים קרובות כוללים שליטה על פיפטה בפה, מושך את פיפטה זכוכית בגודל מתאים לאיסוף הפשטה של תאים סומטיים והגדלת מהירות אוסף כדי לצמצם את הזמן שבו ביציות הן מחוץ לחממה. מומלץ לתרגל פעמים רבות לפני ביצוע הניסויים. העברת ביציות בין microdrops תוך שמירה על אותו מספר של תאים היא דרך מצוינת להיות נוח עם שיטה זו.
מוות של תאים נפוצה בזמן למידה microinjection. זה יכול לקרות מכמה סיבות, כולל הזרקת גדול מדי של אמצעי אחסון של חומר (כלומר פתיחת מחט הזרקה גדול מדי), להכות את הגרעין עם מחט הזריקה, פירסינג הצד הנגדי של הביצית או שהחומר המוזרק רעיל הביצית. תרגול עם הזרקה לתוך ביציות חיץ עד שיעור ההישרדות שלך היא לפחות 50% היא המפתח שליטה בטכניקה זו. אם ביציות אינם בשלים סביר להניח כי milrinone לא מדולל מספיק. אנו ממליצים על שטיפת ביציות באמצעות טיפות גדולות רבות CZB milrinone חופשי לפני ההבשלה.
Microinjection ploidy בעקבות הניתוח היא אחת מבחני רבים להעריך התבגרות meiotic. ניתוח שגרתי אחר אנו משתמשים במעבדה כוללים מעקב אחר קינטיקה שבאמצעותו התקדמות ביציות דרך המיוזה, immunofluorescence לנתח את היווצרות ציר ויישור כרומוזום והפעלה ביצה או הפריה חוץ גופית על מנת להעריך את ההשלכות התפתחותיות של מניפולציה הביצית 14,15, 16, 17.
Disclosures
Acknowledgements
עבודה זו נערך במעבדה שולץ ריצ'רד מ 's. המחברים רוצה גם להודות מיכאל לאמפסון על המשגה של assay-centromere לספור גישה מיקרוסקופ confocal שלו. תרזה צ'אנג ופרנצ'סקה דאנקן סייע אופטימיזציה של assay centromere-הספירה. פאולה שטיין נתמך על ידי HD022681 (כדי RMS) וקארן שינדלר נתמך על ידי HD055822.
Materials
טבלה של חומרים כימיים מסוימים:
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| Milrinone | סיגמא אולדריץ | M4659 | Resuspend ב DMSO ב 2.5mm |
| שמן מינרלי | סיגמא אולדריץ | M5310 | השתמש רק עובר במבחן, סטרילי, מסונן |
| CREST autoserum | Immunovision | HCT-0100 | |
| Sytox גרין | Invitrogen | 57020 | |
| אנטי אנושי אלקסה 594 | Invitrogen | A-11014 | |
| Vectashield | וקטור מעבדות | H-100 | |
| Paraformaldehyde | Polysciences | 577773 | |
| אלבומין בסרום שור מ | סיגמא אולדריץ | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | סיגמא אולדריץ | M8515 | Resuspend ב DMSO ב 100mm |
| Tween-20 | סיגמא אולדריץ | 274348 | |
| TritonX-100 | סיגמא אולדריץ | X-100 |
טבלה של ציוד ספציפי:
| שם ציוד | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| פומית | Biodiseno | MP-001-Y | |
| Watchglass | מיקרוסקופית אלקטרונים למדעים | 70543-30 | |
| מזרק | BD | 309623 | 1ml, 27G 1 / 2 |
| 60 מ"מ צלחת פטרי | בז | 351007 | |
| זכוכית פסטר pipets | פישר מדעי | 13-678-200 | |
| צד חם יותר | פישר מדעי | כל מודל סטנדרטי | |
| Dissection מיקרוסקופ | כל מודל סטנדרטי | ||
| לשכת שקופיות | Nunc | 177372 | |
| נימי Tubing | דראמונד | 1-000-0500 | microcaps |
| פיפטה פולר | Flaming-בראון micropipette חולץ | דגם P-97 | |
| הפוך מיקרוסקופ | ניקון | כל מודל סטנדרטי | |
| Micromanipulators | Eppendorf | כל מודל סטנדרטי | |
| Picoinjector | הרווארד Apparatus | דגם PLI-100 | כל מודל סטנדרטי |
| CO 2 טנקים | עבור חממה | ||
| N2 טנק | עבור שולחן מזרק | ||
| נגד רעידות השולחן | טכני ייצור | כל מודל סטנדרטי | |
| מדגרה | כל מודל סטנדרטי | ||
| אחזקות pipettes | Eppendorf | 930001015 | Vacutip |
| Confocal מיקרוסקופ | לייקה | כל מודל סטנדרטי | |
| Dissection כלים | המדע כלים פיין | כל מודל סטנדרטי | |
| Humidified קאמרית | אנו משתמשים טאפרוור | ||
| ליד צלחת 96 טוב | Nunc | 263339 | |
| מיקרוסקופ שקופיות | פישר מדעי | 12-544-3 | |
| Coverslips | תומאס מדעי | 6663-F10 | עובי ישתנו עבור מיקרוסקופים מסוים |
| מרכז תרבות איבר גם צלחת | פישר מדעי | 353037 | 60 X 15mm |
References
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved