Method Article
마우스 Oocyte의 Microinjection, 성숙과 Ploidy 평가
요약
Oocytes는 meiotic 성숙하는 동안 염색체 분리의 오류로 인해 aneuploidy하는 경향이 있습니다. Aneuploid 계란은 다운 증후군과 같은 불임, 유산 또는 발달 장애를 일으킬 수 있습니다. 여기서 우리는 oocytes과 meiotic 성숙을 연구하고 ploidy 평가 방법에 선택의 자료를 소개하는 방법을 설명합니다.
초록
염색체 분리의 실수 aneuploid 세포를 얻으실 수 있습니다. 체세포에서 aneuploidy가 암 관련지만 gametes에서 aneuploidy가 다운 증후군과 같은 불임, 유산 또는 발달 장애로 연결됩니다. Haploid gametes는 감수 분열에 결합 아르 종의 특정 개발 프로그램을 통해 양식. 상동 염색체가 시위하는 동안 자매 chromatids가 연결되어 남아 있기 때문에 첫 번째 meiotic 사업부 (MI)는 감수 분열에 고유한 것입니다. 완전히 이해하지상의 이유로,이 reductional 부문에서 오류가하는 경향이 있으며, 더 일반적으로 세포의 감수 분열 II (미이)에 오류가 이상하거나 남성 감수 분열 1,2에서 오류보다 aneuploidy의 원천입니다.
포유 동물에서는, 대형, 손상 본원 소포 (GV; 핵)과 MI의 prophase에서 oocytes의 체포와 그들이 ovulatory 신호를받을 경우에만 감수 분열을 재개. 일단 세포의 감수 분열의 이력서, oocytes 전체 MI 및 미이의 metaphase에서 다시 체포, 비대칭 세포 분열을 받다. 그들이 정자에 의해 수정된 때까지 계란은 미이를 작성하지 않습니다. Oocytes 또한 체외 배양 조건 3 설립된 사용 meiotic 성숙을 받다 수 있습니다. 유전자 변형과 유전자 타겟 마우스 돌연변이의 생성은 비용이고 오랜 기간 걸릴 수 있기 때문에, 체외에서 여성 gametes의 조작보다 경제적이고 시간을 절약할 전략이다.
여기, 우리는 생쥐로부터 microinjection을 위해 prophase - 체포 oocytes을 분리하는 방법을 설명합니다. 선택의 모든 자료는 oocyte에 소개 될 수 있지만, meiotically - 관할 oocytes은 4,5 cRNA, 그리고 DNA transcriptionally 침묵 때문에, 이소성 표현 연구 주입해야합니다. ploidy 평가하기 위해, 우리는 미이 달걀 oocytes의 체외의 성숙에 대한 우리의 조건을 설명합니다. 역사적으로, 염색체 - 확산 기술은 염색체 번호 6 카운트에 사용됩니다. 이 방법은 기술적으로 도전하고 오직 hyperploidies을 식별로 제한됩니다. 여기서 우리는 하이포과 7-8 그대로 계란을 사용하여 hyperploidies을 결정하는 방법을 설명합니다. 이 방법은 monastrol 개인 kinetochores가 쉽게 안티 - 크레스트 면역 혈청을 사용하여 검색하고 집계 수 9 있으므로 염색체 분리와 같은 monopolar 스핀들에 바이폴라 스핀들을 붕괴 kinesin - 5 억제제를 사용합니다. 이 메서드가 그대로 계란에서 수행되기 때문에, 염색체는 운영자 오류로 인해 손실되지 않습니다.
프로토콜
1. 마우스 oocyte 컬렉션
- 각 마우스 격리 antral 모공의 수를 최대화하려면 intraperitoneally 임신 암말의 혈청 생식 샘 자극 호르몬 (PMSG) 5 IU와 (과 우리가 할런로부터 6 주 된 CF - 1 쥐를 사용) 성적 성숙 암컷 생쥐를 주입.
- 2.5 μm의에 milrinone을 추가하여 컬렉션 매체 (멤 / PVP) (3 ML / 마우스)를 준비하고 37 그것을 따뜻한 ° C. Milrinone는 oocytes가 모공에서 제거되면 meiotic 체포를 유지 phosphodiesterase 억제제이다. 또는, 3 - 이소 부틸 - 1 - methylxanthine (IBMX) (0.2 ㎜) 또는 dibutyryl - 순환 아데노신 monophosphate (dbcAMP) (100 μg / ML)을 사용하실 수 있습니다. CZB 1 ML에 글루타민 (1 ㎜)과 milrinone을 (2.5 μm의) 추가하여 문화 매체를 준비하고 적어도 한 시간 동안 인큐베이터에서 평형 수 있습니다. 광유와 페트리 접시와 오버레이에있는 각각의 microdrops를 설정합니다. 멤 / PVP 음식은 따뜻한 슬라이드 밖에서 남아있는 동안 CZB 요리는 인큐베이터에 배치됩니다. (전문 미디어 또는 시그마에서 M2와 M16) 상업적으로 사용할 수있는 다른 컬렉션과 문화 매체도 정기적으로 사용됩니다.
- 약 48 H 마중물을 PMSG 후 자궁 전위 다음 CO 2 진정 작용을 사용하여 마우스를 희생, 난소를 해부하다하고 미리 예열 멤 / PVP + milrinone (멤 / PVP + M)를 포함하는 watchglass으로 그들을 놓으십시오.
- 1 ML의 인슐린 주사기를 사용하여 요리에 난소를 앵커 27 게이지 (또는 재봉) 함께 고정 아르 바늘과 함께 그들에게 여러 번 펑쳐링하여 antral 모공 놓습니다.
- 해부 현미경을 통해 보면서, 입으로 작동하는 유리 피펫을 사용하여 큐뮬러스 - oocyte의 단지를 수집합니다. 대비 많은 현미경을 가지고 도움이 그것입니다. 또한, 조직 및 세포를 포함하는 매체가 플라스틱 페트리 접시의 뚜껑에 pipetted 수 있습니다. 단 대형 antral 모공이 아닌 작은 사전 antral 모공이나 denuded oocytes를 수집합니다. 일단 수집, 따뜻한 슬라이드와 기름을 받고있다 멤 / PVP + M의 microdrop에 단지를 전송합니다.
- 작은 피펫을 (oocyte의 직경보다 약간 큰)를 사용하여 적운 세포를 분리하는 단지 아래로 피펫합니다. 큰 CZB + milrinone (CZB + M)의 microdrop에 피펫과 보육의 장소 denuded oocytes을 전송합니다.
- oocytes 이전 조작에 인큐베이터에 최소한 1 H에 대한 복구를 허용합니다.
2. Oocyte의 microinjection
- 기계 풀러에 borosilicate 유리 모세관 튜브를 당겨 분사 pipettes을 만듭니다. P = 500 열 = 300, 당겨 = 150 벨 = 100, 시간 = 150 : 우리는 아래와 같은 설정을 가진 플라밍 - 브라운 micropipette 풀러 (모델 P - 97)를 사용합니다.
- 그 1 잘 챔버 슬라이드 선택 사출 재료의 0.5 μl 드롭 (예 : siRNA, cRNA, morpholino의 oligonucleotide 등) 가능한 한 가까운 멤 / PVP + M의 5 μl 드롭을 배치하여 microinjection 플랫폼을 준비 미디어 챔버가 삭제되었습니다. 현미경 스테이지에 광유 및 장소 (그림 1) 표지.
- 멤 / PVP + M.의 드롭에 소유자 및 위치에 플레이스 주입 및 유지 pipettes picoinjector 및 방진 테이블에 연결되어있는 질소 탱크를 켭니다. 중간 그것을 작성하는 동안 부드럽게 유지 피펫에 대해 그것을 감청하여 주입 피펫의 팁을 엽니다. 오프닝이 너무 큰 경우, 매체는 신속과 밖으로 이동하고 바늘은 세포를 죽일 것입니다. 오프닝 너무 작은과 Pipettes은 종종 쉽게 방해할.
- 플랫폼에 멤 / PVP + M 드롭에 인큐베이터에서 전송 oocytes (5-10). 주입 전에 picoinjector를 설치합니다. PBal = 2.5-3.5 PSI, PInj = 7.8 PSI, PClear = 10-12 PSI, 시간 = 3S로 : 우리는 picoinjector (모델 PLI - 100 하버드 장치에서)에서 다음 매개 변수를 사용합니다. 50-10 PL의 주사 량이 발생합니다.
- CLEAR 누르면서, 재료 드롭에 주입 바늘을 이동하고 입력합니다. 매체 드롭으로 돌아갑니다.
- oocyte를 캡처하고 X - 축을 따라 주사 바늘, oocyte 및 유지 피펫을 정렬하기 위해 개최 피펫을 사용합니다.
- 높은 배율에서 핵을 피하기 위해주의되는 oocyte를 통해 주입 피펫을 사전. 플라즈마 막이 피어싱되면 주입을 누르십시오. 주사 후 바늘을 철회. oocyte과 반복을 놓습니다. 일단 모든 oocytes가 주입되고, 배양기로 돌아갑니다. 시간 원하는 금액 CZB + M으로 잡고,이 시간은 실험 목적 (즉 siRNA와 morpholino의 최저 (최대 24 H), overexpression (3-12 H))에 의존적일 수 밖에 없습니다. 24 H 이상 incubations가 meiotic 성숙을 손상됩니다.
3. Oocyte의 성숙
- 부화는 CZB 여러 방울 (성숙 매체)를 통해 oocytes를 세척하고 인큐베이터에 기름과 장소에 따라 성숙 매체의 microdrop로 전송 후.
- 전체 성숙의 t 16 H 허용 감수 분열 II의 O metaphase.
4. Ploidy 분석
- CZB + monastrol (100 μm의)과 장소 외륜의 물이 가지고있는 장기 문화 요리의 우물에 750 μl를 준비합니다.
- CZB + monastrol 몇 방울을 통해 달걀을 씻고 장기 문화 요리에 그들을 전송합니다. 1 H.위한 인큐베이터에 넣어
- 실온에서 20 분 동안 PBS의 2 % paraformaldehyde를 포함하는 watchglass로 그들을 전송하여 알을 수정. 솔루션을 차단하여 다른 watchglass로 전송합니다. 이것은 요리가 처리 ° C까지 4 저장할 수 있습니다.
- 실온에서 15 분간 watchglass에 permeabilization 솔루션 (PBS + 0.3 % BSA + 0.1 % TritonX - 100 + 0.02 % 넝 3) 전송. 솔루션을 차단 여러 대량 통해 린스 (PBS + 0.3 % BSA + 0.01 트윈 - 20 + 0.02 % 앤 3).
- 절차의 나머지 부분은 빛으로부터 보호 실온에서 humidified 챔버에서 96 - 웰 플레이트의 뚜껑에 수행됩니다. 방울 (~ 25 μl)은 원형 톱니 내부에 배치됩니다. 15 분 동안 솔루션을 차단하기 위해 달걀을 전송합니다.
- 위해 라벨 centromeres, 1시 40분에 방지 혈청 크레스트 포함 차단 솔루션의 한 방울로 전송 달걀. 최소한 1 H.위한 부화 각 15 분 잠복기, 차단 솔루션 3 방울을 통해 씻으십시오.
- Cy5 또는 알렉사 - 형석 - 594 - 복합 안티 인간 IgG (1:200)와 1 시간에 대한 부화를 포함 차단 솔루션의 한 방울에 달걀을 전송합니다. 마지막 단계를 제외하고 위의 단계를 반복 세척, 염색체를 감지 차단 솔루션에 Sytox 그린 (1:5,000)가 포함됩니다. Vectashield 5 μl에 마운트합니다. 계란의 분쇄를 방지하기 위해, coverslip이 거기에있을 것이다의 모서리에서 석유 젤리 4 작은 반점을 넣어. 상단과 매니큐어와 인감에 coverslip 놓으십시오. 4 슬라이드 상자에 보관 ° 공촛점 현미경을 통해 처리까지 C.
- 100X 목적으로 이미징하는 동안, Z - 비행기와 이미지 metaphase 스핀들의 전체 지역에서 0.4 μm의 단계를 캡처합니다. 이러한 이미지 J (NIH)와 같은 이미징 소프트웨어를 사용하여 centromeres 카운트.
5. 대표 결과 :
그림 2는 euploid 계란에서 Z - 프로젝션입니다. 미이의 metaphase에서 euploid 마우스 달걀 염색체의 20 쌍이 포함하고 있으므로 40 centromeres 있습니다. 때때로 염색체는 monastrol 치료에도 불구하고 확산 실패합니다. 이러한 상황은 어려운 안정 centromeres 계산하고 우리는 그러므로 우리의 분석에서 이러한 계란 포함되지 않습니다합니다. 때때로, 그것은 크레스트 - immunoreactive "자리가"1 또는 2 centromeres 여부를 확인하는 도전 수 있습니다. 조심스럽게 염색체의 방향을 지적하면서 하나는 각각의 Z - 부분을 분석할 수 있기 때문에 같은 이미지 J와 같은 프로그램을 사용하는 것이 유용합니다, "장소"가 감지되는 섹션과 픽셀 강도의 "장소"의 숫자가 있습니다. meiotic 스핀들이 북극 신체에 상대적으로 위치를 어디에 따라 DNA의 지역은 중복 수 있으며, 이러한 샘플은 분석에 포함되지 않습니다.
Unmanipulated, reproductively 젊은 생쥐에서 생체내 ovulated 달걀 aneuploidy (~ 1-2%)의 낮은 속도를했습니다. 그러나 이유로 이해하지, microinjection 및 체외 성숙의 절차에 10 %의 속도 이상을 높일 수 있습니다. 따라서 제어 주입 oocytes 어떤 microinjection 연구에 포함되는 것은 중요합니다.

그림 1. Microinjection 요리가 설정할 수 있습니다. 단지 사출 솔루션의 0.5μl 방울 이상의 멤 / PVP + M 5 μl 방울과 챔버 슬라이드. 미네랄 오일 커버. 이 예제에서는 3 3 가지 분사 솔루션 방울과 슬라이드 현미경의 무대에 앉아있다. 왼쪽에있는 microinjection 바늘과 오른쪽에있는 것은 유지 피펫입니다. 바늘 홀더 반영이됩니다.
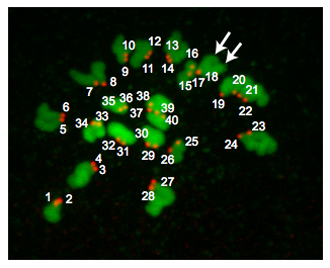
그림 2. Ploidy 결과입니다. euploid metaphase II 달걀의 Z - 프로젝션. DNA는 녹색의 유색 인종이며 kinetochores은 빨간색으로 물들어 있습니다. 화살표는 kinetochores (# 17, # 18) 중복을 나타내는 두 별개의 염색 분체 무기를 가리 킵니다. Euploid 마우스 계란 20 kinetochore 쌍 (40 총 "반점")가 포함되어 있습니다. aneuploid 달걀이 번호에 대한 유사 콘텐츠를 포함하는 것입니다. 이 절차는 metaphase MI의 oocytes 실시이라면, 40 kinetochore 쌍 (80 총 "장소")이있을 것입니다.
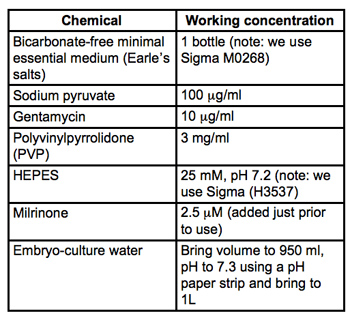
표 1. 수집 microinjection 매체에 대한 레시피 (멤 / PVP + M). 모든 자료는 배아 - 문화 학년 시그마 - 알드리치에서 있습니다. 4 0.22μm PVDF 필터 (우리가 Milipore의 Stericups 사용)하고 저장 ° C. 통해 소독을 필터링
iles/ftp_upload/2851/2851table2.jpg "고도 ="표 2 "/>
표 2. CZB 매체를위한 레시피. 모든 자료는 배아 - 문화 학년 시그마 - 알드리치에서 있습니다. 4 0.22μm PVDF 필터 (우리가 Milipore의 Stericups 사용)하고 저장 ° C. 통해 소독을 필터링
토론
oocytes의 Microinjection은 meiotic 성숙 10,11, 12, 13을 조절 메커니즘을 연구하기위한 강력한 방법입니다. 이 방법은 유전자 변형과 타겟이 마우스 모델을 개발에 큰 투자를 만들기 전에 가설을 테스트하는 경제적인 방법을 제공합니다. Oocyte 수집 및 microinjection 기술은 전형적인 세포 생물학 절차보다 주인에게 더 많은 시간을 필요로합니다. 컬렉션 특정 장애는 종종 수집에 대한 적절한 크기의 유리 피펫을 당기와 체세포의 스트립과 oocytes는 인큐베이터 외부되는 시간을 최소화하기 위해 수집 속도를 증가, 입 피펫을 통제 있습니다. 우리는 실험을하기 전에 여러 번 연습하는 것이 좋습니다. 세포의 같은 번호를 유지하면서 microdrops 사이 oocytes를 전송하면이 방법으로 편안한 될 수있는 좋은 방법입니다.
microinjection을 배우면서 세포 죽음은 일반적으로 발생합니다. 이것은 oocyte의 반대편을 날카로운 주사 바늘로 핵을 치면 소재의 볼륨 (사출 바늘 자리가 너무 큽니다 IE)의 너무 큰의 분사를 포함한 여러 가지 이유로,,, 또는 해당 발생할 수 있습니다 주입 재료 oocyte에 유해합니다. 당신의 생존 비율이 50 % 이상까지 oocytes로 버퍼를 주사와 함께 연습하는 것은이 기술을 마스터하는 열쇠입니다. oocytes가 성숙하지 않으면 그것은 milrinone 충분히 희석되지 않은 것입니다. 우리는 성숙하기 전에 milrinone 무료 CZB 많은 큰 방울을 통해 oocytes를 rinsing 것이 좋습니다.
ploidy 분석 다음의 microinjection은 meiotic 성숙을 평가하기 위해 많은 assays 중 하나입니다. 우리가 실험실에서 사용하는 다른 루틴을 분석하는 스핀들 형성과 염색체 정렬 계란 활성화를 분석하거나 체외의 수정에 oocyte 조작 14,15의 발달 결과, 16을 평가하기 위해 immunofluorescence 감수 분열을 통해 oocytes 진행, 반응 속도론 모니터링을 포함 17.
공개
감사의 말
이 작품은 리차드 M. 슐츠의 연구실에서 수행되었다. 저자는 또한 centromere - 카운팅 분석과 그의 공촛점 현미경에 대한 액세스를 conceptualizing에 대한 마이클 램프슨을 인정하고 싶습니다. 테레사 치앙과 프란체스카 던컨 centromere - 카운팅 분석을 최적화에 도움. 폴라 스테인은 HD022681에서 지원 (RMS로)와 카렌 쉰들러는 HD055822에 의해 지원됩니다.
자료
특정 시약 표 :
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| Milrinone | 시그마 - 알드리치 | M4659 | 2.5mM에서 DMSO에 Resuspend |
| 미네랄 오일 | 시그마 - 알드리치 | M5310 | 단지 배아 테스트, 멸균 필터링 사용 |
| 크레스트 autoserum | Immunovision | HCT - 0100 | |
| Sytox 그린 | Invitrogen | 57,020 | |
| 안티 인간 알렉사 594 | Invitrogen | A - 11014 | |
| Vectashield | 벡터 연구소 | H - 100 | |
| Paraformaldehyde | Polysciences | 577773 | |
| 소 혈청 알부민에서 | 시그마 - 알드리치 | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | 시그마 - 알드리치 | M8515 | 100mM에서 DMSO에 Resuspend |
| 트윈 - 20 | 시그마 - 알드리치 | 274348 | |
| TritonX - 100 | 시그마 - 알드리치 | X - 100 |
특정 장비의 테이블 :
| 장비의 명칭 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| 대변자 | Biodiseno | MP - 001 - Y | |
| Watchglass | 전자 현미경 과학 | 70543-30 | |
| 주사기 | BD | 309623 | 1ml, 27G 2분의 1 |
| 60mm 페트리 접시 | 매 | 351007 | |
| 유리 파스퇴르 pipets | 피셔 과학 | 13-678-200 | |
| 사이드 따뜻해 | 피셔 과학 | 모든 표준 모델 | |
| 해부 현미경 | 모든 표준 모델 | ||
| 챔버 슬라이드 | Nunc | 177372 | |
| 모세관 튜브 | 드루먼드 | 1-000-0500 | microcaps |
| 피펫 풀러 | 플라밍 - 브라운 micropipette 풀러 | 모델 P - 97 | |
| 거꾸로 현미경 | 니콘 | 모든 표준 모델 | |
| Micromanipulators | Eppendorf | 모든 표준 모델 | |
| Picoinjector | 하버드 장치 | 모델 PLI - 100 | 모든 표준 모델 |
| CO 2 탱크 | 보육에 대한 | ||
| N2 탱크 | 테이블과 주입기에 대한 | ||
| 방진 테이블 | 기술 제조 | 모든 표준 모델 | |
| 보육기 | 모든 표준 모델 | ||
| 홀딩 pipettes | Eppendorf | 930001015 | Vacutip |
| 공촛점 현미경 | Leica | 모든 표준 모델 | |
| 해부 도구 | 파인 과학 도구 | 모든 표준 모델 | |
| Humidified 챔버 | 우리는 유리 섬유 복합을 사용 | ||
| 96 잘 접시의 뚜껑 | Nunc | 263339 | |
| 현미경 슬라이드 | 피셔 과학 | 12-544-3 | |
| Coverslips | 토마스 과학 | 6663 - F10 | 두께는 특정 현미경에 따라 다를 것입니다 |
| 센터 아니라 장기 문화 요리 | 피셔 과학 | 353037 | 60 X 15mm |
참고문헌
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유