Method Article
マウス卵母細胞のマイクロインジェクション、成熟および倍数性評価
要約
卵母細胞が減数分裂成熟中に染色体の分離の誤差による異数性になりやすいです。異数体卵は不妊、流産やダウン症などの発達障害を引き起こす可能性があります。ここでは、卵母細胞と減数分裂成熟を研究し、倍数性を評価する方法に選択の材料を導入する方法を説明します。
要約
染色体の分離に間違いが異数体細胞につながる。体細胞では、異数性が癌に関連付けられていますが配偶子には、異数性は、ダウン症候群のように不妊、流産や発育障害につながります。半数体の配偶子は減数分裂に結合されている種特異的な発生プログラムを介して形成されます。姉妹染色分体が相同染色体が分離されている間、接続されたままため、最初の減数分裂(MI)は、減数分裂に特有です。理由はよく分からないのですが、このreductional部門では、エラーを起こしやすいですし、より一般的に減数分裂II(MII)の誤差よりまたは男性の減数分裂の1,2の誤差よりも異数性の源です。
哺乳類では、大規模な、無傷の卵核胞(GV;核)とMIの前期における卵母細胞の逮捕と彼らは排卵の合図を受け取るときだけ減数分裂を再開する。一度減数分裂の再開、卵母細胞の完全なMIとMIIの中期で再び逮捕、非対称細胞分裂を受ける。彼らは精子によって受精されるまで卵はMIIを完了しません。卵母細胞はまた 、in vitro の培養条件3 に確立された使用して減数分裂成熟することができます。トランスジェニックおよび遺伝子標的マウスの変異体の生成はコストがかかると、長時間かかることがあるため、in vitroでの女性の配偶子の操作は、より経済的と時間の節約の戦略です。
ここで、我々は、マウスからとマイクロインジェクション用の前期、逮捕された卵母細胞を分離する方法を説明します。任意に選択した材料は、卵母細胞に導入することができるが、減数分裂、有能な卵母細胞は4,5 cRNAのではなく、DNA転写サイレントなので、異所性発現の研究のために注入されている必要があります。倍数性を評価するために、我々は、MIIの卵に卵母細胞の体外成熟のために私達の条件を説明します。歴史的に、染色体拡散技術は、染色体数6をカウントするために使用されています。このメソッドは、技術的に困難であるとだけhyperploidiesを識別するために制限されています。ここで、我々は、低刺激、7-8無傷の卵を使用してhyperploidiesを決定する方法を説明します。このメソッドは、monastrol、したがって個々の動原体は容易に抗CREST免疫血清を用いて検出してカウントすることができるように染色体を分離するモノポーラスピンドル9にバイポーラスピンドルを折りたたみますキネシン- 5阻害剤を、使用しています。このメソッドはそのまま卵で実行されるため、染色体は、オペレータのエラーのために失われていません。
プロトコル
1。マウスの卵母細胞のコレクション
- 各マウスから分離した胞状卵胞の数を最大化するために、腹腔内には、妊馬血清ゴナドトロピン(PMSG)の5 IUで性的に成熟した雌マウスを(我々はハーランから6週齢のCF - 1マウスを使って)注入する。
- 2.5μMにミルリノンを追加することによって、コレクションの培地(MEM / PVP)(3 0.2ml /マウス)を作製し、37℃で、それを温め℃にミルリノンは、卵母細胞を卵胞から削除されると減数分裂の停止を維持するホスホジエステラーゼ阻害剤である。また、3 - イソブチル-1 - メチルキサンチン(IBMX)(0.2 mm)またはジブチリル環状アデノシン一リン酸(dbcAMP)(100μg/ mlの)を使用することができます。 CZBの1mlにグルタミン(1mMの)とミルリノン(2.5μM)を添加することにより培養液を準備し、それは少なくとも1時間はインキュベーターで平衡化することができます。ペトリ皿とミネラルオイルをオーバーレイでそれぞれのmicrodropsを設定します。 MEM / PVP皿がスライド上に外より暖かいままCZB皿をインキュベータ内に配置されます。 (専門メディアやシグマからM2とM16)市販されている他のコレクションと培地はまた、日常的に使用されています。
- 約48時間プライミングをPMSG後、頚椎脱臼に続いてCO 2鎮静を使用して、マウスを犠牲に、卵巣を解剖し、予め温めておいたMEM / PVP +ミルリノン(MEM / PVP + M)を含むwatchglassにそれらを置きます。
- 1 mlのインスリン注射器を使用して、皿に卵巣をアンカーと一緒に固定されている27ゲージ(またはミシン)針とそれらを数回穿刺することにより胞状卵胞を離します。
- 解剖顕微鏡で見ながら、口で操作するガラスピペットを用いて卵丘 - 卵子複合体を収集する。コントラストの多くの顕微鏡があると便利です。また、組織や細胞を含む培地をプラスチックシャーレの蓋に上にピペットですることができます。唯一の大規模な、胞状卵胞としない小規模なプレ胞状卵胞または剥離した卵母細胞を収集する。が収集されると、暖かいスライド上と油の下にあるMEM / PVP + Mのmicrodropに複合体を転送する。
- 小さなピペットを(卵母細胞の直径よりやや大きい)を使用して、卵丘細胞を分離するために複合体を上下にピペッティングし。 CZB +ミルリノン(CZB + M)とインキュベーター内の場所のmicrodropに大きなピペットで剥離した卵母細胞を移す。
- 卵母細胞は、前の操作にインキュベーター内で少なくとも1時間で回復することができます。
2。卵母細胞のマイクロインジェクション
- メカニカルプラーのホウケイ酸ガラスキャピラリーチューブを引いて、注入ピペットを行う。 P = 500、熱= 300、プル= 150、ヴェル= 100、タイム= 150:我々は、次の設定でフレーミング-ブラウンマイクロピペットプラー(モデルP - 97)を使用します。
- その1 - ウェルチャンバースライド上の選択肢の注入材料0.5μlの低下(例えばsiRNA、cRNAを、モルフォリノオリゴヌクレオチド、など)にできるだけ近い場所にMEM / PVP + Mの5μlの滴を配置することにより、マイクロインジェクションのプラットフォームを準備メディア室は削除されています。顕微鏡ステージ上にミネラルオイルと場所(図1)でカバー。
- MEM / PVP + M.のドロップに所有者との位置に配置注入と保持ピペットpicoinjectorと防振テーブルに接続されている窒素のタンクをオンにします。メディアとそれを充填しながら静かにホールディングピペットに対してそれをタップすることでインジェクションピペットの先端を開きます。開口部が大きすぎる場合、媒体は迅速にと外に移動し、針が細胞を殺すのだ。開口部の小さすぎるとピペットは、しばしば簡単に詰まらせる。
- インキュベーターからプラットフォーム上でMEM / PVP + Mのドロップに転送卵母細胞(5-10)。注入する前に、picoinjectorを設定。 PBal = 2.5〜3.5 PSI、PInj = 7.8 PSI、PClear = 10-12 PSI、時間= 3秒:私たちはpicoinjector(ハーバード装置からモデルPLI - 100)で次のパラメータを使用してください。 50から10 PLの注入量でこの結果。
- CLEARを押しながら、材料のドロップに注射針を移動して埋める。培地のドロップにそれを返します。
- 卵母細胞を捕捉し、x軸に沿って注射針、卵母細胞およびホールディングピペットを揃えるためにホールディングピペットを使用してください。
- 高倍率下で、核に注意しながら卵母細胞を介してインジェクションピペットを進める。原形質膜を貫通されると、注入を押してください。注射後、針を撤回。卵母細胞とリピートを離します。一度、すべての卵母細胞が注入され、インキュベーターに戻す。時間の所望の量のためにCZB + Mで保持する、この時間は、実験的な目的(すなわちsiRNAおよびモルホリノノックダウン(最大24時間)、過剰発現(3-12時間))に依存します。 24時間より長いインキュベーションは、減数分裂の成熟が損なわれることに注意してください。
3。卵成熟
- インキュベーションは、CZB数滴(成熟媒体)を介して卵母細胞を洗浄し、インキュベーター内のオイルと場所の下に成熟培地のmicrodropに転送した後。
- 完全な成熟Tの16時間を許可する減数分裂IIのO中期。
4。倍数性分析
- CZB + monastrol(100μM)と場所外輪に水を持っている器官培養皿のウェルに750μlのを準備します。
- CZB + monastrol数滴を通して卵を洗うと器官の培養皿にそれらを転送する。 1時間インキュベーター内の場所
- 室温で20分間、PBS中2%パラホルムアルデヒドを含むwatchglassにそれらを転送することにより、卵を修正。ブロッキング溶液を別のwatchglassに移す。処理されるまでこの皿は4℃で保存することができます。
- 室温で15分間watchglassで透過液(PBS + 0.3%BSA + 0.1%TritonX - 100 + 0.02%のNaN 3)に移す。ブロッキング溶液のいくつかの大量の(PBS + 0.3%BSA +0.01のTween - 20 + 0.02%のNaN 3)ですすいでください。
- 手順の残りの部分は光から保護されている室温で加湿チャンバー内で96ウェルプレートのフタで実行されます。滴(〜25μl)を円形のくぼみの内側に配置されています。 15分間ブロッキング溶液に卵を移す。
- ラベルの動原体に、午前1時40分でCREST抗血清を含むブロッキング溶液の滴に卵を移す。少なくとも1時間インキュベートするそれぞれに15分インキュベートし、ブロッキング溶液を3滴を通して洗浄する。
- Cy5標識またはAlexa -フルオロ- 594標識抗ヒトIgG(1:200)と1Hインキュベートを含むブロッキング溶液の液滴に卵を移す。最後のステップを除いて上記の手順を洗濯繰り返し、染色体を検出するためにブロッキング溶液でSYTOXグリーン(1:5,000)が含まれています。 Vectashieldの5μlにマウントします。卵の破砕を防ぐために、カバースリップが入る位置の隅にワセリンの4つの小さな斑点を置く。トップとマニキュアとシールでカバーを置きます。 4でスライドボックスに保管°共焦点顕微鏡を介して処理されるまでC。
- 100Xを目的としたイメージングしながら、Z -面と画像の分裂中期紡錘体の全領域で0.4μm以下の手順をキャプチャします。イメージJ(NIH)などのイメージングソフトウェアを使用して、動原体を数える。
5。代表的な結果:
図2は、正倍数体卵からZ -射影である。 MIIの中期で、正倍数体のマウスの卵は、染色体の20ペアを含んでいるため、40セントロメアを持っている。時折染色体はmonastrolの治療にもかかわらず、広めて失敗する。この状況は、それが難しい確実にセントロメアをカウントするために、我々はそれゆえ我々の分析ではこれらの卵が含まれていないことができます。時折、それは、CREST -免疫反応性"スポット"が1または2動原体であるかどうかを決定するために挑戦的な場合があります。 "スポットは"慎重に染色体の向き、"スポット"が検出されたセクションの数とピクセル強度を指摘しながら、1つは各Z -セクションを分析することができるので便利であるようなイメージJのようなプログラムを使用することはできません。減数分裂紡錘体の極体に対して相対的に配置されている場所によっては、DNAの領域はオーバーラップすることができ、これらの試料は分析に含まれるべきではない。
Unmanipulated、 生体内で繁殖若いマウスから排卵された卵は、異数性の低料金(1〜2%)を持っている。しかし、上の理由から理解していない、マイクロインジェクションし、 体外成熟の手順では、10%のこの速度の上向きを増やすことができます。したがって、コントロールを注入した卵母細胞は、任意のマイクロインジェクションの研究に含まれていることが重要です。

図1。マイクロインジェクション皿が設定する 。ちょうど注射液の0.5μl滴上記のMEM / PVP + Mの5μlの滴とチャンバースライド。ミネラルオイルで覆う。この例では3種類の注射液とスライドのための3滴が存在する顕微鏡のステージ上に座っている。左にマイクロインジェクションの針と右には、ホールディングピペットです。ニードルホルダーの反射があることに注意してください。
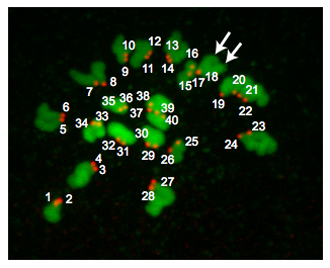
図2。倍数性の結果 。正倍数体中期IIの卵のZ -投影。 DNAは緑色に着色されており、動原体は赤で色分けされています。矢印は、その動原体(#17と#18)の重複を示す2つの異なる染色分体の腕を指している。正倍数体マウスの卵は20動原体のペアを(全40"スポット")が含まれています。異数体卵にはこの数値上の任意のバリエーションが含まれます。この手順は、中期MIの卵母細胞で実施された場合、40動原体ペア(合計80"スポット")があるでしょう。
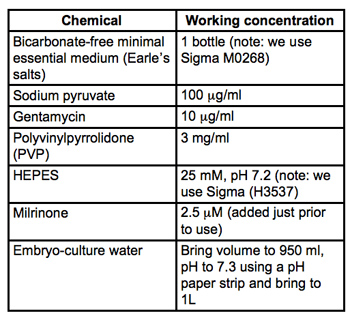
表1。コレクションおよびマイクロインジェクションの培地(MEM / PVP + M)のためのレシピ 。すべての材料はSigma - Aldrich社からの胚培養グレードとなります。 4で0.22μmのPVDFフィルター(我々はミリポアStericupsを使用)、店舗を通して滅菌フィルタリング℃に
iles/ftp_upload/2851/2851table2.jpg"ALT ="表2"/>
表2。 CZB媒体のためのレシピ 。すべての材料はSigma - Aldrich社からの胚培養グレードとなります。 4で0.22μmのPVDFフィルター(我々はミリポアStericupsを使用)、店舗を通して滅菌フィルタリング℃に
ディスカッション
卵母細胞のマイクロインジェクションは、減数分裂成熟10,11、12、13を制御するメカニズムを研究する強力な方法です。このメソッドは、トランスジェニックおよびターゲットマウスモデルの開発に大きな投資を行う前に仮説をテストするための経済的な方法を提供します。卵母細胞の収集とマイクロインジェクション技術は、典型的な細胞生物学の手続きよりもマスターに多くの時間を必要とする。コレクションを持つ特定の障害は、しばしば収集のために適切なサイズのガラスピペットを引くと体細胞の剥離や卵母細胞は、インキュベーターの外である時間を最小限にするためにコレクションの速度を上げ、口のピペットを制御含まれています。我々は実験を実行する前に何度も練習をお勧めします。セルの同じ数を維持しながらmicrodropsの間に卵母細胞を転送すると、この方法に慣れるのに最適な方法です。
マイクロインジェクションを学習しながら細胞死がよく発生します。これは、卵母細胞の反対側にピアス、注射針で核を打つ、材料の体積が大きすぎるの注入(注射針の開口部が大きすぎる、すなわち)を含むいくつかの理由で発生しますか材料が注入されたことができる卵母細胞に対して毒性が強い。あなたの生存率は少なくとも50%になるまで卵母細胞にバッファーを注入して練習すると、このテクニックをマスターする鍵となります。卵母細胞の成熟に失敗した場合には、ミルリノンが十分に希釈されていない可能性があります。我々は、成熟前にミルリノンフリーCZBの多くの大滴を通して卵母細胞を洗浄することをお勧めします。
倍数性分析は、次のマイクロインジェクションは、減数分裂成熟を評価するために多くのアッセイの一つです。我々は実験室で使用する他のルーチン分析には、減数分裂、卵母細胞の操作14,15の発達の影響を評価するための紡錘体形成および染色体の整列と卵の活性化を分析するための免疫蛍光や体外受精、16を通ってから卵母細胞の進行速度を監視して含まれています17。
開示事項
謝辞
この作品は、リチャードM.シュルツの研究室で実施された。また、作者はセントロメア計数アッセイと彼の共焦点顕微鏡へのアクセスを概念化するためのマイケルランプソンに感謝します。テレサチェンとフランチェスカダンカンは、セントロメア計数アッセイの最適化に協力した。ポーラスタインは、HD022681でサポートされています(RMSまで)とカレンシンドラーはHD055822でサポートされています。
資料
特定の試薬の表:
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| ミルリノン | シグマアルドリッチ | M4659 | 2.5mmのでDMSOに再懸濁し |
| 鉱油 | シグマアルドリッチ | M5310 | 滅菌濾過、胚テストのみを使用 |
| CREST自己血清 | Immunovision | HCT - 0100 | |
| SYTOXグリーン | インビトロジェン | 57020 | |
| 抗ヒトアレクサ594 | インビトロジェン | - 11014 | |
| Vectashield | ベクターラボラトリーズ | H - 100 | |
| パラホルムアルデヒド | Polysciences | 577773 | |
| ウシ血清からのアルブミン | シグマアルドリッチ | A3294 | |
| PMSG | カルビオケム | 367222 | |
| Monastrol | シグマアルドリッチ | M8515 | 100mMのでDMSOに再懸濁し |
| Tween - 20を | シグマアルドリッチ | 274348 | |
| TritonX - 100 | シグマアルドリッチ | X - 100 |
特定の機器の表:
| 機器の名前 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| マウスピース | Biodiseno | MP - 001 - Y | |
| Watchglass | 電子顕微鏡学 | 70543〜30 | |
| 注射器 | BD | 309623 | 1ミリリットル、27G 1月2日 |
| 60ミリメートルシャーレ | ファルコン | 351007 | |
| ガラスパスツールピペット | フィッシャーサイエンティフィック | 13-678-200 | |
| サイドウォーマー | フィッシャーサイエンティフィック | 任意の標準モデル | |
| 解剖顕微鏡 | 任意の標準モデル | ||
| チャンバースライド | ヌンク | 177372 | |
| キャピラリーチューブ | ドラモンド | 1-000-0500 | microcaps |
| ピペットプラー | 炎 - ブラウンマイクロピペットプラー | モデルP - 97 | |
| 倒立顕微鏡 | ニコン | 任意の標準モデル | |
| マイクロマニピュレータ | エッペンドルフ | 任意の標準モデル | |
| Picoinjector | ハーバード装置 | モデルPLI - 100 | 任意の標準モデル |
| CO 2タンク | インキュベーターのための | ||
| N2タンク | テーブルとインジェクタ用 | ||
| 防振テーブル | テクニカルマニュファクチャリング | 任意の標準モデル | |
| インキュベーター | 任意の標準モデル | ||
| ホールディングピペット | エッペンドルフ | 930001015 | Vacutip |
| 共焦点顕微鏡 | ライカ | 任意の標準モデル | |
| 解剖ツール | ファイン科学ツール | 任意の標準モデル | |
| 加湿チャンバー | 私たちは、タッパーウェアを使用 | ||
| 96ウェルプレートの蓋 | ヌンク | 263339 | |
| 顕微鏡スライド | フィッシャーサイエンティフィック | 12-544-3 | |
| カバースリップ | トーマス科学 | 6663 - F10 | 厚さは、特定の顕微鏡のために変わる |
| センターも器官培養皿 | フィッシャーサイエンティフィック | 353037 | 60 X 15ミリメートル |
参考文献
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved