Method Article
הדמיה של קולטן אסטרוגן α ב Arterioles Pial עכברוש באמצעות מיקרוסקופ דיגיטלי Immunofluorescent
In This Article
Summary
מטרת מאמר זה היא להדגים שיטה לייעל את זיהוי immunofluorescent של קולטן אסטרוגן α (ERα) על פרוסות עכברוש pial עורקים באמצעות מיקרוסקופ דיגיטלי immunofluorescent.
Abstract
רבים מן ההשפעות של אסטרוגן על תגובתיות כלי הדם מתווכות דרך האינטראקציה עם קולטני אסטרוגן 1, 2, 3. אמנם לשתי תת סוגים קיימים (קולטן אסטרוגן α ו β), קולטן אסטרוגן α זוהתה השריר הן חלק בתאי האנדותל של מגזרים עורקי pial באמצעות מכתים פלורסנט בשילוב עם לייזר confocal מיקרוסקופיית 4. יתר על כן, ER-α נמצא הגרעינים ואת בציטופלסמה של basilar העורקים חולדה 5. הקולטנים נמצאים בשפע לזרוח באור בהיר, אבל ברור להדמיה של קבוצות נפרדות של קולטנים קשה כנראה עקב המספרים ממוקם שכבות תאים רבים של קטעי כלי pial. בנוסף, דיווחים רבים תוך שימוש בטכניקות immunohistochemical יחד עם מיקרוסקופיה פרט confocal גרוע בדרישות קריטי עבור שעתוק של ניסויים 6. מטרתנו במאמר זה היא לתאר טכניקה פשוטה כדי לייעל tהוא מכתים ויזואליזציה של ER-α באמצעות חתך פרוסות arterioles pial לקבל מן המוח חולדה ממין נקבה. אנחנו הראשונים perfuse חולדות עם אוונס כחול צבע לזהות בקלות העורקים משטח pial שבו אנו לבודד תחת מיקרוסקופ לנתח. השימוש cryostat לחתוך 8 חתכים מיקרומטר העורקים מאפשרת לנו להשיג חלקים לכלי כל כך רזה כי מטוסים כלי שיט שונים דמיינו יותר בבירור. חיתוך לרוחב כלי השיט, במקום השימוש קטע כלי קטן יש את היתרון של צפייה קלה יותר של שכבות השריר אנדותל וחלק. בנוסף, השימוש של מיקרוסקופ דיגיטלי עם תוכנה immunofluorescent עומק המורחבת מייצרת תמונות ברורות של 10-12 מטוסים כלי שיט שונים הוא יקר פחות מאשר השימוש במיקרוסקופ לייזר confocal סריקה.
Protocol
1. בידוד הכנת העורקים Pial
- בעוד העכברוש הוא להכניס הרדים ומאובטח קטטר לתוך עורק ו perfuse עם 1% אוונס כחול 1X PBS. כלי Pial כתם היטב עם צבע כחול אוונס שהופך אותם קל יותר לבודד.
- חלץ את המוח לאחסן ב -70 ° C עד הצורך. באופן אופטימלי, המוח צריך להיות מאוחסן לא יותר מ 2 חודשים.
- באמצעות מיקרוסקופ לנתח ולהסיר arterioles pial (ממוצע 35-50 מיקרומטר קוטר) מפני השטח של המוח. משוך בזהירות את כל כחול מוכתם arterioles מפני השטח הגבי ו לרוחב של קליפת המוח באמצעות קנס שקצהו מלקחיים. הסרת עודפי רקמת קליפת המוח חסיד לפני הצבת ב מקבע.
- תקן את arterioles שנבצרו paraformaldehyde קר 2% ב 0.1M PBS למשך 30 דקות.
- כדי להכין את arterioles עבור חתך לשפוך בינוני הטבעה על הקפאת דיסק / צ'אק (קבוצה ב -20 ° C).
- עורקיק מקום בסעיף שטוח על צ'אקnd להמתין עד להקפיא. המקום היטב את כלי הימני על הדיסק cryostat הקפאה על הטבעה התקשורת עם קצה של העורק פונה אליך. תחזיק את זה עם פינצטה עד שהוא קפוא היטב.
- הנח את הדיסק הקפאה עם הכלי לתוך הראש cryostat וחותכים 8 מיקרומטר טבעות עורקיק pial עם cryostat.
- הר בסעיפים עורקיק על כרום, אשלגן ג'לטין שקופיות לספסל.
- אחסן את השקופיות מוכן בתיבת שקופיות במקרר ב 4 מעלות צלזיוס למשך הלילה.
2. ER-α Immunofluorescent מכתים
יום 1
- הסר את השקופיות מהמקרר, להביא כל לטמפרטורת החדר.
- כדי לשטוף את השקופיות לשפוך 1-1.5 מ"ל 0.1M PBS (מספיק כדי לכסות את כל חלקי) בואו לשבת במשך 10 דקות, מסננים וחוזרים על התהליך פעמיים נוספות. כל קצה של השקופית יש סמן הידרופובי. כתוצאה מכך, הנוזל נשאר על פני השטח של השקופית. עם כל נוזל כביסה היא שפכההחוצה והחליפו עם טרי 0.1 M-PBS.
- דגירה שקופיות 1 מ"ל של אמוניום כלוריד 50mm למשך 30 דקות בטמפרטורת החדר כדי להפחית את הקרינה אנדוגני.
- שטפו את השקופיות דקות 0.1M 3x10 PBS. כפי שמתואר 2.2
- מגלשות חסום 0.1% טריטון X-100 בתוספת 1% נסיוב עז רגילה (NGS) ב-PBS למשך 30 דקות. כדי להפחית את הלא ספציפית מחייב.
- דגירה דגימות עם הנוגדן הראשוני (ארנב polyclonal אנטי ER-α; 1:500) ב-PBS + 0.1% + טריטון X-NGS 1% לילה בשעה 4 ° C.
יום 2
- הסר את השקופיות מהמקרר, להביא כל לטמפרטורת החדר.
- שטפו את השקופיות דקות 0.1M 3x10 PBS. כפי שמתואר 2.2
- דגירה עם אורגון גרין 488 ארנבת אנטי משני NGS 1% 0.1% טריטון-X100 + PBS לשעה 2 בחושך בטמפרטורת החדר. מ בשלב זה, הפעולות הבא חייב להיעשות בחושך.
- שטפו את השקופיות דקות 0.1M 3x10 PBS. כפי שמתואר 2.2
- תחת veמכסה המנוע ntilated, ירידה של מקום 1 4 ', 6-diamidino-2-phenylindole (DAPI) פלוס מדיה גובר על כלי ולאחר מכן במקום להחליק לכסות על המדגם.
- החל מסמר ברור למרק כדי לאטום את הקצוות של להחליק את המכסה. אל תזיז את השקופיות עד יבש לחלוטין, אשר לוקח בערך 24 שעות.
3. Digital Imaging פלואורסצנטי
- עבור הדמיה ER-α מכלי pial פרוסה אנו משתמשים Eclipse Nikon 80i מיקרוסקופ דיגיטלי ניאון עם מסננים עבור 3 צבעים (כחול, ירוק ואדום) מצויד במצלמה דיגיטלית.
- הכנס את שקופיות שהוכנו עם פלחי מוכתם כלי pial מתחת למיקרוסקופ ולהתאים לדמיין את האזורים שכותרתו fluorescently של עניין. התחל בהגדלה של x100 אז כדי להגדיל הגדלה X600.
- שימוש במצלמה ללכוד תמונות ב DAPI (כחול) FITC (ירוק) עבור ערוצי גרעיני תאים (DAPI) ו ER-α (אורגון הירוק) באמצעות ניקון תוכנה מורחבת פוקוס עומק להמיר להציג מספרים של מגזרים כלי לתוך 2-D תמונות.
4. נציג תוצאות:
אנו מקומי קולטן אסטרוגן α בכלי עורקי pial באמצעות בדיקות ניאון אופטימיזציה להדמיה שלנו של הקולטן באמצעות מיקרוסקופ פלואורסצנטי דיגיטלית. כדי לזהות נוכחות של הקולטן, נוגדן ארנבת העיקרי polyclonal ו הירוק אורגון 488 נוגדנים משני שכותרתו שימש התמונה קולטנים בעורקים pial מבודד מפני השטח של המוח. כמו כן, גרעיני כתם (DAPI) שימש כדי לזהות את גרעין התא לקבוע אילו יכולנו לזהות קולטנים הממוקמים בגרעין מאז ER-α דווחה להיות נוכח cyotosol את התא לגרעין. בנוסף, אנו מאשרות ניסויים כדי לאמת את הספציפיות של הנוגדן הראשוני כדי לוודא קשירה של משנית הנוגדן הראשוני.

באיור 1. מכתים Immunofluorescent עבור ER-α (ירוק) ו counterstaining עם DAPI (כחול) בטבעת עורק pial מבודד המוח חולדה ממין נקבה. איור 1 א 'מציג את תמונות הממוזגת להציע את נוכחותם של כמה intranuclear קולטן אסטרוגן (חץ). איור 1B ו 1C הם תמונה ממוקדת של ER-α שהוא שילוב של Z-ערימת תמונות. תמונות צולמו בהגדלה X600 והם מהזירה חתך של כלי השיט באותה מטוסים שונים. החצים מצביעים על קולטן אסטרוגן α.
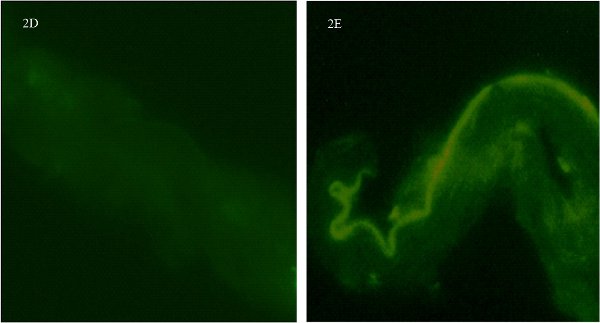
באיור 2. מכתים Immunofluorescent לקבוצות לשלוט בטבעת עורק pial מבודד המוח חולדה ממין נקבה. איור 2 ד מציג את כלי בלי נוגדן ראשוני. 2E איור מראה את הספינה ללא נוגדנים המשני (autofluorescence לב מובהק לצד אנדותל). תמונות צולמו בהגדלה X600 והם מהזירה חתך של כלי השיט באותה different מטוסים.
Discussion
בעבר הראינו כי לאחר פגיעה מוחית העולמי איסכמי חולף יכולת העורק pial לשנות בקוטר בתגובה שניהם vasodilators 7, 8 ו 9 vasoconstrictors מדוכא ניכר בחולדות ovariectomized צעירים. גודש אסטרוגן כרונית משחזר התגובות וזומוטורים 7-9. יתר על כן, האסטרוגן עיכוב הופכת את ההשפעות המיטיבות של אסטרוגן על יכולת pial עורק vasodilatory 10 מוביל אותנו לשאלה אם לטווח ארוך דלדול אסטרוגן משפיע על ER-α הצפיפות cerebrovasculature. תכננו להשתמש בשילוב עם תיוג immunofluorescent המערבי סופג כדי להעריך את השינויים בביטוי ER-α בתגובה דלדול אסטרוגן כרונית. כי היו לנו כמה קשיים להדמיה של קבוצות נפרדות של קולטנים שינינו את השיטה שבה אנחנו מדגימים כאן. לכן, המטרה העיקרית שלנו במחקר זה היה הראשון לפתח שיטה פשוטה יחסית, כדי לייעל את הראייהשנפלו על הקרקע הפורייה של קולטנים arterioles pial. בהסכם עם מספר דיווחים 6,11,12 מצאנו לנכון לבצע התאמות עבור סוג של רקמה היינו חיטוט, עובי המדגם, התפלגות ER-α בתוך כלי, כמו גם את מידת הלא ספציפית מחייב .
השיטה שלנו מאוד יעיל כדי להמחיש את נוכחותו של ER-α בתוך פרוסות כלי pial. אבל כפי שאחרים ציינו בעבר את השימוש המוצלח של שיטות אלו תלויה מאוד ספציפיות ועל ריכוזים של הנוגדנים, את מיקומו subcellular של חלבונים של קיבוע הריבית, ופרוטוקולים חסימת וטיפול ברקמה 12. לפני ויזואליזציה של כלי ההכנות שלנו בילינו זמן לעבוד על כל אלה משתנים. יש לנו הדגיש כמה אנחנו צריכים לשנות כמה הגישה שלנו במאמר זה.
יצאנו באופן אופטימלי לדמיין ER-α ב arterioles pial וזה הציג כמה אתגרים.ראשית, הגודל הממוצע של העורקים עכברוש pial הוא בין 35-50 מיקרומטר ביצוע בידוד והסרה ממשטח המוח מסובך במקצת. מצאנו כי זלוף עם אוונס כחול לצבוע לפני להקריב עושה דיסקציה של העורקים קל. כחול של אוון יכול להשפיע הקרינה, אבל אנחנו מרגישים את היתרון של שימוש לצבוע עולים חסרונות קלים שלה. בפרוטוקול שלנו הכלים נשטפים מספר פעמים. זה ממזער את צבען שיורית הכלים ומקטין את ההשפעות האפשריות של צבע על הקרינה. קושי נוסף נתקלנו היה עובי של המגזרים כלי pial עשה ויזואליזציה ברורה של קולטנים קשה. בנוסף, לא יכולנו לקבל תמונות ברורות במיוחד, כנראה בגלל העובדה ER-α היו פזורים מספר שכבות תאים. ניסינו לעבוד עם פרוסות כלי האורך (כמו אחרים), אך בשל גודל pial קטן היה קשה להתמודד עם הכלים למנוע פיתול של כלי בעת הרכבהבשקופיות גם באמצעות מיקרוסקופ. לבסוף, אנו שונה בהצלחה הטכניקה שלנו באמצעות cryostat חיתוך כלי צולבות חכם ל -8 טבעות מיקרומטר עבה. הטבעות יותר קל לטפל וכמה יכול להיות מותקן בשקופית אחת.
לאחר שרכשנו את כלי הרגשנו צורך לבדוק את האפקטיביות של ההבזק הראשון מקפיא את הרקמה אז תיקון כלי כפי שהוצע על ידי Danseshatalb ושותפים 11. אמנם מצאנו immunofluorescence רקע שולית פחות, אנחנו גם ציין כי הקולטנים מוכתמים פחות אינטנסיבי עושה ויזואליזציה של קולטנים קשה יותר. כתוצאה מכך, אנו מעדיפים הראשון להקפיא את המוח כולו לאחסן עד הצורך (בדרך כלל בין 1-2 חודשים). לאחר מכן לשלוף את כלי כמתואר ולתקן את כלי לפני חיתוך עם cryostat. כפי שאנו מראים כאן.
אחת היא צעד הכרחי כדי להפעיל פקדי עם ראשוני והן משני הנוגדנים בנפרדכדי לקבוע הספציפיות immunofluorescence רקע. קולטן אסטרוגן α נוגדנים יכול להיות קשה לעבוד איתו. למעשה, ניסינו 3 נוגדנים העיקרי שונים (1 ו 2 חד שבטיים polyclonal) לפני שאנחנו מרוצים ההצלחה של מכתים הקולטן שלנו. במסגרת בקרות שלנו לאמת תחילה את הספציפיות של הנוגדן הראשוני על ידי השמטה של תוספת של הנוגדן הראשוני. איור 2 ד מציג את כלי בלי נוגדן ראשוני. אין מכתים ופשוט אות הרקע מעט. מאז הנוגדן העיקרי הוא polyclonal, יש כמה כתמים מפוזר שאינו ספציפי ברקע. שנית, הוספנו את הנוגדן הראשוני, אך לא את הנוגדן משני (איור 2E). ניתן לראות מרווח יפה המייצג את autofluoresence לאורך גבולות אנדותל של כלי. זה עולה בקנה אחד עם עבודתו של דן וחבריו 5. עם זאת, לא נקודות קטנות של immunofluorescence המייצגים ER-α, ולא נ"צ הופעה פרטניתlecting נוכחות של קולטנים רבים ניתן להבחין ללא שילוב של שני נוגדנים ראשוניים ומשניים. ציינו דפוס מובהק של autofluoresence בשולי האנדותל של כלי הדם. אלו בדיקות עצמאיות עבור סגוליות נוגדנים חשובים כפי שהם מאשרים את הספציפיות של הנוגדן עבור ER-α לבין נוגדנים משני נקשר הראשי.
לסיכום, כפי שהוכח על ידי אחרים 4, 5 כלי הדם במוח מכילים מספר רב של ER-α תת סוג הקולטנים. בידיים שלנו, הכנת 8μm פרוסות חתך צלב מן העורקים pial מבודד משפר מכתים ויזואליזציה של הקולטנים. שיטות מסורתיות להשתמש מיקרוסקופיה confocal לבחון את הדגימות. לאחר היכולת להציג קטעי אופטי סדרתי מתוך דגימות עבה היא יתרון חשוב של מיקרוסקופיה confocal. עם זאת, רכישה של מיקרוסקופ confocal טוב יכול להיות מאוד יקר. באמצעות תוכנה מורחבת (EDF) עומק, מצאנו כייכול להפחית את עלויות הציוד שלנו. באמצעות מיקרוסקופ פלואורסצנטי עם EDF השגנו תמונות ברורות והם מסוגלים לדמיין pial עורקי ER-α בכמה רמות באמצעות Z-ערימות. יתרון משמעותי של התוכנה EDF היא שזה מאפשר לכידת תמונה באופן יעיל ליצור תמונה 3-D מן התמונות. עבור מעבדות שאין להם גישה מיקרוסקופ confocal או הקרנות לרכוש אחד מיקרוסקופ פלואורסצנטי דיגיטלי עם תוכנה הופקעו עשויה להיות אפשרות מעשית פחות יקר בהתאם המטרות של החוקר.
Disclosures
הדעות המובאות הן של המחברים ואינן משקפות את המדיניות או העמדה הרשמית של האוניברסיטה שירותים במדים של מדעי הבריאות, משרד ההגנה, או ממשלת ארצות הברית.
Acknowledgements
העבודה על פרויקט זה נתמך על ידי מענקים מהמוסד הלאומי לבריאות R01-NR5339 ואוניברסיטת שירותי במדים של למדעי הבריאות, R061LD.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| אוונס BLUE | סיגמא | E-2129 | |
| 10X PBS | סיגמא | P-5493 | |
| Paraformaldehyde | פישר סיינטיפיק | T353 | |
| רקמות-Tek מתחם אוקטובר | VWR | 25608-930 | |
| אמוניום כלוריד | סיגמא | A9434 | |
| טריטון X-100 | סיגמא | T9284 | |
| עיזים רגיל סרום | Invitrogen | 16210-064 | |
| ER-α ארנב polyclonal נוגדן | סנטה קרוז | H-184 | |
| אורגון 488 ירוק עז נגד ארנב IgG | Invitrogen | O-11038 | |
| Vectashield הרכבהבינוני פלואורסצנציה עם DAPI | וקטור מעבדה | H-1200 |
References
- Smiley, D. A., Khalil, R. A. Estrogen compounds, estrogen receptors and vascular cell signaling in the aging blood vessels. Curr. Med. Chem. 16, 1863-1887 (2009).
- Miller, V. M., Duckles, S. P. Vascular actions of estrogens: functional implications. Pharmacol. Rev. 60, 210-241 (2008).
- Duckles, S. P., Krause, D. N. Cerebrovascular effects of oestrogen: multiplicity of action. Clin. Exp. Parmacol. Physiol. 34, 801-808 (2007).
- Stirone, C., Duckles, S. P., Krause, D. N. Multiple forms of estrogen receptor-a incerebral blood vessels: regulation by estrogen. Am. J. Physiol. Endocrinol. Metab. 284, E184-E192 (2003).
- Dan, P., Cheung, J. C., Scriven, D. R., Moore, E. D. Epitope-dependent localization of estrogen receptor-alpha, but not -beta, in en face arterial endothelium. Am. J. Physiol. Heart Circ. Physiol. 284, 1295-1306 (2003).
- Fritschy, J. M. Is my antibody staining specific? How to deal with pitfalls of immunohistochemistry. Eur. J. Neurosci. 28, 2365-2370 (2008).
- Watanabe, Y., Littleton-Kearney, M. T., Traystman, R. J., Hurn, P. D. Estrogen restores post-ischemic pial and microvascular dilation. Am. J. Physiol. Heart and Circ. 281, H155-H160 (2001).
- Li, M., Zeynalov, E., Li, X., Miyazaki, C., Koehler, R. C., Littleton-Kearney, M. T. Effects of estrogen on postischemic pial artery reactivity to ADP. Microcirculation. 16, 403-413 (2009).
- Qin, X. Y., Hurn, P. D., Littleton-Kearney, M. T. Estrogen restores postischemic sensitivity to thromboxane mimetic U46619 in rat pial artery. Cereb. Blood. Flow. Metab. 25, 1041-1046 (2005).
- Miyazaki, C., Koelher, R. C., Littleton-Kearney, M. T. Effects of HET0016 and estrogen on pial artery vasodilatory capacity. FASEBJ Abstracts. , (2007).
- Daneshtalab, N., Dore, J. J. E., Smeda, J. S. Troubleshooting tissue specificity and antibody selection: procedures in immunohistochemical studies. J. Pharmacol. Toxical. Methods. 61, 127-135 (2010).
- Lorincz, A., Nusser, Z. Specificity of immunoreactants. J. Neurosci. 28, 9083-9086 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved