A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חשיפת טופוגרפיה מעגלים עצביים Multi-Color
In This Article
Summary
אנו מספקים מדריך מעשי קליעים נותבים מתן In vivo ולהשתמש מסלול spinocerebellar כמודל למערכת להפגין צעדים חיוניים לניתוח מוצלח מעגלים עצביים בעכברים. אנו מתארים בפירוט פרוטוקול צדדי שלנו התחקות המנצלת נבט חיטה agglutinin (WGA) מצומדות כדי fluorophores אלקסה.
Abstract
מעגלים עצביים מאורגנים מפות טופוגרפיות תפקודית. כדי להמחיש אדריכלות מעגל מורכב פיתחנו גישה אמינה התווית דפוסים גלובליים של תחזיות הטופוגרפי מרובים. המוח הקטן הוא מודל אידיאלי ללמוד את הסדר מסודר של מעגלים עצביים. לדוגמה, ארגון compartmental של סיבי אזובי spinocerebellar הוכיחה להיות מערכת הכרחית ללימוד דפוסים סיבים טחב. אנחנו לאחרונה הראה כי נבט חיטה agglutinin (WGA) מצומדות כדי אלקסה 555 ו - 488 יכול לשמש התחקות spinocerebellar תחזיות סיבים אזובי בפיתוח עכברים בוגרים (Reeber et al. 2011). מצאנו שלושה מאפיינים עיקריים להפוך את WGA-Alexa כלים קליעים נותבים רצוי תיוג תחזיות עצביים. ראשית, fluorophores אלקסה הם אינטנסיבי הבהירות שלהם מאפשר הדמיה wholemount ישירות לאחר מעקב. שנית, WGA-Alexa קליעים נותבים התווית מסלול שלם של פיתוח מבוגר עצביים projections. שלישית, WGA-Alexa קליעים נותבים מועברים במהירות לשני הכיוונים מדרדר ו אנטרוגרדית. כאן, אנו מתארים בפירוט כיצד להכין את קליעים נותבים והכלים הנדרשים אחרות, כיצד לבצע את הניתוח עבור מעקב spinocerebellar ו מהי הדרך הטובה ביותר לעקוב אחר תחזיות תמונה בשלושה ממדים. לסיכום, אנו מספקים פרוטוקול צעד אחר צעד התחקות כי יהיה שימושי עבור בפענוח ארגון וקישוריות של מפות פונקציונלי ולא רק במוח הקטן, אלא גם בקליפת המוח, גזע המוח, וחוט השדרה.
Protocol
1. אספקת קליעים נותבים in vivo באמצעות ניתוח סטרילי (סעיפים 1.1-1.16)
לאורך כל התהליך אנו ממליצים כי תקן טכניקות ניתוחיות סטרילי לשמש. זה כולל שימוש בכפפות סטריליות, חלוק, ו facemask. כלים צריכים גם להיות autoclaved לפני השימוש או לנקות ביסודיות עם מים ולאחר מכן אתנול. במהלך הניתוח, ובעיקר בין בעלי חיים, שברי הרקמה לנקות את הכלים היבשים לעקר מכשירים עם חם חרוז מעקר (Steri 250 חתול. # 18000-45, כלי המדע פיין). בנוסף, זה קריטי, כי לך לארגן את מרחב העבודה שלך כמו שצריך באזורים המיועדים להכנת בעלי חיים (גילוח וכו '), את הניתוח, ואזור התאוששות שבה חיה ניתן לנטר בקלות, מחוממת, מסופק עם משככי כאבים לפי הצורך. המפתח להישרדות ניתוחים מוצלחים היא להפחית את הסיכון לזיהום ולשמור על אסטרטגיה אגרסיבית שלאחר הניתוח טיפול. עיין בלוח שבו אתה יכול סנפירד כל הציוד הדרוש ריאגנטים עבור פרוטוקול זה.
- הרדימי עכברים בוגרים עם Avertin מוכן טרי (2,2,2-Tribromoethanol, Sigma, סנט לואיס, מיזורי;. Cat # T48402) באמצעות זריקה (IP) intraperitoneal במינון של משקל הגוף 0.2ml/10grams. הרדמה אחרים כגון isoflurane או קטמין / xylazine יעילים באותה מידה אך להבטיח כי המעבדה שלך יש את אישור המוסדיים הפדרלי נדרש לפני השימוש. אם אתה משתמש גורים (P0 - P10) ניתן להרדים אותם על קרח כתוש במשך 10-15 דקות. ודא כי העור של כל גור הוא לא במגע ישיר עם קרח (לדוגמה, על ידי הצבתם של אצבעות כפפות לטקס) כמו מים קרים מהר להשרות רמה קטלני של היפותרמיה. ודא החיה תחת מישור מקובלת של הרדמה על ידי ביצוע קמצוץ הבוהן עם מלקחיים או אצבעות רגליו האחוריות של בעלי החיים. אם יש רפלקס הדוושה, לחכות עד החיה אינו מגיב לגירוי זה כאינדיקציה עמוקה יותררגיל של הרדמה.
- לאחר החיה הוא מורדם לחלוטין ולהניח אותה עם הצד הגבי שלה על כרית גזה סטרילי עם הראש שלה מול ממך ואת הזנב שלה מול כלפיך. לגלח את הפרווה עם קוצץ שיער על מנת לתת לעצמך בתחום כירורגית ברור כי הוא רחב מספיק כדי לקבל גישה אל מערכת העצבים המרכזית. נגב את האזור מגולח עם שני סטים של מגבונים אלכוהול, ולאחר מכן אלכוהול 70% / בבטאדין, ואחר כך נקיים שוב עם מגבונים אלכוהול. השתמש בתוך לדפוס החוזר מחוץ כאשר מנקים את אזור הניתוח. אתה יכול לבחור בבירור לתחום בתחום כירורגית שלך על ידי חיתוך חור קטן לתוך פד גזה סטרילי הצבת הפתיחה על האתר מגולח ונקי שלך כירורגית. למרות שמירה על שדה כירורגי סטרילי יכול להיות מסובך כאשר ההפעלה על חיות קטנות, ובכך תסייע להפחית את הסיכון לזיהום.
- הרם את העור באמצעות מלקחיים ולעשות חתך במספריים על קו האמצע ישירות מעל r החזי, המותני התחתון העליוןegion. האזור התחתון באזור בית החזה העליון, הגב התחתון ניתן לזהות על ידי מפעיל את האצבע על החוליות להרגיש עבור גבנון בתוך עמוד השדרה (איור 1).
- חותכים את fascia השדרה והשרירים שטחית. במידת הצורך, לעצור דימום על ידי צריבה של כלי הדם (כלי מדעי בסדר, פוסטר סיטי, קליפורניה;. Cat # 18000-00). בשנת גורים, הפעלת לחץ עדין סביב החתך עם צמר גפן מספיק כדי לעצור את הדימום.
- בצע laminectomy הגבי על ידי הסרת תהליכים spinous של אחד או שני חלקים של החזה התחתון - חוט השדרה המותני העליון לאחר חיתוך lamina משני צידי השדרה באמצע הטור, בין תהליך במפרק ואת תהליך spinous הגבי (איור 2) . היזהר שלא לפגוע בחוט השדרה במספריים שלך תמיד להסיר את שברי עצמות קטנים ככל שיכלו לקרוע את חוט השדרה. שים לב כי עמוד השדרה של הגורים לאחר הלידה המוקדמת לא התאבן לגמרי, כלומר העצמות הן מאודרך ניתן לחתוך בקלות רבה. לכן, להיזהר לא לחתוך עמוק מדי כפי שאתה עלול לגרום נזק לחוט השדרה.
- אם אתה מעדיף שלא לבצע laminectomy הגבי אצל עכברים מבוגרים, מצאנו כי ניתן לחתוך את רקמות רכות בין מגזרים בחוליות לחשוף אזור קטן של חוט השדרה ללא כל חיתוך העצם. אף על פי שתי השיטות מסלולים יעיל הכניסה חוט השדרה, מניעת laminectomy הגבי יכולים להבטיח את חוט השדרה נשאר ללא פגע.
- מילוי אלקטרודת הזכוכית ומשך (בורוסיליקט זכוכית נימים, חתול # 300056, הרווארד Apparatus, Holliston, MA,. כפולה זכוכית בשלב micropipette פולר מן Narishige דגם 001-PC-10) עם נותב באמצעות מזרק מיקרומטר (0.2mL; Gilmont מכשירים חתול . # GS-1100) או מנגנון המסירה המקבילה.
- הדק את microelectrode זכוכית למקום על micromanipulator והכנס את האלקטרודה 0.1-0.5mm לאזור בית החזה העליון, התחתון המותני של עמוד השדרה, באמצע הדרך בין אמצעקו לרוחב קצה של חוט השדרה. בעלי חיים עשוי להיות מוחזק מנגנון stereotaxic לצורך זיהוי מדוייק של לוקוסים הזרקת לייצוב חיים (בעלי חיים קטנים Stereotaxic דגם מכשיר 940-A ו Manipulator אלקטרודה דגם 960 מ Kopf Instrumentation). לחילופין, אם המשטר הרדמה שלך יכול להיות מותאם על מנת להשיג מטוס יציב ללא תנועות משמעותיות עקב נשימות עמוקות, בעדינות מקליטה את החיה למטה יספיק.
- לחץ להזריק לתוך חוט השדרה מעל 3-5 דקות 0.5μl כ פתרון 2% WGA-Alexa 488 (נבט חיטה agglutinin, Alexa פלואוריד 488 המצומד;. Cat # W11261, Invitrogen, Carlsbad, CA), WGA-Alexa 555 (נבט חיטה agglutinin, Alexa פלואוריד 555 המצומד;. Cat # W32464, Invitrogen, Carlsbad, CA), WGA-Alexa 350 (נבט חיטה agglutinin, Alexa פלואוריד 350 המצומד;. Cat # W11263, Invitrogen, Carlsbad, CA), WGA- HRP (נבט חיטה agglutinin peroxidase חזרת, Sigma, סנט לואיס, מיזורי חתול # L7017) או 0.5μl של 10%BDA (biotinylated dextran אמין;. Cat # D1956, Invitrogen, בקרלסבד, קליפורניה) ב פוספט בופר סליין (PBS: Sigma, סנט לואיס, מיזורי; חתול # P4417). הזרקת אלה כרכים של קליעים נותבים תוצאות ב תיוג כמות גדולה של סיבים. כמויות קטנות יותר יהיה צורך להזריק עבור מיקוד גרעינים קטנים יותר (או תת אזורים של גרעינים בודדים) והחוקר כל צריך לקבוע באופן אמפירי את נפח האידיאלי לספק. Iontophoresis צריך להיחשב למסירה nanoliter מדויק זריקות מדויקות. אנחנו בדרך כלל להשלים את כל פתרונות המעקב עם 0.5% Fast הירוק (סיגמא, סנט לואיס, מיזורי; חתול # F7252) כדי להמחיש את מקום ההזרקה במהלך הניתוח.
- אנו מוסיפים 1μl של שמן תירס (סיגמא, סנט לואיס, מיזורי; חתול # C8267) כדי 10μl כל פתרון BDA לפני הזרקת כדי למנוע את התערובת יידבקו לקירות של pipettes ומשכה. אם יש לך בעיות ולהוציא את נותב מתוך פיפטה, לאט לחזור קצה ליצור כיס קטן בתוך הרקמה מכן לנסות להזריק שוב.אין זה יוצא דופן עבור קצה microelectrode כדי להדביק. ברוב המקרים הכיס גם מסייעת ליצור מאגר שממנו הנוירונים הסמוכים יכולים לספוג את נותב. זכור תמיד להוציא את נותב לאט, כדי למנוע נזק לרקמות מסיבית באזור מחט שלך.
- בעדינות לסגור את העור עם קליפים הפצע דבק רקמות. לחלופין, ניתן להשתמש תפרים כדי לסגור את הפצע.
- שים לב עם הפרקטיקה הליך כירורגי, לפחות עד לנקודה זו, ניתן להשלים בתוך פחות מ 20 דקות.
- מניחים את החיה בחדר התאוששות (מודל Vetcare קאמרית 9.16.0 חתול. # 340508 מ Apparatus הרווארד) על כרית חימום (Pad חתול חימום. # 341241 מ Apparatus הרווארד), כדי למנוע היפותרמיה להאיץ התאוששות. לחלופין, ניתן להשתמש באחד עושה דגמים רבים של חדרי הסקה. נטר את קצב הנשימה ולבדוק סימנים החיה מנסה לנוע. רוב בעלי החיים הם בדרך כלל מגיבים בתוך 10-15 דקות שלאחר הניתוח.
- לאחר החיות להתאושש ההרדמה, לספק להם מים כרצונך מזון משככי כאבים לפי הצורך. זה הוא בעל חשיבות עליונה כדי להשגיח מקרוב על בעלי החיים שלכם, כחלק משטר שלך שלאחר הניתוח טיפול. באופן שגרתי לבדוק סימנים של כאב, אי נוחות, זיהום הולם אכילה ושתייה וכו 'שוב, בבקשה לדון לצרכים שלך עם החיה שלך מכוני קציני הרווחה וטרינרים לפתח את הפרוטוקול הכי טוב כדי להשלים בהצלחה את הניסויים שלך ולשמור על טיפול הכרחי עבור כל בעלי חיים.
- WGA-Alexa 555, WGA-Alexa 488, ו WGA-HRP מועברים במהירות נוירונים מצאנו כי בשני עכברים בוגרים וגם לאחר הלידה המוקדמת המצומד אלקסה קליעים נותבים וחסונה ארוך התווית סיבים שטחים בתוך 24 שעות (Reeber et al. 2011) . WGA-Alexa 350 גם הוא מועבר במהירות למרות לעומת צבעים אחרים אלקסה הניראות שלו תלויה מאוד באיכות ורגישות של מערכות הסינון (מידע לא מוצג;. Reeber et al 2011)
- BDA בדרך כלל דורש יותר פעמים הישרדות באופן מלא עקבות תחזיות עצביים ולכן מיפוי מלא של תחזיות spinocerebellar חיות יהיה צורך להקריב לאחר כ -11 ימים.
2. איתור של סיבי אזובי לייחס anterogradely
- לאחר תקופות הישרדות בהתאמה להרדים את העכברים עם Avertin (או הרדמה המועדפת עליך).
- לאחר אין רפלקסים הדם צריך להיות סמוקות דרך הלב על ידי המרוססת עם 0.1M PBS (pH7.2). לאחר מכן, לתקן את הרקמה המרוססת על ידי החיה עם paraformaldehyde 4% (PFA) ב-PBS. בנוסף אזורים תוכלו לנתח, זה תמיד נחוץ לרכוש רקמה הזריקה לצורך ניתוח רטרוספקטיבי של כמה גדולה הייתה הזריקה, אינדיקציה של מידת הנזק לרקמות שנגרם על ידי אלקטרודה, ועל זיהוי תיוג אפשרי סיבי המעבר (איור 3: לראות Mesulam, 1982;. Reeber et al 2011).
- Postfix brains מעכברים perfused במשך 24-48 שעות PFA 4% ולאחר מכן cryoprotect אותם פתרונות סוכרוז שנאגרו מדולל PBS (15% עבור ~ 2 שעות או עד שוקעת ברקמות אל החלק התחתון של המיכל ולאחר מכן 30% למשך הלילה או עד רקמה כיורים). רקמה יוסר אז מסוכרוז, ניגב בעדינות יבש עם מגבות נייר שקוע אז בדפוס רקמה המכילה אוקטובר (טמפרטורה אופטימלית חיתוך; סאקורה Finetech ארה"ב Inc, CA). הרקמה מוקפאת מכן באמצעות -80 ° C במקפיא ומאוחסנים באותה טמפרטורה עד מוכנים שלה כדי לקצץ.
- Fluorophores אלקסה גלויים ישירות לאחר תיוג ואינם דורשים מכתים נוספים. לכן, לאחר זלוף הרקמה WGA-Alexa לייחס ניתן לגזור רכוב עבור דימות או הדמיה ישירות כהכנה wholemount PFA ב 4%. מצאנו כי הדמיה רקמות 4% PFA נתן את מקדם השבירה הטובה ביותר עבור הדמיה את הטופוגרפיה של תחזיות התחקה wholemounts. עבור חלקים, לחתוך סדרתי coron עבה 40μmסעיפים אל על cryostat ולאסוף אותם חופשי צף מקטעים PBS. לאור הרעילות של PFA, להבטיח כי facemask המתאים שחוקה במהלך זלוף הדמיה, לשמור על האזור מאוורר היטב, וגם כאשר אינו בשימוש מיד להחזיר PFA או PFA-קבוע רקמות מיכלים אטומים. הוא אידיאלי אם מיקרוסקופ שלך נמצא ברדס קטר מתאים.
- סיבים WGA-HRP שכותרתו יכול להתגלות באמצעות tetramethylbenzidine (TMB) כמו אב צבע. אנחנו לא יתאר את פרוטוקול מכתים HRP כאן מאז אותו כבר בעבר תיאר בפרוטרוט (פוגל ו Prittie 1994;. Sillitoe et al 2010)
- עבור BDA סיבים שכותרתו דגירה ריחוף ללא סעיפים רקמה 2 שעות streptavidin-CY3 (קט '# 434315, Invitrogen, בקרלסבד, קליפורניה) או streptavidin-Alexa פלואוריד 488 או 555 (קט # S11223 עבור 488 ו חתול. # S21381 עבור 555, Invitrogen, Carlsbad, CA), להתרחץ PBS ולאחר מכן לעלות עם GEL-Fluoro. עבור DAB, רקמה סעיפים דגירה לילה חיץ התגובה ABC (קט # PK-4000, VEctor Laboratories, Inc Burlingame, CA), לשטוף 3 פעמים PBS ולאחר מכן להגיב למשך 5-10 דקות ב DAB (0.5mg/ml, וקטור Laboratories Inc, Burlingame, CA) בתוספת של 30% 10μl H 2 O 2 פתרון 50 מ"ל כל DAB.
3. אימונוהיסטוכימיה
- אימונוהיסטוכימיה בוצע כפי שתואר לעיל (Sillitoe et al. 2008). בקצרה, דגירה סעיפים רקמה המכילה 0.1M PBS NGS 10% (NGS: Sigma, סנט לואיס, מיזורי), 0.1% Tween-20 ונוגדנים העיקרי (ראה להלן) במשך 16-18 שעות בטמפרטורת החדר. שטפו את החלקים רקמות שלוש פעמים PBS ולאחר מכן לדגור אותם נוגדנים משני (ראה להלן) לתקופה מקסימלית של 2 שעות בטמפרטורת החדר. שטפו את הרקמה שוב לחשוף את immunoreactivity כמתואר להלן.
- כדי לקבוע את הקשר בין התאים פורקינג' וסיבים אזובי לנו שיתוף שכותרתו חינם סעיפים רקמות צף בשיטות המקובלות של צביעה כפולה. השתמשנו WGA-Alexa 555עבור באיתור אלקסה 488 מצומדות אנטי עכבר חמור נוגדנים משני (Invitrogen / בדיקות מולקולריות Inc, בקרלסבד, קליפורניה) כדי לזהות ZebrinII (1:250; מתנה Kind מ ד"ר ריצ'רד הוקס, מאוניברסיטת קלגרי, קלגרי, קנדה). ZebrinII הוא נוגדן חד שבטי עכבר ושימש ישירות בינוני בילה תרבות hybridoma. הנוגדנים fluorophore משני מצומדות שימשו בדילול של 1:1500. לאחר צביעת חלקים הרקמה היו רכוב על שקופיות זכוכית טעונה coverslipped אז עם GEL-Fluoro ב טריס חיץ (מיקרוסקופית אלקטרונים למדעים, הטפילד, PA) או עם Vectashield hardset הרכבה בינונית עם DAPI (קט '# H-1200, וקטור מעבדות, ברלינגיים , CA) עבור הדמיה צבע פלואורסצנטי משולשת.
- בדקנו את הספציפיות של נוגדנים משני חלקים על ידי עיבוד רקמות בהעדר נוגדנים ראשוניים. האות לא זוהה בניסויים שליטה כזאת, המציין מכתים צפינו לא היה בשל אותות ספציפיים מתוך הe-Alexa מצומדות נוגדנים (מידע לא מוצג).
4. מיקרוסקופית וניתוח נתונים
- אנחנו ללכוד photomicrographs סעיפים רקמות באמצעות לייקה DFC360 FX (פלואורסצנטי) ו DFC490 (DAB ו TMB הגיב סעיפים רקמות) מצלמות רכוב על מיקרוסקופ הלייקה DM5500.
- אנו לרכוש ולנתח את התמונות סעיפים רקמות באמצעות Leica Application Suite ו-Leica Application Suite FX חבילות תוכנה.
- Photomicrographs של wholemounts נלכדים באמצעות DFC3000 לייקה המצלמה FX רכוב על stereomicroscope MZ16 FA לייקה לייקה פועל יישום תוכנה Suite FX.
- שני מיקרוסקופים שלנו מצוידים לייקה CY3 (מודל # 11600231) ו FITC (מודל # 11513880) מסננים, ואת DM5500 עם A4 נוסף DAPI / פילטר UV (מודל # 11504162).
- תמונות נרכשים לאחר אופטימיזציה תחת חשיפה מעל / כפי שנקבע באמצעות תוכנת לייקה. אנו מייבאים את כל הנתונים הגולמיים לתוך Adobe Photoshop CS4 ואם יש צורך wדואר לתקן את כל השדה של כל תמונה על, לעומת זאת חדות, בהירות או רמות בלבד. תוכנות עריכת תמונה אחרות יכול לשמש המועדפת.
- שרטוטים המובא כאן נמשכו ב Adobe Illustrator CS4.
- אלקסה 555 ו CY3 נוירונים מוכתם, אשר מזוהים כמו אדום באמצעות מסננים שלנו, היו פסאודו בצבע ארגמן בתמונות שהוצגו לאורך היד.
בעלי חיים
כל המחקרים בבעלי חיים בוצעו תחת פרוטוקול שאושר חיה IACUC על פי הנחיות מוסדיים על אלברט איינשטיין קולג 'לרפואה. זכר ונקבה outbred שוויצרי וובסטר (Taconic, באולבני, ניו יורק) או C57BL6J מולדת (Jax, בר הרבור, ME) עכברים נשמרו במושבה שלנו משמשים כל המחקרים. צהריים ביום תוסף הנרתיק זוהה נחשב יום עובריים 0.5.
5. נציג תוצאות:
Afferents Spinocerebellar לסיים לתוך parasagiלהקות ttal במוח הקטן (איור 3: Voogd et al 1969;. Grishkat ו אייזנמן 1995; פוגל ו Prittie 1994; ויג et al 2005;. Apps ו הוקס 2009; Sillitoe et al 2010;.. Reeber et al 2011). אנחנו מזריקים WGA-Alexa קליעים נותבים לתוך חוט החזה העליון, התחתון של עמוד השדרה המותני להפגין: 1) כי אלה קליעים נותבים ניתן להשתמש בעקביות תווית תת ספציפיות של מסופי במוח הקטן (איור 3: Reeber et al 2011), 2). כי WGA-Alexa קליעים נותבים בהירים מאוד וניתן להשתמש בו כדי להמחיש את התבנית הכללית של הטופוגרפיה סיבים אזובי ב cerebella שלם (איור 3:. Reeber et al 2011), 3) כי WGA-Alexa 488 ו 555 ניתן להשתמש בשילוב עבור מעקב אחר קטעי מרובים חיה אותו (איור 4), ו 4) כי WGA-Alexa קליעים נותבים תואמים מכתים immunohistochemical (איור 5). בשנת העבודה האחרונה הראינו כי WGA-Alexa מסופי קליעים נותבים תווית במוח הקטן כבר 6 שעות לאחר מתן נותב אל חוט השדרה הם בחירה מצוינת עבור מתווים את architecturהדואר של מסלולים לפיתוח (Reeber et al. 2011).
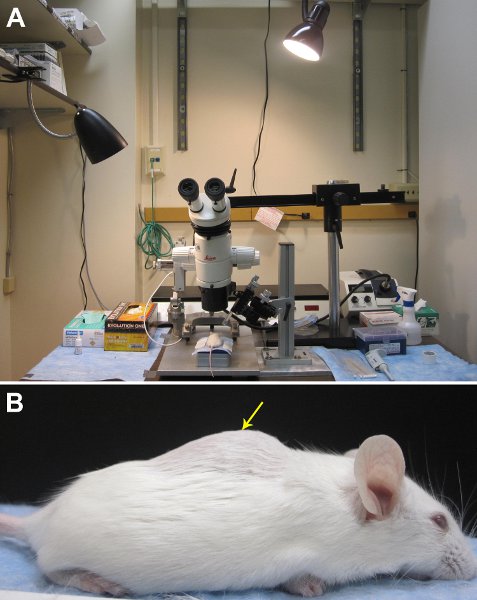
באיור 1. ההתקנה של הציוד לאספקת קליעים נותבים in vivo. A. תמונה של אזור הניתוח שלנו. B. התחתון החזה העליונה באזור המותני ניתן לזהות על ידי הפעלת האצבעות לאורך החוליות להרגיש עבור גבנון בתוך עמוד השדרה. Laminectomy הגבי צריכה להתבצע בערך באמצע של "גיבנת", אשר מסומנת על ידי החץ הצהוב.

איור 2 איור של בית החזה התחתון -... קטע השדרה המותני העליון לפני ואחרי laminectomy הגב סכמטי א 'של קטע השדרה שלם מאזור החזה התחתון, העליון העץ הטור עכבר בחוליות ב dorsalaminectomy אני מתבצע על ידי הסרת תהליכים spinous של אחד או שני קטעים השדרה, לאחר חיתוך באמצע lamina בין תהליך במפרק ואת תהליך spinous הגבי.
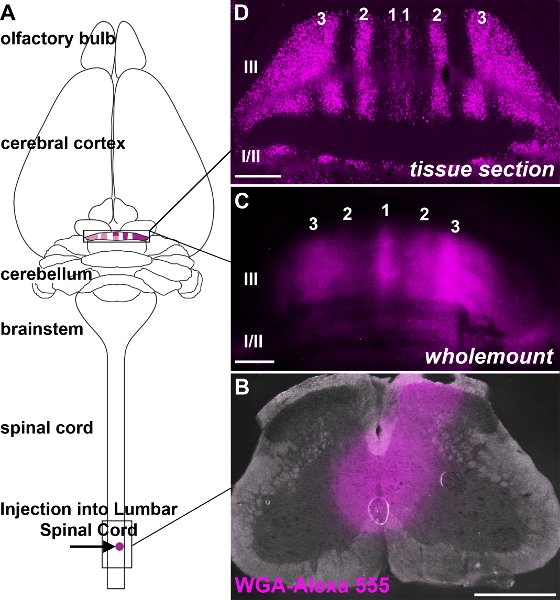
3. איור WGA-Alexa קליעים נותבים בהירים מאוד וניתן להשתמש בו כדי לחזות הטופוגרפיה מביא הקרנה ברזולוציה גבוהה. א סכמטית ממחיש את מקור והפסקת WGA-Alexa 555 נוירונים spinocerebellar שכותרתו. תמונה ב 'של אתר זריקה לאחר מסירת WGA-Alexa 555 לאזור החזה התחתון המותני העליון של חוט השדרה מבוגר. תמונה של ג Wholemount האוניות הקדמי בעקבות זריקה של WGA-Alexa 555 לאזור בית החזה העליון, התחתון המותני של עמוד השדרה. ד WGA-Alexa 555 האנטרוגרד התחקות בדרכי spinocerebellar מגלה להקות של סיבי אזובי כפי שניתן לראות על שיתוףרקמה ronal סעיף. האוניות מוגדרות על ידי ספרות רומיות ומספרי אזובי תווית להקות סיבים משני צדי קו האמצע (חל על כל התמונות). סולם ברים: B, C 500 מיקרומטר, 500 מיקרומטר D, 200 מיקרומטר.
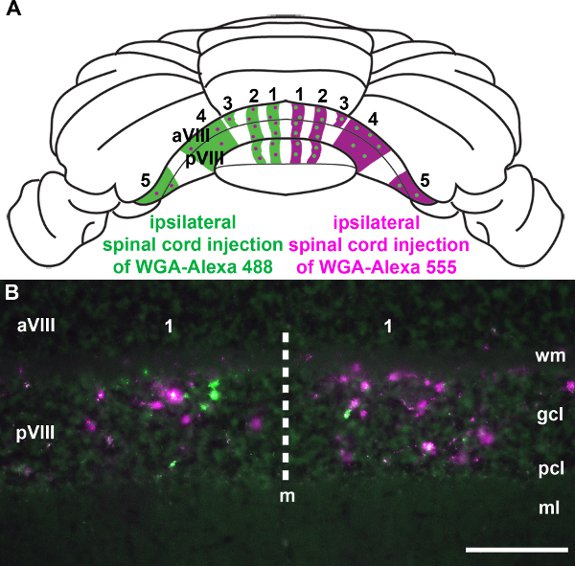
4. איור WGA-Alexa קליעים נותבים יעילים עבור תיוג המסלולים העצביים מספר רב של בעלי חיים זהים. א Wholemount סכימטי של המוח הקטן העכבר המסכם את התבנית הכללית של spinocerebellar להקות סיבים טחב. WGA-Alexa 555 הוזרק בצד ימין של עמוד השדרה המותני ו WGA-Alexa 488 לתוך קטע אותו בצד שמאל. B. כפי שניתן לראות בקטע רקמות העטרה לחתוך את האוניות האחורי, היו שניהם WGA-Alexa קליעים נותבים מועבר במוח הקטן ומסומן בהצלחה תת ברורים של מסופים (ראה גם Reeber et al. 2011). קיצורים: חפרפרתcular השכבה (מ"ל); פורקינג' שכבת תאים (PCL); תא גרגיר השכבה (gcl); החומר הלבן (wm). סולם ברים: B, 100 מיקרומטר.
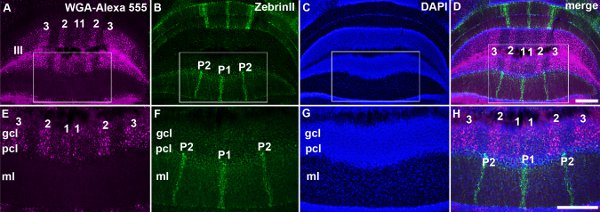
איור 5. WGA-Alexa קליעים נותבים ניתן להשתמש בשילוב עם אימונוהיסטוכימיה ו היסטולוגיה תיוג משולש של נוירונים ותחזיות. א WGA-Alexa 555 מופקד מסופי סיבים אזובי ב lobule III. מכתים ב ZebrinII חושפת מערך של פסים פורקינג' תא lobule III. ג מכתים DAPI של גרעיני עצב גליה. ד שמוזגו תמונה של לוחות A, B , ו-C מראה תיוג משולש של להקות מביא, פסים פורקינג' התא cytoarchitecture בכלל. EH. תמונות בהגדלה גבוהה של האזורים התאגרף שמוצג לספירה לוחות. פסים פורקינג' תא ממוספרים כפי שתואר לעיל (הנסקרתב (Apps ו הוקס 2009)). קיצורים: שכבה מולקולרית (מ"ל); פורקינג' שכבת תאים (PCL); תא גרגיר השכבה (gcl). סולם ברים: D, 500 מיקרומטר (עבור AC); H, 500 מיקרומטר (עבור EG).
Discussion
תיארנו את הפרטים ניתוח טכני נדרש מעקב axonal ו דנדריט מוצלח באמצעות גישה חדשנית מבוססת פלורסנט עבור במהירות תיוג תחזיות עצביים בפיתוח עכברים בוגרים. באמצעות WGA-Alexa אנו מראים כיצד קליעים נותבים וסמנים יכול לשמש לניתוח הטופוגרפיה בדוגמת המעגל ברזולוציה גבוהה בשלושה ממדי...
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו נתמכה על ידי חוקר חדש הזנק כספים אלברט איינשטיין קולג 'לרפואה של הישיבה יוניברסיטי כדי RVs.
Materials
| Name | Company | Catalog Number | Comments |
| ציוד / ריאגנטים | דגם / מספר קטלוגי | חברה | |
| ביד מעקר | דגם 250 Steri חתול. # 18000-45 | המדע כלים פיין | |
| Cauterizer | חתול. # 18000-00 | המדע כלים פיין | |
| בורוסיליקט זכוכית נימי | חתול. # 300056 | הרווארד Apparatus | |
| זכוכית כפולה בשלב micropipette פולר | דגם 001-PC-10 | Narishige | |
| מיקרומטר מזרק | חתול. # GS-1100 | Gilmont מכשירים | |
| בעלי חיים קטנים Stereotaxic Instrument | דגם 940-A | Kopf Instrumentation | |
| Manipulator אלקטרודה | דגם 960 | Kopf Instrumentation | |
| Vetcare קאמרית | חתול. #340508 | הרווארד Apparatus | |
| חימום Pad | חתול. # 341241 | הרווארד Apparatus | |
| לייקה DFC360 FX המצלמה | DFC360 FX | לייקה | |
| לייקה המצלמה DFC490 | DFC490 | לייקה | |
| לייקה DM5500 מיקרוסקופ | DM5500 | לייקה | |
| לייקה DFC3000 FX המצלמה | DFC3000 FX | לייקה | |
| לייקה MZ16 מיקרוסקופ FA | MZ16 FA | לייקה | |
| סנן CY3 | דגם # 11600231 | לייקה | |
| סנן FITC | דגם # 11513880 | לייקה | |
| A4 DAPI / פילטר UV | דגם # 11504162 | לייקה | |
| נבט חיטה agglutinin, Alexa פלואוריד 488 המצומד | חתול. # W11261 | Invitrogen | |
| חיטה גרמ agglutinin, Alexa פלואוריד 555 המצומד | חתול. # W32464 | Invitrogen |
References
- Apps, R., Hawkes, R. Cerebellar cortical organization: a one-map hypothesis. Nat. Rev. Neurosci. 10, 670-681 (2009).
- Grishkat, H. L., Eisenman, L. M. Development of the spinocerebellar projection in the prenatal mouse. J. Comp. Neurol. 363, 93-108 (1995).
- Mesulam, M. . Tracing neural connections with horseradish peroxidase. , (1982).
- Reeber, S. L., Sillitoe, R. V. Patterned expression of a cocaine- and amphetamine regulated transcript (CART) peptide reveals complex circuit topography in the rodent cerebellar cortex. Journal of Comparative Neurology. , (2011).
- Reeber, S. L., Gebre, S. A., Sillitoe, R. V. Fluorescence mapping of afferent topography in three dimensions. Brain. Struct. Funct. , (2011).
- Sillitoe, R. V., Stephen, D., Lao, Z., Joyner, A. L. Engrailed homeobox genes determine the organization of Purkinje cell sagittal stripe gene expression in the adult cerebellum. J. Neurosci. 28, 12150-12162 (2008).
- Sillitoe, R. V., Vogel, M. W., Joyner, A. L. Engrailed homeobox genes regulate establishment of the cerebellar afferent circuit map. J. Neurosci. 30, 10015-10024 (2010).
- Vig, J., Goldowitz, D., Steindler, D. A., Eisenman, L. M. Compartmentation of the reeler cerebellum: segregation and overlap of spinocerebellar and secondary vestibulocerebellar fibers and their target cells. Neuroscience. 130, 735-744 (2005).
- Vogel, M. W., Prittie, J. Topographic spinocerebellar mossy fiber projections are maintained in the lurcher mutant. J. Comp. Neurol. 343, 341-351 (1994).
- Voogd, J., Broere, G., van Rossum, J. The medio-lateral distribution of the spinocerebellar projection in the anterior lobe and the simple lobule in the cat and a comparison with some other afferent fibre systems. Psychiatr. Neurol. Neurochir. 72, 137-151 (1969).
- Wu, H. S., Sugihara, I., Shinoda, Y. Projection patterns of single mossy fibers originating from the lateral reticular nucleus in the rat cerebellar cortex and nuclei. J. Comp. Neurol. 411, 97-118 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved