Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выявление нейронных Топография округа в многоцветном
В этой статье
Резюме
Мы предоставляем практическое руководство для доставки трейсеров В естественных условиях И использовать спиноцеребеллярные путь в качестве модельной системы для демонстрации существенных шагов для успешного анализа нейронной схемы на мышах. Мы подробно описать наш универсальный трассировки протокола, который использует агглютинин зародышей пшеницы (WGA), конъюгированные с Alexa флуорофоров.
Аннотация
Нейронных цепей организованы в функциональные топографических карт. Для того, чтобы визуализировать сложную архитектуру схему мы разработали подход к этикетке надежно глобальных паттернов несколько топографических проекций. Мозжечок является идеальной моделью для изучения упорядоченное расположение нейронных цепей. Например, compartmental организации спиноцеребеллярные мшистые волокна оказалась необходимой системой для изучения паттернов мшистых волокон. Недавно мы показали, что зародыши пшеницы агглютининов (WGA), конъюгированные с Alexa 555 и 488 могут быть использованы для отслеживания спиноцеребеллярные мшистые волокна прогнозы в области разработки и взрослых мышей (Reeber и соавт. 2011). Мы нашли три основных свойства, которые делают WGA-Alexa индикаторов желательно инструменты для маркировки нейронных проекций. Во-первых, Alexa флуорофоров являются интенсивными и их яркость позволяет wholemount изображений непосредственно после трассировки. Во-вторых, WGA-Alexa индикаторов этикетке всей траектории развития и взрослых нейронные projectioнс. В-третьих, WGA-Alexa индикаторов быстро транспортировать в обоих ретроградной и антероградной направлениях. Здесь мы подробно описывают, как подготовить индикаторы и другие необходимые инструменты, как проводить операцию по отслеживанию спиноцеребеллярные и как лучше всего прослеживается изображение проекции в трех измерениях. Таким образом, мы обеспечиваем шаг за шагом трассировки протокола, которые будут полезны для расшифровки организации и подключения функциональных карт не только в мозжечке, но и в коре головного мозга, ствола мозга и спинного мозга.
протокол
1. Доставка трейсеров в естественных использованием стерильных хирургии (разделы 1.1-1.16)
На протяжении процедуры мы рекомендуем стандартные стерильные хирургические методы использовать. Это включает в себя стерильные перчатки, халат и маску. Инструменты должны быть либо автоклаве перед использованием или тщательно очищены с водой, а затем этанола. Во время операции, и, особенно, между животными, чистый фрагментов тканей с инструментами и сухой стерилизации инструментов с горячей бусинка стерилизатор (Steri 250 Кат. # 18000-45, Изысканные инструменты наук). Кроме того, очень важно, чтобы вам организовать рабочее пространство так, что у вас есть областей, предназначенных для животных препарат (для бритья и т.д.), хирургии, и восстановления района, где животных можно легко контролировать, потеплела и поставляется с анальгетиками по мере необходимости. Ключ к успешной операции выживания является снижение риска инфицирования и поддерживать агрессивную послеоперационного ухода стратегии. Пожалуйста, обратитесь к таблице, где вы можете плавникаг все необходимое оборудование и реагенты для этого протокола.
- Обезболить взрослых мышей с свежеприготовленный Avertin (2,2,2-Tribromoethanol, Sigma, Сент-Луис MO;. Cat # T48402) с помощью внутрибрюшинного (ф) раствор для инъекций, при дозировке массы тела 0.2ml/10grams. Другие анестетики, такие как изофлуран или кетамином / ксилазина одинаково эффективны, но убедитесь, что ваша лаборатория имеет необходимые институциональные и федеральных утверждения перед использованием. Если вы используете щенков (P0 - P10), вы можете обезболить их на дробленый лед на 10-15 минут. Убедитесь, что кожа каждого щенка не находится в прямом контакте со льдом (например, путем размещения их в пальцы резиновых перчаток), а холодная вода будет быстро вызвать летальный уровень гипотермии. Убедитесь, что животное находится под приемлемый равнине анестезии, выполняя носок щепотку пинцетом или пальцами задних лап животных. Если есть рефлекс педали, дождитесь, пока животное не отвечает на этот стимул как признак глубокихравнине анестезии.
- Как только животное полностью под наркозом лежал он с его спинной стороны на стерильные марлевые площадку с его головы смотрели в противоположную сторону от вас, и ее хвост обращен к вам. Бритье меха с машинки для стрижки волос для того, чтобы дать себе ясный операционного поля, что является достаточно широким, чтобы получить доступ к центральной нервной системе. Протрите бритой области с двумя наборами спиртовые салфетки, а затем 70% спиртом / бетадин, а затем еще раз чистым спиртом салфеток. Используйте изнутри наружу круговой схеме при очистке хирургических области. Вы можете выбрать, чтобы четко отграничить вашего операционного поля за счет сокращения небольшое отверстие в стерильную марлю и площадки размещения открытия над побрился и чистые места операции. Хотя поддержание стерильной хирургической поле может быть сложным при работе на мелких животных, таким образом поможет снизить риск заражения.
- Поднимите кожу с помощью пинцета и сделать надрез ножницами по средней линии непосредственно над нижней грудной-верхний поясничный тEgion. Нижнего грудного региона верхней поясничной области могут быть идентифицированы, запустив палец вдоль позвонков, чтобы нащупать горб позвоночника (рис. 1).
- Вырезать фасции и поверхностных мышц спины. При необходимости, остановить любое кровотечение путем прижигания сосудов (Fine инструменты Наука, Foster City, Калифорния;. Cat # 18000-00). В щенков, применяя мягкое давление вокруг разреза с ватные тампоны достаточно, чтобы остановить кровотечение.
- Выполните спинного ламинэктомии, удалив остистого отростка одного или двух сегментов нижнего грудного - верхнего поясничного спинного мозга после резки пластинки по обе стороны от позвоночника, на полпути между суставного отростка и спинной остистого отростка (рис. 2) . Будьте осторожны, чтобы не повредить спинной мозг с ножницами и всегда удалить мелкие фрагменты костей, как они могли раздирать спинного мозга. Обратите внимание, что позвоночный столб в раннем послеродовом щенков не является полностью окостенелую, что означает, что кости оченьмягкие и могут быть сокращены очень легко. Поэтому, будьте осторожны, чтобы не зайти слишком глубоко, как это может повредить спинной мозг.
- Если вы предпочитаете не выполнять спинного ламинэктомии у взрослых мышей, мы обнаружили, что Вы можете разрезать мягкие ткани между позвоночных сегментов раскрыть небольшой области спинного мозга без разреза любой кости. Хотя оба эти методы эффективны пути проникновения в спинной мозг, минуя спинной ламинэктомии может гарантировать, что спинной мозг остается неповрежденной.
- Заполните вытащил стеклянный электрод (боросиликатного стекла капилляров; Cat # 300056, Гарвардский Аппарат, Holliston, М. А.;. Двухуровневые Стекло микропипетки Puller от Narishige Модель 001-ПК-10) с трассирующими использованием микрометра шприц (0,2 мл; Gilmont инструменты Cat . # GS-1100) или эквивалент аппарата доставки.
- Затяните стекла микроэлектрода на место на микроманипулятора и вставить электрод 0.1-0.5мм в нижние грудные-верхнем поясничном отделе спинного мозга на полпути между серединелинии и боковые края спинного мозга. Животное может быть проведена в стереотаксической аппарат для точной идентификации инъекции локусов и для стабилизации животных (Маленькое Существо стереотаксической Типовой документ 940-и электродов Манипулятор-960 из инструментария Kopf). Кроме того, если ваш анестезии режим может быть адаптирована для достижения устойчивой плоскости без существенных изменений из-за глубокого дыхания, мягко лентой животное вниз будет достаточно.
- Давление вводят в спинной мозг в течение 3-5 минут примерно 0.5μl из 2% раствора WGA-Alexa 488 (зародыши пшеницы агглютининов, Alexa Fluor 488 сопряжены,. Cat # W11261, Invitrogen, Карлсбад, Калифорния), WGA-Alexa 555 (зародыши пшеницы агглютининов, Alexa Fluor 555 сопряжены,. Cat # W32464, Invitrogen, Карлсбад, Калифорния), WGA-Alexa 350 (зародыши пшеницы агглютининов, Alexa Fluor 350 сопряжены,. Cat # W11263, Invitrogen, Карлсбад, Калифорния), WGA- HRP (зародыши пшеницы агглютинин пероксидазой хрена; Sigma, Сент-Луис, Миссури Cat # L7017) или 0.5μl на 10%BDA (биотинилированного декстран аминов;. Cat # D1956, Invitrogen, Карлсбад, Калифорния) в фосфатном буферном растворе (PBS, Sigma, Сент-Луис, штат Миссури; Cat # P4417). Потребители инъекционных эти объемы результатов индикаторов в маркировке большое количество волокон. Меньшие объемы должны быть введены для таргетинга меньше ядер (или субрегионов отдельных ядер), и каждый исследователь должен эмпирически определить идеальный объем для доставки. Ионофорез должны быть рассмотрены для точной доставки nanoliter для точного инъекций. Как правило, мы все дополнения трассирующими решения с 0,5% Быстрый зеленый (Sigma, Сент-Луис, штат Миссури; Cat # F7252) для визуализации инъекции месте во время операции.
- Мы добавляем 1 мкл кукурузного масла (Sigma, Сент-Луис, штат Миссури; Cat # C8267) для каждого 10 мкл раствора BDA перед инъекцией, чтобы предотвратить смесь от прилипания к стенам вытащил пипеток. Если не удается извлечь трассирующими из пипетки, медленно отведите наконечник для создания небольших кармана в ткани попробуйте инъекционных снова.Это не является необычным для кончика микроэлектрода забивать. В большинстве случаев кармана также помогает создать резервуар, из которого окружающие нейроны могут поглощать индикатора. Не забывайте всегда извлекать трассирующими медленно, чтобы избежать массивного повреждения тканей в непосредственной близости от вашего иглы.
- Аккуратно закройте кожи рана клипы и ткани клеем. Кроме того, вы можете использовать швов, чтобы закрыть рану.
- Обратите внимание, что с практикой хирургическая процедура, по крайней мере до этого момента, может быть завершена менее чем за 20 минут.
- Место животных в восстановлении камеры (камера Vetcare модели 9.16.0 Кат. # 340508 от аппарата Гарвард) на грелку (Cat грелку. # 341241 от аппарата Гарвард), чтобы избежать переохлаждения и ускорить выздоровление. Кроме того, вы можете воспользоваться одним из многих марок и моделей нагрева камеры. Монитор дыхания и проверить его на признаки того, что животное пытается двигаться. Большинство животных, как правило, реагирует в течение 10-15 минут после операции. После животным оправиться от наркоза, предоставить им воду и пищу без ограничений рекламы и анальгетиков по мере необходимости. Это крайне важно держать близкий глаз на ваших животных, как часть вашего послеоперационного ухода режима. Регулярно проверяйте наличие признаков боли, дискомфорт, инфекции, адекватные еде и питье и т.д. Опять же, пожалуйста, обсудите ваши потребности с институтами животных офицеров и ветеринарами, чтобы развивать лучшие протокол, чтобы успешно завершить свои эксперименты и поддерживать необходимый уход для всех Ваших животных.
- WGA-Alexa 555, Alexa WGA-488 и WGA-HRP быстро транспортируется в нейронах и мы обнаружили, что в обоих раннем послеродовом и взрослых мышей Alexa сопряженных индикаторов энергично этикетке длинный участки волокна в течение 24 часов (Reeber и соавт. 2011) . WGA-Alexa 350 также быстро перевозить хотя по сравнению с другими красителями Alexa его видимость сильно зависит от качества и чувствительность наборы фильтров (данные не представлены;. Reeber и др. 2011)
- BDA обычно требуется более длительное время выживания в полной мере следить нейронные прогнозы и, следовательно, для полного отображения спиноцеребеллярные прогнозы животные должны быть принесены в жертву примерно через 11 дней.
2. Обнаружение anterogradely прослеживается мшистые волокна
- После соответствующих периодов выживания обезболить мышей с Avertin (или ваш анестетика).
- После Есть не рефлексы крови должны быть удалены через сердце перфузии с 0,1 М PBS (pH7.2). Затем, исправить ткани перфузии животное с 4% параформальдегида (PFA) в PBS. В дополнение к регионам вы будете анализировать, всегда необходимо приобрести ткани из места инъекции для ретроспективного анализа того, как большие инъекции, указанием степени повреждения тканей вызванных электрода, а также для выявления возможных маркировки в волокнах прохода (рис. 3, см. Mesulam, 1982;. Reeber и др. 2011).
- Postfix брайнов от перфузии мышей в течение 24-48 часов в 4% PFA, а затем cryoprotect их в буфер сахарозы решения разводят в PBS (15% в течение ~ 2 часов или пока ткань опускается на дно контейнера, а затем 30% на ночь или до ткань раковины). Ткани удаляется из сахарозы, мягко приложила насухо бумажным полотенцем, а затем погружены в ткань плесень содержащие октября (оптимальная температура резки; Сакура FINETECH США Inc, Калифорния). Ткань затем замороженные использования -80 ° С морозильной камерой и хранится при той же температуре, пока его готовы быть сокращены.
- Alexa флуорофоров видны сразу после маркировки и не требуют дополнительного окрашивания. Таким образом, после перфузии WGA-Alexa прослеживается ткани можно вырезать и смонтированы для работы с изображениями, либо непосредственно отображается в 4% PFA как wholemount подготовки. Мы обнаружили, что изображения ткани в 4% PFA дал лучший показатель преломления для работы с изображениями топографии прослеживается проекции в wholemounts. Для секций, нарезать толстыми серийный 40 мкм Корондр. разделов по криостата и собирать их в качестве свободно плавающего разделы PBS. Учитывая токсичность PFA, убедитесь, что соответствующие маски носят во время перфузии и обработки изображений, сохранить место должно быть хорошо вентилируемыми, и когда он не используется немедленно вернуть любое PFA или PFA-фиксированные ткани герметичных контейнерах. Это идеально, если ваш микроскоп находится в подходящей вытяжной шкаф.
- WGA-HRP помечены волокна могут быть выявлены использованием тетраметилбензидина (ТМБ) в качестве хромогена. Мы не будем описывать протокол HRP окрашивания здесь, так как ранее было описано в деталях (Фогель и Prittie 1994 года;. Sillitoe и др. 2010)
- Для BDA помечены волокна инкубировать свободно плавающих срезах тканей в течение 2 часов в стрептавидин-Cy3 (кат. # 434315, Invitrogen, Карлсбад, Калифорния) или стрептавидин-Alexa Fluor 488 или 555 (кат. # S11223 для 488 и Cat. # S21381 для 555, Invitrogen, Карлсбад, Калифорния), умойся в PBS, а затем установите с фтор-лари. Для DAB, инкубировать срезах тканей на ночь в буфер реакции ABC (кат. # PK-4000, VЭктор Laboratories, Inc Burlingame, CA), промыть 3 раза в ФСБ, а затем реагировать на 5-10 минут в DAB (0.5mg/ml, Vector Laboratories Inc, Burlingame, CA) с добавлением 10 мкл 30% Н 2 О 2 на каждые 50 мл DAB решение.
3. Иммуногистохимия
- Immunohistochemistry проводили, как описано ранее (Sillitoe и соавт. 2008). Короче говоря, инкубировать срезах тканей в 0,1 М PBS, содержащем 10% NGS (NGS; Sigma, Сент-Луис MO), 0,1% Твин-20 и первичных антител (см. ниже) в течение 16-18 часов при комнатной температуре. Вымойте срезов ткани в три раза PBS, а затем инкубировать их в вторичными антителами (см. ниже) в течение не более 2 часов при комнатной температуре. Промойте ткань снова и выявить иммунореактивности как описано ниже.
- Чтобы определить взаимосвязь между клеток Пуркинье и мшистые волокна мы сотрудничаем помечены свободное плавание срезах тканей с использованием обычных методов двойного окрашивания. Мы использовали WGA-Alexa 555для отслеживания и Alexa 488 сопряженных осла антимышиным вторичными антителами (Invitrogen / Molecular Probes Inc, Карлсбад, Калифорния) с целью выявления ZebrinII (1:250; Вид подарок от доктора Ричарда Hawkes, Университет Калгари, Калгари, Канада). ZebrinII является мышиных моноклональных антител и использовалась непосредственно из отработанного культуральной среде гибридомы. Флуорофора сопряженных вторичные антитела были использованы в разведении 1:1500. После окрашивания срезов тканей были установлены на заряженные стеклянные пластинки, а затем coverslipped с фтор-лари в трис-буфере (электронная микроскопия наук, Hatfield, PA) или с Vectashield hardset монтажа среде с DAPI (кат. # H-1200, Vector Laboratories, Burlingame , Калифорния) для тройного изображения флуоресценции цвета.
- Мы протестировали специфика вторичных антител путем обработки срезов ткани в отсутствие первичных антител. Сигнал не был обнаружен в таких экспериментах контроль, указывая, что окрашивание мы наблюдали не из-за неспецифических сигналов от гоэлектронной Alexa-конъюгированных антител (данные не представлены).
4. Микроскопии и анализа данных
- Мы захвата микрофотографии срезов ткани использовании Leica DFC360 FX (флуоресценции) и DFC490 (DAB и ТМБ отреагировал срезах тканей) камер, установленных на Leica DM5500 микроскопом.
- Мы приобретаем и анализировать изображения срезов тканей использовании Leica приложений и Leica приложений FX пакеты программного обеспечения.
- Микрофотографии wholemounts, получены с помощью Leica DFC3000 FX камерой, установленной на Leica MZ16 FA работает стереомикроскопа Leica приложений FX программного обеспечения.
- Обе наши микроскопы оснащены Leica Cy3 (модель # 11600231) и FITC (модель # 11513880), фильтры и DM5500 с дополнительными A4 DAPI / УФ-фильтром (модель # 11504162).
- Изображения, приобретенные после оптимизации для в / чрезмерного воздействия, как это определено с помощью программного обеспечения Leica. Мы импортируем все исходные данные в Adobe Photoshop CS4, а при необходимости Wэлектронной правильный всему полю изображения для каждого резкость, яркость, контрастность или уровней только. Другое программное обеспечение для редактирования фотографий можно использовать в качестве предпочтительного.
- Схемы, представленные здесь, были сделаны в Adobe Illustrator CS4.
- Alexa 555 и Cy3 окрашенных нейронов, которые обнаруживаются как красные использовании наших фильтров, были псевдо-цветной пурпурный в образы, представленные в рукописи.
Животные
Все исследования на животных проводились в рамках утвержденной IACUC протокол животных в соответствии с руководящими принципами институциональной колледже Альберта Эйнштейна медицины. Мужские и женские швейцарские беспородных Вебстер (Taconic, Олбани, штат Нью-Йорк) или инбредных C57BL6J (JAX, Bar Harbor, ME) мышей были сохранены в нашей колонии и используется для всех исследований. Полдень в день вагинальных плагин был обнаружен считался эмбриональных день 0.5.
5. Представитель Результаты:
Спиноцеребеллярные афферентов прекратить в parasagittal полосы в мозжечке (рис. 3; Voogd и др., 1969;. Grishkat и Айзенман 1995 года; Фогель и Prittie 1994 года; Виг и др. 2005;. приложения и Хоукса 2009 года; Sillitoe и др. 2010;.. Reeber и др. 2011). Мы вводили WGA-Alexa трейсеров в нижний грудной-верхний поясничный спинной мозг, чтобы продемонстрировать: 1) что эти индикаторы могут быть использованы для последовательного этикетку конкретных подмножеств терминалов в мозжечке (рис. 3; Reeber и др. 2011), 2). , что WGA-Alexa индикаторов интенсивно ярких и может быть использован для визуализации общей картины мшистых топографии волокна в целом cerebella (рис. 3,. Reeber и др. 2011), 3), что WGA-Alexa 488 и 555 могут быть использованы в комбинации для отслеживания нескольких путей у того же животного (рис. 4) и 4), что WGA-Alexa индикаторов совместимы с иммуногистохимического окрашивания (рис. 5). В недавней работе мы показали, что WGA-Alexa индикаторов этикетке терминалов в мозжечок еще в 6 часов после доставки трассирующими в спинной мозг и являются отличным выбором для отслеживания архитектурныее развивающихся путей (Reeber и соавт., 2011).
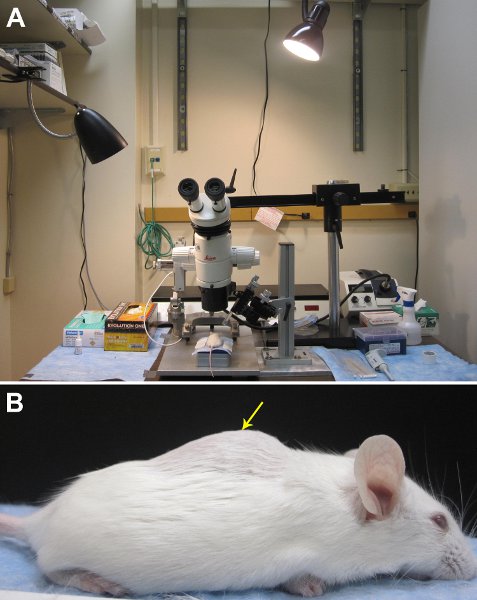
Рисунок 1. Установка оборудования для доставки трейсеров в естественных условиях. A. Изображение нашей хирургической области. Б. нижних грудных-верхней поясничной области могут быть идентифицированы, запустив пальцы вдоль позвонков, чтобы нащупать горб позвоночника. Спинной ламинэктомии должны быть выполнены примерно в середине "горб", на что указывает желтая стрелка.

Рисунок 2 Иллюстрация из нижних грудных -... Верхнего поясничного позвоночного сегмента до и после спинного ламинэктомии А. Схема нетронутыми позвоночного сегмента с нижней грудной-верхний пиломатериалов области мыши позвоночника Б. Дорсал ламинэктомии осуществляется путем удаления остистого отростка одного или двух позвоночных сегментов, после резки пластинки на полпути между суставного отростка и спинной остистого отростка.
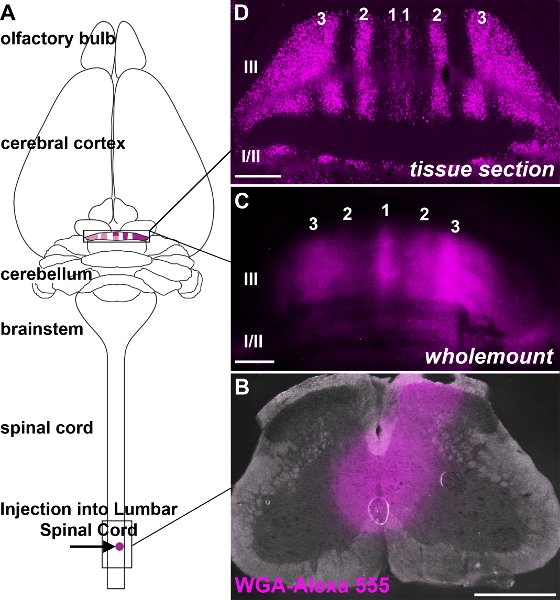
Рисунок 3. WGA-Alexa индикаторов интенсивно ярких и может использоваться для визуализации афферентные проекции рельефа с высоким разрешением. А. схема иллюстрирует Возникновение и прекращение WGA-Alexa 555 меченых спиноцеребеллярные нейронов. B. Изображение месте инъекции после доставки WGA-Alexa 555 в нижних грудных верхнем поясничном отделе спинного мозга взрослого. C. Wholemount образ передние дольки после инъекции WGA-Alexa 555 в нижние грудные-верхнем поясничном отделе спинного мозга. Д. WGA-Alexa 555 антероградной отслеживание спиноцеребеллярные тракта выявляет полос мшистых волокон, как видно на сотрудничествоRonal срез ткани. Долек определяются Римские цифры и номера этикетки мшистые волокна полосы по обе стороны от средней линии (относится ко всем изображениям). Шкала бары: B, C 500 мкм, 500 мкм, D, 200 мкм.
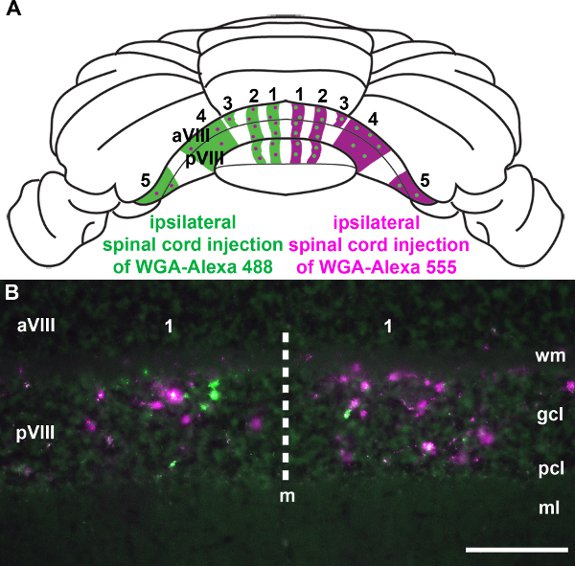
Рисунок 4. WGA-Alexa индикаторов являются эффективными для маркировки нескольких нервных путей в то же животное. А. Wholemount схема мыши мозжечка обобщения общей картины спиноцеребеллярные мшистых полосы волокна. WGA-Alexa 555 был введен в правой части поясничного спинного мозга и WGA-Alexa 488 в одном сегменте с левой стороны. B. Как видно на корональных срез ткани рассекают заднюю дольки, как WGA-Alexa индикаторов были транспортируется в мозжечке и успешно помечены различных подмножеств терминалов (см. также Reeber и соавт. 2011). Сокращения: мольсосудистых слой (мл); Пуркинье слой клеток (PCL); ЗК слой (ГКЛ); белое вещество (WM). Шкала бары: В, 100 мкм.
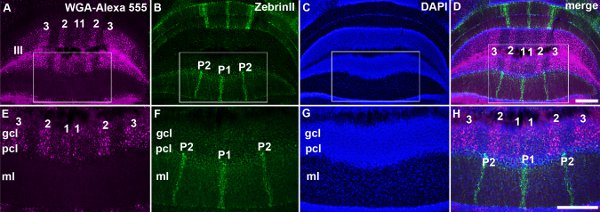
Рисунок 5. WGA-Alexa индикаторов может быть использована в сочетании с иммуногистохимии и гистологии для тройной маркировки нейронов и прогнозы. А. WGA-Alexa 555 откладывается в мшистых терминалы волокна в дольки III. Б. ZebrinII окрашивания выявляет множество полос клеток Пуркинье в дольки III. C. DAPI окрашивания нервных и глиальных ядер. Д. Объединенные образ панелей, В В и С показывает тройной маркировки афферентных полосы, полосы клеток Пуркинье и общей cytoarchitecture. EH. Изображения с высоким увеличением коробку регионов показано в AD панелей. Полосы клеток Пуркинье пронумерованы, как описано ранее (см. обзорв (приложения и Hawkes 2009)). Сокращения: молекулярный слой (мл); Пуркинье слой клеток (PCL); ЗК слой (ГКЛ). Шкала бары: D, 500 мкм (для переменного тока), H 500 мкм (для EG).
Обсуждение
Мы описали хирургических и технических деталей, необходимых для успешного аксонального и дендритов трассировку новых флуоресцентных подход для быстрой маркировки нейронные прогнозы в области разработки и взрослых мышей. Использование WGA-Alexa мы покажем, как индикаторы и маркеры могут...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана новым следователем стартовый капитал от Альберта Эйнштейна Медицинского колледжа университета Ешива в РВС.
Материалы
| Name | Company | Catalog Number | Comments |
| Оборудование / Реагенты | Модель / Номер по каталогу | Компания | |
| Бусы стерилизатор | Модель Steri 250 Кат. # 18000-45 | Инструменты изобразительных наук | |
| Cauterizer | Кат. # 18000-00 | Инструменты изобразительных наук | |
| Боросиликатного стекла капилляров | Кат. # 300056 | Гарвардский аппарата | |
| Двухуровневые Стекло микропипетки Puller | Модель 001-ПК-10 | Narishige | |
| Микрометр шприц | Кат. # GS-1100 | Gilmont инструменты | |
| Малый Инструмент стереотаксической животных | Модель 940- | Kopf инструментария | |
| Электрод Манипулятор | Модель 960 | Kopf инструментария | |
| Vetcare камеры | Кат. #340508 | Гарвардский аппарата | |
| Грелка-подушка | Кат. # 341241 | Гарвардский аппарата | |
| Leica DFC360 FX камеры | DFC360 FX | Leica | |
| Leica DFC490 камеры | DFC490 | Leica | |
| Leica DM5500 микроскопом | DM5500 | Leica | |
| Leica DFC3000 FX камеры | DFC3000 FX | Leica | |
| Leica MZ16 FA микроскопом | MZ16 FA | Leica | |
| Cy3 фильтра | Модель # 11600231 | Leica | |
| FITC фильтра | Модель # 11513880 | Leica | |
| A4 DAPI / УФ-фильтром | Модель # 11504162 | Leica | |
| Зародыши пшеницы агглютининов, Alexa Fluor 488 сопряженных | Кат. # W11261 | Invitrogen | |
| Пшеница герм агглютининов, Alexa Fluor 555 сопряженных | Кат. # W32464 | Invitrogen |
Ссылки
- Apps, R., Hawkes, R. Cerebellar cortical organization: a one-map hypothesis. Nat. Rev. Neurosci. 10, 670-681 (2009).
- Grishkat, H. L., Eisenman, L. M. Development of the spinocerebellar projection in the prenatal mouse. J. Comp. Neurol. 363, 93-108 (1995).
- Mesulam, M. . Tracing neural connections with horseradish peroxidase. , (1982).
- Reeber, S. L., Sillitoe, R. V. Patterned expression of a cocaine- and amphetamine regulated transcript (CART) peptide reveals complex circuit topography in the rodent cerebellar cortex. Journal of Comparative Neurology. , (2011).
- Reeber, S. L., Gebre, S. A., Sillitoe, R. V. Fluorescence mapping of afferent topography in three dimensions. Brain. Struct. Funct. , (2011).
- Sillitoe, R. V., Stephen, D., Lao, Z., Joyner, A. L. Engrailed homeobox genes determine the organization of Purkinje cell sagittal stripe gene expression in the adult cerebellum. J. Neurosci. 28, 12150-12162 (2008).
- Sillitoe, R. V., Vogel, M. W., Joyner, A. L. Engrailed homeobox genes regulate establishment of the cerebellar afferent circuit map. J. Neurosci. 30, 10015-10024 (2010).
- Vig, J., Goldowitz, D., Steindler, D. A., Eisenman, L. M. Compartmentation of the reeler cerebellum: segregation and overlap of spinocerebellar and secondary vestibulocerebellar fibers and their target cells. Neuroscience. 130, 735-744 (2005).
- Vogel, M. W., Prittie, J. Topographic spinocerebellar mossy fiber projections are maintained in the lurcher mutant. J. Comp. Neurol. 343, 341-351 (1994).
- Voogd, J., Broere, G., van Rossum, J. The medio-lateral distribution of the spinocerebellar projection in the anterior lobe and the simple lobule in the cat and a comparison with some other afferent fibre systems. Psychiatr. Neurol. Neurochir. 72, 137-151 (1969).
- Wu, H. S., Sugihara, I., Shinoda, Y. Projection patterns of single mossy fibers originating from the lateral reticular nucleus in the rat cerebellar cortex and nuclei. J. Comp. Neurol. 411, 97-118 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены