A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
באמצעות מערכי LED משתלמת עבור גירוי-תמונה של נוירונים
In This Article
Summary
למבוגרים יליד נוירונים להביע ChR2 ניתן לטפל בהכנות פרוסה אלקטרו על מנת לבחון את תרומתם כלפי פונקציה של מעגלים עצביים חוש הריח.
Abstract
Electrophysiology פרוסה רגילה אפשרה לחוקרים לחקור רכיבים בודדים של המעגלים העצביים על ידי הקלטה התגובות החשמלית של תאים בודדים בתגובה 1,2 מניפולציות חשמלי או תרופתי. עם המצאת שיטות בקרה אופטית נוירונים ממוקד גנטית (optogenetics), חוקרים כעת יש רמה חסרת תקדים של שליטה על קבוצות ספציפיות של נוירונים בהכנת פרוסה רגילה. בפרט, רגישים channelrhodopsin-2 (ChR2) מאפשר לחוקרים להפעיל נוירונים עם 3,4 אור. על ידי שילוב של כיול מדוקדק של photostimulation מבוססי LED של ChR2 עם electrophysiology פרוסה סטנדרטיים, אנו מסוגלים בדיקה עם בפירוט רב יותר את תפקיד המבוגר יליד interneurons ב הנורה חוש הריח, את ממסר המרכזי הראשון של מערכת חוש הריח. שימוש בביטוי ויראלי של ChR2-YFP במיוחד מבוגר, יליד נוירונים, אנחנו יכולים לשלוט באופן סלקטיבי צעיר מבוגר, יליד הנוירונים בסביבה של מבוגריםד נוירונים בוגרים. שליטה אופטית שלנו משתמשת במערכת LED פשוט וזול, ואנחנו מראים כיצד מערכת זו יכולה להיות מכויל כדי להבין איך הרבה אור היא צריכה לעורר spiking פעילות נוירונים בודדים. לפיכך, הבזקים קצרים של אור כחול יכול לשלוט מרחוק את דפוס ירי ChR2-transduced תאים שזה עתה נולד.
Protocol
1. כיול אופטי: Power LED מדידת
- צרף מערך LED כדי קירור מקורר באופן אקטיבי על ידי מאוורר וגם להדביק זה aparatus / קירור LED על העדשה collimating.
- החלפת מנורה המשמשים brightfield עם תאורה LED / קירור / מאוורר / מנגנון העדשה. מנגנון זה חייב להיות ממוצבת היטב כך קרן LED collimated נוסע בנתיב אופטי ישר לכיוון העדשה הקבל. ודא heatsink / אוהד מעוגנת כהלכה מכנה משותף של המערכת.
- כונן את מערך LED עם ספק כוח שיכול לתת פולסים מהיר רבועים של הנוכחי. אספקת כוח זה עשוי להיות נשלט על ידי TTL 5V הדופק שמקורם גנרטור הדופק.
- מרכז קרן collimated לאורך השביל אור מוגדר בין הסרעפת שדה העדשה condensor. באופן אידיאלי, קרן LED יהיה מעט תמלא יותר מדי את הסרעפת השדה נפתח במלואו. בדרך כלל, קרן LED collimated חזק יותר שימלא את הצמצם פחות, תפיק מורדואר כוח על חשבון אחידות. ב ההתקנה שלנו הגדלנו אחידות אור על ידי בחירת עדשה collimating כי מוקרן דימוי מורחבת מעט של מערך ה-LED על מטוס המצומד שלה הסרעפת consenser.
- השג תאורה קולר על ידי התמקדות את הקבל כך את התמונה של הסרעפת שדה (הסרעפת הקרוב ביותר למקור אור) מתמקדת החדר פרוסה (איור 1). רקמה דקה של נייר העדשה יכול לשמש כמסך הקרנה לדמיין את התמונה ממוקדת של הסרעפת בתחום בעומקים אחרים.
- מקדחה סדרה של pinholes בקוטר ידוע חומר אטום. מקום אחד כזה pinholes קטן על החיישן של מד הכוח אופטי. הנח את מד הכוח על הבמה הדגימה במרכז מד הכוח על התמונה ממוקדת של הסרעפת השדה פשוט על ידי הזזת מד הכוח עד שהוא נותן קריאה מקסימלית. לצרף את מד הכוח בעמדה זו.
- לגמרי לפתוח את כל הפתחים (הסרעפת aperature ובתחום הסרעפת). באופן שיטתי להעביר את פרוסת המצורפת תא / כוח מטר ביחס lightpath האופטי ולחשב את האחידות של כוח אופטי בתוך השטח המואר. בנה את העלילה אחידות עבור המערכת שלך. אם המיקרוסקופ כשורה קולר עם תאורה ממוקדת במוקד של אובייקטיבי, ההספק המרבי צריך להיות ישירות מתחת ליעד, ואזורים מחוץ להתמקד הזה צריך עכשיו לקבל כמות ידועה של כוח על פי העלילה אחידות.
- לכל גודל של חריר, לבנות עקומת תקן של כוח אופטי לעומת פני השטח חריר. על ידי התאמת קלט הנוכחי למערך ה-LED, להפיק את עקומת במספר רמות הספק וממנו לחשב את כל עקומת כוח לכל mm2. אם מערך LED היא לשמש עבור אופטיקה תיקון, הקפד להציג אלמנטים אופטיים הדרוש תיקון (מעבים, pinholes ומסננים) לדעת כמה אור מועבר תחת תאורה תיקון.
- Flipping את מד הכוחמול המטרה, לחשב את עוצמת התאורה ב 470nm כאשר המנורה כספית מופעלת.
- הוספת פרוסה לחיות לחדר, ולבנות מחדש את העיקולים על מנת לקבוע את תקן כוח האור המועבר דרך רקמת המוח פיזור.
2. נוהל לחתוך Electrophysiology
חלק א: הכנת Slice
- הרדימי (60 מ"ג / ק"ג קטמין ו 2mg/kg Xylazine) ו לערוף את העכבר. מנתחים את המוח מלאכותי בנוזל השדרה מוחין (ACSF, במ"מ: 124 NaCl, KCl 3, 1.3 MgSO 4, 26 NaHCO 3, 1.25 NaHPO 4, 20 גלוקוז, 2 CaCl 2; ~ 310mOsm, pH 7.4 כאשר בועות בתערובת של O2 95% ו 5% CO 2 5,1), נזהרת שלא לפגוע נורות חוש הריח. הפרד את שתי ההמיספרות ומניחים על אגר עם משטח הגחון אפילו עם קצה אחד (סעיפים אופקי).
- דבק אגר פני השטח הגבי של האונה כל קליפת המוח כדי vibratome צ'אק, ולאט לאט למלא את האמבט קר כקרח ACSF. פורסים מפני השטח הגחון ב 300 סעיפים מיקרומטר, העברת כל סעיף כדי התחמם (34-36 ° C) ACSF מחומצן, ולאפשר להם להתאושש במשך 30-45 דקות.
חלק ב ': מדידה תיקון Loose הסף את ספייק
- לאחר שהביא את פרוסות לטמפרטורת החדר במשך 30 דקות, בעדינות במקום פרוסת בחדר הקלטה של החדר תחת מיקרוסקופ טפטוף מתמיד של ACSF מחומצן.
בסיכון יתר מגרה נוירונים ChR2 נגוע, בנוכחות EYFP-ChR2 ניתן לאשר תחת epifluorescence (איור 2a) - משוך אלקטרודות זכוכית על חולץ פיפטה (סאטר P-97). מילוי זה אלקטרודה עם ACSF. כאשר הניח באמבטיה ACSF ההתנגדות טיפ צריך להיות בין 70-10 MOhms.
- תחת תאורה פלורסנט, לאתר הפרוסה תא עצב בריא ChR2-EYFP עם מורפולוגיה בשלה. כמו כן לאתר סומה של נוירון תחת אופטיקה תיקון.
- עם לחץ חיובי קל עבר קצה האלקטרודה, מנמיכים את האלקטרודה תיקון כלפי הנוירון פלורסנט מזוהה. כאשר איש הקשר קרום מורכב, במהירות לשחרר לחץ חיובי וליישם כמות קטנה וקצרה של יניקה דרך קצה. חותם גיגה אוהם צריך להיעשות בין הממברנה פלזמה קירות אלקטרודה את התיקון.
- גם אם גיגה חותם לא נוצר, אם האלקטרודה הוא מספיק קרוב פעילות הנוירון פלורסנט spiking צריך לייצר פוטנציאל למדידה בשדה המקומי. הפעל ChR2 בנוירון הזה מהבהב על ידי מינונים שונים של אור. בגלל אור במינון היא פונקציה של כוח הן LED ומשך, לחשב כמה הרבה אור יש צורך לעורר פוטנציאל פעולה בכל כוחות מרובים המשכים (איור 2b). כמו כן לצפות כמה spiking מתרחשת תחת אור מנורת כספית.
3. נציג תוצאות:
על מיקרוסקופ שלנו (אולימפוס BX51WI), LED שלנו היא iקו n עם 2 פתחים ו עדשה הקבל, ובכך שמירה על lightpath המקורי של המנורה, מפעל מותקנת קשת. על ידי סגירת שני הסרעפת שדה הסרעפת aperature, אנחנו יכולים להשיג ניגודיות brightfield מספיק מהדק הקלטות התיקון (איור 1b). עם דיאפרגמה כל במלואה לפתוח לנו לחשוף את הפרוסה לשלטון האור המרבית channelrhodopsin ההפעלה (איור 1 א). על מיקרוסקופ שלנו, זו תצורה תיקון מייצרת אור כי צפיפות הוא כ שלושה סדרי גודל נמוך יותר צפיפות השדה המקסימלי מלא (4.1 μW / 2 מ"מ לעומת 6.88 mW / מ"מ 2).
אנו רואים תיוג החזקה של גרגיר מבוגר יליד נורת חוש הריח ועל נוירונים periglomerular שבועות לאחר ההדבקה lentiviral של נודדות neuroblasts בזרם נודדות מקורי (איור 2a) הקלטה רופף-תיקון מ יחיד מבוגר יליד ChR2-EYFP להביע תא גרגיר מציינת כי 5 ms גירוי על האימרהאממ כוח (6.88 mW / מ"מ 2) מספיקה כדי לעורר spiking (איור 2b). מאז רמת הביטוי משתנה בין התאים, את כמות האור שעוברת את הסף אל ספייק ישתנו וצריך תיאר סטטיסטית לכל סוג תא של עניין.
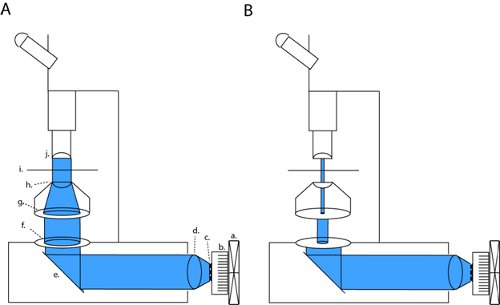
באיור 1. LED הגדרת מערך עבור photostimulation מלא שדה תיקון-clamp electrophysiology פרוסה. כדי להפעיל channelrhodopsin (ChR2) אנו פרוייקט קרן collimated בחזרה דרך פתחים פתוחים אופטיקה מעבה (א). תצורה זו ניתן לשנות לתוך ניגודיות גבוהה אופטיקה תיקון מלא על ידי סגירת הסרעפת שדה רוחב ויסות של הסרעפת שדה (ב). קיצורים: א מאוורר, גוף קירור ב, מערך LED ג, ד collimating העדשה, ה ראי, דיאפרגמה ו שדה, הסרעפת ז הצמצם, העדשה הקבל ח, ט saבשלב mple, י אובייקטיבי.
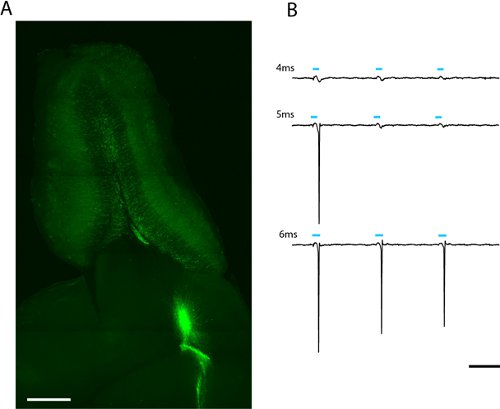
באיור 2. מקדימה של פרוסת אופקי 300μm של הנורה חוש הריח של מהדק תיקון כל שדה photostimulation (א). נגוע Lentivirally מבוגר יליד תאים גרגיר להביע ChR2-EYFP ניתן לראות מקרין מליבה של הנורה חוש הריח. האור במינון הנדרש לעורר spiking ניתן למצוא על ידי הגדלת משך הזמן של פלאש LED (ב). סף עבור תא זה היה גרגיר 5ms בעצימות LED מלאה (2.43mW/mm 2). סולם ב (א) = 500μm, היקף (ב) = 50ms.
Access restricted. Please log in or start a trial to view this content.
Discussion
בשנים האחרונות אנו עדים התפוצצות הפופולריות של כלים optogenetic עבור מחקר המוח 6. כתוצאה מכך, חשוב יותר ויותר כדי להוריד את מחסום הכניסה עבור מעבדות המעוניינים להתחיל להשתמש בכלים חדשים אלה. כאן אנו מתארים כיצד לנהל retrofitting עלות פשוט נמוך כיול של המתקן תיקון-clamp קונבנ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו נתמכה על ידי חברת ביטוח החיים "AG2R-La-מונדיאל", Ecole des Neurosciences de Paris (ENP), את Agence Nationale de la משוכלל ונדיר "ANR-09-NEUR-004" בתוך המסגרת של נוירון ERA-NET " "תוכנית FP7 על ידי הנציבות האירופית, וקרן פסטר. סבסטיאן וגנר נתמך על ידי קרן Letten.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
References
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 Forthcoming.
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved