JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
뉴런의 사진 자극에 저렴한 LED 배열을 사용하여
요약
ChR2을 표현 성인에서 태어난 뉴런은 후각 신경 회로의 기능들에 대한 그들의 기여를 검토하기 위해 슬라이스 electrophysiological 준비로 조작할 수 있습니다.
초록
표준 슬라이스 전기 생리학은 연구자가 전기 또는 약리 조작 1,2에 대한 응답으로 단일 세포의 전기적 반응을 기록하여 신경 회로의 개별 구성 요소를 프로브 수 있습니다. 광학 유전자 타겟으로 뉴런을 (optogenetics) 제어 방법의 발명과 함께, 연구자들은 이제 표준 슬라이스 준비 뉴런의 특정 그룹을 제어할의 전례없는 수준을했습니다. 특히, channelrhodopsin - 2 (ChR2) 감광성의 연구자들이 빛을 3,4과 뉴런을 활성화 할 수 있습니다. 표준 슬라이스 전기 생리학과 ChR2의 LED 기반 photostimulation주의 교정을 결합함으로써, 우리는보다 세부와 후각 망울, 후각 시스템의 첫 번째 중앙 릴레이에 성인 태어나 interneurons의 역할을 탐침 수 있습니다. 성인에서 태어난 뉴런에 특별히 ChR2 - YFP의 바이러스 표현을 사용하여, 우리는 선택 이전의 환경에서 젊은 성인에서 태어난 뉴런을 제어할 수 있습니다D 성숙한 뉴런. 우리 광학 제어는 간단하고 저렴한 LED 시스템을 사용하고, 우리는이 시스템이 더 많은 햇빛이 하나의 뉴런의 활동을 급상승 연상하는 데 필요한 방법을 이해 조정 할 수있는 방법을 보여줍니다. 따라서, 파란색 빛을 짧은 깜박 원격 ChR2 - transduced 신생아 세포의 발사 패턴을 제어할 수 있습니다.
프로토콜
1. 광학 보정 : 측정 LED 전원
- 적극적으로 collimating 렌즈에 팬 부착이 LED / 방열판의 aparatus에 의해 냉각 방열판에 LED 배열을 연결합니다.
- LED / 히트싱크 / 팬 / 렌즈 장치와 brightfield 조명에 사용되는 램프를 교체하십시오. 이 장치는 조심스럽게 collimated LED 광선은 콘덴서 렌즈를 향해 직선 광 경로를 따라 여행 있도록 배치해야합니다. 히트싱크 / 팬 제대로 시스템의 공통 접지에 접지되어 있는지 확인하십시오.
- 현재의 신속하고 사각형 펄스를 줄 수있는 전원 공급 장치와 LED 배열을 드라이브. 이 전원 공급 장치는 펄스 발생기에서 발생하는 5V TTL 펄스에 의해 제어 수 있습니다.
- 필드 다이아 프램과 condensor 렌즈 사이에 정의된 빛의 경로를 따라 센터는 collimated 빔. 이상적으로, LED 광선은 약간 완전히 오픈 필드 다이어프램을 너무 많이 넣다 것입니다. 일반적으로, 더 단단히 collimated LED 빔 덜이 조리개를 채울 것이며, mor을 생산합니다균일의 비용으로 전자 파워. 우리의 설정에 우리는 consenser 다이어프램에의 활용 비행기에서 LED 배열의 약간 확장된 이미지를 투영 collimating 렌즈를 선택하여 빛을 균일 증가했습니다.
- 필드 다이아 프램 (광원에 가장 가까운 다이아 프램)의 이미지가 슬라이스 챔버 (그림 1)에 초점을 맞추고 있습니다 있도록 콘덴서를 집중하여 쾰러 조명을 얻을 수 있습니다. 렌즈 종이의 얇은 조직은 다른 깊이에있는 필드 다이아 프램의 초점을 맞춘 이미지를 시각화하기 위해 프로젝션 스크린의 역할을 수행할 수 있습니다.
- 불투명 재료로 알려진 직경 pinholes 일련의 드릴. 광 파워 미터의 센서를 통해 이러한 작은 pinholes 중 하나를 놓으십시오. 그것이 최대 읽기를 제공하기 전까지 단순히 전원 측정기를 이동하여 필드 다이아 프램의 초점을 맞춘 이미지 위에 표본 무대와 센터의 전원 측정기 전원 측정기를 놓습니다. 이 위치에 접사 전원 측정기.
- 완벽하게 모든 apertures (aperature 다이어프램과를 엽니다분야 다이어프램). 체계적으로 광학 lightpath에 상대적으로 첨부된 슬라이스 챔버 / 파워 미터를 이동하고 조명 지역 광 전력의 균일을 계산합니다. 시스템의 균일 계획을 작성할 수 있습니다. 현미경이 제대로 목표의 초점을 중심 쾰러 조명과 함께 설치하는 경우, 최대 전력 직접 목표 아래 있어야하고,이 초점 이외의 지역은 지금 균일 계획에 따라 전력 알려진 금액을 받으실 수 있습니다.
- 핀홀의 각 크기, 광학 전력 대 핀홀 면적의 표준 곡선을 빌드합니다. LED 배열 전류 입력을 조정하여 여러 전력 레벨에서이 곡선을 생산하고 각 곡선에서 mm2 당 전력을 계산합니다. LED 배열 패치 광학 사용하는 경우, 빛이 패치 조명 아래에서 전염이 얼마나 알고 패치 (콘덴서, pinholes 및 필터)에 필요한 광학 요소를 소개했는지 확인하십시오.
- 의 전원 측정기를 내리고수은 램프가 켜져 때 목표를 얼굴, 470nm에서 조명의 강도를 계산합니다.
- 실로 살아있는 슬라이스를 추가하고, 산란 뇌 조직을 통해 전달 빛을 전력을 결정하는 표준 곡선을 재건.
2. 깔끔히 절차 및 전기 생리학
부품 A : 슬라이스 준비
- 마우스를 마취 (60 MG / kg 케타민을 및 2mg/kg Xylazine)와 목을 벨. ;의 혼합물과 함께 부풀어 오른 ~ 310mOsm, 산도 7.4 124 NaCl, 3 KCl, 1.3 MgSO 4, 26 NaHCO 3, 1.25 NaHPO 4, 20 포도당, 2 CaCl 2 : 인공 대뇌 척수에서 두뇌 (ACSF, MM의 해부하다 95 % O2와 5 %는 후각 전구를 손상하지 않도록 돌봐 2 5,1)를 CO. 하나도 에지 (가로 섹션)와 복부 표면 한천에있는 두 개의 반구과 장소를 구분합니다.
- 접착제 vibr에 한천 각 피질 반구의 표면 지느러미atome 척, 천천히 얼음처럼 차가운 ACSF와 함께 목욕을 입력합니다. 300 μm의 섹션에서 복부 표면에서 슬라이스, 예열 (34-36 ° C)에 각 섹션을 전송하는 산소 ACSF, 그들 30~45분에 대한 복구하는 수.
파트 B : 스파이크에 대한 임계값의 루스 패치 측정
- 30 분 동안 실내 온도에 조각을 가져갈 후, 부드럽게 산소 ACSF의 지속적인 재관류 아래 현미경 챔버의 기록 챔버에서 슬라이스를 배치합니다.
지나치게 ChR2 감염된 신경을 자극 위험, EYFP - ChR2의 존재는 epifluorescence (그림 2A)에서 확인할 수 있습니다 - 피펫 풀러 (셔터 P - 97)에 유리 전극을 당기세요. ACSF이 전극을 입력합니다. ACSF 목욕에 배치하면 끝 저항은 70-10 MOhms 사이 여야합니다.
- 형광등 조명 아래에서 성숙한 형태로 슬라이스 건강한 ChR2 - EYFP 신경 세포에서 찾습니다. 또한 패치 광학에서이 신경 세포의 소마를 찾습니다.
- 전극 팁 통과 밝은 긍정적인 압력을 통해 확인된 형광 뉴런쪽으로 패치 전극을 낮춥니다. 막 연락이 이루어질 때, 신속하게 긍정적인 압력을 풀어 팁을 통해 흡입의 작고 간단한 금액을 적용합니다. 기가 - 옴 시일이 플라즈마 막과 전극 패치의 벽 사이에하여야한다.
- 기가 - 인감은 측정 지역 현장 잠재력을 생산해야하는 전극이 충분히 형광등 신경 요동 치고 활동에 가까운 경우, 형성했다. 없다고해도 빛의 여러 복용을 깜박하여이 신경 세포에 ChR2을 활성화합니다. 광 선량은 LED 전원 및 기간 모두의 함수이기 때문에, 많은 빛이 여러 권력 및 기간이 있습니다 (그림 2B)에서 실천 가능성을 연상하는 데 필요한 방법을 계산합니다. 급상승은 수은 램프 조명 아래에서 발생하는 얼마나 많은도 관찰합니다.
3. 대표 결과 :
우리의 현미경에 (올림푸스 BX51WI), 우리 LED가 나는 것입니다이 apertures과 콘덴서 렌즈와 n은 라인, 따라서 공장 설치된 아크 램프의 원래 lightpath을 유지. 필드 다이아 프램과 aperature 다이어프램을 모두 닫아, 우리는 패치 클램프 레코딩 (그림의 1B)에 대한 brightfield 대비가 충분 얻을 수 있습니다. 모든 diaphragms과 완벽하게 우리가 channelrhodopsin 활성화 (그림 1A)에 대한 최대의 조명 전원 슬라이스 노출 엽니다. 우리의 현미경에서이 패치 구성 (4.1 μW / mm 2 대 6.88 MW / mm 2) 최대 전체 필드 밀도보다 크기의 약 세 주문 낮은 광 밀도를 생산하고 있습니다.
한 성인 태어나 ChR2 - EYFP은 과립 세포를 표현하는 것을 나타냅니다 우리는 주동이의 철새 스트림 (그림 2A)에서 느슨한 - 패치 녹음에 neuroblasts 마이 그 레이션의 lentiviral 감염 이후 성인 태어난 후각 망울의 과립과 periglomerular의 뉴런 주의 강력한 상표를 참조하십시오 맥심에서 5 MS의 자극음 전력 (6.88 MW / mm 2) (그림 2B) 요동 치고 연상하기에 충분합니다. 표현 수준이 세포 사이에 차이가 있기 때문에, 스파이크에 대한 임계값을 전달 빛의 양은 다를 수 있으며 관심있는 각 세포 유형에 대한 통계 설명한다.
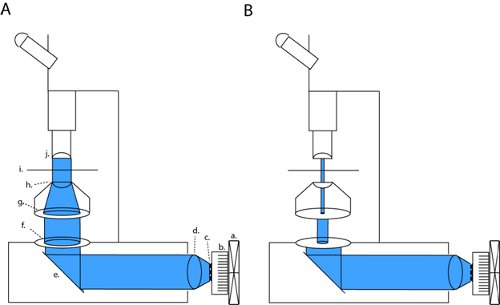
그림 1. 전체 분야 photostimulation 및 패치 - 클램프 슬라이스 전기 생리학에 대한 배열 설정을 이끌었습니다. channelrhodopsin를 활성화하려면 (ChR2) 우리는 오픈 뒤로 apertures 및 콘덴서 광학 (A)을 통해 collimated 광선을 프로젝트. 이 구성은 완전히 필드 다이어프램을 폐쇄하고 필드 다이아 프램의 modulating 폭 (B)에 의해 높은 대비 패치 광학으로 변경할 수 있습니다. 약어 : A. 팬, B.의 히트싱크, C. LED 배열, D. collimating 렌즈, E. 거울, F. 필드 다이어프램, G. 조리개 다이어프램, H. 콘덴서 렌즈, 난 SAmple 단계, J. 객관적.
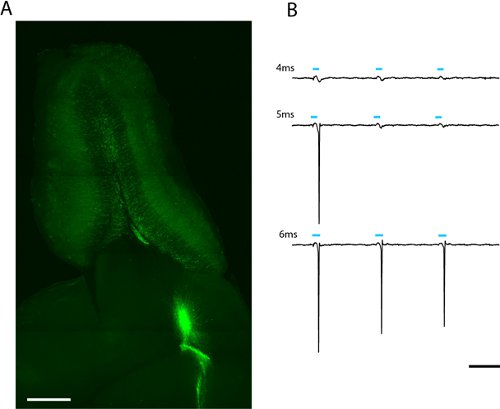
그림 2. 패치 클램프 및 전체 필드 photostimulation에 대한 후각 망울의 300μm 수평 슬라이스 (A)의 이미지. ChR2 - EYFP을 표현 Lentivirally 감염된 성인 출생 과립 세포는 후각 망울의 핵심에서 발산 볼 수 있습니다. 급상승 연상하는 데 필요한 빛을 복용량은 LED 플래시 (B)의 기간을 늘려 찾을 수 있습니다. 이 과립 세포에 대한 임계값은 전체 LED 강도 (2.43mW/mm 2)에서 5ms되었습니다. 규모 (A) = 500μm, (B) = 50ms 규모.
Access restricted. Please log in or start a trial to view this content.
토론
최근 몇 년 동안은 신경 과학 연구 6 optogenetic 도구의 인기가 폭발을 보았다. 결과적으로, 이러한 새 도구를 사용하여 시작하고자하는 실험실에 대한 항목의 장벽을 낮출 점점 더 중요합니다. 여기서 우리는 channelrhodopsin - 표현 뉴런의 전체 필드 광 자극을 할 수 있도록 기존 패치 - 클램프 장비의 간단하고 저렴한 비용 retrofitting 및 교정을 실시하는 방법을 설명합니다. 특히, 우리는 특별히...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 "ERA - NET 신경 세포의 프레임에있는 생명 보험 회사"AG2R 라 Mondiale "가르슈 DES Neurosciences 드 파리 (ENP), 회사 직원 Nationale 드 라 공들인"ANR - 09 - NEUR - 004 "에 의해 지원되었다 "유럽위원회, 그리고 파스퇴르 재단 FP7 프로그램의. ㅁ 와그너는 Letten 재단에 의해 지원되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
참고문헌
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 Forthcoming.
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유