Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'utilisation abordable tableaux LED pour photo-stimulation des neurones
Dans cet article
Résumé
Adulte-né neurones exprimant CHR2 peuvent être manipulés dans des préparations tranche électrophysiologiques afin d'examiner leur contribution à la fonction de olfactive circuits neuronaux.
Résumé
Électrophysiologie tranche standard a permis aux chercheurs de sonder les composantes individuelles des circuits neuronaux par l'enregistrement des réponses électriques des cellules individuelles en réponse à des manipulations électriques 1,2 ou pharmacologiques. Avec l'invention de méthodes pour le contrôle des neurones génétiquement optiquement ciblées (optogénétique), les chercheurs ont désormais un niveau sans précédent de contrôle sur des groupes spécifiques de neurones dans la préparation tranche standard. En particulier, photosensibles channelrhodopsin-2 (CHR2) permet aux chercheurs d'activer des neurones avec 3,4 lumière. En combinant l'étalonnage minutieux des LED à base de photostimulation CHR2 à l'électrophysiologie tranche de la norme, nous sommes en mesure de sonder avec plus de détails sur le rôle de l'adulte-né interneurones dans le bulbe olfactif, premier relais central du système olfactif. En utilisant l'expression virale des CHR2-YFP spécifiquement chez l'adulte-né neurones, nous pouvons contrôler sélectivement les jeunes adultes-né des neurones dans un milieu d'une ancienneneurones d matures. Notre contrôle optique utilise un système simple et peu coûteux à LED, et nous montrons comment ce système peut être calibré pour bien comprendre comment la lumière est nécessaire pour évoquer l'activité de dopage dans les neurones unique. Ainsi, de brefs éclairs de lumière bleue peut contrôler à distance le modèle tirs de CHR2-cellules transduites nouveau-né.
Protocole
1. Calibrage optique: Mesure de LED
- Fixez une barrette de DEL à un dissipateur thermique activement refroidi par un ventilateur et apposer cette aparatus LED / radiateur à une lentille de collimation.
- Remplacer la lampe utilisée en fond clair l'éclairage à LED / radiateur / ventilateur / appareil de l'objectif. Cet appareil doit être soigneusement placé de sorte que le faisceau LED collimaté se déplace le long d'une trajectoire rectiligne optiques vers la lentille de condenseur. Assurez-vous que le dissipateur / ventilateur est correctement mise à la terre commune du système.
- Conduire le tableau LED avec une alimentation qui peut donner des impulsions rapides et carrés de courant. Cette alimentation peut être contrôlée par une impulsion de 5V TTL provenant d'un générateur d'impulsions.
- Centrer le faisceau collimaté le long du trajet de la lumière défini entre le diaphragme de champ et de la lentille condenseur. Idéalement, le faisceau LED peu trop le diaphragme de champ complètement ouvert. Typiquement, un faisceau plus étroitement collimaté LED va remplir cette ouverture moins, et va produire MorPower E au détriment de l'uniformité. Dans notre configuration, nous avons augmenté l'uniformité de lumière en choisissant une lentille de collimation qui a projeté une image légèrement élargie de la matrice de LED à son plan conjugué au niveau du diaphragme consenser.
- Atteindre éclairage de Köhler en concentrant le condenseur afin que l'image du diaphragme de champ (le diaphragme le plus proche de la source de lumière) est axé sur la chambre tranche (fig. 1). Un tissu mince de papier pour objectif peuvent agir comme un écran de projection pour visualiser l'image focalisée sur le diaphragme de champ à d'autres profondeurs.
- Percer une série de trous de diamètre connu dans un matériau opaque. Placez un de ces trous petits sur le capteur d'une puissance-mètre optique. Placer le mesureur de puissance sur la scène spécimen et le centre du compteur de pouvoir sur l'image focalisée sur le diaphragme de champ en déplaçant simplement le compteur de puissance jusqu'à ce qu'il donne une valeur maximale. Apposez le wattmètre dans cette position.
- Totalement ouvert toutes les ouvertures (diaphragme et aperaturediaphragme de champ). Systématiquement passer la tranche attachée de chambre / wattmètre par rapport à la lightpath optiques et de calculer l'uniformité de la puissance optique dans la zone éclairée. Construire l'intrigue d'uniformité pour votre système. Si le microscope est correctement configuré avec illumination Kohler centrée au foyer de l'objectif, la puissance maximale doit être directement en dessous de l'objectif, et les régions en dehors de cette focalisation doit maintenant recevoir une quantité connue de puissance en fonction de l'intrigue uniformité.
- Pour chaque taille de trou d'épingle, de construire une courbe standard de puissance optique vs surface sténopé. En ajustant le courant d'entrée du tableau de LED, de produire cette courbe plusieurs niveaux de puissance et de chaque courbe de calculer la puissance par mm2. Si le tableau de LED est utilisé pour l'optique patch, assurez-vous d'introduire des éléments optiques nécessaires pour patcher (condenseurs, les piqûres et les filtres) pour savoir combien la lumière est transmise sous un éclairage patcher.
- Retournement du wattmètre pourface à l'objectif, calculer l'intensité de l'éclairage à 470nm lorsque la lampe au mercure est allumé.
- Ajouter une tranche en direct à la chambre, et de reconstruire les courbes standard pour déterminer la puissance lumineuse transmise à travers les tissus du cerveau de diffusion.
2. Procédure de tranchage et d'électrophysiologie
Partie A: Préparation Trancher
- Anesthetize (60 mg / kg de kétamine et de xylazine 2mg/kg) et décapiter la souris. Disséquer le cerveau dans le liquide céphalorachidien artificiel (ACSF, en mm: 124 NaCl, KCl 3, 1,3 MgSO 4, 26 NaHCO 3, 1,25 NaHPO 4, 20 de glucose, 2 CaCl 2; ~ 310mOsm, pH 7,4 lors barbotage avec un mélange de O2 95% et 5% de CO 2 5,1), en prenant soin de ne pas endommager les bulbes olfactifs. Séparez les deux hémisphères et le lieu sur une gélose à la surface ventrale, même avec un bord (pour les sections horizontales).
- Collez l'agar-agar et la surface dorsale de chaque hémisphère cortical à l'vibrAtome Chuck, et lentement, remplissez la baignoire avec glacée ACSF. Trancher de la surface ventrale dans 300 sections um, le transfert de chaque section pour réchauffé (34-36 ° C) et oxygénées ACSF, leur permettant de récupérer pendant 30-45 minutes.
Partie B: Mesure Patch en vrac du Seuil à Spike
- Après avoir porté les tranches à la température ambiante pendant 30 minutes, placez doucement une tranche dans la chambre d'enregistrement de la chambre de microscope sous perfusion constante de l'ACSF oxygénée.
Au risque de trop stimuler CHR2 neurones infectés, la présence de EYFP-CHR2 peut être confirmée en vertu épifluorescence (fig. 2a) - Tirez électrodes de verre sur un extracteur de pipette (Sutter P-97). Remplissez cette électrode avec l'ACSF. Lorsqu'il est placé dans le bain ACSF la résistance de pointe devrait être entre 7-10 MOhms.
- Sous un éclairage fluorescent, de localiser dans la tranche d'une saine CHR2-EYFP neurone avec une morphologie mature. Également localiser le soma ce neurone dans le cadre de l'optique patcher.
- Avec une pression positive lumière passait à travers la pointe de l'électrode, l'électrode inférieure correctif vers le neurone identifié fluorescentes. Quand le contact est fait de membrane, de libérer rapidement la pression positive et appliquez une petite quantité et brève de l'aspiration à travers la pointe. Un sceau de giga-ohms doit être faite entre la membrane plasmique et les murs de l'électrode de patch.
- Même si un giga-joint n'est pas formé, si l'électrode est suffisamment proche d'une activité des neurones fluorescents dopage devrait produire un potentiel de champ mesurable locales. Activer CHR2 dans ce neurone par le clignotement des doses différentes de la lumière. Parce que la lumière dose est fonction de deux LED d'alimentation et de la durée, calculer la quantité de lumière est nécessaire pour évoquer un potentiel d'action à des puissances et des durées multiples (fig. 2b). Aussi observer combien de dopage se produit sous une lampe à mercure d'éclairage.
3. Les résultats représentatifs:
Sur notre microscope (Olympus BX51WI), notre LED est in ligne avec deux ouvertures et un condenseur, maintenant ainsi le chemin optique d'origine de l'usine installée lampe à arc. En fermant la fois le diaphragme de champ et le diaphragme aperature, nous pouvons obtenir un contraste suffisant pour fond clair enregistrements de patch-clamp (Fig. 1b). Avec tous les diaphragmes totalement ouverte, nous exposent la tranche à puissance lumineuse maximale pour channelrhodopsin activation (figure 1A). Sur notre microscope, cette configuration patcher produit à faible densité qui est d'environ trois ordres de grandeur inférieure à la densité maximale plein champ (4,1 uW / mm 2 versus 6,88 mW / mm 2).
Nous voyons l'étiquetage robuste de l'adulte née granules bulbe olfactif et des neurones periglomerular semaines après l'infection de la migration des neuroblastes lentiviral dans le flux migratoire rostrale (fig. 2a) Un enregistrement lâche-correctif à partir d'un seul adulte-né CHR2-EYFP exprimer cellules granulaires indique que une stimulation de 5 ms chez Maximeuh la puissance (6,88 mW / mm 2) est suffisante pour évoquer dopage (fig. 2b). Depuis le niveau d'expression varie entre les cellules, la quantité de lumière qui passe le seuil à pic sera variable et devrait être décrit statistiquement pour chaque type de cellule d'intérêt.
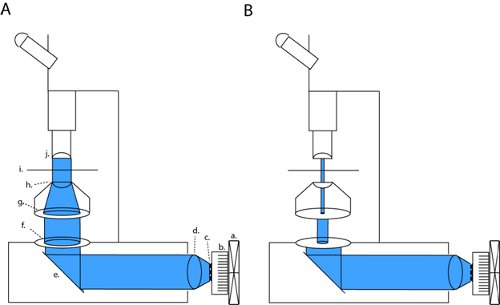
Figure 1. DEL de configuration réseau pour le plein champ photostimulation et l'électrophysiologie tranche de patch-clamp. Pour activer channelrhodopsin (CHR2) nous projettent un faisceau collimaté à travers les ouvertures dos ouvert et l'optique condenseur (a). Cette configuration peut être modifiée en optique à contraste élevé patcher par la fermeture complète du diaphragme de champ et la modulation de la largeur du diaphragme de champ (b). Abréviations: a. ventilateur, radiateur b., c. LED array, d. lentille de collimation, e. miroir, diaphragme de champ f., g. ouverture de diaphragme, condenseur h., i. SAstade de mple, J. objectif.
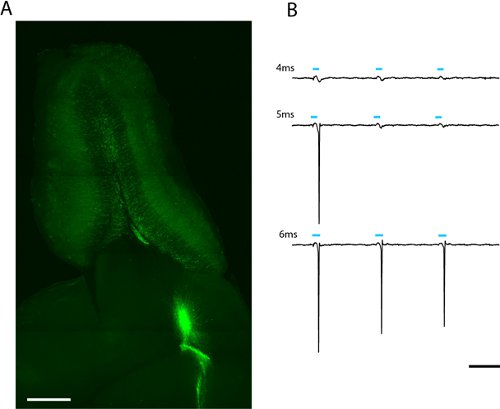
Figure 2. Image d'une tranche horizontale de 300 um bulbe olfactif pour le patch-clamp et de l'ensemble du champ de photostimulation (a). Lentivirally cellules infectées par des granules pour adultes-né exprimer CHR2-EYFP peut être vu rayonnant à partir du noyau du bulbe olfactif. La lumière-dose requise pour évoquer dopage peuvent être trouvés en augmentant la durée du flash à LED (b). Le seuil de cette cellule a été granules 5ms à intensité LED complet (2.43mW/mm 2). Échelle en (a) = 500 um, de l'échelle en (b) = 50 ms.
Access restricted. Please log in or start a trial to view this content.
Discussion
Ces dernières années ont vu une explosion de la popularité des outils de recherche en neurosciences pour optogénétique 6. En conséquence, il est plus important d'abaisser la barrière d'entrée pour les laboratoires qui désirent commencer à utiliser ces nouveaux outils. Nous décrivons ici comment procéder à une rénovation simple et peu coûteuse et l'étalonnage d'un classique de patch-clamp banc afin qu'il puisse faire plein champ stimulation optique de channelrhodopsin exprim...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par la compagnie d'assurance vie "AG2R-La Mondiale-", l'Ecole des Neurosciences de Paris (ENP), l'Agence Nationale de la Recherche "ANR-09-NEUR-004" dans le cadre de «ERA-NET NEURON »du FP7 programme par la Commission européenne et la Fondation Pasteur. Sébastien Wagner a été soutenu par la Fondation Letten.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Ketamine | Imalgène 1000 | 100 mg/ml | |
| Xylazine | Rompun | 2% | |
| NaCl | Sigma-Aldrich | S5886 | &nbps; |
| KCl | Sigma-Aldrich | P5405 | |
| MgSO4 | Sigma-Aldrich | M1880 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| NaHPO4 | Sigma-Aldrich | S5011 | |
| Glucose | Sigma-Aldrich | G7021 | |
| CaCl2 | Sigma-Aldrich | C7902 | |
| Agarose | Sigma-Aldrich | A9539 | |
| Pipette Puller | Sutter Instrument Co. | P-97 | |
| Glass Capillaries | Harvard Apparatus | GC150T-10 | 1.5 mm O.D./1.17 mm I.D. |
| LED array | Bridgelux | BXRA-C2000 | |
| Collimating lens | Thorlabs Inc. | LEDC1 | 40 mm beam diameter |
| Power supply | A1W Electronik | HKO2800 | 2.8 amp |
| Optical power meter | Thorlabs Inc. | PM 100 | |
| Heatsink | Thermaltake | A1838 | Silent Boost K8 |
| Fan | Thermaltake | A1838 | Silent Boost K8 |
| Vibratome | Leica Microsystems | VT1200S |
Références
- Nissant, A. Adult neurogenesis promotes synaptic plasticity in the olfactory bulb. Nature Neuroscience. 12, 728-730 (2009).
- Apicella, A. Pyramidal Cells in Piriform Cortex Receive Convergent Input from Distinct Olfactory Bulb Glomeruli. Journal of Neuroscience. 30, 14255-14260 (2010).
- Boyden, E. S. genetically targeted optical control of neural activity. Nature. 8, 1263-1263 (2005).
- Bardy, C. where new inhibitory neurons release neurotransmitters in the adult olfactory bulb. The Journal of Neuroscience. 30, 17023-17034 (2010).
- Grubb, M. S. Functional maturation of the first synapse in olfaction: development and adult neurogenesis. The Journal of neuroscience. 28, 2919-2932 (2008).
- Zhang, F. Circuit-breakers: optical technologies for probing neural signals and systems. Nature reviews. Neuroscience. 8, 577-581 (2007).
- Grossman, N. Multi-site optical excitation using ChR2 and micro-LED array. Journal of neural engineering. 7, 16004-16004 (2010).
- Dhawale, A. K. Non-redundant odor coding by sister mitral cells revealed by light addressable glomeruli in the mouse. Nature neuroscience. 13, 1404-1412 (2010).
- Weick, J. P. Functional control of transplantable human ESC-derived neurons via optogenetic targeting. Stem cells. 28, 2008-2016 (2010).
- Toni, N. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nature Neuroscience. 11, 901-907 (2008).
- Grubb, M. S., Burrone, J. Channelrhodopsin-2 Localised to the Axon Initial Segment. PLoS ONE. 5, e13761-e13761 Forthcoming.
- Tye, K. M. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon