Method Article
נעול חומצות גרעין תזרים cytometry פלואורסצנציה באתרו (LNA זרימה FISH): שיטה לגילוי חיידקי RNA קטנים
In This Article
Summary
שיטה חדשנית תפוקה גבוהה מתואר המאפשר איתור quantitation היחסי של RNA קטנים ביטוי mRNA של תאים חיידקיים יחיד באמצעות נעול בדיקות חומצות גרעין תזרים cytometry פלואורסצנציה באתרו.
Abstract
הקרינה הכלאה באתרו (FISH) היא טכניקה רבת עוצמה המשמש לזהות בתרגום ספציפי רצפי חומצות גרעין בסביבה הסלולרית. על מנת להגדיל את התפוקה, דגים ניתן לשלב עם cytometry זרימה (flow-FISH) כדי לאפשר את זיהוי ממוקד של רצפי חומצות גרעין אלפי תאים בודדים. כתוצאה מכך, תזרים-FISH מציעה יתרון בולט על פני lysate / אנסמבל מבוססי חומצת גרעין לזיהוי שיטות כי כל תא היא כאל תצפית עצמאית, ובכך לאפשר ניתוח סטטיסטי ושונות חזק. תכונות אלה גרמו שימוש בשיטות דגים זרימה דגים במספר יישומים שונים בכלי של שיטות אלה הודגמה בהצלחה בזיהוי הטלומרים קביעת אורך, 1,2 הסלולר ביטוי גנים 3,4, ניטור כפל ויראלי תאים נגועים 5, וניתוח הקהילה ספירת חיידקים6.
באופן מסורתי, סגוליות של שיטות דגים זרימה דגים כבר הנחילה ידי בדיקות דנ"א oligonucleotide. ואולם, החלפת oligonucleotide בדיקות DNA עם אנלוגים של חומצות גרעין כמו בדיקות דגים זרימה FISH גדל הן רגישות וספציפיות של טכניקה זו בשל הטמפרטורות היתוך גבוהה (T מ ') של אנלוגים אלו חומצות גרעין טבעי 7,8 . חומצות גרעין נעול (LNA) בדיקות הן סוג של חומצות גרעין אנלוגי המכילים נוקלאוטידים LNA זינק לאורך רצף ה-DNA או RNA 9,10. בשילוב עם דגים זרימה, בדיקות LNA בעבר הוכח להכות בדיקות דנ"א קונבנציונלי 7,11 ו כבר השתמשו בהצלחה כדי לזהות mRNA אוקריוטים 12 ו-RNA נגיפי בתאי יונקים 5.
כאן אנו להרחיב את יכולת לתאר שיטה זרימה FISH LNA אשר מאפשר זיהוי ספציפי של RNA בתא החיידקs (איור 1). באופן ספציפי, אנו מעוניינים זיהוי של קטן ללא קידוד הרגולציה RNA (sRNA) אשר משכו עניין רב בשנים האחרונות כפי שהם נמצאו לשמש גורמים רגולטוריים מרכזיים רבים תהליכים תאיים קריטי 13. עם זאת, יש כלים מוגבלים ללמוד sRNAs ואת האתגרים של גילוי sRNA בתאי החיידקים נובע בחלקו לגודל קטן יחסית (בדרך כלל 5-30 נוקלאוטידים אורך) ושפע נמוך של מולקולות sRNA כמו גם את הקושי הכללי בעבודה עם תאים ביולוגיים קטנים יותר עם משתנים ממברנות התאים. בשיטה זו, אנו מתארים קיבעון ו permeabilzation התנאים לשמר את המבנה של תאים חיידקיים ולאפשר את חדירת בדיקות LNA, כמו גם הגברה אות צעדים המאפשרים זיהוי ספציפי של שפע sRNA נמוך (איור 2).
Protocol
1. LNA בדיקות & עיצוב ניסיוני
- עיצוב LNA בדיקות כי הם משלימים הפוך sRNA עיבד שלך / mRNA או יש להם אישית מעוצבת על www.exiqon.com . אם אתה משתמש באפשרות עיצוב מותאם אישית, אתה תדע את הרצף, אבל לא את דפוס spiking LNA. התוספת של שאריות כל LNA לתוך ה-DNA או RNA תוצאות oligonucleotide גידול מ T של בין שנתיים 10 ° C עבור דופלקס LNA-RNA הכלאה 14. באופן אידיאלי, בדיקות LNA מתוכנן צריך להיות בין 20-25 נוקלאוטידים אורך (בדיקות כבר קשה יותר לסנתז) ויש לי מ-T של בין 85-90 מעלות צלזיוס למשך RNA ההכלאה.
- לאחר תכנון רצף, השתמש תפציץ http://blast.ncbi.nlm.nih.gov/Blast.cgi או להשוות את רצף בדיקה למסד הנתונים המקומי שלך כדי להבטיח בדיקה ספציפית רק sRNA שלך / mRNA של עניין.
- בעת הזמנת בדיקה LNA, להוסיף שינוי ביוטין-TEG עד הסוף '5 של oligonucleotide LNA. Biotinylation הכרחי מכתים שלאחר הכלאה עם המצומד streptavidin-צבע. אפשר להוסיף שינוי על 3 'בסוף במידת הצורך, אבל בנוסף 5 "סוף הוא פחות יקר וצריך להביא תשואות גבוהות יותר.
- שלושה שולטת שלילי יש לכלול השיטה: (i) שליטה "לא LNA" שבו בדיקה LNA לא הוסיף במהלך השלב הכלאה, (ii) שליטה "לא לצבוע" שבו בדיקה LNA הוא הכלאה של היעד sRNA אבל האירוע הכלאה לא זוהה בשל העדר של הכתם ניאון, ושליטה (iii) "mRNA לא הביע sRNA /" אשר מנצל בדיקה LNA כי מטרות sRNA לא קיים או שאינו בא לידי ביטוי סדר כדי לפקח על הלא ספציפית הכלאה.
- בדיקה ספציפית LNA כאן הוא משלים CsrB sRNA ויש לו את הרצף 5'-ביוטין-TEG-gTccAttTccCgtCctTagCagC-3 "(מונומרים LNA באותיות גדולות).
- בעקבות קבלת LNA lyophilized, resuspend עם מים nuclease-חופשית 50 מיקרוגרם / מ"ל ו - חנות 10-20 aliquots μL ב -20 ° C.
פתרונות
- 8% paraformaldehye (PFA), חומצה אצטית 10% ב-PBS: מערבבים 1 מ"ל PFA 32%, חומצה אצטית μL 400, 400 PBS 10X μL, pH = 7.4, ו -2.2 מ"ל nuclease ללא מים. עבור aliquots קפוא, הקפאת aliquots להשתמש יחיד -20 ° C ללא חומצה אצטית.
- 60% dextran פתרון סולפט: להוסיף 6.0 גרם סולפט dextran אל צינור חרוטי 50 מ"ל ולהוסיף מים עד לנפח סופי של 10 מ"ל. מחממים את התערובת עד 65 מעלות צלזיוס באמבט מים עד סולפט dextran הוא מומס (יכול לקחת 1-2 שעות). מים נוספים ייתכן שיהיה צורך להוסיף לאורך כל תהליך solubilization לשמור על נפח 10 מ"ל. Aliquot 60% סולפט dextran פתרון ולאחסן ב -20 ° C עד השימוש.
2. קיבוע
- קציר 1x10 8 תאים של bioluminescent Vibrio campbellii או חיידקים העניין שלך ולהעביר אותם לתוך צינור microcentrifuge 1.5 מ"ל. זו כמות מספקת של תאים מספיק חומר המוצא במשך ארבע זרימה דגימות דגים (אחד ספציפי מדגם LNA בדיקה ושלושה שולטת שלילי). נוסף microcentrifuge 1.5 מ"ל aliquots הצינור צריך להיות אם אחרים שנאספו sRNA / mRNA מינים צריכים להיבדק.
- גלולה תאים חיידקיים ידי צנטריפוגה XG ב 2300 למשך חמש דקות. בטל supernatant ידי pipetting ו resuspend התאים μL 400 של 1X PBS.
- לתערובת זו, להוסיף 400 μL paraformaldehye של 8% (PFA) וחומצה אצטית 10% פוספט 1X שנאגרו מלוחים (1X PBS) פתרון, לערבב היטב, דגירה במשך 10 דקות במהירות של 25 ° C ערבוב פעם אחת אחרי חמש דקות. Incubations כל, אלא אם צוין אחרת, מבוצעות בעל צינור מחומם. הפתרון PFA צריך להיות מוכן טרי או משומש aliquots קפוא לאחר תוספת של חומצה אצטית. Paraformaldehyde הוא מקבע crosslinking כי helps לשמר מורפולוגיה תא ולשמור RNA תאיים.
- גלולה התאים מתערובת זו על ידי צנטריפוגה XG ב 4500 במשך שתי דקות ולהסיר את supernatant ידי pipetting. כל הצעדים בעתיד שדורשים צנטריפוגה צריך להשתמש באותן הגדרות (7K, 2 דקות). חשוב לציין כי צנטריפוגה בעקבות supernatants יש להסיר על ידי pipetting ולא decanting.
- שוטפים את התאים פעמיים עם 400 μL 1X PBS ו resuspend התא גלולה האחרון 400 μL 1X PBS. התאים הם קבועים עכשיו ניתן לאחסן 4 מעלות צלזיוס 400 μL 1X PBS עד שבעה ימים.
3. Diethyl טיפול pyrocarbonate
- הכן 400 μL של פתרון 0.1% diethyl pyrocarbonate (DEPC) ב 1X PBS (400 μL של פתרון זה דרוש מדגם כל להיבדק בקנה מידה כל כך בהתאם). הפתרון DEPC צריכים להיות מוכנים טריים מלאי DEPC. טיפול DEPC inactivates RNases ידי carbethoxylation ומפחיתה אתרקע האות.
- הוספת 400 μL של הפתרון DEPC 0.1% מדגם קבוע בכל תא חיידקי ומערבבים היטב על ידי pipetting. דגירה זו תערובת של 25 מעלות צלזיוס למשך 12 דקות. שוטפים את התאים פעמיים עם 400 μL 1X PBS, גלולה התאים (7K, 2 דקות) ולהסיר את supernatant.
4. Permeabilization
- הוסף 1.0 מ"ג ליזוזים עד 1 מ"ל טריס-EDTA חיץ (10 mM טריס, 1 mM EDTA, pH 8.0) פתרון 1.0 מ"ג / מ"ל. פתרון זה אמור להיות מוכן טרי. הוספת 800 μL של הפתרון ליזוזים 1 מ"ג / מ"ל לתאים, ומערבבים היטב על ידי pipetting ו דגירה של 25 מעלות צלזיוס במשך 30 דקות עם ערבוב מדי פעם. גלולה התאים (7K, 2 דקות) ולהסיר את supernatant. ליזוזים משמש מגיב permeabilization ידי hydrolyzing הנוכחי peptidoglycan בקירות תא החיידק.
- הכן 3.0 מיקרוגרם / מ"ל פתרון של proteinase K במאגר TE. פתרון זה אמור להיות מוכן טרי מניה 20 מ"ג / מ"ל K proteinase המאוחסן ב -20 ° C.Proteinase K הוא פרוטאז סרין כי מעכל מגוון רחב של חלבונים מסייע הנגישות של בדיקות ריאגנטים ל-RNA.
- הוספת 800 μL של 3.0 מיקרוגרם / מ"ל proteinase הפתרון K כדי התא גלולה ומערבבים היטב על ידי pipetting. דגירה של 25 מעלות צלזיוס במשך 15 דקות עם vortexing באמצע הדגירה.
- גלולה התאים (7K, 2 דקות), להסיר את supernatant לשטוף את התאים פעם עם 400 μL 1X PBS. לאחר הסרת supernatant לשטוף, resuspend התאים 400 μL 1X PBS ולהוסיף 100 μL של resuspension לארבע חדש 1.5 צינורות microcentrifuge מ"ל. גלולה התאים (7K, 2 דקות) ולהסיר את supernatant.
5. הכלאה
- הכן 100 μL של חיץ הכלאה (HB) עבור כל דגימה. HB מורכב לפוראמיד 50% לפי נפח, 10% סולפט dextran ידי המסה (16.7 להוסיף μL הפתרון dextran סולפט 60% עבור כל μL 100), הפתרון של 1X Denhardt, 50 mM נתרן פוספט pH 7.0,סודיום ציטרט 2X (SSC), 20 מיקרוגרם של ה-DNA טעון סלמון זרע (SSSD) ו - 20 מיקרוגרם שמרים tRNA.
- כל המרכיבים של HB יש מטרה שונה. לפוראמיד מורידה את טמפרטורת ההתכה של חומצות גרעין דופלקסים ובכך עוזרים עם denaturation של RNA ומזעור נזק לתאים. סולפט dextran משמש נפח למעט פולימר לרכז את החללית ולהגדיל את שיעור הכלאה. פתרון Denhardts, שמרים tRNA ו SSSD לשמש סוכנים חסימת להפחית הלא ספציפית מחייב.
- בכל תא resuspension המכילים 1.5 מ"ל microcentrifuge צינורות, להוסיף 95 HB μL ו μL של 5.0 sRNA / mRNA ספציפי LNA [20 pmol ריכוז LNA ספציפי הסופי] או מים (שליטה לא LNA שלילי). לדוגמה:
- Tube 1-95 HB μL + 5.0 sRNA μL / mRNA ספציפי בדיקה
- Tube 2-95 μL HB + 5.0 μL sRNA / mRNA ספציפי בדיקה (בקרה שלילית "אין צבע")
- Tube 3-95 μL HB + sRNA 5.0 μL/ MRNA בדיקה ("לא הביע sRNA / mRNA 'שליטה שלילי)
- Tube 4-95 μL HB + מים 5.0 μL (שליטה שלילית "לא LNA")
- דגירה כל ארבע דגימות ב 60 ° C למשך 60 דקות. הטמפרטורה הכלאה תלוי בדיקה LNA (ים) T מ 'צריך להיות מוגדר על כ 30 מעלות צלזיוס מתחת לחזות T מ' עבור RNA חישול. גם הטמפרטורה הכלאה לפוראמיד מוגבה ב HB מבטיח denaturation של המבנה המשני של sRNA או mRNA של עניין.
6. פוסט הכלאה שוטף
- בעקבות הכלאה, להוסיף 1.0 מ"ל 0.1X SSC עם 0.1% tween-20 (SSCT) לתערובת הכלאה. זה הכרחי כדי לאפשר את התאים יוסר הפתרון הכלאה צמיג. גלולה התאים (7K, 2 דקות) ולהסיר את supernatant.
- הוספת 200 μL של לפוראמיד 50%, 2X SSC, 0.1% tween-20 של תא כדורי, לערבב היטב incubאכלו במשך 30 דקות ב 65 מעלות צלזיוס בתוך גוש חימום.
- הוסף 1 מ"ל 0.1X SSCT לתערובת, גלולה התאים (7K, 2 דקות) ולהסיר את supernatant.
- הוספת 500 SSCT 0.1X μL כדי resuspend את התאים דגירה במשך 40 דקות ב 65 מעלות צלזיוס בתוך גוש חום. גלולה התאים (7K, 2 דקות) ולהסיר את supernatant.
7. חסימת מכתים
- הכן את החיץ חסימה (BB) והפתרון streptavidin-לצבוע מכתים. הכן פתרון 1X BB ממלאי 5X (זמינים מסחרית, לראות ריאגנטים). עבור כל קבוצה של ארבעה צינורות, להכין 1.2 מ"ל 1X BB.
- הוספת 200 BB μL 1X את כדורי התא, resuspend ו דגירה במשך 30 דקות במהירות של 25 ° C.
- לצבוע streptavidin-מצומדות משמש כדי לזהות את בדיקות LNA biotinylated. בעוד חסימה, להכין פתרון של 2 מיקרוגרם / מ"ל DyLight 488 streptavidin או הרצוי צבען streptavidin המצומד ב 1X BB למשך 30 דקות (שלוש דגימות, לבצע 300 μL).
- לאחר incubation עם 1X BB, גלולה התאים (7K, 2 דקות) ולהסיר את supernatant. הוסף 50 μL של פתרון streptavidin-לצבוע את כדורי התא, ומערבבים היטב, ועל דגירה במשך 12 דקות במהירות של 25 ° C עם ערבוב מתמיד על מערבולת או thermomixer. בשביל לשלוט "אין צבע", מוסיפים 50 μL חיץ חסימת 1X בלבד. במשך שארית פרוטוקול, להגן על הצינורות מן האור באמצעות רדיד אלומיניום.
- שוטפים את התאים פעם עם חיץ SSCT μL 500 0.1X ופעם עם 400 μL 1X PBS עם 0.1% tween-20 (PBST). גלולה התאים (7K, 2 דקות) ולהסיר את supernatant.
- בעקבות מכתים את streptavidin-המצומד הראשוני, האות מוגבר על ידי החדרת נוגדן אנטי biotinylated streptavidin אל המצומד streptavidin-צבע ולאחר מכן מכתים בפעם השנייה עם streptavidin-צבען ובכך להגדיל את התפוקה לכל אות הכלאה LNA בדיקה (איור 2) .
- הוספת 100 μL של 1 מיקרוגרם / מ"ל biotinylated אנטי streptavidin הנוגדן 1X PBS, resuspenד תאים, דגירה של 25 מעלות צלזיוס במשך 30 דקות עם ערבוב מדי פעם. גלולה התאים (7K, 2 דקות), להסיר את supernatant ולשטוף פעמיים עם PBST 400 1X μL.
- הוסף 50 μL של 2 מיקרוגרם / מ"ל streptavidin-פתרון לצבוע את התאים, ומערבבים היטב, ועל דגירה במשך 12 דקות במהירות של 25 ° C עם ערבוב מתמיד על מערבולת או thermomixer. בשביל לשלוט "אין צבע", מוסיפים 50 μL חיץ חסימת 1X בלבד.
- שוטפים את התאים פעם עם חיץ SSCT μL 500 0.1X ופעם עם 400 PBST 1X μL.
- Resuspend התאים PBST 200 1X חנות μL ובו 4 ° C עד מוכן לניתוח cytometry הזרימה. עבור תאים חיידקיים קטנים להגדיר את קצב הזרימה איטי כדי להקטין את גודל הליבה. בנוסף, עבור cytometers לזרום עם הפסקות קדימה סף פיזור, הפסקת חייב להיות מוגדר נמוך ככל האפשר כדי להבטיח את תאים חיידקיים קטן מזוהים.
- לגילוי 488 DyLight, cytometer את זרימת צריך להיות מצויד עם 488 ננומטר לייזר תקן פליטהמסננים עבור FITC. לפחות 2x10 4 אירועים צריכה להיות שנאספו. כדי להבטיח תאימות עם cytometers תזרים מצויד לייזרים שונים, אחרים streptavidin-מצומדות fluorophores ניתן להשתמש בפרוטוקול זה.
8. נציג תוצאות
דוגמה בתאים קבועים permeabilized ביעילות מוצגת העלילה cytometry נקודה לזרום איור 3A. בעת השימוש בתנאים שתוארו עבור permeabilization, האוכלוסייה תא קטן הומוגנית אגרגטים המציין כמה תאים. כאשר גבוה (5 מ"ג / מ"ל) בריכוזים של ליזוזים משמשים, התאים נוטים יותר המצרפי להראות ערכים פיזור מוגבר קדימה, מעיד על חלקיקים גדולים יותר (איור 3B). דוגמה cytometry זרימת הנתונים מתוך ניסוי מוצלח תזרים-FISH LNA מוצגת באיור 4. ההיסטוגרמה מדגים את זיהוי ספציפי של sRNA מטרה יחד עם שלושה שולטת שלילית.השליטה שלילי "אין צבע" מייצרת את הקרינה המעטה, ואחריו 'לא LNA' ו 'לא הביע sRNA "שולטת שלילית. לבסוף, את המדגם עם sRNA ספציפי LNA בדיקה מייצרת את הקרינה הגדולה ביותר. פעם את השיטה בדיקות LNA מאומתים באופן זה, ניסויים נוספים ניתן שנועד לעקוב אחר השינויים האות sRNA לאורך זמן, בתגובה מוטציות או תנאים תרבות מגוונות, וכו '
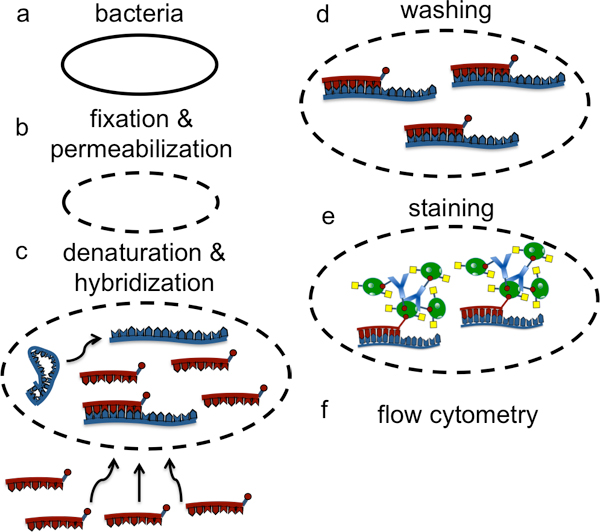
באיור 1. תיאור התכנית הכוללת של הניסוי LNA זרימה FISH עבור זיהוי של sRNA חיידקי.

באיור 2. מכתים וגם הגברה של האות LNA תזרים-FISH. א) הכלאה של החללית LNA biotinylated. ב) צביעה עם המצומד פלורסנט DyLight streptavidin 488. ג) הכבילה של biotinylated אנטי streptavidin נוגדנים streptavidin 488 DyLight. נוגדן יכול להיקשר streptavidin דרך האתר אנטיגן מחייב, או יכול להיות מחויב streptavidin דרך שאריות ביוטין שלה. ד) הגברה של האות על ידי צביעה נוספת עם המצומד פלורסנט DyLight streptavidin 488.
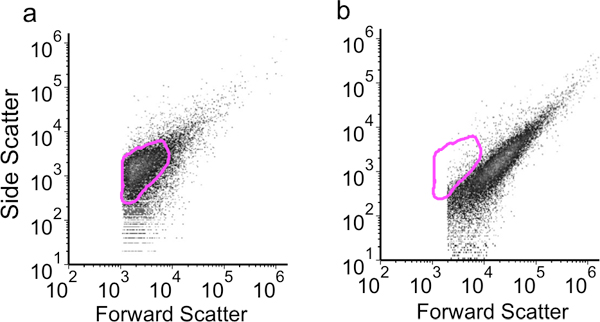
באיור 3. Cytometry זרימה נקודה מגרשים מראה קדימה לעומת פיזור תוצאות לוואי) 1 מ"ג / מ"ל ליזוזים, 3 מיקרוגרם / מ"ל proteinase K permeabilization ו-b) 5 מ"ג / מ"ל ליזוזים, 3 מיקרוגרם / מ"ל permeabilization proteinase K.
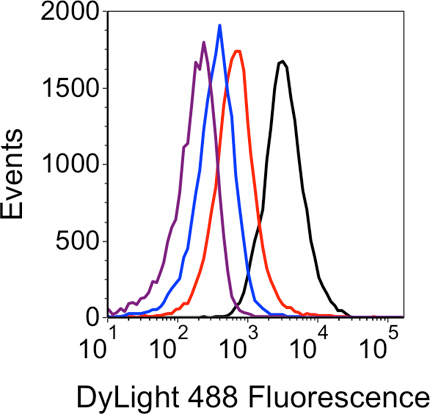
איור 4. ניתוח היסטוגרמה של זרימה FISH תוצאות LNA. אות הניאון שנוצר מכל מדגם מוצג על ידי ארבע עקבות: שחור - sRNA ספציפי LNA בדיקה: אדום - שליטה שלילית "לא הביע sRNA '; כחול - שליטה שלילית" לא LNA "; סגול -שליטה שלילית "אין צבע".
Discussion
השיטה זרימה FISH LNA המוצג כאן נעשה שימוש כדי לאתר את הביטוי של sRNA מן גראם שליליים ימיים החיידק Vibrio campbellii אשר הביטוי כבר בעבר אישרו דרך פרופיל microarray המבוסס על הביטוי שעתוק לאחור polymerase תגובת שרשרת 16. עד כה השתמשנו בשיטה זו כדי לעקוב אחר הביטוי של מגוון רחב של RNAs (למשל טרנס מקודד sRNA, sRNA כי לווסת את פעילות החלבון, riboswitches, ו-mRNA). ככזה, אנו בטוחים כי השיטה ניתנת להתאמה והוא יכול לשמש כדי לזהות כל יעד sRNA או mRNA והוא יכול להיות שונה לשימוש בכל מיני חיידקים או סוג תא. אם שינוי של פרוטוקול זה הוא הכרחי עבור סוגי תאים אחרים, המשתנה החשוב ביותר לשקול מניפולציה היא הצעד permeabilization. לדוגמה, כאשר שינוי תנאי permeabilization המתואר כאן, שינויים בריכוזים של ליזוזים ו proteinase K צריך להיבדק. מצאנו כי הכפלת אושילש את כמות ליזוזים ו proteinase K הביא שינויים משמעותיים הזרימה-FISH תוצאות LNA. יתר על כן, כאשר בדיקות permeabilization תנאים נוספים, התאים יש לנתח עבור clumping, אובדן התא האות השגה הטוב ביותר יחס רקע פלואורסצנטי. היקף clumping התא יכול להיבדק על ידי מיקרוסקופיה / או cytometry הזרימה. עד cytometry זרימה, גושים תא קיימים כמו זנבות של קדימה לעומת פיזור נקודה בצד העלילה ואת שיטת permeabilization הנכון יהיה למזער את האפקט הזה עוקב. שיטה זו היא גם מקובל זיהוי זמנית sRNA בלי שינויים גדולים לפרוטוקול כמתואר בדיקות נוספות LNA שכותרתו עם haptens אחרים כגון digoxigenin ניתן להוסיף במהלך שלב הכלאה ו זוהה אז עם נוגדן אנטי digoxigenin ו המצומד משני נוגדנים fluorophore. נכון לעכשיו, המגבלה היחידה שאנו נתקלים בשיטה זו היא חוסר יכולתה ליצור אות מספקת מצד לשעבר חלושותמינים sRNA נלחץ מאמצים נערכים כדי לקבוע את סף זיהוי (מספר העתק מוחלט לכל תא).
בסך הכל, את שיטת תזרים LNA-FISH מספקת את ההזדמנות כדי למדוד sRNA חיידקי או ביטוי mRNA ברמת תא בודד באופן תפוקה גבוהה, כדי לספק תובנות על נוכחות השפע היחסי של מינים sRNA ואת מידת הביטוי שלו משתנה באוכלוסייה.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי משרד המחקר של הצי הימי של ארה"ב באמצעות כספים במעבדת המחקר הליבה.
Materials
שמור מיובש
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| פוספט 10X שנאגרו מלוחים (PBS), pH 7.4 | Applied Biosystems / Ambion | AM9625 | |
| Nuclease ללא מים | Applied Biosystems / Ambion | AM9932 | (לא DEPC מטופלים) |
| 32% paraformaldehyde | מיקרוסקופית אלקטרונים למדעים | RT 15714 | אתנול חינם |
| חומצה אצטית | Acros אורגניקס | 327290010 | |
| Diethyl pyrocarbonate (DEPC) | סיגמא אולדריץ' | D5758 | |
| ליזוזים | סיגמא אולדריץ' | L2879 | |
| Proteinase K (20 מ"ג / מ"ל) | Applied Biosystems / Ambion | AM2546 | |
| לפוראמיד | Applied Biosystems / Ambion | AM9342 | Aliquot Deionized, ולהקפיא |
| Dextran סולפט MW> 500.000 | סיגמא אולדריץ' | D8906 | Aliquot פתרון 60% ולהקפיא |
| 50X פתרון Denhardt נתרכז | סיגמא אולדריץ' | D2532 | Aliquot ולהקפיא |
| סודיום ציטרט חיץ 20X | Applied Biosystems / Ambion | AM9770 | |
| זרע DNA סלמון (טעון) 10 מ"ג / מ"ל | Applied Biosystems / Ambion | AM9680 | Aliquot ולהקפיא |
| שמרים tRNA (10 מ"ג / מ"ל) | Life Technologies / Invitrogen | 15401-011 | Aliquot ולהקפיא |
| Tween-20 | סיגמא אולדריץ' | P9416 | |
| 5X בפתרון הכלאה באתרו חסימת | וקטור מעבדות | MB-1220 | |
| DyLight 488 streptavidin | וקטור מעבדות | SA-5488-1 | |
| Biotinylated אנטי streptavidin | וקטור מעבדות | BA-0500 | Aliquot ולהקפיא |
References
- Rufer, N., Dragowska, W., Thornbury, G., Roosnek, E., Lansdorp, P. M. Telomere length dynamics in human lymphocyte subpopulations measured by flow cytometry. Nat. Biotechnol. 16, 743-747 (1998).
- Lansdorp, P. M. Heterogeneity in telomere length of human chromosomes. Hum. Mol. Genet. 5, 685-691 (1996).
- Pernthaler, A., Amann, R. Simultaneous Fluorescence In Situ Hybridization of mRNA and rRNA in Environmental Bacteria. Appl. Environ. Microbiol. 70, 5426-5433 (2004).
- Jen, C. J. Flow-FISH analysis and isolation of clostridial strains in an anaerobic semi-solid bio-hydrogen producing system by hydrogenase gene target. Appl. Microbiol. Biotechnol. 74, 1126-1134 (2007).
- Robertson, K. L., Verhoeven, A. B., Thach, D., Chang, E. Monitoring Viral RNA in Infected Cells with LNA Flow-FISH. RNA. 16, 1679-1685 (2010).
- Friedrich, U., Lenke, J. Improved Enumeration of Lactic Acid Bacteria in Mesophilic Dairy Starter Cultures by Using Multiplex Quantitative Real-Time PCR and Flow Cytometry-Fluorescence In Situ Hybridization. Appl. Environ. Microbiol. 72, 4163-4171 (2006).
- Thomsen, R., Nielsen, P. S., Jensen, T. H. Dramatically improved RNA in situ hybridization signals using LNA-modified probes. RNA. 11, 1745-1748 (2005).
- Silahtaroglu, A. N., Tommerup, N., Vissing, H. FISHing with locked nucleic acids (LNA): evaulation of different LNA/DNA mixmers. Mol. Cell. Probes. 17, 165-169 (2003).
- Obika, S. Synthesis of 2'-O, 4'-C-methyleneuridine and -cytidine. Novel bicyclic nucleosides having a fixed C3'-endo sugar puckering. Tetrahedron. Lett. 38, 8735-8738 (1997).
- Koshkin, A. A. LNA (locked nucleic acids): synthesis of the adenine, cytosine, guanine, 5-methylcytosine, thymine, and uracil bicyclonucleoside monomers oligomerisation, and unprecedented nucleic acid recognition. Tetrahedron. 54, 3607-3630 (1998).
- Kubota, K., Ohashi, A., Imachi, H., Harada, H. Improved in situ hybridization efficiency with locked-nucleic-acid-incorporated DNA probes. Appl. Environ. Microbiol. 72, 5311-5317 (2006).
- Robertson, K. L., Thach, D. C. LNA flow-FISH: A flow cytometry-fluorescence in situ hybridization method to detect messenger RNA using locked nucleic acid probes. Anal. Biochem. 390, 109-114 (2009).
- Waters, L., Storz, G. Regulatory RNAs in bacteria. Cell. 136, 615-628 (2009).
- Petersen, M., Wengel, J. LNA: a versatile tool for therapeutics and genomics. Trends. Biotechnol. 21, 74-81 (2003).
- Corput, M. P. C. v. d., Grosveld, F. G. Fluorescence in Situ Hybridization Analysis of Transcript Dynamics in Cells. Methods. 25, 111-118 (2001).
- Silveira, A. C. G. Identification of non-coding RNAs in environmental vibrios. Microbiology. 156, 2452-2458 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved