Method Article
ロックされた核酸のフローサイトメトリー、蛍光その場でハイブリダイゼーション(LNAフロー- FISH):細菌のsmall RNAの検出のための方法
要約
小説ハイスループット法は、ロックされた核酸プローブとフローサイトメトリー、蛍光を用いて、単一の細菌細胞からの検出と小さなRNAとmRNA発現の相対定量を可能にすることが記載されているその場でハイブリダイゼーション。
要約
蛍光 in situハイブリダイゼーション (FISH)が検出し、細胞環境内の特定の核酸配列をローカライズするために使用される強力な手法です。スループットを向上させるために、FISHは、個々の細胞の数千の標的核酸配列の検出を可能にするためにフローサイトメトリー(フロー- FISH)と組み合わせることができます。各セルは、それによってより強力な統計と分散分析を可能にする、独立した観察として扱われるため、結果として、フロー- FISHは、ライセート/アンサンブルベースの核酸の検出方法に比べて明確な利点を提供しています。これらの属性は、異なるアプリケーションの数のFISH、フロー- FISH法の使用を促していると、これらのメソッドのユーティリティが正常にウイルス増殖を監視し、テロメアの長さの決定1,2、細胞の同定と遺伝子発現3,4に示されている感染細胞5、および細菌群集の解析と列挙6。
伝統的に、FISH、フロー- FISH法の特異性はDNAのオリゴヌクレオチドプローブにより付与されています。しかし、最近、FISH、フロー- FISHプローブとしての核酸アナログによるDNAオリゴヌクレオチドプローブの交換が原因で、天然核酸7,8のためのこれらのアナログのより高い融解温度(T m)に各手法の感度と特異度の両方を増加している。ロックされた核酸(LNA)プローブは、DNAまたはRNA配列9,10を通してスパイクLNAヌクレオチドを含む核酸アナログの一種です。フロー- FISHと組み合わせることで、LNAプローブは以前に、従来のDNAプローブ7,11を上回ることが示されていると、正常5哺乳動物細胞内で真核生物のmRNAは12とウイルスRNAを検出するために使用されている。
ここでは、この機能を展開し、細菌の細胞内でRNAの特異的検出を可能にLNAフロー- FISH法を説明します。の( 図1)。具体的には、小さな非コード彼らは多くの重要な細胞プロセス13の主要な調節要素として機能するように発見されているとして、過去数年間でかなりの関心を集めている規制のRNA(sRNAを)の検出に興味を持っています。しかし、sRNAsと細菌細胞のsRNAを検出する課題を研究するために、限られたツールでは、一部の比較的小さなサイズ(通常は長さが50から300ヌクレオチド)とsRNA分子の低濃度だけでなく、作業の一般的な難しさに起因するあります細胞膜を変化させると小さな生物細胞と。この方法では、我々は細菌細胞の構造を維持し、LNAプローブの浸透だけでなく、低濃度sRNA( 図2)の特異的検出を可能にする信号増幅のステップを可能に固定し、permeabilzation条件について説明します。
プロトコル
1。 LNAプローブと実験計画
- あなたの転写sRNA / mRNAの逆補数であるか、またはそれらにカスタムデザインをお持ちの設計LNAプローブwww.exiqon.com 。カスタム設計のオプションを使用している場合は、シーケンスを知っている、ではなく、LNAスパイクパターンになります。の間のT mの増加にDNAまたはRNAオリゴヌクレオチド結果に各LNA残基のほか2〜10 ° C LNA - RNAハイブリダイゼーションの二重14。理想的には、設計したLNAプローブは、長さ20〜25ヌクレオチド(長いプローブを合成するより困難である)の間であると85から90の間のT m℃のRNAのハイブリダイゼーションが必要です。
- シーケンスを設計した後、BLASTの使用http://blast.ncbi.nlm.nih.gov/Blast.cgiをプローブにのみ興味のあるsRNA / mRNAに特異的であることを確認したり、ローカルデータベースへのプローブ配列を比較する。
- LNAプローブをご注文の際は、LNAオリゴヌクレオチドの5'末端にビオチン- TEGの変更を追加。ビオチンは、ストレプトアビジン - 色素複合体とポストハイブリダイゼーション染色のために必要です。それは3にこの変更を追加することが可能である"必要があれば終わりが、5に加えて'末端には、安価で高収率になるはずです。
- 三ネガティブコントロール方法に含まれるべきである:(i)のLNAプローブはハイブリダイゼーション工程中に追加されていない'NO LNA"制御、LNAプローブはにハイブリダイズされている(II)"無色素"制御ターゲットsRNAがハイブリダイゼーションのイベントは順番に、存在しないまたは非発現sRNAをターゲットとLNAプローブを利用した制御を蛍光染色の欠如に起因する検出、および(iii)"非発現sRNA /発現"されていません非特異的ハイブリダイゼーションをモニターする。
- ここに特定のLNAプローブはsRNA CsrBを補完するものであり、配列5' -ビオチン- TEG - gTccAttTccCgtCctTagCagC - 3'(LNAのモノマーでいます)の文字を大文字。
- -20℃で10〜20μLのアリコートで50μg/ mLとし、店舗にヌクレアーゼフリー水で再懸濁し凍結乾燥LNAの受領、次の
ソリューション
- 8パーセントparaformaldehye(PFA)、PBS中10%酢酸:ミックス1 mLの32パーセントPFA、400μLの酢酸、400μL10 × PBS、pHは= 7.4、および2.2 mLのヌクレアーゼフリー水。冷凍アリコートの場合は、酢酸なし-20 ° Cで単回使用のアリコートに凍結する。
- 60パーセントデキストラン硫酸溶液:50mLのコニカルチューブに6.0グラムデキストラン硫酸を加え、10 mlの最終体積に水を加える。デキストラン硫酸(1-2時間を取ることができる)に溶解するまで℃の水浴中で65にこの混合物を加熱する。追加の水を10 mLのボリュームを維持するために可溶化プロセス全体を追加する必要があります。使用するまで-20℃でアリコート60パーセントデキストラン硫酸溶液および店。
2。固定
- 生物発光の収穫1 × 10 8細胞ビブリオcampbelliiたり、細菌関心のと1.5 mLのマイクロ遠心チューブに移す。細胞のこの量は、4つのフロー- FISHのサンプル(特定のLNAプローブのサンプル三ネガティブコントロール)のための十分な出発原料を提供します。他のsRNA / mRNAが種をテストする必要がある場合はさらに1.5 mlのマイクロ遠心チューブのアリコートを収集する必要があります。
- ペレットを5分間2300 × gで遠心分離によって細菌細胞。ピペッティングにより上清を捨て、1 × PBS 400μLで細胞を再懸濁します。
- この混合物に、、(1X PBS)溶液を緩衝生理食塩水うまくミックス1Xリン酸8%paraformaldehye(PFA)及び10%酢酸の400μLを追加し、25℃で10分間インキュベート℃、5分後に一度混合。すべてのインキュベーションは、特に断りのない限り、加熱管のホルダーで実行されます。 PFAのソリューションは、新しく調製し又は酢酸の添加後、凍結アリコートから使用する必要があります。パラホルムアルデヒドはhその架橋固定液です。elps細胞の形態を維持し、細胞内のRNAを保持する。
- ペレットは、2分間に4500 × gで遠心分離によりこの混合物から細胞をピペッティングにより上清を取り除く。遠心分離を必要とする将来のすべての手順は同じ設定を(7K、2分)使用する必要があります。以下の遠心分離は、上清をピペッティングし、デカンテーションではないが除去されるべきであることに注意することは重要です。
- 400μL1X PBSで2回細胞を洗浄し、400μlの1X PBSで最終的に細胞ペレットを再懸濁します。細胞は修正され、4℃で保存できます400μlの1X PBSでCは、最大7日間。
3。ジエチルピロカーボネート処理
- 1X PBSでジエチルピロカーボネート(DEPC)(この溶液400μLをそれに応じてその規模テストされるすべてのサンプルのために必要とされる)の0.1%溶液400μLを準備します。 DEPC溶液はDEPCストックから、新鮮な準備する必要があります。 DEPC処理はcarbethoxylationでRNaseを不活性化し、減少バックグラウンド信号。
- 各固定細菌の細胞サンプル0.1%DEPC溶液400μLを追加し、ピペッティングによりよく混和する。 12分間25℃でこの混合物をインキュベートする。 400μLの1 × PBS、細胞をペレット化(7K、2分)で細胞を2回洗浄し、上清を取り除く。
4。透過化
- は1.0 mg / mL溶液を1 mLのトリス- EDTA緩衝液(10mM Tris、1mMのEDTA、pH8.0)中にリゾチームの1.0ミリグラムを追加。このソリューションは、新鮮な準備する必要があります。 25℃で800セルに1 mg / mLのリゾチーム溶液のμL、ピペッティングでよく混合し、インキュベートを追加°時々混ぜながら30分間。ペレット細胞(7K、2分間)し、上清を取り除く。リゾチームは、細菌の細胞壁のペプチドグリカンに存在する加水分解することにより透過化の試薬として機能します。
- TE緩衝液中のプロテイナーゼK 3.0μg/ mLの溶液を調製します。この溶液を-20℃で保存されている20 mg / mlのプロテイナーゼKの在庫からの新鮮な準備する必要がありますプロテイナーゼKは、様々なタンパク質を消化し、RNAのプローブと試薬のアクセシビリティを支援するセリンプロテアーゼである。
- 細胞ペレットを〜3.0μg/ mLのプロテイナーゼK溶液800μLを追加し、ピペッティングでよく混ぜる。インキュベーションの途中にボルテックスしながら15分間25℃でインキュベートする。
- ペレット細胞(7K、2分間)、上清を除去し、400μlの1X PBSで細胞を1回洗浄する。洗浄上清を除去した後、400μlの1 × PBSで細胞を再懸濁し、つの新しい1.5 mlのマイクロチューブに再懸濁液100μLを加える。ペレット細胞(7K、2分間)し、上清を取り除く。
5。交配
- 各サンプルのハイブリダイゼーションバッファー(HB)100μLを準備します。 HBは、体積、質量10%デキストラン硫酸(100μL、60%デキストラン硫酸溶液の16.7μLを加える)、1Xデンハルト溶液、50mMリン酸ナトリウムpH7.0の50%ホルムアミドで構成されています2Xクエン酸ナトリウム(SSC)、剪断サケ精子DNA(SSSD)と20μgの酵母tRNAの20μgの。
- HBの各コンポーネントは、異なる目的を持っています。ホルムアミドは、それによってRNAの変性と細胞の損傷を最小限に抑えることを手伝って核酸二重鎖の融解温度を下げる。デキストラン硫酸は、ポリマーは、プローブを集中し、ハイブリダイゼーションの速度を高めるために - を除くボリュームとして使用されます。 Denhardtsソリューションは、酵母tRNAとSSSDは、非特異的結合を減らすためにブロッキング剤として機能する。
- セルの各々の再懸濁を含む1.5 mlのマイクロチューブを、95μLHBとsRNA /の5.0μL追加mRNAを特異的LNAまたは水(LNAネガティブコントロールがないため)[特定のLNAの最終濃度を20 pmolの]。次に例を示します。
- チューブ1から95μLHB + 5.0μLsRNA / mRNAの特異的プローブ
- チューブ2から95μLHB + 5.0μLsRNA / mRNAの特異的プローブ("無色素"ネガティブコントロール)
- チューブ3から95μLHB + 5.0μLsRNA/ mRNAのプローブ("非発現sRNA / mRNAは"ネガティブコントロール)
- 管4から95μLHB + 5.0μL水('NO LNA"ネガティブコントロール)
- 60分間60℃ですべての4つのサンプルをインキュベートする。ハイブリダイゼーション温度は、LNAプローブ(S)T mに依存し、約30に設定する必要があります℃のアニーリングRNAのT mを予測以下。 HBの上昇、ハイブリダイゼーション温度とホルムアミドの両方がsRNAまたは関心のmRNAの二次構造の変性を保証します。
6。ポストハイブリダイゼーションの洗浄
- ハイブリダイゼーション後、ハイブリダイゼーション混合物に0.1%Tween - 20を1.0 mLの0.1 × SSC(SSCT)を追加します。これは、細胞が粘性のハイブリダイゼーション溶液から除去できるようにする必要があります。ペレット細胞(7K、2分間)し、上清を取り除く。
- 徹底的にとincub混ぜ、細胞のペレットに50%ホルムアミド200μLの、2X SSC、0.1%Tween - 20を追加65℃の加熱ブロックに30分間食べた。
- 混合、ペレット細胞(7K、2分)に1 mLの0.1 × SSCTを追加し、上清を取り除く。
- 細胞を再懸濁し、ヒートブロックで65℃40分℃でインキュベートする500μL0.1X SSCTを追加。ペレット細胞(7K、2分間)し、上清を取り除く。
7。ブロッキングと染色
- ブロッキングバッファー(BB)とストレプトアビジン - 色素染色液を準備する。 5X在庫から1X BBの溶液を調製します(市販の、試薬を参照)。 4本のチューブのすべてのセットの場合は、1.2 mLの1X BBを準備。
- 、細胞のペレットを200μL1X BBを追加し再懸濁し、25℃で30分間インキュベート℃、
- ストレプトアビジンコンジュゲート色素、ビオチン化LNAプローブを検出するために使用されます。ブロックしながら、2μg/ mLのDyLight 488ストレプトアビジンまたは30分(三つの試料のために、300μLを加える)のための1X BBでご希望の色素-ストレプトアビジン複合体の溶液を調製。
- incub後1X BB、細胞をペレット化(7K、2分間)、上清を除去するとation。 、細胞ペレットにストレプトアビジン - 色素溶液50μLを加えて完全に混合し、25℃で12分間インキュベート° C渦上またはサーモミキサーで一定のミキシングと。 "無色素"制御のために、わずか50μL1Xブロッキング緩衝液を加える。プロトコルの残りの部分では、アルミ箔を使用して、光からチューブを保護します。
- 500μL0.1X SSCTのバッファを持つと一度0.1%のTween - 20(PBST)400μL1 × PBSで細胞を1回洗浄する。ペレット細胞(7K、2分間)し、上清を取り除く。
- 最初のストレプトアビジンコンジュゲート染色後、信号はストレプトアビジン-色素複合体にビオチン化抗ストレプトアビジン抗体を導入してから( 図2)ハイブリダイズしたLNAプローブあたりの信号の出力を増加させるため、ストレプトアビジン-色素で2回目を染色することによって増幅され。
- 1X PBS、resuspenで1μg/ mlのビオチン化抗ストレプトアビジン抗体を100μLを追加D細胞、および25℃でインキュベート時々混ぜながら30分間を。ペレット細胞(7K、2分間)、上清を除去し、400μlの1X PBSTで2回洗浄。
- 、細胞を2μg/ mLのストレプトアビジン - 色素溶液50μLを追加徹底的に混合し、25℃で12分間インキュベートします渦上またはサーモミキサーで混合定数Cを。 "無色素"制御のために、わずか50μL1Xブロッキング緩衝液を加える。
- 500μL0.1X SSCTのバッファーで1回細胞を洗浄し、一度400μL1X PBST。
- 4で200μL1X PBSTと店舗で細胞を再懸° C、フローサイトメトリー解析のための準備ができるまで。小さな細菌細胞のコアサイズを小さくするために減速する流量を設定します。さらに、前方散乱のしきい値のカットオフを持つフローサイトメーター用に、カットオフは小さな細菌細胞が検出されるように、可能な限り低く設定する必要があります。
- DyLight 488検出のために、フローサイトメーターは、488 nmのレーザーと基準排出ガスに装備する必要がありますFITC用のフィルター。少なくとも2 × 10 4つのイベントを収集する必要があります。別のレーザーを搭載したフローサイトメーターとの互換性のために、他のストレプトアビジン結合蛍光色素は、このプロトコルのために使用することができます。
8。代表的な結果
固定し、効果的に浸透化されたセルの例を図3aにフローサイトメトリードットプロットで示されています。透過化のために、上記の条件を使用する場合は、細胞集団は小さく、均一なことを示すいくつかの細胞集合体です。リゾチームの高い(5 mg / mLの)濃度が使用されている場合、細胞が凝集する可能性が高いとより大きな粒子( 図3B)を示す前方に増加散布値を、示す。成功したLNAフロー- FISHの実験から、フローサイトメトリーデータの例を図4に示されています。ヒストグラムは、次の3つのネガティブコントロールと共にターゲットsRNAの特異的検出を示しています。"無色素"ネガティブコントロールは、"いいえLNA'と'非発現sRNA"ネガティブコントロールに続いて、少なくとも蛍光を生成します。最後に、sRNA固有のLNAプローブを用いたサンプルは、最大の蛍光を生成します。方法とLNAプローブはこの方法で検証されると、追加の実験が変異または様々な培養条件、等に反応して、時間をかけてsRNA信号の変化を監視するように設計することができます
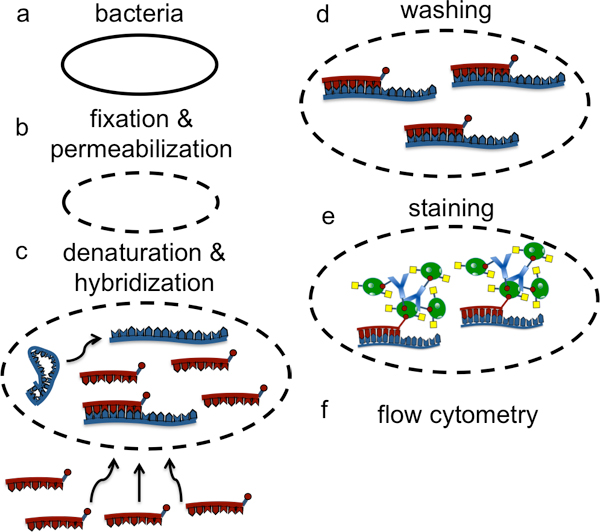
図1。細菌sRNAの検出のためのLNAフロー- FISHの実験の全体的なスキームの描写。

図2。LNAフロー- FISH信号の染色と増幅。ビオチン化LNAプローブのa)ハイブリダイゼーション。蛍光DyLight 488ストレプトアビジンコンジュゲートとB)染色。ビオチン化抗- sのc)の結合DyLight 488ストレプトアビジンへtreptavidinの抗体。抗体はその抗原結合部位を介してストレプトアビジンを結合することができるか、そのビオチン残基を介してストレプトアビジンが結合することができる。蛍光DyLight 488ストレプトアビジンコンジュゲートとのさらなる染色による信号のd)の増幅。
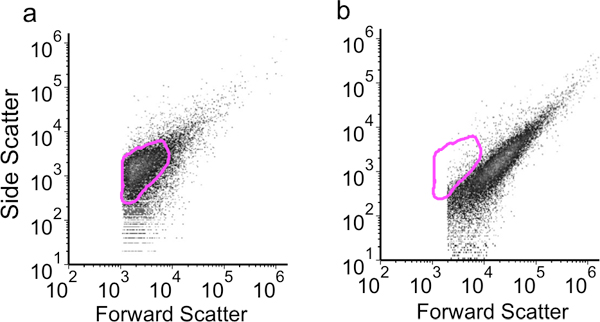
図3。)1 mg / mLのリゾチーム、3μg/ mLのプロテイナーゼK透過およびb)5 mg / mLのリゾチーム、3μg/ mlのプロテイナーゼKの透過処理のための側方散乱の結果対前方に示すフローサイトメトリードットプロット。
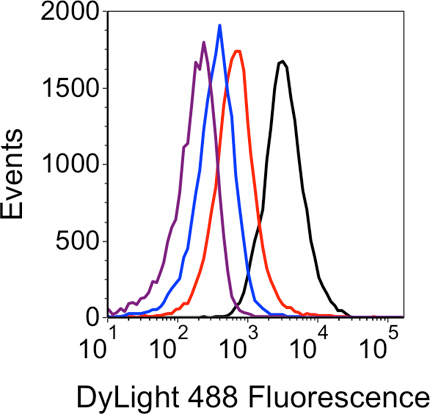
図4。LNAフロー- FISHの結果のヒストグラム解析。各試料から発生する蛍光信号は、4つのトレースで示されています:ブラック - sRNA固有のLNAプローブ、赤 - "非発現sRNA"陰性コントロール;青 - 'NO LNA"ネガティブコントロール;紫 -"無色素"ネガティブコントロール。
ディスカッション
ここに示すLNAフロー- FISH法は、式の前にマイクロアレイベースの発現プロファイリングと逆転写ポリメラーゼ連鎖反応法16を介して確認されているグラム陰性海洋細菌ビブリオcampbelliiからsRNAの発現を検出した。これまでに、我々は分子RNA(タンパク質活性、リボスイッチ、およびmRNAを調節するなどのトランスエンコードされたsRNA、sRNA)の様々な表現を監視するために、このメソッドを使用している。このように、我々は方法が適応であり、任意のsRNAまたはmRNAターゲットを検出するために使用することができ、あらゆる細菌種や細胞タイプで使用するために変更できると確信しています。このプロトコルの変更が他の細胞型のための必要な場合は、操作に考慮すべき最も重要な変数は、透過性のステップです。例えば、ここで説明する透過処理の条件を変更するときに、リゾチームおよびプロテイナーゼKの濃度の変化をテストする必要があります。我々はその倍を見つけたりリゾチームおよびプロテイナーゼKの量を三倍にするとLNAフロー- FISHの結果に大きな変化をもたらした。さらに、追加の透過化の条件をテストするとき、細胞が凝集、細胞の損失、およびバックグラウンド蛍光比に得られるべき最高のシグナルを分析する必要があります。セルクランピングの程度は、顕微鏡および/またはフローサイトメトリーによって試験することができる。前方対側方散乱ドットプロットと正しい透過法で尾がこのテーリングの影響を最小限にするようにフローサイトメトリーにより、細胞塊が存在しています。このメソッドは、ハイブリダイゼーションステップの間に追加した後、抗ジゴキシゲニン抗体と二次抗体-フルオロフォアのコンジュゲートで検出できるようなジゴキシゲニンなどの他のハプテンで標識された追加のLNAプローブは前述のようにプロトコルに大きな変更を加えることなくまた多重sRNAの検出に適している。現在、我々はこの方法で発生していることを唯一の制限は弱く元から十分な信号を生成することができない点です。押さsRNA種と努力は(セル当たりの絶対コピー数で)検出のしきい値を決定するために進行中です。
全体的に、LNAフロー- FISH法では、プレゼンスとsRNAの種の相対量とその発現が変化する度合いについての洞察を提供するために、ハイスループットの方法で、単一細胞レベルでの細菌sRNAまたはmRNAの発現を測定する機会を提供します。人口インチ
開示事項
著者らは、開示することは何もない。
謝辞
この作品は、米国海軍研究所のコアファンドを経由して米海軍研究局によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| 10Xリン酸緩衝生理食塩水(PBS)、pH7.4の緩衝化 | アプライドバイオシステムズ/アンビオン | AM9625 | |
| ヌクレアーゼフリー水 | アプライドバイオシステムズ/アンビオン | AM9932 | (DEPCは扱われません) |
| 32%パラホルムアルデヒド | 電子顕微鏡学 | RT 15714 | エタノールフリー |
| 酢酸 | アクロスオーガニック | 327290010 | |
| ジエチルピロカーボネート(DEPC) | シグマアルドリッチ | D5758 | キープ乾燥した |
| リゾチーム | シグマアルドリッチ | L2879 | |
| プロテイナーゼK(20 mg / mLの) | アプライドバイオシステムズ/アンビオン | AM2546 | |
| ホルムアミド | アプライドバイオシステムズ/アンビオン | AM9342 | イオンは、分注して凍結 |
| デキストラン硫酸MW> 500,000 | シグマアルドリッチ | D8906 | 一定分量の60%溶液及び凍結 |
| デンハルト溶液の50X濃縮物 | シグマアルドリッチ | D2532 | 分注して凍結 |
| クエン酸ナトリウム緩衝液20倍 | アプライドバイオシステムズ/アンビオン | AM9770 | |
| サケ精子DNA(せん断)に10 mg / mLの | アプライドバイオシステムズ/アンビオン | AM9680 | 分注して凍結 |
| 酵母tRNA(10 mg / mLの) | ライフテクノロジーズ/インビトロジェン | 15401-011 | 分注して凍結 |
| Tween - 20を | シグマアルドリッチ | P9416 | |
| in situハイブリダイゼーションブロッキング溶液で 5倍 | ベクターラボラトリーズ | MB - 1220 | |
| DyLight 488ストレプトアビジン | ベクターラボラトリーズ | SA - 5488から1 | |
| ビオチン化抗ストレプトアビジン | ベクターラボラトリーズ | BA - 0500 | 分注して凍結 |
参考文献
- Rufer, N., Dragowska, W., Thornbury, G., Roosnek, E., Lansdorp, P. M. Telomere length dynamics in human lymphocyte subpopulations measured by flow cytometry. Nat. Biotechnol. 16, 743-747 (1998).
- Lansdorp, P. M. Heterogeneity in telomere length of human chromosomes. Hum. Mol. Genet. 5, 685-691 (1996).
- Pernthaler, A., Amann, R. Simultaneous Fluorescence In Situ Hybridization of mRNA and rRNA in Environmental Bacteria. Appl. Environ. Microbiol. 70, 5426-5433 (2004).
- Jen, C. J. Flow-FISH analysis and isolation of clostridial strains in an anaerobic semi-solid bio-hydrogen producing system by hydrogenase gene target. Appl. Microbiol. Biotechnol. 74, 1126-1134 (2007).
- Robertson, K. L., Verhoeven, A. B., Thach, D., Chang, E. Monitoring Viral RNA in Infected Cells with LNA Flow-FISH. RNA. 16, 1679-1685 (2010).
- Friedrich, U., Lenke, J. Improved Enumeration of Lactic Acid Bacteria in Mesophilic Dairy Starter Cultures by Using Multiplex Quantitative Real-Time PCR and Flow Cytometry-Fluorescence In Situ Hybridization. Appl. Environ. Microbiol. 72, 4163-4171 (2006).
- Thomsen, R., Nielsen, P. S., Jensen, T. H. Dramatically improved RNA in situ hybridization signals using LNA-modified probes. RNA. 11, 1745-1748 (2005).
- Silahtaroglu, A. N., Tommerup, N., Vissing, H. FISHing with locked nucleic acids (LNA): evaulation of different LNA/DNA mixmers. Mol. Cell. Probes. 17, 165-169 (2003).
- Obika, S. Synthesis of 2'-O, 4'-C-methyleneuridine and -cytidine. Novel bicyclic nucleosides having a fixed C3'-endo sugar puckering. Tetrahedron. Lett. 38, 8735-8738 (1997).
- Koshkin, A. A. LNA (locked nucleic acids): synthesis of the adenine, cytosine, guanine, 5-methylcytosine, thymine, and uracil bicyclonucleoside monomers oligomerisation, and unprecedented nucleic acid recognition. Tetrahedron. 54, 3607-3630 (1998).
- Kubota, K., Ohashi, A., Imachi, H., Harada, H. Improved in situ hybridization efficiency with locked-nucleic-acid-incorporated DNA probes. Appl. Environ. Microbiol. 72, 5311-5317 (2006).
- Robertson, K. L., Thach, D. C. LNA flow-FISH: A flow cytometry-fluorescence in situ hybridization method to detect messenger RNA using locked nucleic acid probes. Anal. Biochem. 390, 109-114 (2009).
- Waters, L., Storz, G. Regulatory RNAs in bacteria. Cell. 136, 615-628 (2009).
- Petersen, M., Wengel, J. LNA: a versatile tool for therapeutics and genomics. Trends. Biotechnol. 21, 74-81 (2003).
- Corput, M. P. C. v. d., Grosveld, F. G. Fluorescence in Situ Hybridization Analysis of Transcript Dynamics in Cells. Methods. 25, 111-118 (2001).
- Silveira, A. C. G. Identification of non-coding RNAs in environmental vibrios. Microbiology. 156, 2452-2458 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved