Method Article
בידוד תאי גזע ממעיים למבוגרים
In This Article
Summary
Understanding the endogenous molecular changes in adult stem cells during aging requires isolating the cells of interest. The method described here presents a simple and robust approach to enrich for and isolate Drosophila intestinal stem cells and the enteroblast progenitor cells by FACS at any time point during aging.
Abstract
Aging tissue is characterized by a continuous decline in functional ability. Adult stem cells are crucial in maintaining tissue homeostasis particularly in tissues that have a high turnover rate such as the intestinal epithelium. However, adult stem cells are also subject to aging processes and the concomitant decline in function. The Drosophila midgut has emerged as an ideal model system to study molecular mechanisms that interfere with the intestinal stem cells’ (ISCs) ability to function in tissue homeostasis. Although adult ISCs can be easily identified and isolated from midguts of young flies, it has been a major challenge to study endogenous molecular changes of ISCs during aging. This is due to the lack of a combination of molecular markers suitable to isolate ISCs from aged intestines. Here we propose a method that allows for successful dissociation of midgut tissue into living cells that can subsequently be separated into distinct populations by FACS. By using dissociated cells from the esg-Gal4, UAS-GFP fly line, in which both ISCs and the enteroblast (EB) progenitor cells express GFP, two populations of cells are distinguished based on different GFP intensities. These differences in GFP expression correlate with differences in cell size and granularity and represent enriched populations of ISCs and EBs. Intriguingly, the two GFP-positive cell populations remain distinctly separated during aging, presenting a novel technique for identifying and isolating cell populations enriched for either ISCs or EBs at any time point during aging. The further analysis, for example transcriptome analysis, of these particular cell populations at various time points during aging is now possible and this will facilitate the examination of endogenous molecular changes that occur in these cells during aging.
Introduction
תוצאה בלתי נמנעת של הזדקנות היא יכולת הירידה של רקמות ואיברים להישאר פונקציונלי. תאי גזע בוגרים, חיוניים לשמירה על הומאוסטזיס רקמה ואיבר פונקציונלי, אולם כפי אורגניזמים גיל, תאי הגזע גם לחוות ירידה בהתנהגותם הביולוגית. זה מזיק במיוחד לרקמות שבם שיעור תחלופה גבוה, כגון אפיתל במעי. סימני ההיכר של תאי גזע בגילים כוללים נזק הגנומי, מנגנוני תיקון לקויים, רגולציה מחזור התא פגומה ומסלולי איתות misregulated, אשר כולם משפיעים על התנהגות נורמלית של תאי גזע (הנסקרת ב 1-3). על ידי מניפולציה מסלולי איתות ספציפיות או דריסה גנים ספציפיים, רכשנו תובנה לתוך התפקידים שלהם בויסות ושמירה על תאי גזע נורמלי התנהגות. מאחר שרוב הניסויים אלה הן גישות מולקולת מועמד, יש לנו מעט מאוד ידע בנוגע לשינויים המולקולריים אנדוגני המתרחשים בתאי גזע במהלךהזדקנות. דרך אחת לגשת לשאלה זו היא להשוות את transcriptome של צעיר לעומת תאי גזע ישנים לזהות מולקולות ביטוי שפרופיל משתנה באופן משמעותי במהלך הזדקנות. לרוע המזל, אתגרים ביולוגיים וטכניים יש הכבידו את ההתקדמות שלנו לגבי גישה זו עד כה.
דרוזופילה melanogaster הוא אורגניזם מודל מתאים ביותר ללמוד הזדקנות מאז יש לו תוחלת חיים קצרים (כ 60-70 ימים) ומוצגי הזדקנות פנוטיפים (הנסקרת ב 4). יתר על כן, את תהליך ההזדקנות בדרוזופילה יכול להיות מואץ על ידי טמפרטורה. כאשר השמירה על הזבובים בגיל 29 ° C, פנוטיפ גילאים ברקמת המעי יכול להיות כבר נצפה לאחר 15 ימים 5. יתר על כן, דרוזופילה היא נוחה לשפע של מניפולציות גנטיות. בפרט, midgut תסיסנית התפתחה כמערכת מודל מצוינת ללמוד את ההשפעה של מסלולי איתות שונים ואתגרים סביבתיים בהביולוגיה של תאי גזע במעי (ISCs) במהלך הזדקנות (שנסקרה ב6-10). יש אפיתל במעי תסיסנית תחלופה גבוהה ומתחדש כל שבועיים בנקבות ובערך פעם בחודש אצל גברים 11. יש לי ISCs המתגורר בmidgut תסיסנית היכולת להתחלק ולייצר ISC-מחודש עצמי ותא אב לאחר mitotic נקרא enteroblast (EB) 12,13. EB מבדילה לתוך או אנתרוציט הקליטה או תא enteroendocrine הפרשה. למועד זה, שילוב הסמן היחיד שבאופן חד משמעי תוויות ISC הוא הביטוי של Escargot גורם שעתוק (ESG) ויגנד Notch הדלתא (DL) 14. עם זאת, זה רק נכון גם לגבי בטן צעירה ובריאה. במהלך הזדקנות, האפיתל midgut מאופיין בהתרבות המהירה של ISC 15-17. בנוסף, איתות Notch חריגה משבשת את החלטת גורלם של תאי בת ISCוגורם misdifferentiation של 15 EBS. התוצאה היא הצטברות של תאים שאינם פעילים לאיתות Notch וESG שיתוף מפורש וד"ל, ובכך הופך את ביטוי Dl מספיק לזיהוי תאי גזע בתום לב בmidgut גילאים. הקושי בזיהוי ISCs האמיתי משבש את היכולת לבחון את השינויים אנדוגניים בISCs הזדקנות עד עכשיו.
יש לנו לטפל בבעיה זו על ידי ניצול של ESG -Gal4, קו לטוס מהונדס UAS-GFP שברמת הביטוי של GFP בISCs וEBS הוא שונה במהות ונשארה שונה ברחבי הזדקנות. גישה דומה תוארה לבידוד של neuroblasts ונוירונים 18,19 זחל. Midguts של זבובים צעירים וESG -Gal4 הישן, UAS-GFP נותח וניתק לתוך תאים בודדים. התאים אז מוינו לתאי GFP החיובי באמצעות תא הקרינה מיון מופעל (FACS). מעניין, ג GFP החיובי מסודריםאמות חילקו לשתי פסגות נפרדות המבוססות על עוצמת הקרינה GFP (GFP גבוה וGFP נמוך). יתר על כן, חלוקת תאי GFP החיובי בשתי הפסגות גם בקורלציה עם גודל תא: התאים שהציגו עוצמת GFP נמוכה היו קטנות ופחות גרגירים ואילו תאים בעוצמה הגבוה GFP היו גדולים יותר ויותר פרטניים. תצפית זו הציעה שISCs הקטן יותר יכול להבחין בין EBS הגדול יותר באמצעות FACS מבוסס על עוצמת GFP ובחירת פיזור מתאים קדימה (FSC) והגדרות צד פיזור (SSC). מעניין לציין, ששתי הפסגות נותרו מופרדות בבירור במהלך הזדקנות. יתר על כן, היחס בין שתי הפסגות השתנה באופן המשקף את סימני ההיכר כאמור midguts הזדקנות: כלומר שהמספר גדול, misdifferentiated עליות EBS לאורך זמן. מממצאים אלה אנו מסיקים כי על ידי מיון תאי GFP החיובי תוך שימוש בהגדרות פרמטר FACS המתאימות אנחנו יכולים להעשיר לISCs וEBS בכל נקודה זמן דuring הזדקנות.
לסיכום, אנו מציגים אסטרטגית FACS שמאפשר לחוקרים להעשרה לשתי אוכלוסיות תאים שונות, ISCs וEBS, מmidguts דרוזופילה בכל גיל ולבודד תאים אלה לניתוח נוסף, כגון רצף של הדור הבא. שיטה זו עוצמה מאפשרת לחקר המנגנונים המולקולריים אנדוגני שטבועים להזדקנות באוכלוסייה מועשרת בתאי גזע או אב. נתונים שהתקבלו ממחקרים אלה יהיו ללא ספק להקל על זיהוי של מולקולות נשמרים, כי הם משמעותיים בהזדקנות על פני מינים.
Protocol
הערה: אם פרוטוקול זה משמש בפעם הראשונה לבודד את ISCs ידי FAC מיון, הפקדים הבאים הם חובה כדי תחילה להגדיר את הפרמטרים FACS כראוי: תאים הם מנותקים מסוג בר (למשל w 1118) midguts תסיסנית ללא Sytox. תאים ניתקו מסוג בר (למשל w 1118) midguts תסיסנית עם Sytox (ראו שלב 3.6). תאים ניתק מmidguts של ESG -Gal4 קו הזבוב, UAS-GFP ללא Sytox.
1. הכנה של פתרונות וכלים לDissection Gut
- הכן 4-6 בקבוקונים כל נקבה המכילה 40 עפה מESG -Gal4, קו לטוס UAS-GFP.
- מפתרון מניות 10x PBS להכין 500 מיליליטר 1x PBS (1.8 מ"מ לאא 2 PO 4 · H 2 O, 8.4 מ"מ Na 2 HPO 4 · 2H 2 O, 175 מ"מ NaCl, להתאים את ה- pH 7.4).
- הכן 3.5% פתרון agarose ב1x PBS (agarose הכיתה אלקטרופורזה 3.5 g ב100 מיליליטר 1x PBS). להכין צלחות לנתיחה על ידי שפיכת פתרון זה לצלחות פטרי (בקוטר 8.5 סנטימטרים) כדי לכסות את התחתית. שכבת agarose מונעת נזק לקצות המלקחיים במהלך ההליך לנתיחה. לאחר ג'ל בסס לאחסן את הצלחות לנתיחה על 4 מעלות צלזיוס.
- הכן 300 מיליליטר של 1x PBS + 1% BSA טרי לפני לנתח ומניח את הבקבוק על קרח או על 4 מעלות צלזיוס.
- הפעל צנטריפוגות ולתת לו מגניב 4 מעלות צלזיוס.
- להבת הטיפים של 2 טפטפות פסטר זכוכית להחליק את הקצוות.
- שני זוגות נקיים של מלקחיים וסכין גילוח אחד עם אתנול 70%.
- הנח 05:56 1.5 מיליליטר צינורות microcentrifuge לאיסוף midguts גזור על קרח.
2. הכנה של מערכת העיכול וDissection של midgut
- הרדימי זבובים מבקבוקון אחד (40 זבובים) עם CO 2 על מיטה לטוס סטנדרטית, לערוף את כלזבובים באמצעות סכין גילוח ולהעביר אותם לצלחת לנתיחה. יוצקים פתרון קר 1x PBS BSA / 1% לצלחת לנתיחה כדי לכסות את agarose ג'ל. הזבובים יצופו.
- תפוס את הבטן לטוס עם זוג אחד של מלקחיים, כשהוא אוחז את בית החזה עם זוג מלקחיים האחר. הפרד את בית החזה מהבטן. הבטן תהיה גלויה והמעי הקדמי / היבול יהיה ככל הנראה עדיין להיות מחובר לבית החזה.
- תפוס את הבטן ולהוציא את זה של בית החזה. להתפתח הבטן, תופס את היבול ולמשוך את הבטן מעט anteriorly מהבטן.
- תפוס את הקצה האחורי של הבטן עם זוג אחד של מלקחיים וקצה הציפורן הפתוחה anteriorly עם זוג מלקחיים האחר. היזהר שלא להרוס את רקמת המעי הבולטת. משוך את הקצה האחורי משם כדי לשבור את הציפורן ולהמשיך מושכים בדיעבד מאוד בעדינות עד שכל הבטן כבר משכה מתוך חלל הבטן. היבול יכול להיות שיש להסירו מראש אם הוא גדול מדי כדי להתאיםדרך חלל הגוף.
- הסר את המעי הקדמי, tubules Malpighian, המעי האחורי ושחלות עוזב midgut החשופה.
- בעזרת פיפטה פסטר זכוכית, להעביר את הקבוצה של midguts גזור ל1.5 מיליליטר צינור המכיל microcentrifuge / 1% פתרון BSA קר 1x PBS ולשמור על הצינור על קרח. הדגימות חייבות להיות מעובד בשעה 2.
- לאחר הנתיחה של כל אצווה היא מלאה, לשטוף את הצלחת לנתיחה עם מים מזוקקים פעמיים כדי לשטוף את השמאל על פסולת. התחל לנתח את המנה הבאה של midguts (חזור על שלבי 2.1-2.7). לנתח קבוצות רבות ככל האפשר בתוך 2 שעות, ולאחר מכן המשך לשלב 3.1.
3. עיכול של רקמת המעי לתאי קציר לFAC מיון
- הסר את / 1% פתרון BSA 1x PBS מmidguts ולהוסיף 500 μl של 0.5% פתרון טריפסין-EDTA לכל דגימה.
- מערבולת היטב במשך 20 שניות ודגירת הדגימות על ידי נדנדה עדינה / מסתובבות בסל"ד 20 בטמפרטורת חדר למשך 25-30 דקות.
- מערבולת שוב לאחר כ 30 דקות ולתת את כיור רקמת midgut שלם לחלק התחתון של הצינור. מוציא בזהירות את התאים שנמצאים בהשעיה עם הזכוכית פיפטה פסטר בערה ולסנן אותם באמצעות ניילון 35 מיקרומטר רשת לתוך צינור microcentrifuge טרי 1.5 מיליליטר.
- ספין התאים למטה ב 100 XG במשך 5 דקות על 4 מעלות צלזיוס. שימו לב, כאשר מתחילים לעכל, תא גלולה אולי לא יהיה גלוי בהתחלה, אבל יהיה גלוי כמו רקמת התקציר מתקדמת.
- להעביר בזהירות את פתרון טריפסין חזרה לצינור המדגם המקורי המכיל את רקמת midgut שלמה שנותרה. הימנע מהעברת תאים רבים מדי מהגלולה.
- בעדינות מחדש להשעות את התא גלולה ב400 μl של BSA / 1% הקרים 1x PBS. שמור את צינורות microcentrifuge המכילים את התאים ניתקו על קרח ולכסות את הצינורות בנייר אלומיניום כדי להגן על התאים מפני אור.
- מערבולת פתרון טריפסין המכיל את הרקמה שנותרה ללא פגע midgut שוב ומניח את הדגימותעל הנדנדה למשך 30 דקות נוספות בטמפרטורת חדר.
- חזור על שלבים 3.3 ל3.4.3 עד שכל רקמת midgut כבר מעוכלים. מערבבים את התאים ניתקו מכל צינורות microcentrifuge לתוך צינור microcentrifuge אחד. זה עשוי לדרוש צעד צנטריפוגה כמו ב3.4, מאז הנפח של כל השעיות התא בשילוב יכול שיעלה על 1.5 מיליליטר. שמור את ההשעיה התא על קרח ולהגן על התאים מפני אור.
- ספין התאים ניתקו את ב 100 XG במשך 5 דקות ב 4 מעלות צלזיוס. מוציא בזהירות כמה שיותר supernatant ככל האפשר עוזב כ 50-100 μl של / 1% פתרון BSA 1x PBS בצינור microcentrifuge. בעדינות resuspend התאים ניתקו ב800 μl 1x BSA / 1% PBS המכיל Sytox (1: 20,000).
- מעביר את ההשעיה התא ל5 מיליליטר צינור פלקון מסביב לתחתית ידי סינון התאים דרך מסננת תא כובע הצמד (רשת ניילון 35 מיקרומטר). תמיד לשמור על דגימות תאים על קרח ומוגן מפני אור. התאים מוכנים כעת ללהיות מסודר.
- פיפטה 600 μl של פתרון RNAlater לכל צינור microcentrifuge שלתאים ימוינו לבידוד RNA שלאחר מכן. עבור יישומים במורד הזרם אחרים ניתן לאסוף התאים בפתרון אחר, למשל בPBS סטרילי.
4. FAC מיון לבודד תאי גזע מעיים
- הפעל את מכשיר cytometry זרימה לפחות שעה אחת לפני המיון. ודא כי מערכת fluidic היא ללא בועות אוויר.
- בחר את גודל נחיר 70 מיקרומטר להזריק את התאים לתוך זרם נדן הנוזל.
- התאם את המשרעת של זרם נוזל הליבה, כך שערך הפער תואם את ערך הייחוס (6-7, בעת שימוש בנחיר 70 מיקרומטר). בואו זרם נוזל הליבה לייצב לפני שמתחיל למיין.
- עקוב צו זה כאשר בתחילה קביעת הפרמטרים למיון:
- טען את התאים ניתקו מתקבלים מאומץ מהסוג בר. ראשית, להתאים את מתחי FSC וSSCעלילת התאים במרכז עלילת הפיזור. שנית, להתאים את מתח FITC (GFP), כך שכל התאים הם זממו מתחת ל -10 2 על ציר X לוגריתמית. הגדרת פרמטר FITC קובע את הגבול לautofluorescence.
- טען את התאים ניתקו מתקבלים מאומץ מהסוג בר עם Sytox הוסיפו. התאם את ערך פסיפיק בלו המתח ושער לזהות ותאי מגורים נפרדים מהתאים מתים, Sytox חיוביים בכחול האוקיינוס השקט לעומת FSC-עלילת פיזור.
- טען את התאים ניתקו מתקבלים מESG -Gal4, קו לטוס UAS-GFP ללא Sytox ולהתאים את מתח FITC כדי להבטיח שכל תאי GFP חיובי הם זממו בתוך עלילת הפיזור.
- טען את התאים ניתקו מתקבלים מESG -Gal4, קו לטוס UAS-GFP עם Sytox הוסיף. התאם את ערך פסיפיק בלו המתח ושער לזהות ותאי מגורים נפרדים מתאי Sytox-חיוביים (P1 שער) המת,.
- הגדר את SSC-וFSC-שער לזהות GFP-תאים חיוביים (המבוססים על עלילת היסטוגרמה) כפי שנקבע על ידי גודל והגרעיניות (P2 שער).
- הגדר את שער FSC-H וFSC-W לזהות ולהוציא כפילויות תא GFP חיובי המבוססות על הגודל (P3 השער) שלהם.
- הגדר את SSC-H ושער SSC-W לזהות ולהוציא כפילויות תא GFP חיובי המבוססות על הגרעיניות (P4 השער) שלהם.
- השתמש P4 השער לתאר את תאי GFP חיובי בעלילה היסטוגרמה המציגה את מספר התאים (count) לעומת עוצמת GFP. שני שיאים שונים של תאי GFP החיובי יהיו גלויים. צור שער לכל שיא (השערים P5 וP6). שער P5 מכיל אוכלוסיית תאים המועשרת לISCs וניתן למיין בנפרד מהתאים בP6 שער.
- חזור שער במגרש קונטור כדי לוודא ששתי אוכלוסיות תאי GFP החיובי מובהקות מכילות תאי חיים (השווה עם השער P1) ותאים בגודל הנכון (השווה עם השער P2).
- למיין את התאים לתוך צינור 1.5 מיליליטר microcentrifuge המכיל 600 & #181; l של פתרון RNAlater. המיון נעשה בקצב זרימה נמוך (מקסימום. 2.0, 70 זרבובית מיקרומטר, 1,000 אירועים / sec, 70 psi) ומעסיק סוג טוהר דו-כיווני.
- לאחר המיון יושלם, המערבולת מייד התאים הממוינים לזמן קצר ולשמור על צינורות microcentrifuge על קרח עד שתמשיך עם בידוד RNA או יישומים במורד הזרם אחרים.
תוצאות
כדי להשיג בין 50,000-100,000 תאים מFAC מיון, בין 160 ו -200 midguts צריך להיות גזור. ברור שזה הזמן רב ביותר צעד של ההליך כולו. הקריקטורה שמוצגת באיור 1 א ממחישה את השלבים העיקריים של נתיחת בטן, אשר מתוארות בפירוט בפרוטוקול ניתן כאן. הליך זה יכול להיות שונה באופן אינדיבידואלי. מערכת עיכול, כל גזור מוצגת באיור 1 ב '.
כאשר כל רקמות midgut כבר מעוכל, מייד להמשיך במיון FAC. בעקבות אסטרטגית gating המתוארת בפרוטוקול מאפשר לזיהוי ומיון המוצלח של אוכלוסיית תאים מועשרת לISCs ולEBS מצעיר (איור 2) ומmidguts הישן (איור 3). שער P1 מוגדר לכלול רק תאי חיים בריאים ולשער את תאים מתים. תאים שעלילה מעל 10 3 על y-גרזן הלוגריתמיםהוא בעת שימוש בערוץ Pacific Blue מוגדרים כתאים מתים. הנקודות שעלילה מתחת ל -40 על ציר x (FSC-A) הן בעיקר פסולת ולכן גם אינן נכללות (איור 2 א). בעלילת הפיזור של SSC-לעומת FSC-התאים מופצים על בסיס הגודל והגרעיניות שלהם. לרזולוציה אופטימלית, התאים ממוקמים בעלילת הפיזור כפי שמוצגים באיור 2 על ידי התאמת מתח צינור מכפיל (PMT). במגרשי פיזור FSC-H לעומת FSC-W וSSC-H לעומת SSC-W תאים בודדים מופרדים מאגרגטים וכפילויות המבוססים על גודל (איור 2 ג) ומבוססים על גרעיניות (איור 2 ד). כאשר מתארים את התאים כלולים בP4 שער במגרש היסטוגרמה, ההפרדה ברורה של, (P5 שער) GFP-שלילי GFP הנמוך ותאי GFP גבוהים (P6 שער) גלוי (איור 2E). תאים מציגים עצמת GFP נמוכה הם קטנים ופחות גרגירים ומייצגים ISCs. תאים מציגים int GFP גבוה יותרensity הם גדולים יותר ופרטניים יותר ולייצג EBS. הפוך transcriptase (RT) -PCR לDl על cDNA מסונתז מRNA של תאים של כל אוכלוסיית GFP החיובי (P5 שערים, P6) גילה כי אות DL היא אכן חזקה יותר בתאים הקטנים יותר, GFP הנמוך מאשר ב, GFP גבוה יותר תאים (איור 2H). התאים אז היו backgated ומתואר בחלקות גובה כדי לוודא שתאי GFP נמוך (P5 שער) ו- (P6 שער) הגבוה GFP שונים בגודלם וגרעיניות (איור 2F) ועדיין בחיים (איור 2G). ראוי לציין, שתי פסגות של תאי GFP חיובי (GFP נמוך וGFP גבוה) יכולות להיות רק יפה מכובדות אם FITC הערוץ (GFP) כבר מכוילת כראוי באמצעות הבקרות מתוארות בפרוטוקול.
אותו אסטרטגית gating שימשה בעת מיון ISCs נגזר מקרבים ישנים (איור 3). מגרשי הפיזור (figur3A-D E), היסטוגרמה (איור 3E) וחלקות קווי המתאר (איור 3F, G) הן מקבילים לאלה שמוצגים באיור 2. כפי שצוין לעיל, אין סמן בתום לב כדי לזהות ISCs בmidguts הישן ולכן אין נתונים RT-PCR מוצג כאן. עם זאת, התצפית המעניינת כאן היא ששתי פסגות המכילות GFP (P5 שער) הנמוך או תאי GFP גבוהים (P6 שער) תישארנה מובהק להפריד במהלך הזדקנות. יתר על כן, מספר התאים בשיא GFP הגבוה (P6 שער) מגביר באופן משמעותי במהלך ההזדקנות, אשר בבירור מחקה את ההצטברות הידועה של EBS misdifferentiated עם גיל. השינוי ביחסם של שתי אוכלוסיות התאים גם ניתן לראות במגרשי הפיזור (השווה 3A-D איור עם איור 2 א-D) ובחלקות הגובה (השווה איור 3F, G עם איור 2F, G). מממצאים אלה אנו מסיקים כי על ידי מיון לGFPתאי -positive באמצעות FACS אנחנו יכולים להעשיר לISCs וEBS בmidguts הצעיר והמבוגרים.
כדי לאמת את טוהר ISCs המבודד וEBS, ניתוח מסוג פוסט בוצע (איור 4). חלקות היסטוגרמה של ISCs-מסודרים הפוסט וEBS (איור 4, C) מתארות purities בין 95% ו -98%.
אם ההיררכיה של קביעת פרמטרי FACS כפי שתוארו לעיל היא ורק אחרי, שתי אוכלוסיות התאים השונות (GFP נמוך, קטן וGFP גבוה, גדול יותר) יכולות כבר להבחין בעלילה פיזור GFP לעומת FSC-A (איור 5 א). שתי אוכלוסיות תאים אלה לא ניתן להבחין אם היררכיה זו התעלמה (איור 5 ב-ד).
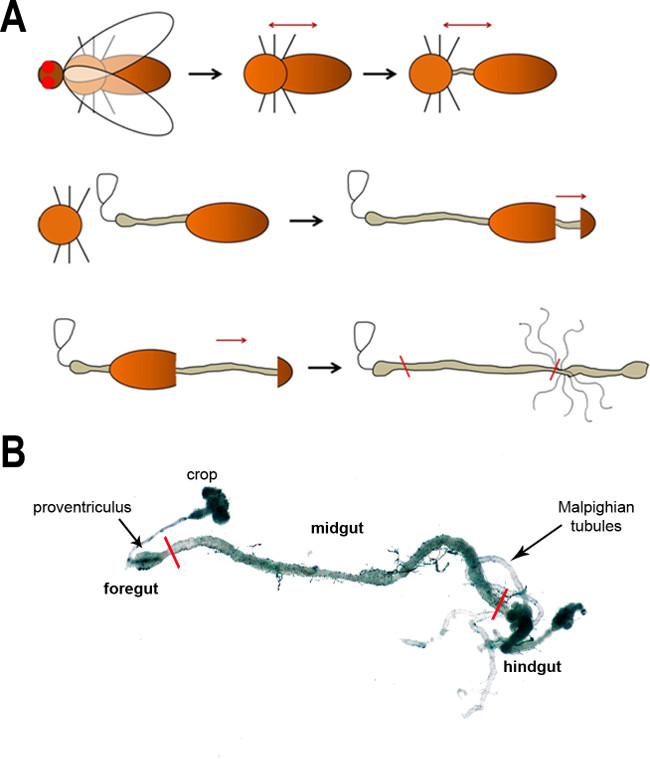
איור 1: (א) סכמטי של השלבים העיקריים של dissecting מעי הזבוב. ראשית, הראש מוסר (הסרת הכנפיים היא אופציונלית) ואחריו הפרדה של בית החזה והבטן לחשוף את הבטן. הבטן תשוחרר לאחר מכן מחלל הגוף בשלבים הבאים. החיצים השחורים מראים את ההתקדמות של נתיחה, ואילו החצים האדומים הכהים מסמלים את כיוון המשיכה. הקווים האדומים בתמונה האחרונה מצביעים גבולות הקדמי והאחוריים של midgut. תמונת מיקרוסקופ אור של מעי הזבוב הבוגר (B). האזורים העיקריים והתכונות אנטומיים מסומנים. קווים אדומים מסמנים את גבולות midgut.
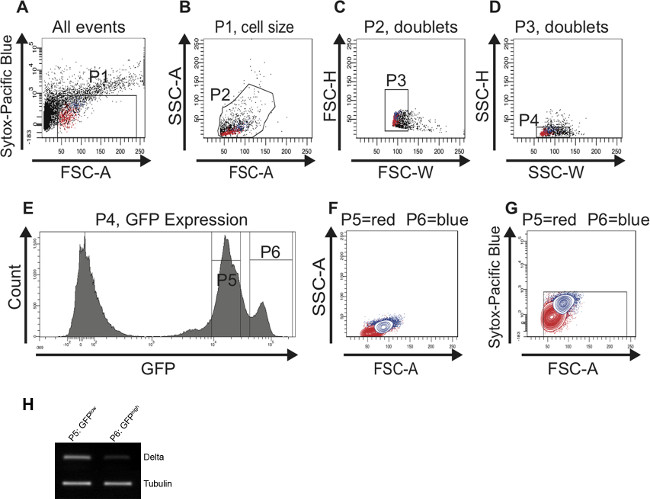
איור 2:. תאי FAC מיון אסטרטגיה לזהות ולבודד ISCs וEBS מmidguts הצעיר (7 ימים) להדמיה טובה יותר, המייצגים ISCs מודגשים באדום ותאים המייצגים EBS מודגשיםבכחול במגרשי פיזור (AD) ובחלקות הגובה (F, G). (א) שער P1 מוגדר שלא לכלול תאים מתים, Sytox חיובי זממו מעל 10 3 על ציר y לוגריתמים. הסף של FSC-מוגדר ב 40 גם לא לכלול תאים מתים ופסולת. תאים (B) היו סגור לFSC-וSSC-לבחור תאים בהתאם לגודל וגרעיניות (P2 שער). עלילת היסטוגרמה (E) שימשה במקביל לזיהוי תאי GFP החיובי בFSC-מול SSC-עלילת פיזור (B). (C, D) מגרשי הפיזור FSC-H לעומת FSC-W ו SSC-H לעומת SSC-W לשמש כדי להסיר אגרגטים וכפילויות ובחר לsinglets (P3 שער בC ו- P4 השער בD). (E) עלילת ההיסטוגרמה מציגה את מספר התאים ובעוצמתם GFP. שני שיאים, (P5 שער) GFP הנמוך ו( P6 שער) הגבוה GFP ניתן להבחין. תאים (F, G) היו מגודרת חזרה במגרש קונטור כדי לוודא שתא GFP החיובי המובהק שני populatיונים הם בגודל הנכון (F) ומכילים תאי חיים (G). (H) Reverse transcriptase (RT) -PCR לDl על cDNA מסונתז מRNA מבודד מהתאים הנמצאים בשיא הראשון (P5 השער) וב שיא שני (P6 שער), בהתאמה. יותר ביטוי Dl ניתן היה לזהות בתאים הנמצאים בP5 שער מול P6 שער. טובולין שימש כביקורת טעינה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
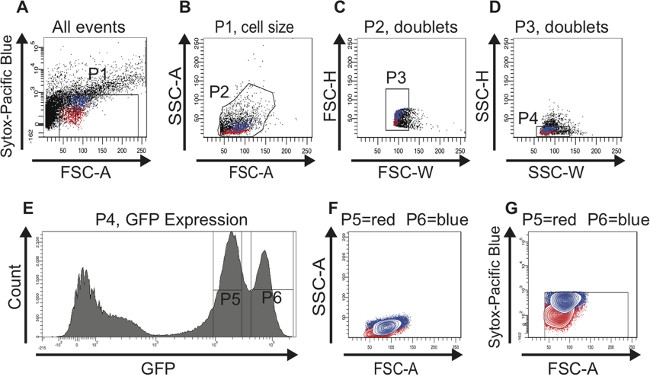
איור 3: FAC מיון אסטרטגיה לזהות ולבודד ISCs וEBS מישן (60 ימים) midguts להדמיה טובה יותר, תאים המייצגים ISCs מודגשים באדום ותאים המייצגים EBS מודגשים בכחול במגרשי הפיזור (AD) וב. חלקות גובה (F, G). (א) שער P1 מוגדר שלא לכלול תאים מתים, Sytox החיוביים זממו מעל 10 3 על ציר y לוגריתמים. הסף של FSC-מוגדר ב 40 גם לא לכלול תאים מתים ופסולת. ראוי לציין, העלייה תלוית גיל בתאי GFP החיובי גדולים יותר היא כבר ברורה בחלקה זו. תאים (B) היו סגור לFSC-וSSC-לבחור תאים בהתאם לגודל וגרעיניות (P2 שער). עלילת היסטוגרמה (E) שימשה במקביל לזיהוי תאי GFP החיובי בFSC-מול SSC-עלילת פיזור (B). (C, D) מגרשי הפיזור FSC-H לעומת FSC-W ו SSC-H לעומת SSC-W לשמש כדי להסיר אגרגטים וכפילויות ובחר לsinglets (P3 שער בC ו- P4 השער בD). (E) עלילת ההיסטוגרמה מציגה את מספר התאים ובעוצמתם GFP. שני שיאים, (P5 שער) GFP הנמוך ו( P6 שער) הגבוה GFP ניתן להבחין. ראוי לציין, גבוה GFP אוכלוסיית תאים המכילים תאים גדולים יותר גדל iמספר n במהלך ההזדקנות. (F, G) תאים חזרו מגודרת בעלילה קווי המתאר כדי לוודא ששתי אוכלוסיות תאי GFP החיובי מובהקות הן בגודל הנכון (F) ומכילות תאי חיים (G). אנא לחץ כאן ל להציג גרסה גדולה יותר של דמות זו.
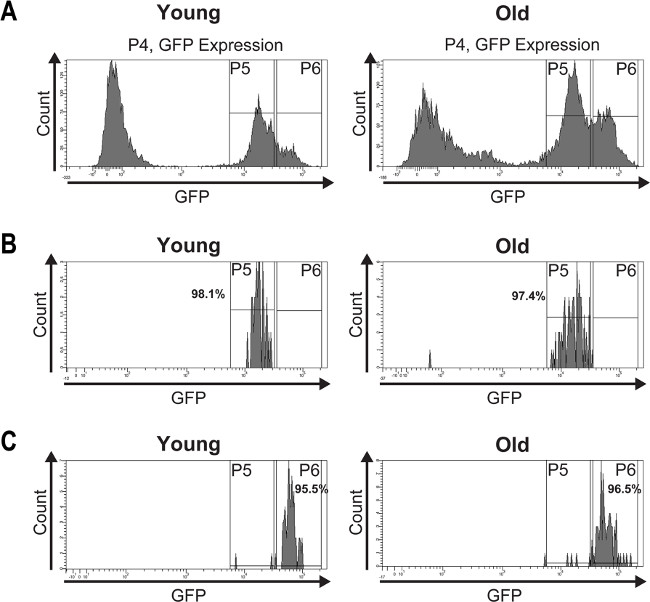
איור 4:. Midguts (60 ימים) ניתוח שלאחר מין בוצע על מנת לקבוע את הטוהר של ISCs המבודד וEBS תאים () GFP חיוביים מצעיר (7 ימים) וישן היה FAC מסודרים וחלקות ההיסטוגרמה מראות את התפלגותם לשתי פסגות המבוססים על עוצמת GFP. (ב) הניתוח שלאחר הסוג מדגים את טוהר ISCs המבודד מmidguts הצעיר והמבוגרים שהוא> 97%. (ג) הניתוח שלאחר הסוג של E הממוינתארוחת בוקר מmidguts הצעיר ומבוגרת תערוכות טוהר> 95%. הזיהומים קלים עשויים לנבוע ממרווית הקרינה או תאי GFP להביע פגומים מכאני הנגרמים על ידי מחדש מיון התאים. אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
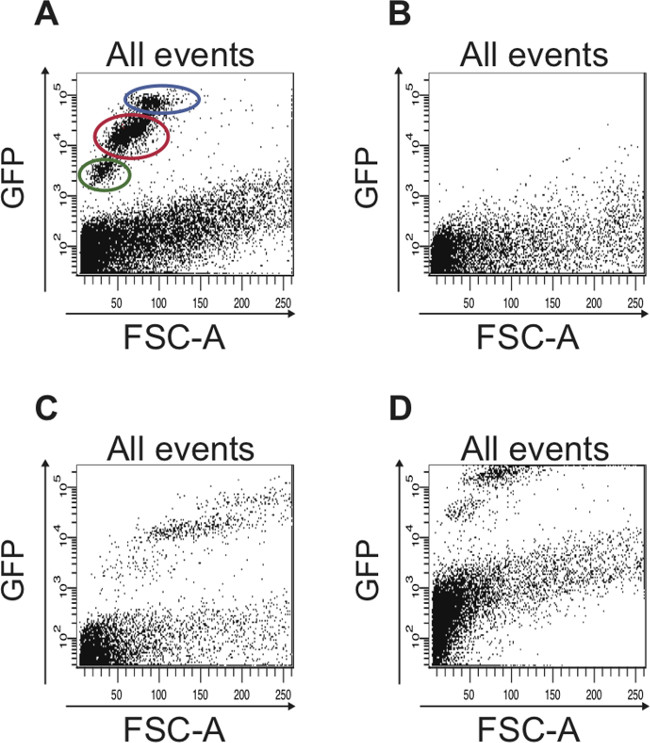
איור 5: דוגמאות למגרשי פיזור המציגים נתונים FACS הכי מוצלחים, אשר נתפס כאשר פרמטרי FACS לא מוגדרים כהלכה () פרופיל הנציג FACS של כל התאים כאשר פרמטרי FACS נקבעו כראוי מבוסס על הבקרות מתוארות בפרוטוקול.. אוכלוסיית התאים המכילה ISCs הוא מוקף בעיגול אדום ואוכלוסיית התא המכילה EBS היא מוקפת בעיגול כחול. התאים מוקפים בעיגול הירוק הם תאים מתים שיש לי autofluorescence חזק בהשוואה לתאי חיים, שהם זממו מתחת ל -10 3 על ציר y לוגריתמים. (ב) עלילת הפיזור מתארת תוצאה אופיינית מתקבלת כאשר מכשיר FACS לא מכויל. אין GFP חיובי תאים מזוהים. (ג) אם FSC לא מוגדר כראוי, אוכלוסיות תאי GFP החיובי השונות אינן מזוהות. (ד) אם FITC הערוץ (GFP) אינו מותאם כהלכה, רוב GFP- תאים חיוביים להיות מסודרים לא זממו בעלילת הפיזור אלא לאורך הקצה העליון של העלילה. כמו כן, בעלילה שמוצגת כאן, הגבול עבור autofluorescence לא הותאם, ומכאן תאים שעלילה מעל 10 2 על ציר y הלוגריתמים הם autofluorescent למעשה ויכולים להיות טועה כמו תאי GFP חיובי.
Discussion
הפרוטוקול הציג מתאר שיטה לבודד ISCs מmidguts תסיסנית הצעיר והמבוגר ישנים, אשר לאחר מכן ניתן להשתמש עבור ניתוחים מולקולריים נוספים כגון רצף של הדור הבא. מיון FAC של אוכלוסיית תאי GFP החיובי מESG -Gal4, קו לטוס UAS-GFP כבר הושג על ידי מספר קבוצות 21,22. עם זאת, עד עכשיו הנוכחות של שתי פסגות שונות של תאי GFP חיובי כבר התעלמה או או המעיטו. אנו מראים כי הפרדה זו מייצגת לא רק את שתי אוכלוסיות שונות של סוגי תאים (ISCs וEBS), אלא גם ששתי הפסגות של תאי GFP החיובי מובהק להישאר נפרדות במהלך הזדקנות. תצפית זו היא רלוונטית ובעל ערך לחוקרים המעוניינים בלימודים בתאי גזע או אב במהלך הזדקנות מאוד. בידוד של ISCs מmidguts הישן כבר הקשו על ידי העובדה שאין שילוב סמן מולקולרי לזהות ISCs בmidgut גילאים. הסמן היחיד שunambiguously מזהה ISCs בmidgut ישנה הוא phospho-histone3 (PH3), מאז ISCs הם תאי החלוקה רק בmidgut 12,13. עם זאת, PH3 הוא סמן לא מתאים לבודד ISCs מאז מספר חלוקת תאי גזע בכל נקודת זמן נתון הוא נמוך מדי על מנת לקבל סכום מכובד של ISCs לניתוחים שלאחר מכן. ESG קו זבוב -Gal4, UAS-GFP הוא קו הזבוב הנפוץ ביותר בשימוש על ידי חוקרים הלומדים ISC פונקציה, תחזוקה ובידול. הידע הנוכחי שלנו על תקנה המולקולרית של הומאוסטזיס ISCs מבוסס על מחקרים שבהם מולקולות ספציפיות ומסלולי איתות כבר מניפולציה (שנסקר ב7). מכאן, אנחנו עדיין חסרים את הידע על השינויים המולקולריים אנדוגני המתרחשים במהלך הזדקנות. השיטה זאת תיארה סוגרת את הפער הזה והוא מבוסס על העובדה שיכול להיות מבודד ISCs מבוסס על העצמה, גודל, הגרעיניות וGFP מmidguts המבוגר בכל נקודה במהלך הזדקנות זמן.
בעודההקמה וייעול שיטה זו מצאנו את השלבים הבאים כדי להיות קריטיים לתוצאה אמינה. כ -200 אומץ צריך להיות גזור על מנת לקבל כמות טובה של ISCs למיון FAC. המהירות של נתיחה חיונית ותלויה במנהגו של הפרט. אדם מאומן יכול לנתח 40 אומץ בתוך 20-30 דקות. מאז GFP בא לידי ביטוי גם בtubules Malpighian בESG -Gal4, UAS-GFP קו זבוב, זה הכרחי כדי להסיר לחלוטין את tubules Malpighian מmidgut. Midguts גזור חייב להיות כל הזמן בסביבה קרירה, כדי למנוע ניוון רקמות ולצמצם את פעילות RNAse ברקמה. לכן, midguts גזור חייב להיות מועבר מהצלחת לנתח לתוך צינורות microcentrifuge המכילים פתרון BSA / 1% קרים 1x PBS לאחר מרבי של 20-30 דקות ושמר על קרח. עם זאת, לא צריך להשאיר midguts גזור על קרח במשך יותר מ 2 שעות לפני תחילת ניתוק הרקמה עם טריפסין. Effici ביותרגישת ent היא לנתח קבוצות רבות של זבובים ככל האפשר בתוך 2 שעות אלה, ולאחר מכן להתחיל טריפסין לעכל לקבוצות אלה. אם יש צורך יותר midguts, הם יכולים להיות גזורים בזמנים הדגירה של טריפסין לעכל.
למרות טריפסין הוא אנזים חזק מאוד ויכול להיות השפעה מזיקה על תאים, אנחנו עדיין מתקבלים מספיק חיים, תאים בריאים למיון FAC שלאחר מכן. הצעד המרכזי של הליכנו שמאפשר הבידוד של תאים שלמים הוא שהתאים ניתק מוסרות מפתרון טריפסין כל 30 דקות. אם midguts גזור הם טופחו במשך 2 וחצי שעות בטריפסין המכיל פתרון בטמפרטורת חדר, ראה גידול 20-30% בתאים מתים, Sytox-חיוביים. יש לציין כי פתרון טריפסין אנו משתמשים מכיל EDTA. הנוכחות של EDTA כנראה מאפשרת התפוררות רקמה על ידי chelating יוני סידן ומגנזיום הנחוץ לתפקוד התקין של מולקולות חוץ-תאיות.
צעדים החשובים ביותר לסוג הצלחת ISCs מבטן צעירה ומבוגרת הם ההגדרות הראשוניות המתאימות של FACS ופרמטרי gating באמצעות הפקדים תיארו והבאים היררכית מיון ספציפית. אנחנו ביצענו את FAC מיון על ARIA II Flow Cytometer (תוכנת FACSDiva). חשוב שהמכשיר מופעל לפחות שעה אחת לפני המיון לחמם את הלייזרים. ראוי לציין, כאשר מיון FAC של ISCs מתבצע בפעם הראשונה, את הפרמטרים למיון ולצורך פיצוי שנקבעו באמצעות הפקדים האמורים: (1) ניתק תאים מסוג בר (למשל w 1118) midguts תסיסנית ללא תוספת של Sytox - הגדרת פרמטר זה (שלב 4.4.1) מונעת מיון תאים על בסיס autofluorescence; (2) ניתק תאים מסוג בר (למשל w 1118) midguts תסיסנית עם Sytox הוסיף - הגדרת פרמטר זה(שלב 4.4.2) מאפשר הפרדה מתות מתאי חיים (יש לי תאים מתים autofluorescence גבוה ויכולים לזהם תאי GFP חיובי מסודרים); (3) ניתק תאים מmidguts של ESG -Gal4, קו UAS-GFP לטוס ללא Sytox - הגדרת פרמטר זה (שלב 4.4.3) מבטיח כי כל תאי GFP חיובי הם זממו בתוך עלילת הפיזור. אם פרמטרים אלה אינם מוגדרים כהלכה, אוכלוסיית התאים הממוינת תהיה ככל הנראה מכילה תאים מתים ופסולת (איור 5 ב, ג), תאי GFP חיובי רבים יחסרו (איור 5D) ושתי פסגות נפרדות לתאי GFP חיובי כ ראו בעלילת היסטוגרמה (איור 2E ואיור 3E) לא יזוהו. ברגע שFACS ופרמטרי gating נקבעו, המכשיר מכויל ומוכן כדי למיין תאים מ-GAL4 ESG קו זבוב UAS-GFP,. מאז ניתן לשמור את הפרמטרים האלה, את כל עתיד מיון הפעלות לISCs וEBS מESG -GAL4, UAS-קו זבוב GFP יכול להתחיל משלב 4.5. למרות שהבחירה במצב "הטוהר" וביצוע טוהר דו-כיוונית סוג מקטינה את מספר התאים הממוינים, היא מאפשרת להחמרה גבוהה מיון (שלב 4.6 ואיור 4, C). ראוי לציין, את היתרון של שימוש Sytox במקום יודיד propidium לתייג תאים מתים הוא שיש רק זליגה נמוכה לערוץ FITC (GFP), שהופך אותו קל, כדי לפצות על הגלישה.
השיטה להעשרה ולISCs EBS שלנו, בהתאמה, מבוססת על מיון התאים על פי רמות הביטוי של GFP שונים. זה יכול להיות שבזמן הזדקנות EBS misdifferentiated גם להביע GFP ברמה נמוכה יותר ויכול להיות טועה כמו ISCs. עם זאת, מאז התאים הממוינים גם נבדלים בגודל ובגרעיניות, אנו מאמינים כי אסטרטגית המיון שלנו היא המתאים ביותר למועד זה כדי להעשיר לISCs וEBS. כמו כן, ידוע כי התאים בmidgut הזדקנות שמירה על זהות ISC גרעין קטן 15. כדי לקבל יותר בהיר על זהותו של התאים הממוינים, אפשר למיין תאים מקו מהונדס זבוב שנושא ESG -GAL4, UAS-GFP וtransgene כתב איתות Notch. מאז Notch הוכח להיות פעיל רק בEBS 12,13, ISCs מבודד מmidgut צעירה יהיה שלילי לכתב Notch, ואילו EBS יהיה חיובי לכתב Notch. עם זאת, במהלך הזדקנות איתות Notch הופכת חריגה ברקמת midgut. לכן, הוא צריך להיבדק אם זה ניסיון להגדיר הוא אכן יותר אמין להבחין בין ISCs וEBS מבודד מmidgut ישנה.
יש לנו כבר מועסקים בגישה זו לניתוח השוואתי של transcriptome ISCs מmidguts הצעיר והמבוגרים וזיהינו מספר גורמים אשר מוסדרים באופן דיפרנציאלי במהלך הזדקנות (unpub. Observ.). בנוסף, שיטה זו מאפשרת לניתוח הבדלים בביטוי גנים בין ISCs וEBS. חקירה כזוs תספק תובנה השינויים המולקולריים הראשוניים המתרחשים בתא נכנס לתהליך הבידול. כמו כן, הבידוד של EBS במהלך ניתוחי הזדקנות ולאחר מכן ישפוך אור על השינויים המולקולריים של misdifferentiation מושרה גיל. יתר על כן, שיטה זו יכולה להיות משולבת עם כלים גנטיים אחרים המשמשים בדרוזופילה ללמוד תפקוד גן. לסיכום, שיטה זו מציעה גישה משוחדת לחקור מאפיינים ושינויים של ISCs וEBS מולקולריים במהלך הזדקנות. זה הוא כלי רב ערך שיאפשר חקירה של מנגנוני הזדקנות בתאי גזע ואב למבוגרים.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
We are grateful to Gabriele Allies for excellent technical assistance. We thank the University Ulm Medical Faculty for the use of the FACS Core Facility and the Institut für Molekulare und Zelluläre Anatomie for using the confocal microscope. We thank S. Hayashi for the esg-Gal4, UAS-GFP fly line. This project is funded by the Federal Ministry of Education and Research (BMBF, Forschungskern SyStaR). A.T. is supported by SFB 1074 (Project A2). A.T. and G.A. are supported by the Deutsche Forschungsgemeinschaft (DFG, FE578/3-1). H.M.T. is a member of the International Graduate School in Molecular Medicine Ulm (GSC 270).
Materials
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Forceps: Dumont, Inox Biologie #5 | Fine Science Tools | 11252-20 | |
| SefarNitex 03-150um/38 (35 µm nylon mesh) | Sefar | 3A03-0150-102-00 | |
| Falcon 5ml Round Bottom Polystyrene Test Tube with Cell Strainer Snap Cap | Corning | 352235 | |
| Polymax 1040 | Heidolph | 543-42210-00 | |
| Albumin from bovine serum (BSA) | Sigma | A4503-50G | |
| 0.5% Trypsin-EDTA | Invitrogen | 15400-054 | Trypsin obtained from a different company most likely has a different activity and the duration of the trypsin digest has to be adjusted accordingly. |
| SYTOX Blue Dead Cell Stain for flow cytometry | Life Technologies | S34857 | |
| RNAlater Stabilization Solution | Life Technologies | AM7023 | other solutions, e.g. Trizol can be used for subsequent RNA isolation |
| FACSAria II cell sorter | Becton Dickinson | Turn on one hour prior to sorting |
References
- Jones, D. L., Rando, T. A. Emerging models and paradigms for stem cells ageing. Nat. Cell Biol. 13 (5), 506-512 (2011).
- Otín, C., Blasco, M. A., Partridge, L., Serrano, M., Kroemer, G. The hallmarks of aging. Cell. 153 (6), 1194-1217 (2013).
- Signer, R. A., Morrison, S. J. Mechanisms that regulate stem cell aging and life span. Cell Stem Cell. 12 (2), 152-165 (2013).
- Iliadi, K. G., Knight, D., Boulianne, G. L. Healthy Aging – Insights from Drosophila. Front. Physiol. 3, 106 (2012).
- Biteau, B., Jasper, H. EGF signaling regulates the proliferation of intestinal stem cells in Drosophila. Development. 138 (6), 1045-1055 (2011).
- Jasper, H., Jones, D. L. Metabolic regulation of stem cell behavior and implications for aging. Cell Metab. 12 (6), 561-565 (2010).
- Biteau, B., Hochmuth, C. E., Jasper, H. Maintaining tissue homeostasis: dynamic control of somatic stem cell activity. Cell Stem Cell. 9 (5), 402-411 (2011).
- Wang, L., Jones, D. L. The effects of aging on stem cell behavior in Drosophila. Exp. Gerontol. 46 (5), 340-344 (2011).
- Lucchetta, E. M., Ohlstein, B. The Drosophila midgut: a model for stem cell driven tissue regeneration. Wiley Interdiscip. Rev. Dev. Biol. 1 (5), 781-788 (2012).
- Ayyaz, A., Jasper, H. Intestinal inflammation and stem cell homeostasis in aging Drosophila melanogaster. Front. Cell Infect. Microbiol. 3 (98), (2013).
- Jiang, H., Patel, P. H., Kohlmaier, A., Grenley, M. O., McEwen, D. G., Edgar, B. A. Cytokine/Jak/Stat Signaling Mediates Regeneration and Homeostasis in the Drosophila Midgut. Cell. 137 (7), 1343-1355 (2009).
- Ohlstein, B., Spradling, A. The adult Drosophila posterior midgut is maintained by pluripotent stem cells. Nature. 439, 470-474 (2006).
- Micchelli, C. A., Perrimon, N. Evidence that stem cells reside in the adult Drosophila midgut epithelium. Nature. 439, 475-479 (2006).
- Ohlstein, B., Spradling, A. Multipotent Drosophila intestinal stem cells specify daughter cell fates by differential notch signaling. Science. 315 (5814), 988-992 (2007).
- Biteau, B., Hochmuth, C. E., Jasper, H. JNK Activity in Somatic Stem Cells Causes Loss of Tissue Homeostasis in the Aging Drosophila Gut. Cell Stem Cell. 3 (4), 442-455 (2008).
- Choi, N. H., Kim, J. G., Yang, D. J., Kim, Y. S., Yoo, M. A. Age-related changes in Drosophila midgut are associated with PVF2, a PDGF/VEGF-like growth factor. Aging Cell. 7, 318-334 (2008).
- Park, J. S., Kim, Y. S., Yoo, M. A. The role of p38b MAPK in age-related modulation of intestinal stem cell proliferation and differentiation in Drosophila. AGING. 1 (7), 637-651 (2009).
- Berger, C., Harzer, H., Burkard, T. R., Steinmann, J., vander Horst, S., Laurenson, A. S., Novatchkova, M., Reichert, H., Knoblich, J. A. FACS purification and transcriptome analysis of Drosophila neural stem cells reveals a role for Klumpfuss in self-renewal. Cell Rep. 2 (2), 407-418 (2012).
- Harzer, H., Berger, C., Conder, R., Schmauss, G., Knoblich, J. A. FACS purification of Drosophila larval neuroblasts for next-generation sequencing. Nat. Protoc. 8 (6), 1088-1099 (2013).
- Yagi, Y., Hayashi, S. Role of the Drosophila EGF receptor in determination of the dorsoventral domains of escargot expression during primary neurogenesis. Genes Cells. 2 (1), 41-53 (1997).
- Amcheslavsky, A., Ito, N., Jiang, J., Ip, Y. T. Tuberous sclerosis complex and Myc coordinate the growth and division of Drosophila intestinal stem cells. J. Cell Biol. 193 (4), 695-710 (2011).
- Dutta, D., Xiang, J., Edgar, B. A. RNA expression profiling from FACS-isolated cells of the Drosophila intestine. Curr. Protoc. Stem Cell Biol. 13 (27), (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved