Method Article
Isoler intestinaux cellules souches de l'adulte
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Understanding the endogenous molecular changes in adult stem cells during aging requires isolating the cells of interest. The method described here presents a simple and robust approach to enrich for and isolate Drosophila intestinal stem cells and the enteroblast progenitor cells by FACS at any time point during aging.
Résumé
Aging tissue is characterized by a continuous decline in functional ability. Adult stem cells are crucial in maintaining tissue homeostasis particularly in tissues that have a high turnover rate such as the intestinal epithelium. However, adult stem cells are also subject to aging processes and the concomitant decline in function. The Drosophila midgut has emerged as an ideal model system to study molecular mechanisms that interfere with the intestinal stem cells’ (ISCs) ability to function in tissue homeostasis. Although adult ISCs can be easily identified and isolated from midguts of young flies, it has been a major challenge to study endogenous molecular changes of ISCs during aging. This is due to the lack of a combination of molecular markers suitable to isolate ISCs from aged intestines. Here we propose a method that allows for successful dissociation of midgut tissue into living cells that can subsequently be separated into distinct populations by FACS. By using dissociated cells from the esg-Gal4, UAS-GFP fly line, in which both ISCs and the enteroblast (EB) progenitor cells express GFP, two populations of cells are distinguished based on different GFP intensities. These differences in GFP expression correlate with differences in cell size and granularity and represent enriched populations of ISCs and EBs. Intriguingly, the two GFP-positive cell populations remain distinctly separated during aging, presenting a novel technique for identifying and isolating cell populations enriched for either ISCs or EBs at any time point during aging. The further analysis, for example transcriptome analysis, of these particular cell populations at various time points during aging is now possible and this will facilitate the examination of endogenous molecular changes that occur in these cells during aging.
Introduction
Une conséquence inévitable du vieillissement est la capacité décroissante des tissus et des organes de rester fonctionnelle. Les cellules souches adultes sont essentiels pour maintenir l'homéostasie tissulaire et la fonctionnalité de l'organe, mais comme organismes âge, les cellules souches connaissent également une baisse de leur comportement biologique. Ceci est particulièrement préjudiciable aux tissus qui ont un taux de rotation élevé, tels que l'épithélium intestinal. Caractéristiques de cellules souches âgées incluent des dommages génomique, mécanismes de réparation douteux, la réglementation altération du cycle cellulaire et de voies de signalisation misregulated, tous qui affectent le comportement des cellules souches normales (revue dans 1-3). En manipulant les voies de signalisation spécifiques ou abattre des gènes spécifiques, nous avons acquis un aperçu de leurs rôles dans la régulation et le maintien de comportement des cellules souches normales. Comme la plupart de ces expériences sont des approches de molécules candidates, nous avons très peu de connaissances sur les changements moléculaires endogènes qui se produisent dans les cellules souches au coursle vieillissement. Une façon d'aborder cette question est de comparer le transcriptome des jeunes par rapport aux cellules souches anciennes pour identifier des molécules dont le profil de l'expression change de manière significative au cours du vieillissement. Malheureusement, les défis biologiques et techniques ont entravé notre progrès concernant cette approche jusqu'à présent.
Drosophila melanogaster est un organisme modèle très approprié d'étudier le vieillissement car il a une courte durée de vie (environ 60-70 jours) et des expositions de vieillissement phénotypes (revue dans 4). En outre, le processus de vieillissement chez la drosophile peut être accélérée par la température. En gardant les mouches à 29 ° C, un phénotype ans dans le tissu intestinal peut déjà être observée après 15 jours 5. En outre, la drosophile est prête pour une multitude de manipulations génétiques. En particulier, l'intestin moyen Drosophila a émergé comme un excellent modèle pour étudier l'influence des différentes voies de signalisation et les défis environnementaux surla biologie des cellules souches intestinales (CSI) au cours du vieillissement (revue dans 10/06). L'épithélium intestinal Drosophila a un taux de rotation élevé et est renouvelé toutes les deux semaines chez les femelles et environ une fois par mois chez les hommes 11. CSI résidant dans l'intestin moyen Drosophila ont la capacité de se diviser et de produire une ISC auto-renouvellement et une cellule post-mitotique progéniteur appelé enteroblast (EB) 12,13. L'EB différencie en soit un entérocyte d'absorption ou une cellule entéroendocrine sécrétoire. À ce jour, la seule combinaison de marqueurs qui marque clairement une ISC est l'expression de l'escargot du facteur de transcription (ESG) et le ligand Notch Delta (Dl) 14. Toutefois, cela ne est vrai pour un intestin jeune et saine. Au cours du vieillissement, l'épithélium de l'intestin moyen est caractérisé par une augmentation de la prolifération de 15 à 17 ISC. De plus, la signalisation Notch aberrante perturbe la décision de devenir des cellules filles ISCet induit misdifferentiation d'EBS 15. Il en résulte une accumulation de cellules qui sont actives pour la signalisation Notch et co-expriment ESG et Dl, Dl rendant ainsi l'expression insuffisante pour identifier bona fide des cellules souches dans un intestin moyen vieilli. La difficulté d'identifier les vrais CSI a nui à la capacité d'examiner les changements endogènes dans CSI vieillissement jusqu'à présent.
Nous avons abordé cette question en prenant avantage de l'ESG -Gal4, UAS-GFP ligne de mouche transgénique dans lequel le niveau d'expression de la GFP dans CSI et EBS est intrinsèquement différent et reste différente tout au long vieillissement. Une approche similaire a été décrite pour l'isolement des neuroblastes et les neurones 18,19 larvaires. Estomacs de jeunes et vieux ESG -Gal4, vol d'UAS-GFP ont été disséqués et dissociés en cellules individuelles. Les cellules ont ensuite été triées pour les cellules positives pour la GFP en utilisant le tri de cellules activé par fluorescence (FACS). Fait intéressant, le triés GFP-positives caunes répartis en deux pics distincts en fonction de l'intensité de la fluorescence de la GFP (GFP GFP élevé et faible). En outre, la distribution des cellules positives pour la GFP dans les deux pics aussi en corrélation avec la taille des cellules: les cellules qui présentaient une faible intensité de la GFP étaient petites et moins granulaire tandis que les cellules avec une forte intensité de GFP étaient plus grandes et plus granulaire. Cette observation suggère que les petits entrepreneurs indépendants pourraient être distingués des grands EB utilisant FACS basé sur l'intensité de la GFP et en choisissant diffusion appropriée avant (FSC) et les paramètres diffusion latérale (SSC). Curieusement, les deux pics sont restés nettement séparés au cours du vieillissement. En outre, le rapport des deux pics modifié d'une manière qui reflète les caractéristiques précitées de mésogastres vieillissement: à savoir que le nombre de grands, misdifferentiated augmentations EBS au fil du temps. A partir de ces résultats, nous concluons que par le tri des cellules GFP-positives en utilisant les paramètres FACS appropriées, nous pouvons enrichir en CSI et EBS à un point quelconque du temps du cours de vieillissement.
En résumé, nous introduisons une stratégie FACS qui permet aux chercheurs d'enrichir pour deux populations de cellules différentes, CSI et EBS, des estomacs de drosophile de tout âge et d'isoler ces cellules pour une analyse plus approfondie, comme le séquençage de prochaine génération. Cette méthode permet puissant pour étudier les mécanismes moléculaires endogènes qui sont inhérents au vieillissement dans une population enrichie de cellules souches ou progénitrices. Les données obtenues à partir de ces études seront sans aucun doute faciliter l'identification des molécules conservées qui sont importants dans le vieillissement à travers les espèces.
Protocole
NOTE: Si ce protocole est utilisé pour la première fois à isoler CSI par AEC tri, les commandes suivantes sont obligatoires afin de mettre d'abord les paramètres de FACS correctement: Les cellules dissociées de type sauvage (par exemple W 1118) de drosophile estomacs sans Sytox. Les cellules dissociées de type sauvage (par exemple w 1118) de mésogastres Drosophila avec Sytox (voir l'étape 3.6). Les cellules dissociées de mésogastres de la, ligne de mouche UAS-GFP ESG -Gal4 sans Sytox.
1. Préparation des solutions et vaisselle pour Gut Dissection
- Préparer 4-6 flacons contenant chacun 40 femmes contenant oiseau de l'ESG -Gal4, ligne de mouche UAS-GFP.
- Partir d'une solution 10x PBS boursier préparer 500 ml 1x PBS (1,8 mM NaH 2 PO 4 · H 2 O, 8,4 mM Na 2 HPO 4 · 2H 2 O, 175 mM de NaCl, ajuster le pH à 7,4).
- Préparer un 3.5% de solution d'agarose dans du PBS 1x (3,5 g d'agarose de qualité d'électrophorèse dans 100 ml de 1 x PBS). Préparer plaques de dissection en versant cette solution dans des boîtes de Pétri (diamètre 8,5 cm) pour couvrir le fond. La couche d'agarose empêche d'endommager les pointes de la pince lors de la procédure de dissection. Après que le gel se est solidifié stocker les plaques de dissection à 4 ° C.
- Préparez 300 ml de PBS 1x + 1% BSA frais avant de disséquer et de placer la bouteille sur la glace ou à 4 ° C.
- Allumez centrifugeuse et le laisser refroidir à 4 ° C.
- Flamber les conseils de deux pipettes Pasteur en verre pour lisser les bords.
- Nettoyer les deux paires de pinces et une lame de rasoir avec 70% d'éthanol.
- Placez quatre à six 1,5 ml microtubes de collecte mésogastres disséqués sur de la glace.
2. Préparation de l'appareil gastro-intestinal et la dissection de l'intestin moyen
- Anesthésier mouches de un flacon (40 vol) avec du CO 2 sur un lit de volée standard, décapiter tousmouches en utilisant une lame de rasoir et les transférer sur le plat de dissection. Verser la solution / 1% de BSA froid 1x PBS dans le plat de dissection pour couvrir le gel d'agarose. Les mouches vont flotter.
- Prenez l'abdomen de mouches avec une paire de pinces, tout en maintenant le thorax avec l'autre paire de forceps. Séparer le thorax de l'abdomen. L'intestin sera visible et l'intestin antérieur / culture sera très probablement encore être relié au thorax.
- Prenez l'intestin et le sortir du thorax. Pour déplier l'intestin, prenez la culture et tirez l'intestin légèrement en avant loin de l'abdomen.
- Prenez l'extrémité postérieure de l'abdomen avec une paire de forceps et le bord ouvert de la cuticule avant avec l'autre paire de forceps. Veillez à ne pas détruire le tissu intestinal en saillie. Tirez l'extrémité postérieure loin de briser la cuticule et continuez à tirer en arrière très doucement jusqu'à ce que toute l'intestin a été retirée de la cavité abdominale. La récolte peut devoir être retiré à l'avance si elle est trop grande pour se adapterà travers la cavité corporelle.
- Retirer l'intestin antérieur, tubes de Malpighi, intestin et des ovaires laissant l'intestin moyen nu.
- En utilisant une pipette Pasteur en verre, transférer le lot de mésogastres disséqués à un tube de 1,5 ml contenant une solution de BSA / 1% 1x PBS froid et maintenir le tube sur la glace. Les échantillons doivent être traitées dans les 2 heures.
- Après la dissection de tout un lot est terminé, rincez le plat de dissection avec de l'eau distillée deux fois pour se laver de gauche sur les débris. Lancer disséquer le prochain lot de mésogastres (répétez les étapes 2.1 à 2.7). Disséquer autant de lots que possible dans 2 h, puis passez à l'étape 3.1.
3. La digestion du Gut tissus aux cellules de récolte pour AEC tri
- Retirer la solution de BSA / 1% de PBS 1x à partir des estomacs et ajouter 500 ul de 0,5% de solution de trypsine-EDTA à chaque échantillon.
- Vortex bien pour 20 secondes et incuber les échantillons par doux balancement / tournant à 20 tours par minute à température ambiante pendant 25 à 30 min.
- Vortex à nouveau au bout d'environ 30 min et laisser le puits de tissu de l'intestin moyen intactes au fond du tube. Retirez délicatement les cellules qui sont en suspension avec une flammé pipette Pasteur en verre et les filtrer à travers un nylon de 35 um de maille dans un nouveau tube de 1,5 ml à centrifuger.
- Faites tourner les cellules vers le bas à 100 g pendant 5 min à 4 ° C. Fait à noter, lors du démarrage de l'empreinte, un culot cellulaire pourrait ne pas être visible au début, mais devient visible que le tissu digest progresse.
- Soigneusement transférer la solution trypsine retour au tube de l'échantillon original contenant le tissu de l'intestin moyen intacte restante. Éviter de transférer trop de cellules du culot.
- Doucement remettre en suspension le culot cellulaire dans 400 pi de PBS froid 1x / 1% BSA. Gardez les microtubes contenant les cellules dissociées sur glace et couvrir les tubes avec une feuille d'aluminium pour protéger les cellules de la lumière.
- Vortex la solution trypsine contenant à nouveau le tissu de l'intestin moyen intacte restante et placez les échantillonssur la bascule pendant 30 minutes supplémentaires à température ambiante.
- Répéter les étapes 3.3 à 3.4.3 jusqu'à ce que le tissu de l'intestin moyen a été digéré. Combiner les cellules dissociées de tous les microtubes dans un tube à centrifuger. Cela peut nécessiter une étape de centrifugation selon la 3,4, puisque le volume de l'ensemble des suspensions de cellules combinées peut dépasser 1,5 ml. Gardez la suspension de cellules sur de la glace et de protéger les cellules de la lumière.
- Faites tourner les cellules dissociées bas à 100 g pendant 5 min à 4 ° C. Retirez soigneusement autant de surnageant que possible en laissant environ 50 à 100 pi de la solution de BSA / 1% 1x PBS dans le tube à centrifuger. Resuspendre doucement les cellules dissociées dans 800 ul 1x PBS / 1% BSA contenant Sytox (1: 20,000).
- Transférer la suspension cellulaire à 5 ml tube Falcon à fond rond par filtration des cellules à travers un capuchon à encliquetage de filtre cellulaire (35 um de maille de nylon). Toujours garder des échantillons de cellules sur la glace et à l'abri de la lumière. Les cellules sont maintenant prêts àtrier.
- Pipeter 600 ul de solution RNAlater dans chaque tube de microcentrifugeuse dans lequel les cellules sont triées pour l'isolement d'ARN ultérieur. Pour les autres applications en aval les cellules peuvent être recueillies dans une solution différente, par exemple dans du PBS stérile.
4. FAC tri à isoler des cellules souches intestinales
- Allumer l'appareil de cytométrie de flux au moins une heure avant le tri. Assurez-vous que le système fluidique est libre de bulles d'air.
- Choisir la taille de la buse 70 um pour injecter les cellules dans le flux de fluide d'enveloppement.
- Ajuster l'amplitude du courant de fluide de base de sorte que la valeur de l'écart correspond à la valeur de référence (6-7, pour l'utilisation de la buse 70 um). Laissez le courant de fluide de base stabiliser avant de commencer à trier.
- Suivez cet ordre lors de la configuration d'abord les paramètres de tri:
- Chargez les cellules dissociées obtenus à partir de tripes de type sauvage. Tout d'abord, régler les tensions FSC et SSCpour tracer les cellules dans le centre de le nuage de points. Ensuite, ajuster le (GFP) FITC tension de sorte que toutes les cellules sont représentées ci-dessous 10 2 sur l'axe des x logarithmique. La définition du paramètre FITC définit la limite de autofluorescence.
- Chargez les cellules dissociées obtenus à partir de tripes de type sauvage avec Sytox ajoutés. Réglez la valeur Pacific Blue de tension et la porte d'identifier et de cellules de vie distincts de cellules mortes, Sytox-positifs dans le Pacific Blue vs. FSC Un diagramme de dispersion.
- Chargez les cellules dissociées obtenus à partir de l'ESG -Gal4, ligne de mouche UAS-GFP sans Sytox et ajuster la tension FITC pour se assurer que toutes les cellules GFP-positives sont tracées dans le nuage de points.
- Charger les cellules dissociées obtenus à partir de l'ESG -Gal4, ligne de mouche UAS-GFP avec Sytox ajouté. Réglez la valeur Pacific Blue de tension et la porte d'identifier et de cellules d'un salon séparé de morts, les cellules Sytox-positifs (porte P1).
- Réglez le SSC-A et FSC Une porte d'identifier la GFPcellules positives (basé sur l'intrigue de l'histogramme) tel que déterminé par la taille et la granularité (porte P2).
- Réglez la porte FSC-H et FSC-W pour identifier et exclure doublets de cellules GFP-positives fonction de leur taille (porte P3).
- Réglez le SSC-H et la porte SSC-W pour identifier et exclure doublets de cellules GFP-positives en fonction de leur granularité (porte P4).
- Utilisez porte P4 pour décrire les cellules GFP-positives dans un histogramme qui montre le nombre de cellules (chiffre) contre l'intensité de la GFP. Deux pics distincts de cellules GFP-positives seront visibles. Créer un portail pour chaque pic (portes P5 et P6). Porte P5 contient la population de cellules qui est enrichie pour les ISC peuvent être triés et séparément des cellules de porte P6.
- Retour porte dans un tracé de contour pour vérifier que les deux populations cellulaires distinctes GFP-positives contiennent des cellules vivantes (Comparer avec porte P1) et les cellules de la taille correcte (Comparer avec porte P2).
- Trier les cellules dans un tube de 1,5 ml contenant 600 & #181; l de solution RNAlater. Le tri se fait à un faible débit (max. 2,0, 70 buse de um, 1000 événements / sec, 70 psi) et employant une pureté de tri à deux voies.
- Après un tri est terminée, Vortex immédiatement les cellules triées brièvement et garder les microtubes sur la glace jusqu'à ce que de procéder à l'isolement de l'ARN ou d'autres applications en aval.
Résultats
Pour obtenir entre 50,000-100,000 cellules de FAC de tri, entre 160 et 200 estomacs doivent être disséqué. Evidemment, ce est la plupart du temps l'étape de consommer toute la procédure. Le dessin représenté sur la figure 1A illustre les principales étapes de dissection intestin, qui sont décrits en détail dans le protocole fourni ici. Cette procédure peut être modifiée individuellement. Un disséqué, ensemble tractus gastro-intestinal est représenté sur la figure 1B.
Lorsque tous les tissus de l'intestin moyen a été digéré, poursuivra immédiatement FAC tri. Conformément à la stratégie de déclenchement décrite dans le protocole permet l'identification et le tri des succès une population cellulaire enrichie pour CSI et pour EBS de jeunes (Figure 2) et de vieilles estomacs (figure 3). La porte P1 est réglé pour ne inclure que les cellules vivantes et en bonne santé à la porte des cellules mortes. Les cellules qui complotent-dessus de 10 3 sur le y-hache logarithmiquece est quand en utilisant le canal Pacific Blue sont définis comme les cellules mortes. Les points qui intrigue en dessous de 40 sur l'axe des x (FSC-A) sont pour la plupart des débris et donc sont également exclus (figure 2A). Dans le diagramme de dispersion des SSC-A vs FSC-A, les cellules sont réparties en fonction de leur taille et de granularité. Pour une résolution optimale, les cellules sont placées dans le nuage de points comme représenté sur la figure 2B en ajustant la tension tube photomultiplicateur (PMT). Dans les diagrammes de dispersion FSC-H vs FSC-W et SSC-H vs SSC-W cellules individuelles sont séparées des agrégats et doublets basées sur la taille (figure 2C) et basés sur granularité (figure 2D). Lorsque représentant les cellules comprises dans la porte P4 dans un histogramme, la séparation distincte de la GFP-négatif, GFP faible (porte P5) et (porte P6) cellules GFP élevés est visible (figure 2E). Cellules présentant l'intensité de la GFP inférieure sont de petite taille et moins granuleux et représentent CSI. Les cellules présentant ultérieure int GFPensité sont plus grands et plus granulaire et représentent EBS. Transcriptase inverse (RT) -PCR pour Dl sur ADNc synthétisé à partir d'ARN de cellules de chaque population de la GFP-positives (portes P5, P6) a révélé que le signal Dl est en effet plus forte dans les cellules plus petites, GFP faibles que dans la plus grande, la GFP haute les cellules (figure 2H). Les cellules ont ensuite été backgated et représentés dans les parcelles de contour pour confirmer que les cellules GFP faible (porte P5) et GFP haute (porte P6) diffèrent par la taille et la granularité (figure 2F) et sont encore en vie (figure 2G). Fait à noter, les deux pics de cellules GFP-positives (GFP basse et haute GFP) ne peuvent être bien distinguée si le (GFP) canal FITC a été calibré correctement en utilisant les commandes décrites dans le protocole.
La même stratégie de déclenchement a été utilisé lors du tri CSI dérivés de vieilles tripes (figure 3). Les diagrammes de dispersion (Figure 3A-D), l'histogramme (Figure 3E) et les tracés de contours (Figure 3F, G) sont analogues à ceux présentés dans la figure 2. Comme mentionné ci-dessus, il n'y a pas de marqueur de bonne foi pour identifier CSI dans les vieux estomacs et donc pas de données RT-PCR est présentée ici. Cependant, l'observation intrigante ici est que les deux pics contenant GFP faible (porte P5) ou (porte P6) cellules GFP élevés restent nettement séparés au cours du vieillissement. En outre, le nombre de cellules dans la haute (porte P6) crête GFP augmente de façon significative au cours du vieillissement, qui émule clairement le gisement connu d'EBS misdifferentiated avec l'âge. Le changement dans le rapport des deux populations de cellules peut également être vu dans les diagrammes de dispersion (comparer la figure 3A-D avec la figure 2A-D) et dans les tracés de contour (comparer la figure 3F, G à la figure 2F, G). De ces résultats, nous concluons que par le tri pour la GFP-positifs cellules utilisant FACS nous pouvons enrichir en CSI et EBS chez les jeunes et les anciens estomacs.
Pour valider la pureté de la CSI isolé et EBS, une analyse de tri poste a été effectuée (Figure 4). Les parcelles de l'histogramme de la CSI post-triés et EBS (figure 4B, C) représentent entre 95 puretés% et 98%.
Si la hiérarchie de fixer les paramètres FACS comme décrit plus haut est strictement suivie, les deux populations cellulaires différents (GFP faible, petite et GFP élevé, plus grande) peuvent déjà être distingués dans un nuage de points GFP vs. FSC-A (figure 5A). Ces deux populations cellulaires ne peuvent pas être distingués si cette hiérarchie ne est pas respectée (figure 5B-D).
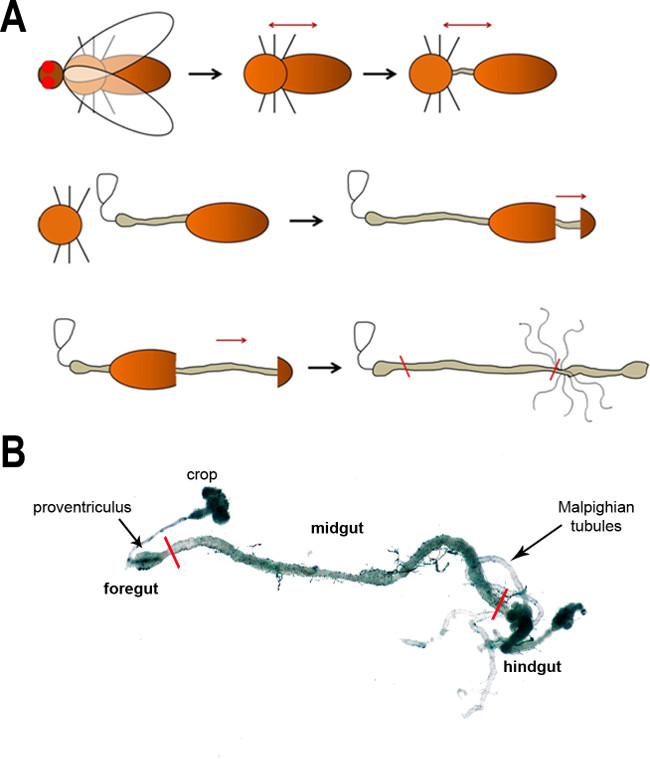
Figure 1: (A) Un schéma des étapes majeures de dissection l'intestin à la mouche. Tout d'abord, la tête est retirée (enlèvement des ailes est facultative) suivie d'une séparation du thorax et de l'abdomen pour exposer l'intestin. L'intestin est ensuite libéré à partir de la cavité corporelle dans les étapes suivantes. Les flèches noires indiquent la progression de la dissection, alors que les flèches rouges foncées indiquent la direction de traction. Les lignes rouges dans la dernière image indiquent les limites antérieure et postérieure de l'intestin moyen. (B) Une image de microscope optique de l'intestin de mouche adulte. Les principales régions et les caractéristiques anatomiques sont étiquetés. Les lignes rouges marquent les limites de l'intestin moyen.
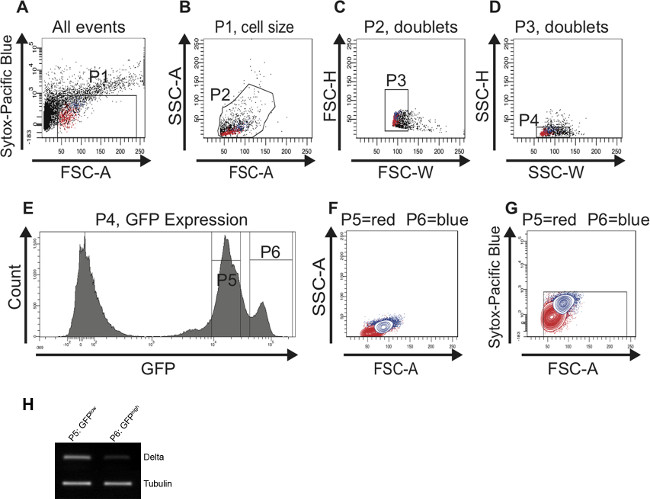
Figure 2:. FAC tri stratégie pour identifier et isoler CSI et EBS de jeunes (7 jours) mésogastres Pour une meilleure visualisation, cellules représentant CSI sont surlignés en rouge et les cellules représentant EB sont mis en évidenceen bleu dans le diagrammes de dispersion (AD) et dans les tracés de contours (F, G). (A) La porte P1 est configuré pour exclure les cellules mortes, Sytox-positives tracées ci-dessus 10 3 sur le axe des y logarithmique. Le seuil de la FSC-A est fixé à 40 pour exclure également les cellules mortes et les débris. (B) des cellules ont été bloqués pour les FSC-A et SSC-A pour sélectionner des cellules en fonction de la taille et de la granularité (porte P2). L'histogramme (E) a été utilisé en parallèle pour identifier les cellules GFP-positives dans le FSC-A vs SSC-Un diagramme de dispersion (B). (C, D) Les diagrammes de dispersion FSC-H vs FSC-W et SSC-H vs SSC-W servent à éliminer les agrégats et doublets et de sélectionner pour maillots (porte P3 en C et en D porte P4). (E) L'histogramme indique le nombre de cellules et leur intensité de la GFP. Deux pics, GFP faible (porte P5) et GFP haute (porte P6) peuvent être distingués. (F, G) Les cellules ont été back-gated dans une courbe de niveau pour vérifier que les deux cellules GFP-positives distincte populatLes ions sont de la taille correcte (F) et qui contiennent des cellules vivantes (G). (H) de la transcriptase inverse (RT) -PCR pour Dl sur l'ADNc synthétisé à partir d'ARN isolé à partir des cellules présentes dans le premier pic (P5) et porte dans la second pic (porte P6), respectivement. Plus expression Dl pourrait être détectée dans les cellules présentes dans la porte P5 P6 vs. porte. Tubuline a servi de témoin de charge. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
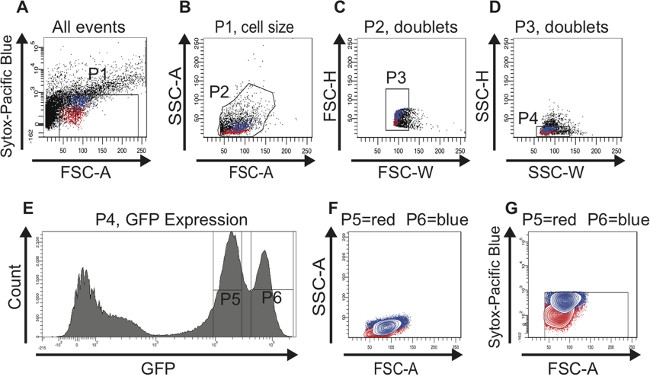
Figure 3: FAC tri stratégie pour identifier et isoler CSI et EBS de l'ancien (60 jours) mésogastres Pour une meilleure visualisation, cellules représentant CSI sont surlignés en rouge et les cellules représentant EB sont surlignés en bleu dans les nuages de points (AD) et dans le. tracés de contours (F, G). (A) La grille P1 est défini pour exclure les cellules mortes, Sytox positifs tracées au-dessus de 10 3 sur l'ordonnée à l'axe logarithmique. Le seuil de la FSC-A est fixé à 40 pour exclure également les cellules mortes et les débris. Fait à noter, l'augmentation de l'âge-dépendante dans les cellules GFP-positives grands est déjà évident dans ce complot. (B) des cellules ont été bloqués pour les FSC-A et SSC-A pour sélectionner des cellules en fonction de la taille et de la granularité (porte P2). L'histogramme (E) a été utilisé en parallèle pour identifier les cellules GFP-positives dans le FSC-A vs SSC-Un diagramme de dispersion (B). (C, D) Les diagrammes de dispersion FSC-H vs FSC-W et SSC-H vs SSC-W servent à éliminer les agrégats et doublets et de sélectionner pour maillots (porte P3 en C et en D porte P4). (E) L'histogramme indique le nombre de cellules et leur intensité de la GFP. Deux pics, GFP faible (porte P5) et GFP haute (porte P6) peuvent être distingués. Fait à noter, la forte population cellulaire de GFP contenant des cellules plus grandes a augmenté inombre n au cours du vieillissement. (F, G) cellules ont été back-gated dans un tracé de contour pour vérifier que les deux populations cellulaires distinctes GFP-positives sont de la taille correcte (F) et contiennent des cellules vivantes (G). Se il vous plaît cliquez ici pour voir une version plus grande de cette figure.
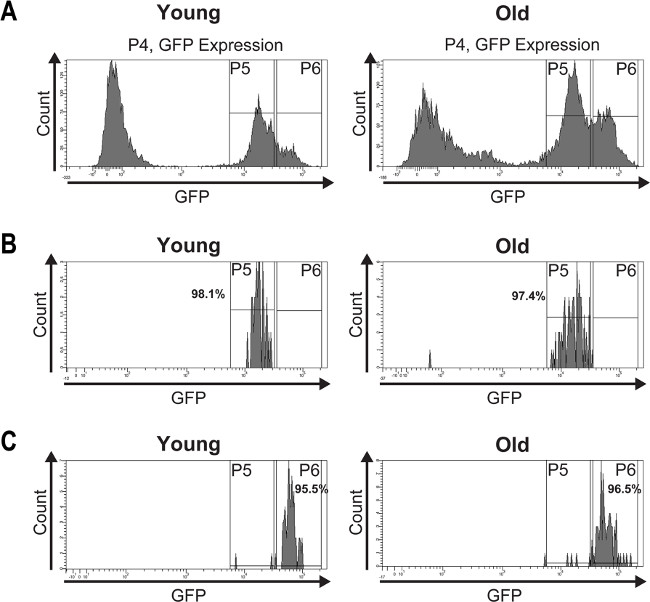
Figure 4:. Une analyse post de tri a été effectué pour déterminer la pureté de la CSI isolé et EB cellules (A) GFP-positives de jeunes (7 jours) et vieux (60 jours) estomacs étaient FAC triées et les parcelles de l'histogramme montrent leur distribution en deux pics basés sur l'intensité de la GFP. (B) L'analyse post de tri démontre la pureté des entrepreneurs indépendants isolés de jeunes et moins jeunes estomacs qui est> 97%. (C) L'analyse post de tri des déchets triés EBreakfasts à partir de jeunes et moins jeunes estomacs montre une pureté de> 95%. Les légères impuretés peuvent résulter d'extinction de la fluorescence ou de cellules exprimant la GFP mécaniquement endommagées causées par re-tri des cellules. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
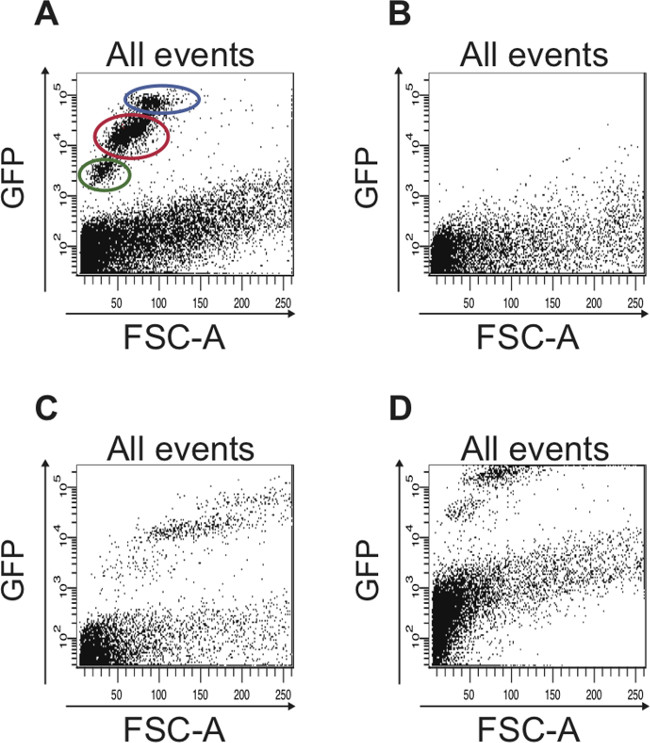
Figure 5: Exemples de diagrammes de dispersion qui affichent les données FACS sous-optimales, qui est considérée lorsque les paramètres FACS ne ont pas été réglés correctement (A) profil Représentant FACS de toutes les cellules lorsque les paramètres FACS ont été correctement définis sur la base des commandes décrites dans le protocole.. La population de cellules contenant CSI est encerclé en rouge et la population de cellules contenant EB est encerclé en bleu. Les cellules dans le cercle vert sont des cellules mortes qui ont une plus forte par rapport à autofluorescencecellules vivantes, qui sont tracés ci-dessous 10 3 sur le axe des y logarithmique. (B) Le nuage de points représente un résultat typique obtenu quand l'instrument FACS n'a pas été calibrée. Pas de cellules GFP-positives sont détectés. (C) Si la FSC ne est pas configuré correctement, les différentes populations de cellules GFP-positives ne sont pas détectés. (D) Si le (GFP) canal FITC ne est pas correctement réglée, la majorité des GFP cellules positives pour être triées ne sont pas tracées dans le nuage de points, mais plutôt le long du bord supérieur de la parcelle. En outre, dans le complot montré ici, la limite pour autofluorescence n'a pas été ajusté, donc ce complot cellules ci-dessus 10 2 sur l'axe y logarithmiques sont effectivement autofluorescente et pourraient être confondus avec des cellules GFP-positives.
Discussion
Le protocole présenté décrit une méthode pour isoler CSI de jeunes et vieux adultes mésogastres drosophile, qui peuvent ensuite être utilisés pour d'autres analyses moléculaires tels que le séquençage de prochaine génération. FAC tri de la population de cellules GFP-positives de l'ESG -Gal4, ligne de mouche UAS-GFP a déjà été atteint par plusieurs groupes 21,22. Toutefois, jusqu'à présent, la présence des deux sommets distincts de cellules GFP-positives a été soit négligée ou sous-évalué. Nous montrons que cette séparation ne représente pas seulement deux populations différentes de types de cellules (CSI et EBS), mais aussi que les deux pics de cellules GFP-positives restent nettement séparées au cours du vieillissement. Cette observation est très pertinente et précieuse pour les chercheurs intéressés par l'étude des cellules souches ou progénitrices au cours du vieillissement. Isolement de CSI à partir de vieux estomacs a été entravée par le fait qu'il n'y a pas de combinaison des marqueurs moléculaires pour identifier CSI dans un intestin moyen âge. Le seul marqueur que uidentifie nambiguously CSI dans une ancienne intestin moyen est phospho-histone3 (PH3), puisque CSI sont les seules cellules de division dans l'intestin moyen 12,13. Cependant, PH3 est un marqueur inadapté pour isoler CSI puisque le nombre de cellules souches en division à tout instant donné est trop faible pour obtenir une quantité décente de CSI pour des analyses ultérieures. La ligne de mouche ESG -Gal4, UAS-GFP est la ligne de mouche le plus couramment utilisé par les chercheurs qui étudient ISC fonction, l'entretien et la différenciation. Nos connaissances actuelles sur la régulation moléculaire de CSI homéostasie est basée sur des études dans lesquelles des molécules spécifiques et voies de signalisation ont été manipulés (revu en 7). Par conséquent, nous manquons encore de connaissances sur les changements moléculaires endogènes qui se produisent pendant le vieillissement. Le procédé décrit ici de comble cette lacune et est basé sur le fait que CSI peut être isolé sur la base de leur taille, la granularité et l'intensité de la GFP mésogastres adultes à ne importe quel point dans le temps au cours du vieillissement.
Tandis quel'établissement et l'optimisation de cette méthode, nous avons trouvé les étapes suivantes pour être critique pour un résultat fiable. Environ 200 tripes doivent être disséqués afin d'obtenir une bonne quantité de CSI pour AEC tri. La vitesse de la dissection est crucial et dépend de la pratique de l'individu. Une personne formée peut disséquer 40 tripes dans les 20 à 30 min. Depuis GFP est également exprimé dans les tubes de Malpighi dans l'ESG -Gal4, UAS-GFP ligne de mouche, il est essentiel de supprimer complètement les tubes de Malpighi de l'intestin moyen. Les estomacs disséqués doivent être conservés dans un endroit frais pour éviter la dégradation des tissus et réduire l'activité de RNAse dans le tissu. Par conséquent, les estomacs disséqués doivent être transférés dans le plat de dissection dans des microtubes contenant une solution / 1% de BSA froid 1x PBS après un maximum de 20 à 30 min et maintenus sur de la glace. Cependant, les estomacs disséqués ne devraient pas être laissés sur la glace pendant plus de deux heures avant de commencer la dissociation de tissu avec de la trypsine. Le plus efficient approche est de disséquer autant de lots de mouches que possible au sein de ces deux heures, puis démarrer la trypsine digérer pour ces lots. Si plusieurs estomacs sont nécessaires, ils peuvent être disséqués pendant les temps d'incubation de la trypsine digest.
Bien que la trypsine est une enzyme très puissant et pourrait avoir des effets néfastes sur les cellules, nous avons encore obtenu assez de vie, les cellules saines pour la suite tri FAC. L'étape clé de notre procédure qui permet l'isolement des cellules intactes, ce est que les cellules dissociées sont éliminés de la solution de trypsine toutes les 30 min. Si les mésogastres disséqués sont incubées pendant 2 h ½ à une solution contenant de la trypsine à la température ambiante, on a observé une augmentation de 20 à 30% de cellules mortes, Sytox-positifs. Il convient de souligner que la solution de trypsine nous utilisons contient de l'EDTA. La présence d'EDTA facilite probablement désintégration des tissus en chélatant les ions calcium et de magnésium requises pour le bon fonctionnement de molécules de la matrice extracellulaire.
Les étapes les plus cruciales au succès de tri des CSI de jeunes et vieux tripes sont les paramètres initiale appropriée de la FACS et les paramètres de déclenchement en utilisant les commandes suivantes décrits et une hiérarchie de tri spécifique. Nous avons effectué la FAC de tri sur un cytomètre de flux ARIA II (logiciel de FACSDiva). Il est important que l'instrument est mis sous tension au moins une heure avant le tri pour réchauffer les lasers. Fait à noter, lorsque FAC tri des CSI est effectuée pour la première fois, les paramètres de tri et d'indemnisation doivent être réglés à l'aide des commandes ci-dessus: (1) dissocié les cellules de type sauvage (par exemple w 1118) mésogastres drosophile sans ajout de Sytox - ce paramètre (étape 4.4.1) empêche le tri des cellules en fonction de leur autofluorescence; (2) dissocié les cellules de type sauvage (par exemple W 1118) de mésogastres Drosophila avec Sytox ajouté - ce paramètre(Étape 4.4.2) permet la séparation morts de cellules vivantes (cellules mortes ont une forte autofluorescence et peuvent contaminer les cellules GFP-positives triées); (3) dissociée de cellules estomacs de l'ESG -Gal4, ligne de mouche UAS-GFP sans Sytox - ce paramètre (étape 4.4.3) veille à ce que toutes les cellules GFP-positives sont tracées dans le nuage de points. Si ces paramètres ne sont pas réglés correctement, la population de cellules triées sera probablement contenir des cellules mortes et les débris (Figure 5B, C), de nombreuses cellules GFP-positives seront manqués (Figure 5D) et les deux pics distincts pour les cellules GFP-positives que voir dans le graphique de l'histogramme (Figure 2E et figure 3E) ne seront pas détectés. Une fois les FACS et les paramètres de déclenchement ont été définis, l'instrument est étalonné et prêt pour trier les cellules de l'ESG -GAL4, ligne de mouche UAS-GFP. Étant donné que ces paramètres peuvent être sauvegardés, toutes les futures sessions de tri pour CSI et EBS de l'ESG -GAL4, UAS-ligne de mouche de la GFP peut commencer à partir de l'étape 4.5. Bien que le choix du mode "pureté" et l'exécution d'une pureté bidirectionnelle diminue sorte le nombre de cellules triées, il permet une stringence plus élevée de tri (étape 4.6 et la figure 4B, C). Il faut noter que l'avantage d'utiliser à la place Sytox d'iodure de propidium pour marquer les cellules mortes est qu'il n'y a qu'une faible débordement dans le canal FITC (GFP), ce qui le rend facile à compenser le débordement.
Notre procédé d'enrichissement pour CSI et EB, respectivement, est basée sur le tri des cellules en fonction de différents niveaux d'expression de la GFP. Il se peut que le cours du vieillissement misdifferentiated EB GFP expriment également à un niveau inférieur et pourrait être confondu avec CSI. Cependant, depuis les cellules triées diffèrent aussi dans la taille et la granularité, nous croyons que notre stratégie de tri est le plus approprié à cette date pour enrichir CSI et EBS. En outre, il est connu que les cellules de l'intestin moyen d'un vieillissement de retenue identité ISC ont un petit noyau 15. Pour obtenir plus de clarté sur l'identité des cellules triées, on pourrait trier les cellules d'une lignée transgénique de mouche qui porte ESG -GAL4, UAS-GFP et un journaliste transgène de signalisation Notch. Depuis Notch a été montré actif seulement dans les EB 12,13, CSI isolé d'un jeune intestin moyen serait négatif pour le journaliste de Notch, alors que les EB serait positif pour le journaliste de Notch. Cependant, au cours du vieillissement signalisation Notch aberrant devient dans le tissu de l'intestin moyen. Par conséquent, il doit être testé si ce dispositif expérimental mis en place est en effet plus fiable de distinguer entre CSI et EBS isolé d'un vieux intestin moyen.
Nous avons déjà utilisé cette méthode pour l'analyse comparative du transcriptome du CSI de jeunes et moins jeunes estomacs et a identifié un certain nombre de facteurs qui sont régulés différemment au cours du vieillissement (inédites. Observ.). En outre, ce procédé permet l'analyse des différences dans l'expression génique entre CSI et le EBS. Cette enquêtes fournira un aperçu des changements moléculaires qui se produisent initiales comme une cellule entre dans le processus de différenciation. En outre, l'isolement d'EBS lors des analyses de vieillissement et suivantes fera la lumière sur les changements moléculaires de misdifferentiation liée à l'âge. En outre, ce procédé peut être combiné avec d'autres outils génétiques utilisés dans Drosophila pour étudier la fonction de gènes. En résumé, cette méthode offre une approche impartiale pour enquêter sur les caractéristiques moléculaires et les changements de CSI et EBS au cours du vieillissement. Ce est un outil précieux qui facilitera l'exploration des mécanismes de vieillissement dans les cellules souches et progénitrices adultes.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
We are grateful to Gabriele Allies for excellent technical assistance. We thank the University Ulm Medical Faculty for the use of the FACS Core Facility and the Institut für Molekulare und Zelluläre Anatomie for using the confocal microscope. We thank S. Hayashi for the esg-Gal4, UAS-GFP fly line. This project is funded by the Federal Ministry of Education and Research (BMBF, Forschungskern SyStaR). A.T. is supported by SFB 1074 (Project A2). A.T. and G.A. are supported by the Deutsche Forschungsgemeinschaft (DFG, FE578/3-1). H.M.T. is a member of the International Graduate School in Molecular Medicine Ulm (GSC 270).
matériels
| Name | Company | Catalog Number | Comments |
| Forceps: Dumont, Inox Biologie #5 | Fine Science Tools | 11252-20 | |
| SefarNitex 03-150um/38 (35 µm nylon mesh) | Sefar | 3A03-0150-102-00 | |
| Falcon 5 ml Round Bottom Polystyrene Test Tube with Cell Strainer Snap Cap | Corning | 352235 | |
| Polymax 1040 | Heidolph | 543-42210-00 | |
| Albumin from bovine serum (BSA) | Sigma | A4503-50G | |
| 0.5% Trypsin-EDTA | Invitrogen | 15400-054 | Trypsin obtained from a different company most likely has a different activity and the duration of the trypsin digest has to be adjusted accordingly. |
| SYTOX Blue Dead Cell Stain for flow cytometry | Life Technologies | S34857 | |
| RNAlater Stabilization Solution | Life Technologies | AM7023 | Other solutions, e.g., Trizol can be used for subsequent RNA isolation |
| FACSAria II cell sorter | Becton Dickinson | Turn on one hour prior to sorting |
Références
- Jones, D. L., Rando, T. A. Emerging models and paradigms for stem cells ageing. Nat. Cell Biol. 13 (5), 506-512 (2011).
- Otín, C., Blasco, M. A., Partridge, L., Serrano, M., Kroemer, G. The hallmarks of aging. Cell. 153 (6), 1194-1217 (2013).
- Signer, R. A., Morrison, S. J. Mechanisms that regulate stem cell aging and life span. Cell Stem Cell. 12 (2), 152-165 (2013).
- Iliadi, K. G., Knight, D., Boulianne, G. L. Healthy Aging – Insights from Drosophila. Front. Physiol. 3, 106 (2012).
- Biteau, B., Jasper, H. EGF signaling regulates the proliferation of intestinal stem cells in Drosophila. Development. 138 (6), 1045-1055 (2011).
- Jasper, H., Jones, D. L. Metabolic regulation of stem cell behavior and implications for aging. Cell Metab. 12 (6), 561-565 (2010).
- Biteau, B., Hochmuth, C. E., Jasper, H. Maintaining tissue homeostasis: dynamic control of somatic stem cell activity. Cell Stem Cell. 9 (5), 402-411 (2011).
- Wang, L., Jones, D. L. The effects of aging on stem cell behavior in Drosophila. Exp. Gerontol. 46 (5), 340-344 (2011).
- Lucchetta, E. M., Ohlstein, B. The Drosophila midgut: a model for stem cell driven tissue regeneration. Wiley Interdiscip. Rev. Dev. Biol. 1 (5), 781-788 (2012).
- Ayyaz, A., Jasper, H. Intestinal inflammation and stem cell homeostasis in aging Drosophila melanogaster. Front. Cell Infect. Microbiol. 3 (98), (2013).
- Jiang, H., Patel, P. H., Kohlmaier, A., Grenley, M. O., McEwen, D. G., Edgar, B. A. Cytokine/Jak/Stat Signaling Mediates Regeneration and Homeostasis in the Drosophila Midgut. Cell. 137 (7), 1343-1355 (2009).
- Ohlstein, B., Spradling, A. The adult Drosophila posterior midgut is maintained by pluripotent stem cells. Nature. 439, 470-474 (2006).
- Micchelli, C. A., Perrimon, N. Evidence that stem cells reside in the adult Drosophila midgut epithelium. Nature. 439, 475-479 (2006).
- Ohlstein, B., Spradling, A. Multipotent Drosophila intestinal stem cells specify daughter cell fates by differential notch signaling. Science. 315 (5814), 988-992 (2007).
- Biteau, B., Hochmuth, C. E., Jasper, H. JNK Activity in Somatic Stem Cells Causes Loss of Tissue Homeostasis in the Aging Drosophila Gut. Cell Stem Cell. 3 (4), 442-455 (2008).
- Choi, N. H., Kim, J. G., Yang, D. J., Kim, Y. S., Yoo, M. A. Age-related changes in Drosophila midgut are associated with PVF2, a PDGF/VEGF-like growth factor. Aging Cell. 7, 318-334 (2008).
- Park, J. S., Kim, Y. S., Yoo, M. A. The role of p38b MAPK in age-related modulation of intestinal stem cell proliferation and differentiation in Drosophila. AGING. 1 (7), 637-651 (2009).
- Berger, C., Harzer, H., Burkard, T. R., Steinmann, J., vander Horst, S., Laurenson, A. S., Novatchkova, M., Reichert, H., Knoblich, J. A. FACS purification and transcriptome analysis of Drosophila neural stem cells reveals a role for Klumpfuss in self-renewal. Cell Rep. 2 (2), 407-418 (2012).
- Harzer, H., Berger, C., Conder, R., Schmauss, G., Knoblich, J. A. FACS purification of Drosophila larval neuroblasts for next-generation sequencing. Nat. Protoc. 8 (6), 1088-1099 (2013).
- Yagi, Y., Hayashi, S. Role of the Drosophila EGF receptor in determination of the dorsoventral domains of escargot expression during primary neurogenesis. Genes Cells. 2 (1), 41-53 (1997).
- Amcheslavsky, A., Ito, N., Jiang, J., Ip, Y. T. Tuberous sclerosis complex and Myc coordinate the growth and division of Drosophila intestinal stem cells. J. Cell Biol. 193 (4), 695-710 (2011).
- Dutta, D., Xiang, J., Edgar, B. A. RNA expression profiling from FACS-isolated cells of the Drosophila intestine. Curr. Protoc. Stem Cell Biol. 13 (27), (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon