A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אינדוקציה של Murine דלקת מעיים על ידי העברת המאמצת של מפעיל CD4
In This Article
Summary
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
Abstract
יש מודלים של בעלי חיים רבים ושונים זמינים ללימוד פתוגנזה של מחלות בבני אדם מעי דלקתיות (IBD), כל אחד עם יתרונות משלה וחסרונות. אנו מתארים כאן מודל קוליטיס ניסיוני שהוא ביוזמת העברת מאמצת של תאי טחול syngeneic CD4 + T CD45RB הגבוה לעכברי נמען חסרי T ו- B תא. אוכלוסיית תאי T מסוג CD4 + הגבוה CD45RB שמורכבת בעיקר של תאי מפעיל נאיביים היא מסוגלת גרימת דלקת מעיים כרונית, דומה מאוד להיבטים מרכזיים של IBD האנושי. שיטה זו ניתן להשפיע ללמוד היבטים של תחילת מחלה והתקדמות. בנוסף ניתן להשתמש בו כדי ללמוד את הפונקציה של מולדת, מסתגל, ואוכלוסיות תאים חיסוני רגולציה, ואת התפקיד של חשיפות סביבתיות, כלומר, החיידקים, בדלקת מעיים. במאמר זה אנו מדגימים את המתודולוגיה לגרימת דלקת המעי הגס עם פרוטוקול צעד-אחר-צעד. inc זהלרכב וידאו הדגמה של היבטים טכניים מפתח נדרשו לפתח מודל העכברי של קוליטיס הניסיוני למטרות מחקר בהצלחה.
Introduction
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: ודא שכל הפרוטוקולים של בעלי החיים שאושרו על ידי ובעמידה בבעלי חיים מוסדי טיפול ושימוש ועדת תקנות (IACUC) והמדריך של המועצה הלאומית למחקר לטיפול והשימוש בחי מעבדה. עכברי תורם יכולים להיות זכר או נקבה, אבל עכברי נמען צריכים להיות גבר. אם המקבלים נשיים הם לשמש, עכברי התורם חייבים להיות נקבה 5. לשמור על מושבות משתמשים במצעים רגילים, שאינם סטרילי ומים acidified עישון, כמו אלה עלולים להשפיע על חיידקי מעיים, ו, ובכך, את הפנוטיפ קוליטיס של העכברים 5,6.
1. ניסיוני הכנה
- להשתמש במדיה קרים כקרח ומאגרים. שמור את התאים על קרח לאורך כל הניסוי.
- לבצע את הניסוי במכסת מנוע Biohazard סטרילי באמצעות טכניקה סטרילית.
2. בידוד של תאי הטחול T
- להרדים עכבר תורם / עכברים בתא CO 2 ואחריו dislocatio צוואר הרחםn. תרסיס בטן עם אתנול 70%.
- לעשות חתך אופקי בבטן ולקלף את העור לחשוף הצפק. החזק הצפק מהאיברים הפנימיים עם המלקחיים ולעשות חתך בבטן השמאלי הצפק לחשוף ולהסיר את הטחול.
- מניחים את הטחול ב 10 מיליליטר של מדיה מלאה בצלחת פטרי. להסיר ולסלק רקמה עודפת מטחול.
- השתמש 2 שקופיות זכוכית מעוקרות למחוץ ולהפריד טחול להשעית תא בודד. תא מסנן השעיה דרך מסננת 70 מיקרומטר לתוך צינור חרוטי 50 מ"ל ולשטוף מסננת עם 5 מיליליטר של מדיה מלאה. הנח עד 5 טחולים בצינור אחד 50 מיליליטר חרוטי.
- תאי צנטריפוגה ב 450 XG במשך 7 דקות. בטל supernatant על ידי שפיכה כבויה או על ידי שאיבת אבק למכל פסולת.
- בעדינות resuspend תאים ב5 מיליליטר לטחול של תמוגה הצפת לlyse תאי דם אדומים במשך 10 דקות בטמפרטורת חדר. הוסף נפח שווה של מדיה מלאה (5 מיליליטר לטחול) לצינור.
- תאי צנטריפוגה ב 450 XG במשך 7 דקות. בטל supernatant על ידי שפיכה כבויה או על ידי שאיבת אבק למכל פסולת.
- בעדינות resuspend תאים ב 10 מיליליטר של תיוג הצפת.
- ספירת תאים על ידי הרחקה הכחולה trypan.
- הסר 20 μl של השעיה תא ולהוסיף לtrypan כחול 180 μl לצינור microfuge ומערבבים היטב. אחרי 5 דקות, להוסיף 10 μl שכותרתו תאים לhemocytometer ולספור תאים שאינם כחולים-מתחת למיקרוסקופ. לקבוע את מספר כולל של תאי קיימא. מחק תא / trypan תערובת כחולה.
- תאי צנטריפוגה ב 10 מיליליטר של תיוג הצפת ב 450 XG במשך 7 דקות. בטל supernatant על ידי שפיכה כבויה או על ידי שאיבת אבק למכל פסולת.
3. העשרה של תאי CD4 + T
הערה: בצע את ההוראות של היצרן למוצרים ספציפיים בשימוש בסעיף זה.
- בעדינות resuspend תאים להשעית תא בודד של 20 x 10 6 תאים / מיליליטר בתווית קרהing מאגר.
- הוסף 5 μl לכל 1 x 10 6 תאים של נוגדני העשרת תאי CD4 T biotinylated. דגירה תאים על קרח במשך 15 דקות.
- להוסיף 10x נפח של תיוג הצפת. תאי צנטריפוגה בg × 450 במשך 7 דקות. בזהירות לשאוב את כל supernatant באמצעות שאיבת ואקום למכל פסולת.
- ביסודיות מערבולת חלקיקים מגנטיים streptavidin מצומדות. הוסף 5 μl של חלקיקים לכל 1 x 10 6 תאים.
- מערבבים היטב אך בעדינות. שמור תערובת ב6-12 מעלות צלזיוס למשך 30 דקות.
- הוספת תיוג הצפת לריכוז של 20-80 x 10 6 תאים / מיליליטר. להעביר עד 1.0 מיליליטר שכותרתו תאים לכל 12 x 75 מ"מ מבחנה מסביב לתחתית (המכונה "הצינור חיובי-חלק").
- מניחים כל צינור חיובי-שבריר על מגנט במשך 6-8 דקות.
- עם הצינורות החיובי-שבריר עדיין על המגנט, בזהירות להעביר supernatant מצינור חיובי-חלק עם pipet פסטר זכוכית לצינור חרוטי 50 מיליליטר סטרילי חדש (referreד כל" שבריר המועשר "). חלק מועשר זה מכיל תאי CD4 + T. היזהר שלא לשבש את התאים שכותרתו נמשכים אל המגנט.
- תאי Resuspend נותרו בצינורות החיובי-החלק באותו הנפח של תיוג הצפת כמו בשלב 3.6 ידי pipetting למעלה ולמטה במרץ. מניחים צינור חיובי-חלק אחורי על מגנט במשך 6-8 דקות.
- עם צינורות חיובי-שבריר עדיין על המגנט, בזהירות להעביר supernatant (מועשרת שבריר, CD4 +) מצינור חיובי-חלק עם pipet פסטר זכוכית לסטרילי 50 מיליליטר צינור חרוטי מצעד 3.8 מבלי לשבש תאים מצורפים למגנט.
- חזור על שלבים 3.9-3.10 להגדיל את התשואה של תאי CD4 + T שהושגו. המשך פרוטוקול באמצעות שבריר מועשר (CD4 + תאים).
4. תאי תיוג ומיון 7
- צנטריפוגה מועשרת תאים ב 450 XG במשך 7 דקות. בטל supernatant על ידי שפיכה כבויה או suct ואקוםיון למכל פסולת.
- תאי Resuspend ב 1 מיליליטר של תיוג הצפת. הסר aliquot של תאים לספור ולהעריך כדאיויות תא על ידי הרחקה הכחולה trypan כמו בשלב 2.9.
- הוספת נפח של תיוג הצפת עד 10 x 10 6 תאים / מיליליטר; אם תאים כבר <10 x 10 6, צנטריפוגות ב 450 XG במשך 7 דקות, להשליך supernatant על ידי שפיכה כבויה או שאיבת אבק למכל פסולת, ולהוסיף נפח של תיוג הצפת עד 10 x 10 6 תאים / מיליליטר.
- הגדר את aliquots הנפרד של × 10 5 תאים כ 5-10 כל לתאי שליטה בלא כתם, מוכתם אלוטיפ, ומוכתם יחידים בצינורות microfuge.
- הוסף 5 מיקרוגרם CD4-FITC ו1 מיקרוגרם / מיליליטר CD45RB-PE / מיליליטר לתאים. להוסיף כתמי שליטת אלוטיפ וכתמים בודדים באותו הריכוז לנכס aliquots בצינורות microfuge. מערבבים היטב אך בעדינות ולדגור על הקרח המוגן מפני אור למשך 30 דקות.
- להוסיף 10x נפח של תיוג מאגר לתאים ובקרהs. צנטריפוגה XG 450 במשך 7 דקות. בטל supernatant על ידי שאיבת אבק למכל פסולת.
- Resuspend בתיוג הצפת הנפח בשלב 4.5. צנטריפוגה XG 450 במשך 7 דקות. בטל supernatant על ידי שאיבת אבק למכל פסולת.
- Resuspend בתיוג הצפת עד 10 x 10 6 תאים / מיליליטר. עובר תאים דרך מסננת 70 מיקרומטר לתוך צינור FACS. שמור על הקרח המוגן מפני אור עד מוכן לFACS.
- להגדיר ולקבוע פיצוי הולם על סדרן התא עם תאים בלא כתם ובקרות מוכתמים יחידים.
- אל תכלול תאי nonviable עם gating צופה וצד-פיזור (איור 1 א). הגדרת gating לCD4 + וCD45RB + תאים עם פקדים מוכתמים אלוטיפ. תאי שער בCD4 + אוכלוסייה.
- מיין CD4 + תאים לאוכלוסיות נמוכות CD45RB הגבוה וCD45RB באמצעות היסטוגרמה פשוטה לתאים מוכתמים PE לתוך צינורות עם 2 מיליליטר של מדיה מלאה. CD45RB הגבוה אוכלוסייה מייצגת 40% הגבוהים ביותר של CD4 + CD45RB + תאים (CD45RB הגבוה), והאוכלוסייה הנמוכה CD45RB היא 20% הנמוכים ביותר של CD4 + CD45RB + תאים (CD45RB הנמוך; איור 1).
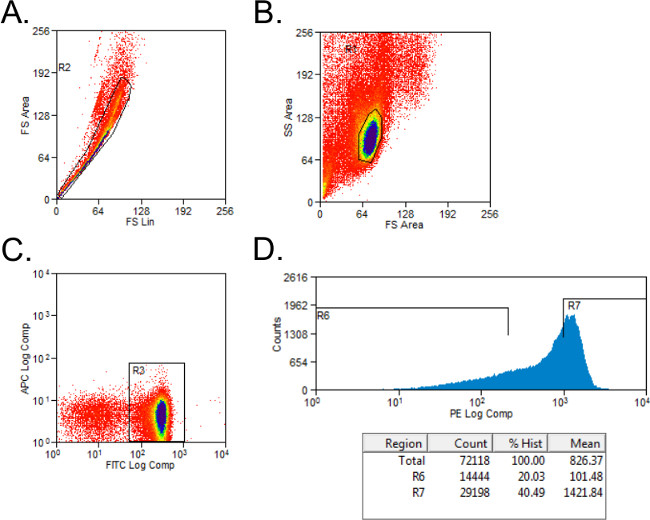
איור 1: תזרים נציג cytometry חלקות של אוכלוסיות תאי CD4 + T CD45RB במהלך ניתוח FACS (- C) FITC CD4- וPE CD45RB מוכתם splenocytes מהתורם C57BL / 6 עכברים מסודרים על ידי FACS ל+ גבוה וCD4 CD4 + CD45RB. אוכלוסיות תאי T הנמוך CD45RB. אירועים () כפיל לא נכללו בעלילת הפיזור קדימה. (ב) לימפוציטים היו מגודר בעלילה קדימה וצד פיזור. (C) CD4 + תאי T היו סגור, ותאים (D) CD4 + CD45RB + T היו זממו על היסטוגרמה אירועי PE לעומת. תאי CD4 + נמוכים CD45RB נחשבו 20% הנמוכים ביותר של CD45RB + תאים. תאי CD4 + גבוהים CD45RB הוגדרו כ-40% הגבוהים ביותר של CD45RB + תאים.
- הפעל aliquot של כל אוכלוסיית תאים במכונה FACS להעריך טוהר של אוכלוסיות.
- צנטריפוגה מסודרים תאים ב 450 XG במשך 7 דקות. Resuspend ב 1 מיליליטר PBS. הסר aliquot של תאים לספור ולהעריך כדאיויות תא על ידי הרחקה הכחולה trypan כמו בשלב 2.9.
5. הזרקה של תאים לתוך מקבלי
- Resuspend מסודרים תאים עד 4 x 10 6 תאים / מיליליטר (CD45RB גבוה) או 2 x 10 6 תאים / מיליליטר (CD45RB הנמוך) בPBS.
- העבר את תאים גבוהים CD45RB 100 μl למקבל לצינור סטרילי החדש. הוספה של כל PBS 100 μlנמען לצינור זה. לפיכך, הזרקה הכולל לבעלי חי נפח הוא 200 μl, וסכום כולל של תאים לכל נמען הוא 4 תאים נאיביים גבוהים x 10 5 CD4 + T CD45RB.
- אם קבוצת ניסוי שקיבלה תאי T רגולטורים היא רצויה, להעביר תאים גבוהים CD45RB 100 μl למקבל לצינור סטרילי החדש. הוספה של תאים נמוכים CD45RB למקבל 100 μl לאותו צינור. הזרקה הכולל לבעלי חי נפח הוא 200 μl; יחס הגבוה CD45RB: התאים נמוכים CD45RB הוא 2: 1.
- הזרק של CD45RB גבוה או CD45RB 100 μl CD4 הגבוה / הנמוך CD45RB + תאים intraperitoneally לימין וצד שמאל של הבטן (הכוללת של 200 μl) של כל אחד מנמענים.
6. ניטור של מחלת התקדמות בבעלי חיים נמען
- על מנת להעריך את המצב הקליני של בעלי החיים הנמען, להקצות עשרות קליניים מצטברים לparamete הבאrs 8 ביום ההזרקה, שבועי לאחר מכן, ובזמן של הקרבה:
- לקבוע מבזבז על ידי מדידת ירידה במשקל: 0 - אין ירידה במשקל; הפסד 0.1-10% ממשקל גוף ראשוני - 1; 2 - אובדן יותר מ -10% ממשקל גוף ראשוני (איור 2 א).

איור 2: סימנים פתולוגיים קליניים וגולמיים של דלקת להתרחש לאחר העברת סוג בר תאי T מסוג CD4 + הגבוה CD45RB לRag1 - / - ועכברים נמען NRDKO 11 () מקבלי NRDKO איבדו בממוצע 10% ממשקל הגוף הראשוני שלהם על ידי 5. שבועות לאחר העברה-, ואילו Rag1- / - המקבלים לא מפגינים סימנים קליניים של מחלה בשלב זה. כל נקודה מייצגת את האחוז הממוצע של משקל גוף ראשוני למחזור ± SEM. ** P <0.005. (ב) עכברי חלק פיתחו דלקת מעיים חמורה, כפי שהודגם על ידי הנוכחות של צניחה של פי הטבעת. זוהי תמונה מייצגת של צניחה של פי הטבעת בעכבר נמען NRDKO. (C) באופן בוטה, נקודותיים משני Rag1 - / - ועכברים נמען NRDKO מעובה וקצרו בהשוואה למתיישבי Rag1 - / - והעכברים NRDKO ללא העברת מאמצת תא T. מתיישבי עכברי נמען NRDKO להראות דלקת חמורה ומשקולות מעי גס מוגברות (מידע לא מוצג). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- לקבוע את האיכות של צואה על ידי הצבת בעלי חיים במכל נקי עד שעברשרפרף: 0 - אין; 1 - צואה רכה; 2 - שרפרף מימי ו / או דמים.
- לקבוע בריאות כללית של בעלי חיים על ידי נוכחות של הסימנים של המחלה הבאה: 0 - אין יציבה כפופה, זיפי פרווה, עור או נגעים; 1 - כל אחד מהנוכחים הבאים: היציבה כפופה, זיפי פרווה, או נגעים בעור.
- לקבוע נוכחות של צניחה של פי הטבעת: 0 - נעדר; 1 - הווה (איור 2).
- להקריב בעלי חיים משאיפת CO 2 ואחריו נקע בצוואר הרחם, כאשר הם איבדו 20% ממשקל גופם ההתחלתי או בנקודת זמן רצויה, לפי המוקדם מביניהם. מחלה קלינית היא בדרך כלל לכאורה מתחילה בשבוע 5 לאחר הגודש.
- להעריך את חומרת מחלה כפי שתואר בעבר 5,7.
- להקצות עשרות קליניים כמו בשלב 6.1 8.
- למדוד אורך מעי גס ומשקל (איור 2 ג).
- לבצע ניתוח היסטולוגית של דלקת5.
- לקבוע ביטוי ציטוקינים ספונטני בתרבויות explant רקמת מעי 9, הלימפה mesenteric צומת 10, ו / או בסרום 11.
- בקצרה, לתרבויות explant 9, להסיר נקודותיים לאחר הקרבה, פתוח לאורך הזמן, ונקי עם PBS. דגירה נקודותיים בייקר מסלולית נקבע על 250 סל"ד במדיה שלמה למשך 30 דקות בטמפרטורת חדר.
- קוצצים רקמה לחתיכות קטנות וטופחו על 37 מעלות צלזיוס במדיה שלמה עבור 24 שעות. לאסוף את supernatant ולהשתמש כדי לכמת את ציטוקינים לכל 100 מ"ג רקמה על ידי ELISA.
- בצע vivo לשעבר אפיון של פנוטיפים תאי T ו / או פונקציה 10.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כ 10 x 10 6 תאי T מסוג CD4 + הגבוה CD45RB מ -10 טחולים ממבוגרי C57BL / 6 עכברים תורמים באופן מהימן מבודדים. מספר זה ישתנה בהתאם לגיל והמתח של עכבר התורם ומיומנותו של החוקר. כאשר 4 x 10 5 C57BL / 6 תאי T מסוג CD4 + הגבוה CD45RB מועברים לתוך C57BL Rag1 / 6 - / - עכברי נמען, סי...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן אנו מתארים פרוטוקול צעד-אחר-צעד גרימת דלקת במעי הגס בעכברים על ידי העברת מאמצת של תאי CD4 + CD45RB + T לעכברי immunodeficient. אנחנו השתמשנו טחולי C57BL / 6 תורם וRag1 syngeneic - / - עכברי נמען, אם כי זנים אחרים (למשל, BALB / ג, 129S6 / SvEv, סוכרת שאינן סובל מהשמנת יתר (NOD)) ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
עבודה זו נתמכה על ידי אמריקאי Gastroenterological Association (AGA) מחקר חוקרי פרס וקרוהן וקוליטיס קרן של אמריקה (CCFA) פיתוח קריירה פרס (לSZS), DK089692 F30 NIH NIDDK (לECS), ואוניברסיטת צפון מרכז קרוליינה לביולוגיה במערכת העיכול וDK34987 P30 מחלת גרנט (היסטולוגיה Core). מתקן UNC cytometry זרימת Core נתמך בחלקו על ידי NCI מרכז Core תמיכת גרנט (P30CA016086) למרכז לסרטן UNC Lineberger. אנו מודים ללוק B. Borst מState College אוניברסיטת צפון קרוליינה לרפואת וטרינרית על עזרתו עם ניתוח ואימונוהיסטוכימיה histopathological.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
References
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416(2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437(2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved