Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индукционная мышиных воспаление кишечника с помощью приемных передачи эффекторных CD4
В этой статье
Резюме
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
Аннотация
Есть много различных животных моделях, доступных для изучения патогенеза воспалительных заболеваний человека кишечника (ВБК), каждый со своими преимуществами и недостатками. Здесь мы опишем экспериментальную модель колита, который по инициативе приемных передачи сингенных селезенки CD4 + CD45RB высокой Т-клеток в дефицитных мышей-реципиентов Т и В клеток. CD4 + Т CD45RB высокой клеточная популяция, что в основном состоит из наивных эффекторных клеток способна индуцировать хронический кишечного воспаления, напоминающий ключевых аспектов человеческого IBD. Этот метод можно манипулировать, чтобы изучить аспекты начала заболевания и прогрессирования. Кроме того, он может быть использован для изучения функции врожденной, адаптивных и регуляторных популяциях клеток иммунной системы и роль экологических факторов, т.е. микрофлоры, кишечной воспаление. В этой статье мы проиллюстрируем методику для индукции колита с протоколом шаг за шагом. Это Includes видео демонстрация основных технических аспектов, необходимых для успешного развития этого мышиной модели экспериментального колита, для научно-исследовательских целей.
Введение
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Убедитесь, что все протоколы животных утверждаются и в соответствии с Уходу за животными и использованию комитета (IACUC) правил и руководство Национального научно-исследовательского совета по уходу и использованию лабораторных животных. Мышей-доноров могут быть мужского или женского пола, но Мыши-реципиенты должны быть мужчины. Если женщины получатели, которые будут использоваться, донорские мышей должна быть женщина 5. Поддержание колоний, используя обычные, не стерильный постельные принадлежности и неподкисленному воду, так как они могут повлиять на кишечную микрофлору, и, таким образом, колит фенотип мышей 5,6.
1. Экспериментальная Подготовка
- Используйте ледяные СМИ и буферы. Хранить клеток на льду в течение всего эксперимента.
- Выполните эксперимент в стерильной биологической капот, используя стерильную технику.
2. Выделение селезенки Т-клеток
- Усыпить мыши-донора, / мышей в CO 2 камеры с последующим шейки dislocatioп. Спрей живота с 70% этанола.
- Сделайте горизонтальную разрез в брюшной полости и очистить от кожи, чтобы разоблачить брюшины. Держите брюшины от внутренних органов с помощью пинцета и сделать разрез в левой брюшной брюшины для выявления и акцизного селезенки.
- Поместите селезенки в 10 мл полной среды в чашке Петри. Снимите и выбросьте лишнюю ткань из селезенки.
- Используйте 2 стерилизованные стеклянные слайды, чтобы сокрушить и дразнить друг от друга селезенки в одной клеточной суспензии. Фильтр клеточной суспензии через 70 мкм сито в 50 мл коническую трубку и промыть сетчатый фильтр с 5 мл полной среды. Поместите до 5 селезенке в одном 50 мл коническую трубку.
- Центрифуга клетки при 450 мкг в течение 7 минут. Удалите супернатант с помощью слива или вакуумного всасывания в контейнер для отходов.
- Осторожно ресуспендирования клеток в 5 мл на селезенке лизирующего буфера для лизиса эритроцитов в течение 10 мин при комнатной температуре. Добавить равный объем в полной среде (5 мл) в селезенке к трубе. Центрифуга клетки при 450 мкг в течение 7 минут. Удалите супернатант с помощью слива или вакуумного всасывания в контейнер для отходов.
- Аккуратно ресуспендирования клеток в 10 мл маркировки буфера.
- Граф клеток от трипанового синего.
- Удалить 20 мкл клеточной суспензии и добавить к 180 мкл трипанового синего в пробирке и тщательно перемешивают. После 5 мин, добавить 10 мкл меченых клеток в гемоцитометра и посчитать, не синие клетки под микроскопом. Определить общее количество жизнеспособных клеток. Откажитесь клеток / трипанового синий микс.
- Центрифуга клетки в 10 мл буфера при маркировки 450 мкг в течение 7 мин. Удалите супернатант с помощью слива или вакуумного всасывания в контейнер для отходов.
3. Обогащение CD4 + Т-клеток
ПРИМЕЧАНИЕ: Следуйте инструкциям производителя для конкретных продуктов, используемых в этом разделе.
- Аккуратно ресуспендирования клеток в одной клеточной суспензии 20 х 10 6 клеток / мл в холодной этикеткиING буфера.
- Добавить 5 мкл на 1 х 10 6 клеток биотинилированными CD4 Т-антител обогащению клеток. Инкубируйте клетки на льду в течение 15 мин.
- Добавить 10x объем маркировки буфера. Центрифуга клетки при 450 × г в течение 7 мин. Тщательно аспирата все супернатант, используя вакуумный отсос в контейнер для отходов.
- Тщательно вихрь стрептавидин-сопряженных магнитных частиц. Добавить 5 мкл частиц на 1 × 10 6 клеток.
- Тщательно, но осторожно перемешать. Держите смесь на 6-12 ° С в течение 30 мин.
- Добавить Labeling буфера до концентрации 20-80 × 10 6 клеток / мл. Передача до 1,0 мл меченых клеток на 12 х 75 мм с круглым дном пробирки (упоминается как "положительно фракции трубки").
- Место каждого положительного фракции трубку на магните на 6-8 мин.
- С положительной фракции труб еще на магните, тщательно передачи супернатант из положительной фракции трубки со стеклянным Пастера пипетки на новый стерильные 50 мл коническую трубку (referreд как "обогащенной фракции"). Это обогащенную фракцию содержит CD4 + Т-клеток. Будьте осторожны, чтобы не нарушать меченых клеток, привлеченных к магниту.
- Ресуспендируют клеток осталось в положительной фракции труб в том же объеме и маркировки буфера, как в шаге 3,6 с помощью пипетки вверх и вниз энергично. Поместите положительной фракции трубку обратно на магните на 6-8 мин.
- С положительной фракции труб еще на магните, тщательно передачи супернатант (фракции, обогащенной, CD4 +) с положительным фракции трубки со стеклянным Пастера пипетки в стерильную 50 мл коническую трубку с шага 3,8, не нарушая клетки, прикрепленные к магниту.
- Повторите этапы 3.9-3.10, чтобы увеличить выход CD4 + Т-клеток, полученных. Продолжить протокол, используя обогащенную фракцию (CD4 + клеток).
4. Маркировка и сортировки клеток 7
- Центрифуга обогащенный клетки при 450 мкг в течение 7 минут. Удалите супернатант с помощью слива или вакуумный suctиона в контейнер для отходов.
- Ресуспендируют клеток в 1 мл маркировки буфера. Удалить аликвоту клеток рассчитывать и на предмет жизнеспособности клеток трипанового синего исключения, как в шаге 2.9.
- Добавить объем маркировки буфером 10 х 10 6 клеток / мл; Если клетки уже <10 х 10 6, центрифуги при 450 мкг в течение 7 минут, отбросить супернатант слива или вакуумного всасывания в контейнер для отходов, и добавить объем и маркировки буфером 10 х 10 6 клеток / мл.
- Настройка отдельных аликвот приблизительно 5-10 × 10 5 клеток на каждый из неокрашенных, изотипу окрашенных и отдельных окрашенных контрольными клетками в микроцентрифужные труб.
- Добавить 5 мкг / мл CD4-FITC и 1 мкг / мл CD45RB-PE к клеткам. Добавить контрольного изотипа пятна и отдельные пятна при той же концентрации в соответствующие аликвоты в микроцентрифужных пробирках. Все хорошо перемешать, но осторожно и инкубировать на защищенном от света в течение 30 мин льду.
- Добавить 10x объем маркировки буфера в клетки и контроляс. Центрифуга 450 мкг в течение 7 минут. Удалите супернатант с помощью вакуумного отсоса в контейнер для отходов.
- Ресуспендируют при маркировке буфером объемом в шаге 4.5. Центрифуга 450 мкг в течение 7 минут. Удалите супернатант с помощью вакуумного отсоса в контейнер для отходов.
- Ресуспендируют при маркировке буфером 10 х 10 6 клеток / мл. Pass клетки через 70 мкм сито в FACS трубы. Продолжайте не защищенном от света до готовности для FACS льда.
- Настройка и определять размер соответствующей компенсации на клеточного сортера с неокрашенных клеток и отдельных окрашенных элементов управления.
- Исключить нежизнеспособных клеток с Форвард и боковые рассеяния стробирования (рис 1А). Настройка стробирования для CD4 + и CD45RB + клеток с изотипных окрашенных элементов управления. Ворота клетки по населению CD4 +.
- Сортировка клеток CD4 + в CD45RB высоким и низким CD45RB популяций с использованием простой гистограммы для PE-окрашенных клеток в пробирки с 2 мл полной среды. CD45RB высокой населения представляет собой высший 40% CD4 + CD45RB + клеток (CD45RB высокой), и низкий населения CD45RB является самым низким 20% + CD45RB CD4 + клеток (CD45RB низким; фиг.1В).
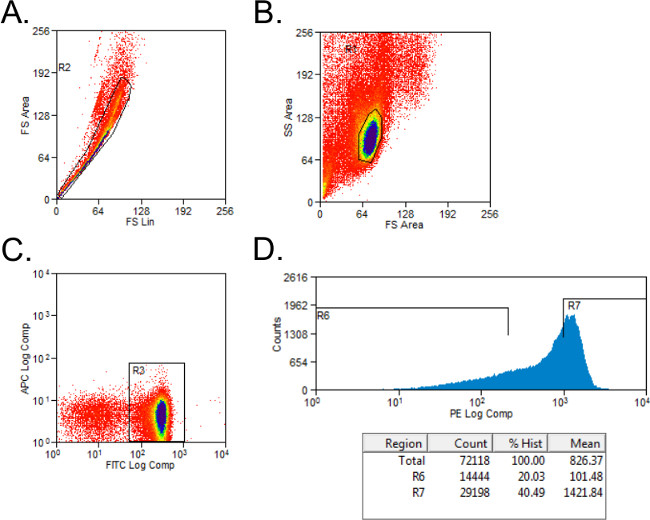
Рисунок 1: представитель проточной цитометрии участков популяции CD4 + Т-клеток CD45RB течение анализа FACS (- C), ФИТЦ CD4-РЕ и CD45RB окрашенных спленоцитов от доноров C57BL / 6 мышей, отсортированных по FACS в CD4 + CD45RB высокой и CD4 +. CD45RB населения с низким Т-клеток. События () Дуплет были исключены на передней диаграммы рассеяния. (В) Лимфоциты закрытого в передней и боковой диаграммы разброса. (С) CD4 + Т-клетки закрытого и (D) CD4 + CD45RB + Т-клетки были нанесены на ПЭ по сравнению с события гистограммы. CD4 + клетки CD45RB низкие считались самым низким 20% CD45RB + клеток. CD4 + клетки CD45RB высокие были определены как высший 40% CD45RB + клеток.
- Запустите аликвоту каждой клеточной популяции на машине FACS для оценки чистоты населения.
- Центрифуга сортируются клетки в 450 мкг в течение 7 минут. Ресуспендируют в 1 мл PBS. Удалить аликвоту клеток рассчитывать и на предмет жизнеспособности клеток трипанового синего исключения, как в шаге 2.9.
5. инъекции клеток реципиентов
- Ресуспендируйте сортируются клетки 4 х 10 6 клеток / мл (CD45RB высокий) или 2 х 10 6 клеток / мл (CD45RB низкий) в PBS.
- Передача 100 мкл CD45RB высоких клеток на реципиента к новым стерильную пробирку. Добавить 100 мкл PBS перполучателю этой трубки. Таким образом, общий объем впрыска каждого животного составляет 200 мкл, и общая сумма клеток на получателя 4 х 10 5 CD4 + CD45RB высокие наивные Т-клетки.
- Если экспериментальная группа, получающая Т регуляторных клеток желательно, передать 100 мкл CD45RB высоких клеток на одного получателя к новым стерильную пробирку. Добавить 100 мкл CD45RB низких клеток на получателя в одной пробирке. Общий объем инъекции в животных составляет 200 мкл; Отношение CD45RB высокого: CD45RB низких клеток составляет 2: 1.
- Вводите 100 мкл CD45RB высокой или CD45RB высокая / CD45RB низким CD4 + клетки внутрибрюшинно в правой и левой стороне живота (всего 200 мкл) каждого получателя.
6. Мониторинг прогрессирования заболевания в животных-реципиентов
- Для оценки клинического состояния животных-реципиентов, назначить совокупные клинические показатели на следующий parameteRS 8 в день инъекции, в неделю после этого, и во время умерщвления:
- Определить тратить путем измерения потери веса: 0 - нет потеря веса; 1 - 0,1-10% потери первоначальной массы тела; 2 - потери более 10% от исходной массы тела (фиг.2А).

Рисунок 2: Клинические и грубые патологические признаки воспаления происходят после передачи дикого типа CD4 + CD45RB высокой Т-клеток в RAG1 - / - и мышей получателей NRDKO 11 (A) получатели NRDKO потеряли в среднем 10% своих первоначальных массы тела на 5. недели после передачи, в то время как RAG1- / - Получатели не проявляют клинических признаков заболевания в настоящее время. Каждая точка представляет средний процент от начальной массы тела для когорты ± SEM. ** Р <0,005. (B) В некоторых мышей развилась тяжелая кишечное воспаление, о чем свидетельствует наличие ректального пролапса. Это показательная картина выпадения прямой кишки у реципиента мыши NRDKO. (C) Грубо, двоеточия от обоих RAG1 - / - и мышей получателей NRDKO утолщены и сократил по сравнению с двоеточия из RAG1 - / - и мышей NRDKO без Т-клеток приемных передачи. Колоны из мышей-реципиентов NRDKO показать сильное воспаление и увеличение веса двоеточие (данные не показаны). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
- Определение качества стула, поместив животное в чистый контейнер до тех пор, пока не пройдетстул: 0 - нет; 1 - мягкий стул; 2 - водянистые и / или кровавый стул.
- Определить общее состояние здоровья животного наличием следующих признаков заболевания: 0 - не выгибание спины, ощетинился мех, или повреждений кожи; 1 - любой из следующих признаков: сгорбившись позе, ощетинился мех, или повреждения кожи.
- Определить наличие ректального пролапса: 0 - отсутствует; 1 - присутствует (фиг.2В).
- Жертвоприношение животных СО 2 ингаляции с последующим смещением шейных позвонков, когда они потеряли 20% своего веса отправной тела или на нужную точку времени, в зависимости от того что наступит раньше. Клиническая форма болезни, как правило, очевидны, начиная с 5 недели после переполнения.
- Оценка для тяжести заболевания, как описано выше 5,7.
- Связать клинические показатели, как в шаге 6,1 8.
- Измерьте длину толстой кишки и вес (Рисунок 2C).
- Выполните гистологический анализ воспаления5.
- Определение спонтанной экспрессии цитокинов в культурах тканей кишечника эксплантов 9, брыжеечных лимфатических узлов 10, и / или сывороточный 11.
- Одним словом, для эксплантов культур 9, удалить двоеточия после жертвоприношения, открытый в продольном направлении, и чистый с PBS. Инкубируйте двоеточие на орбитальном шейкере при 250 оборотах в минуту в полной среде в течение 30 мин при комнатной температуре.
- Нарезать ткани на мелкие кусочки и инкубировали при 37 ° С в полной среде в течение 24 ч. Соберите супернатант и использовать для количественного определения цитокинов в 100 мг ткани ELISA.
- Выполните Экс Vivo характеристику клеток фенотипа Т и / или функции 10.
Access restricted. Please log in or start a trial to view this content.
Результаты
Приблизительно 10 × 10 6 CD4 + CD45RB высокой Т-клетки из селезенки 10 от взрослых мышей C57BL / 6 мышей-доноров являются надежно изолированы. Это количество будет варьироваться в зависимости от возраста и штамма мыши-донора и мастерства исследователя. Когда 4 х 10 5 C57BL / 6 CD4 +...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Здесь мы опишем протокол шаг за шагом, индуцирующий толстой воспаление у мышей приемных передачи CD4 + CD45RB + Т-клеток в иммунодефицитных мышей. Мы использовали C57BL / 6 доноров селезенки и сингенная RAG1 - / - мышей-реципиентов, хотя другие штаммы (например, BALB / с, 129S6 / S...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
Эта работа была поддержана Американской гастроэнтерологической ассоциации (AGA) ученых-исследователей премии и болезнь Крона и колит фонда Америки (CCFA) Карьера премии в области развития (в СЗС), NIH NIDDK F30 DK089692 (ЭКС), и Университета Северной Каролины Центра желудочно-кишечного тракта биологии и болезни Грант P30 DK34987 (гистология ядро). UNC проточной цитометрии основной комплекс поддерживается частично в результате NCI центральный внутренний грантовой поддержки (P30CA016086) к UNC Lineberger всеобъемлющем онкологического центра. Мы благодарим Люк Б. Borst из Государственного университета Северной Каролины колледжа ветеринарной медицины за помощь в гистопатологического анализа и иммуногистохимии.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
Ссылки
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416(2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437(2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены