JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
이펙터 CD4의 입양 전송하여 쥐과 장내 염증의 유도
요약
Here, we present a protocol to induce colonic inflammation in mice by adoptive transfer of syngeneic CD4+CD45RBhigh T cells into T and B cell deficient recipients. Clinical and histopathological features mimic human inflammatory bowel diseases. This method allows the study of the initiation of colonic inflammation and progression of disease.
초록
인간의 염증성 장 질환 (IBD), 자신의 장점과 단점 각각의 발병 기전을 연구에 사용할 수 많은 다른 동물 모델이 있습니다. 우리는 여기에서 T 및 B 세포 결핍 마우스에게 수신자 동계 비장 CD4 + T CD45RB 높은 세포의 대체 전송에 의해 개시되는 실험적 대장염 모델을 설명한다. 나이브 크게 이펙터 세포로 구성되어 CD4 + T CD45RB 높은 세포군 밀접 인간 IBD의 주요 측면을 닮은, 만성 장염을 유도 할 수있다. 이 방법은 질병의 발병과 진행의 측면을 연구하기 위해 조작 할 수 있습니다. 또한 그것은 장내 염증 즉, 타고난, 적응의 기능 및 규제 면역 세포 인구, 환경 노출의 역할, 미생물을 연구하는 데 사용할 수 있습니다. 이 문서에서 우리는 단계별 프로토콜 대장염을 유도하는 방법을 설명한다. 이 INCludes 성공적 연구 목적 대장염이 실험 쥐 모델을 개발하기 위해 필요한 키의 기술적 측면에 비디오 데모.
서문
The inflammatory bowel diseases (IBD) Crohn’s disease and ulcerative colitis result from an incompletely defined and complex interaction between host immune responses, genetic susceptibility, environmental factors, and the enteric luminal contents1. Recent genome-wide association studies report associations between immune cell regulatory genes and IBD susceptibility2,3. Both innate and adaptive immune cell intrinsic genes are represented in these studies, indicating a central role for these cell populations in IBD pathogenesis.
There currently exist more than 50 animal models of human IBD. While no one model perfectly phenocopies human IBD, many are useful for studying various aspects of human disease, including disease onset and progression and the wound-healing response. In the method described here, intestinal inflammation is initiated with syngeneic splenic CD4+CD45RBhigh T cell adoptive transfer into T and B cell deficient recipient mice4. The CD4+CD45RBhigh T cell population contains mainly naïve T cells primed for activation that are capable of inducing chronic small bowel and colonic inflammation. This method allows the researcher to modify key experimental variables, including both innate and adaptive immune cell populations, to answer biologically relevant questions relating to disease pathogenesis. Additionally, this method provides precise initiation of disease onset and a well-characterized experimental time course. This permits the kinetic study of clinical features of disease progression in mice. Intestinal inflammation induced by this method shares many features with human IBD, including chronic large and small bowel transmural inflammation, pathogenesis driven by cytokines such as TNF and IL-12, and systemic symptoms such as wasting5. Thus, it is an ideal model system for studying the pathogenesis of human IBD.
The method here describes in detail the protocol for inducing experimental colitis by adoptive transfer of CD4+CD45RBhigh T cells into Rag1-/- mice. We discuss key technical steps, expected results, optimization, and trouble-shooting. We address the required elements for the successful development of this murine model of intestinal inflammation for research purposes.
Access restricted. Please log in or start a trial to view this content.
프로토콜
참고 : 모든 동물의 프로토콜에 의해 실험 동물의 관리 및 사용을위한 기관 동물 관리 및 사용위원회 (IACUC) 규정 및 국가 연구위원회의 가이드를 준수 승인되어 있는지 확인합니다. 기증자 마우스는 남성 또는 여성이 될 수 있지만,받는 사람 마우스는 남성이어야한다. 여성 수신자가 사용되는 경우, 도너 5 암컷 쥐이어야한다. 따라서, 마우스 5,6의 대장염 표현형을 이러한 장내 미생물에 영향을 미칠 수 있으므로, 정기적으로, 비 살균 침구 및 비 산성화 된 물을 사용하여 식민지를 유지합니다.
1. 실험 준비
- 얼음처럼 차가운 미디어와 버퍼를 사용합니다. 실험을하는 동안 얼음에 세포를 보관하십시오.
- 멸균 기술을 사용하여 멸균 생물 학적 후드에서 실험을 수행합니다.
비장 T 세포의 격리 2.
- 기증자 마우스 / CO에 마우스 자궁 dislocatio에 의해 2 챔버 따라 안락사N. 70 % 에탄올로 복부 스프레이.
- 복부에 수평 절개를하고 복막을 노출 피부를 벗겨. 멀리 집게와 내부 장기에서 복막 잡고 노출과 비장을 절제하는 왼쪽 복부 복막에 절개를합니다.
- 페트리 접시에 전체 미디어 10ml에 비장를 놓습니다. 제거하고 비장에서 초과 조직을 폐기합니다.
- 분쇄 및 단일 세포 현탁액에 비장 떨어져 애타게 2 멸균 유리 슬라이드를 사용합니다. 필터 셀 50 ML 원뿔 튜브에 70 μm의 여과기를 통해 서스펜션과 전체 미디어의 5 ml로 여과기를 씻어. 한 50 ML 원뿔 튜브에 5 비장까지 놓습니다.
- 7 분 450 XG에 원심 분리기 세포. 쏟아 또는 폐기물 용기에 진공 흡입에 의해 상층 액을 제거한다.
- 조심스럽게 10 분 동안 실온에서 적혈구를 용해하는 용해 완충액 비장 당 5 ml의 세포를 재현 탁. 튜브 전체 미디어 동량 (비장 당 5 ㎖)를 첨가.
- 원심 분리기 세포 7 분 450 XG에. 쏟아 또는 폐기물 용기에 진공 흡입에 의해 상층 액을 제거한다.
- 부드럽게 라벨링 완충액 10ml에 세포를 재현 탁.
- 트리 판 블루 배제하여 세포를 계산합니다.
- 세포 현탁액의 20 μl를 제거하고 미세 원심 튜브에 180 μL 트리 판 블루에 추가하고 잘 혼합. 5 분 후, 혈구와 현미경이 아닌 파란색 셀을 계산하는 세포를 표지 10 μl를 추가합니다. 가능한 세포의 수를 결정합니다. 세포 / 트리 판 블루 믹스를 폐기하십시오.
- 7 분 450 XG에 라벨링 버퍼 10 ㎖의 원심 분리기 세포. 쏟아 또는 폐기물 용기에 진공 흡입에 의해 상층 액을 제거한다.
CD4 + T 세포의 보충 3.
참고 :이 섹션에서 사용되는 특정 제품에 대한 제조업체의 지침을 따르십시오.
- 부드럽게 감기 레이블 20 × 106 세포 / ㎖ 단일 세포 현탁액으로 세포를 재현 탁ING 버퍼.
- 바이오틴 CD4 T 세포 농축 항체의 1 × 10 6 세포 당 5 μl를 추가합니다. 시료를 얼음에서 15 분 동안 세포를 배양한다.
- 라벨링 버퍼의 10 배 볼륨을 추가합니다. 7 분 동안 450 × g에서 원심 분리기 세포. 조심스럽게 폐기물 용기에 진공 흡입을 사용하여 모든 뜨는을 대기음.
- 철저하게 스트렙 타비 딘 - 복합 자성 입자를 소용돌이. 1 × 10 6 세포 당 입자의 5 μl를 추가합니다.
- 철저하게 조심스럽게 섞는다. 30 분 동안 6-12 ℃에서 혼합 보관하십시오.
- 20-80 × 106 세포 / ml의 농도로 라벨링 버퍼를 추가한다. 12 X 75mm 환저 시험관 당 세포 표지를 1.0ml까지 이동 ( "포지티브 분획 튜브"라고 함).
- 6-8 분 동안 자석의 각 포지티브 분수 튜브를 놓습니다.
- 자석에 여전히 긍정적 인 분율 튜브, 신중 (새로운 멸균 50 ML 원뿔 튜브에 유리 파스퇴르 피펫으로 포지티브 분수 관에서 referre을 뜨는 전송"풍부한 부분") 등을 개발. 이 농축 분획은 CD4 + T 세포가 포함되어 있습니다. 자석에 매력을 표지 세포를 방해하지 않도록주의하십시오.
- 재현 탁 된 세포를 피펫 팅 다운 격렬함으로써 단계 3.6과 같이 레이블링 완충액 동일한 체적 분률 포지티브 튜브에 남아. 6-8 분 동안 다시 자석에 긍정적 - 분수 튜브를 놓습니다.
- 자석에 여전히 긍정적 인 분율 튜브,주의 깊게 자석에 부착 된 세포를 방해하지 않고 50 ㎖를 단계 3.8에서 원뿔 튜브를 멸균하기 위해 유리 파스퇴르 피펫으로 포지티브 분수 관에서 상층 액 (농축 분수, CD4 +)를 전송합니다.
- 반복하여 얻은 CD4 + T 세포의 수율을 증가시키는 단계를 3.9-3.10. 농축 분획 (CD4 + 세포)를 사용하여 프로토콜을 계속합니다.
4. 라벨링 및 정렬 셀 (7)
- 원심 분리기는 7 분 동안 450 XG에 세포를 농축. 또는 진공 suct을 부어 상층 액을 제거한다폐기물 용기에 이온.
- 레이블 버퍼 1 ㎖에 재현 탁 세포. 계산하는 단계 2.9에서와 같이 트리 판 블루 배제에 의해 세포 생존 능력에 대해 평가하기 위해 세포의 나누어지는을 제거합니다.
- 10 × 106 세포 / ml로 라벨링 완충액 볼륨을 추가; 세포가 이미있는 경우 <10 × 10 (6), 7 분 450 XG에 원심 분리기는, 폐기물 용기에 쏟아 또는 진공 흡입에 의해 상층 액을 버린다, 10 × 10 6 세포 / ㎖로 라벨링 버퍼의 볼륨을 추가합니다.
- 미세 원심 튜브에 이소 염색, 흠, 및 단일 염색 대조군 세포에 대해 약 5 ~ 10 × 10 5 세포 각각의 별도의 분취 량을 설정합니다.
- 세포에 5 ㎍ / ㎖의 CD4-FITC와 1 ㎍ / ㎖의 CD45RB-PE를 추가합니다. 미세 원심 튜브에 분주 적절한 동일한 농도로 이소 제어 얼룩과 하나의 얼룩을 추가합니다. 물론 조심스럽게 혼합하고 30 분 동안 빛으로부터 보호 얼음에 품어.
- 세포 및 제어 라벨링 버퍼의 10 배 볼륨을 추가의. 7 분 동안 원심 분리기 450 XG. 폐기물 용기에 진공 흡입하여 상층 액을 버린다.
- 4.5 단계에서 볼륨 레이블 버퍼에 재현 탁. 7 분 동안 원심 분리기 450 XG. 폐기물 용기에 진공 흡입하여 상층 액을 버린다.
- 10 × 106 세포 / ml로 재현 탁 완충액 라벨링. FACS 튜브에 70 μm의 스트레이너를 통해 세포를 전달합니다. FACS를 위해 준비 될 때까지 빛으로부터 보호 얼음에 보관하십시오.
- 설정하고 흠없는 세포와 단일 얼룩진 컨트롤 셀 소터에 대한 적절한 보상을 결정합니다.
- 정방향 및 측면 산란 게이트 (그림 1A)와 생존 할 세포를 제외합니다. 이소 염색 컨트롤 CD4 +와 CD45RB + 세포 게이팅 설정합니다. CD4 + 인구에 게이트 셀.
- 전체 미디어 2 ㎖와 튜브에 PE-염색 된 세포에 대한 간단한 히스토그램을 사용하여 높은 CD45RB 및 CD45RB 낮은 집단으로 분류 CD4 + 세포. 높은 CD45RB 인구 + CD4 + 세포 CD45RB (높은 CD45RB)의 최고 40 %를 나타내고, 낮은 인구 CD45RB + CD4 + 세포의 CD45RB 최저 20 % (저 CD45RB도 1B).
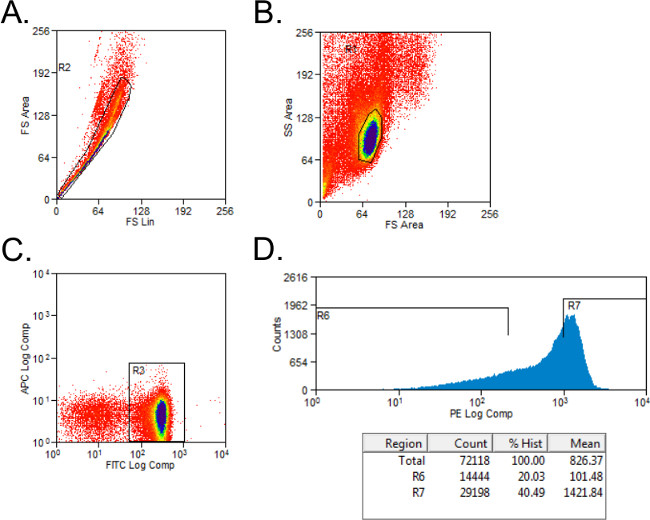
그림 1 : FACS 분석 중 CD4 + CD45RB T 세포 인구의 플롯 세포 계측법 대표 흐름 (A - C) FITC CD4- 및 PE에 FACS으로 분류 된 기증자 C57BL / 6 마우스의 비장 세포를 CD45RB가 묻은 CD4 + CD45RB 높은 CD4 +. CD45RB 낮은 T 세포 인구. (A) 이중선 이벤트는 앞으로 산포도에서 제외 하였다. (B) 림프구는 전방 및 측면 산란 음모에 문이되었다. (C) CD4 + T 세포를 게이팅하고, (D) CD4 + CD45RB + T 세포 대 PE 이벤트 히스토그램 플롯 하였다. 낮은 CD4 + 세포 CD45RB CD45RB + 낮은 세포의 20 %로 간주 하였다. CD4 + 세포는 높은 CD45RB CD45RB + 세포의 최고 40 %로 정의 하였다.
- 인구의 순도를 평가하기 위해 FACS 시스템에서 각 셀 인구의 나누어지는을 실행합니다.
- 원심 분리기는 7 분 동안 450 XG에 세포를 분류. 1 ml의 PBS에 재현 탁. 계산하는 단계 2.9에서와 같이 트리 판 블루 배제에 의해 세포 생존 능력에 대해 평가하기 위해 세포의 나누어지는을 제거합니다.
받는 사람으로 세포의 5. 주입
- 재현 탁 4 × 106 세포 / ㎖ (CD45RB 높음) 또는 PBS에 2 × 106 세포 / ㎖ (낮은 CD45RB)에 셀을 정렬.
- 새로운 멸균 튜브에받는 사람 당 CD45RB 높은 세포 100 μl를 전송합니다. PBS의 당 100 μl를 추가이 튜브에받는 사람. 따라서, 동물 당 총 주입량 200 μL, 그리고받는 사람 당 세포의 총량은 4 × 10 5 CD4 + CD45RB 고 나이브 T 세포이다.
- T 조절 세포를 수신 한 실험군이 요구된다면, 새로운 멸균 튜브에 수신자 당 CD45RB 높은 세포 100 ㎕를 전송. 같은 튜브에받는 사람 당 CD45RB 낮은 세포의 100 μl를 추가합니다. 동물 당 총 주입 부피는 200 μL이다; CD45RB 높은 비율 : CD45RB 낮은 세포는 2 : 1입니다.
- 고 / CD45RB 낮은 CD4 + 세포 복강 각받는 사람의 복부 (200 μL의 총)의 오른쪽과 왼쪽에 CD45RB 높거나 CD45RB 100 ㎕를 주입한다.
받는 사람 동물에서 질병 진행의 6. 모니터링
- 받는 사람 동물의 임상 상태를 평가하고 다음 paramete 집계 임상 점수를 할당하려면주사의 날에 RS 8 주간 이후, 희생의 시간 :
- 체중 감량을 측정하여 낭비 결정 : 0 - 아니 체중 감소; 1 - 초기 체중의 0.1 ~ 10 %의 손실; 2 - 초기 체중 (도 2A)의 10 % 이상 손실.

그림 2 : 염증의 임상 및 병리학 적 징후 Rag1에 야생 형 CD4 + CD45RB 높은 T 세포의 이동 이후에 발생하는 - / - 11 (A) NRDKO받는 사람 (5)에 의해 초기 체중의 평균 10 %에 손실 NRDKO받는 사람 마우스.이 주 전송 이후, Rag1 반면,- / -받는 사람은이 시간에 질병의 임상 증상을 나타내지 않았다. 각 점은 SEM ± 코호트에 대한 초기 체중의 평균 비율을 나타냅니다. **, P <0.005. 직장 탈출증의 존재에 의해 입증되는 바와 같이 (B) 몇몇 마우스는 장내 심한 염증을 개발했다. 이 NRDKO받는 사람 마우스에서 직장 탈출증의 대표적인 사진입니다. (C) 육안에서 콜론 모두 Rag1 - / - 및 NRDKO받는 사람 마우스 Rag1에서 콜론에 비해 두꺼워 짧게 - / - 및 T 세포 입양 전송하지 않고 NRDKO 마우스. NRDKO받는 사람 마우스의 콜론은 심한 염증 증가 대장 무게 (데이터가 표시되지 않음)를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 이 사라질 때까지 깨끗한 용기에 동물을 배치하여 대변의 질을 결정의자 : 0 - 없음; 1 - 부드러운 의자; 2 - 물 및 / 또는 혈변.
- 질병의 다음 증상의 존재에 의해 동물의 건강을 결정하지 : 0 - 더 웅크 리고 자세를, 모피, 또는 피부 병변을 곤두; 1 - 다음 현재의 어느 한 웅크 자세, 모피, 또는 피부 병변을 곤두.
- 직장 탈출증의 존재 결정 : 0 - 결석을; 1 - 현재 (그림 2B).
- 그들의 초기 체중의 20 %를 손실 또는 제 도래 원하는 시점에서 CO 때 의해 경추 탈구이어서이 흡입을 희생이. 임상 질환은 주 5 사후 충만에서 시작 일반적으로 알 수있다.
- 이전 5,7 설명 된대로 질병 심각도 평가합니다.
- 단계 6.1 8과 임상 점수를 할당합니다.
- 대장의 길이와 무게 (그림 2C)를 측정한다.
- 염증의 조직 학적 분석을 수행5.
- 장 조직 절편 배양 9 자연 사이토 카인의 발현을 결정, 장간막 림프절은 10 노드, 및 / 또는 혈청 (11).
- 간단히, 이식편 문화 9, 길이 방향으로 개방, 희생 후 콜론을 제거하고 PBS와 깨끗한. 실온에서 30 분 동안 완전 배지에서 250 rpm으로 설정 한 궤도 진탕 기에서 인큐베이션 콜론.
- 작은 조각으로 조직을 잘라 24 시간 동안 전체 미디어에 37 ° C에서 배양. 상층 액을 수집하고 ELISA 100 mg의 조직 당 사이토 카인의 정량을 위해 사용합니다.
- T 세포 표현형 및 / 또는 기능 (10)의 생체 특성을 수행합니다.
Access restricted. Please log in or start a trial to view this content.
결과
약 성체 C57BL / 6 마우스 공여체 비장에서 10 내지 10 × 106 CD4 + CD45RB 높은 T 세포를 확실하게 분리된다. 이 숫자는 나이와 변형 기증자 마우스 및 연구자의 능력에 따라 달라집니다. 때 4 × 6 CD4 + CD45RB 높은 T 세포는 C57BL / 6 Rag1로 전송됩니다 / 10 5 C57BL - / -받는 사람 마우스, 질병의 임상 증상은 주 5 사후 충만 주위에 등장 또는 마우스 (?...
Access restricted. Please log in or start a trial to view this content.
토론
여기에서 우리는 면역 결핍 쥐에 CD4 + CD45RB + T 세포의 입양 전송에 의해 쥐에서 대장 염증을 유발하는 단계별 프로토콜을 설명합니다. 받는 사람 마우스 다른 균주 있지만 (예를 들어, BALB / C, 129S6 / SvEv, 비만이 아닌 당뇨병 (NOD)) 면역 결핍과 유전 적 모델 (예를 들어, SCID, Rag2 - / - 우리는 C57BL / 6 기증자 비장과 동계 Rag1을 사용 - / -)도 4,14-16 사...
Access restricted. Please log in or start a trial to view this content.
공개
The authors declare that they have no competing financial interests.
감사의 말
이 작품은 미국 소화기 학회 (AGA) 연구 학자 상과 크론과 미국 (CCFA) (ECS에) (SZS에) 경력 개발 상, NIH NIDDK의 F30의 DK089692의 대장염 재단과 위장 생물 노스 캐롤라이나 센터의 대학에 의해 지원되었다 과 질병 부여 P30의 DK34987 (조직학 코어). UNC 유동 세포 계측법 핵심 시설은 UNC Lineberger 종합 암 센터 NCI 센터 코어 지원 그랜트 (P30CA016086)에 의해 부분적으로 지원됩니다. 우리는 조직 병리학 적 분석과 면역 조직 화학 그의 도움을 동물 용 의약품의 노스 캐롤라이나 주립 대학에서 누가 B. BORST 감사합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| 10x PBS | Gibco | 14200075 | |
| 12 mm x 75 mm round-bottom tube | Falcon | 352052 | |
| 15 ml conical | Corning | 430790 | |
| 26 G x 3/8 Needle | BD Biosciences | 305110 | |
| 50 ml conical | Corning | 430828 | |
| 70 μm Cell Strainer | Fisherbrand | 22363548 | |
| BD IMagnet | BD Biosciences | 552311 | |
| β-mercaptoethanol | Thermo Scientific | 35602 | |
| CD4-FITC IgG2b | eBioscience | 11-0041 | |
| CD45RB-PE IgG2a | BD Pharminogen | 553101 | |
| Complete Media | RPMI-1640, 1% Pen/Strep, 10% FBS, 0.0004% β-ME | ||
| FACS tube + strainer | BD Falcon | 352235 | |
| Glass Microscope Slides | Fisherbrand | 12550A3 | |
| Heat-inactivated FBS | Gemini | 100-106 | |
| Labeling Buffer | 1x PBS, 0.5% BSA, 2 mM EDTA | ||
| Lysis Buffer | 0.08% NH4Cl, 0.1% KHCO3, 1 mM EDTA | ||
| MoFlo XDP | Beckman Coulter | ||
| Mouse CD4 T lymphocyte Enrichment Set - DM | BD Biosciences | 558131 | |
| Mouse IgG2a-PE | BD Pharminogen | 553457 | |
| Mouse IgG2b-FITC | eBioscience | 11-4732 | |
| Pasteur pipet | Fisherbrand | 13-678-20D | |
| Penicillin-Streptomycin Solution, 100X | Corning Cellgro | 30-002-CI | |
| [header] | |||
| Petri Dish | Fisherbrand | 875713 | |
| Pure Ethanol 200 Proof | Decon Labs | 2705-HC | |
| RPMI-1640 | Gibco | 11-875-093 | |
| Syringe | BD Biosciences | 309597 | |
| Trypan blue | Corning Cellgro | 25-900-CI | |
| Wash Media | RPMI-1640, 1% Pen/Strep, 0.0004% β-ME | ||
참고문헌
- Xavier, R. J., Podolsky, D. K. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 448 (7152), 427-434 (2007).
- Cho, J. H., Brant, S. R. Recent insights into the genetics of inflammatory bowel disease. Gastroenterology. 140 (6), 1704-1712 (2011).
- Jostins, L., et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease. Nature. 491 (7422), 119-124 (2012).
- Powrie, F., Leach, M. W., Mauze, S., Caddle, L. B., Coffman, R. L. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 5 (11), 1461-1471 (1993).
- Ostanin, D. V., et al. T cell transfer model of chronic colitis: concepts, considerations, and tricks of the trade. Am J Physiol Gastrointest Liver Physiol. 296 (2), 135-146 (2009).
- Ma, B. W., et al. Routine habitat change: a source of unrecognized transient alteration of intestinal microbiota in laboratory mice. PLoS One. 7 (10), e47416(2012).
- Read, S., Powrie, F. Induction of inflammatory bowel disease in immunodeficient mice by depletion of regulatory T cells. Curr Protoc Immunol. Chapter 15 (Unit 15 13), (1999).
- Maillard, M. H., et al. The Wiskott-Aldrich syndrome protein is required for the function of CD4(+)CD25(+)Foxp3(+) regulatory T cells. J Exp Med. 204 (2), 381-391 (2007).
- Hegazi, R. A., et al. Carbon monoxide ameliorates chronic murine colitis through a heme oxygenase 1-dependent pathway. J Exp Med. 202 (12), 1703-1713 (2005).
- Kole, A., et al. Type I IFNs regulate effector and regulatory T cell accumulation and anti-inflammatory cytokine production during T cell-mediated colitis. J Immunol. 191 (5), 2771-2779 (2013).
- Kobayashi, T., et al. NFIL3-deficient mice develop microbiota-dependent, IL-12/23-driven spontaneous colitis. J Immunol. 192 (4), 1918-1927 (2014).
- Steinbach, E. C., et al. Innate PI3K p110delta Regulates Th1/Th17 Development and Microbiota-Dependent Colitis. J Immunol. 192 (8), 3958-3968 (2014).
- Kobayashi, T., et al. NFIL3 is a regulator of IL-12 p40 in macrophages and mucosal immunity. J Immunol. 186 (8), 4649-4655 (2011).
- Leach, M. W., Bean, A. G., Mauze, S., Coffman, R. L., Powrie, F. Inflammatory bowel disease in C.B-17 scid mice reconstituted with the CD45RBhigh subset of CD4+ T cells. Am J Pathol. 148 (5), 1503-1515 (1996).
- Powrie, F., et al. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45RBhi CD4. T cells. Immunity. 1 (7), 553-562 (1994).
- Read, S., Malmstrom, V., Powrie, F. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J Exp Med. 192 (2), 295-302 (2000).
- Rogers, G. B., et al. Functional divergence in gastrointestinal microbiota in physically-separated genetically identical mice. Sci Rep. 4, 5437(2014).
- Fukata, M., et al. The myeloid differentiation factor 88 (MyD88) is required for CD4+ T cell effector function in a murine model of inflammatory bowel disease. J Immunol. 180 (3), 1886-1894 (2008).
- Kurtz, C. C., et al. Extracellular adenosine regulates colitis through effects on lymphoid and nonlymphoid cells. Am J Physiol Gastrointest Liver Physiol. 307 (3), 338-346 (2014).
- Naganuma, M., et al. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunol. 177 (5), 2765-2769 (2006).
- Ranatunga, D. C., et al. A protective role for human IL-10-expressing CD4+ T cells in colitis. J Immunol. 189 (3), 1243-1252 (2012).
- Srikrishna, G., et al. Carboxylated glycans mediate colitis through activation of NF-kappa. B. J Immunol. 175 (8), 5412-5422 (2005).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131 (4), 1153-1163 (2006).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유