Method Article
Microbead השרשה בעובר דג הזברה
In This Article
Summary
The zebrafish is an excellent model system for genetic and developmental studies. Bead implantation is a valuable tissue manipulation technique that can be used to interrogate developmental mechanisms by introducing alterations in local cellular environments. This protocol describes how to perform microbead implantation in the zebrafish embryo.
Abstract
דג הזברה התפתחה כמערכת מודל גנטית יקרת ערך לחקר ביולוגיה ומחלות התפתחותיות. דג הזברה לשתף רמה גבוהה של שימור הגנומי, כמו גם דמיון בתהליכים תאיים, מולקולריים, ופיסיולוגיים, עם חוליות אחרות כולל בני אדם. במהלך ontogeny המוקדם, עוברי דג הזברה הם שקופים אופטי, המאפשרים לחוקרים לחזות את הדינמיקה של organogenesis באמצעות סטראו פשוט. השתלת Microbead היא שיטה המאפשרת מניפולציה של רקמות באמצעות השינוי של גורמים בסביבה מקומית. זה מאפשר לחוקרים assay את ההשפעות של כל מספר של מולקולות איתות של עניין, כגון פפטידים מופרשים, בנקודות מרחב ובזמן ספציפיות בעובר המתפתח. כאן, אנו פרטנו פרוטוקול לכיצד לתפעל וחרוזים שתל במהלך התפתחות מוקדמת דג הזברה.
Introduction
חוקרי ביולוגיה התפתחותית לנצל מגוון רחב של שיטות סלולריות, מולקולריות, וגנטיות לחשוף את המנגנונים ששולטים באופן האורגניזם נוצר. בין גישות אלה, מניפולציה רקמות היא כלי מרכזי בפענוח שאלות מורכבות על גורל תא, תנועה סלולרית, והארגון של רקמות. דרך אחת לשנות סביבות רקמות מקומיות היא באמצעות היישום כירורגית של microbeads המשמשים כדי לספק מקור מוקד של חלבונים או מולקולות איתות אחרות 1. סוג זה של מניפולציה ניסויית יושם באופן נרחב במודלים קלאסיים חוליות אמבריולוגיה, כגון צפרדע וחומוס 2.
דג הזברה הפכה אורגניזם מודל חוליות חשוב לחקר organogenesis וגם מספקת יתרונות רבים ייחודיים לדוגמנות מחלה 3-5 כפי שהם חולקים שימור גנטי גבוה עם בני אדם 6. ב, השקיפות האופטית מסוימת ולשעברפיתוחן פנימי של עובר דג הזברה מציע נקודת מבט שאין כמוהו לתצפית של ontogeny הרקמה 3-5. היישום של מסך גנטי קדימה בקנה מידה גדולה יצר מאגר עוצמה של זנים מוטנטים דג הזברה למחקר נוסף 7,8, וזיהוי של טכניקות הקרנה חלופיות שניתן לבצע ביעילות בקנה מידה מופחתת במעבדות בודדות 9,10. בהמשך עבודה ניסויית עם דג הזברה כבר מתאפשרת באמצעות התקדמות בשיטות מהונדסים גנטיות ולהפוך גישות 11,12, כמו גם גנטיקה כימית 13-15.
טכניקות מניפולציה רקמה, כגון היישום של microbeads, לא היו מועסקים באופן נרחב בדג הזברה, אבל בכל זאת לספק כלי שימושי להבנה נוספת איתות תא במהלך התפתחות. השתלת Microbead נעשתה שימוש כדי לחקור את תהליכי היווצרות של איבר ברשתית דג הזברה16,17, 18 לב, מוח 19-22, עצבי פסגה 23, ו24,25 סנפיר. במחקרים אלה ואחרים, חרוזים יושמו במהלך ההתפתחות להבין את דיפוזיה של מולקולות איתות 26, איך להשפיע הדרגתיים תא הגירה 27 ודפוסים צירי 28. לאחרונה, microbeads כבר נוצל כדי להעריך מנגנוני התחדשות במבוגרים דג הזברה 29. במחקרים התפתחותיים, למשל, עבודת microbead דג הזברה סיפקה תובנות לתוך מנגנוני היווצרות איבר באמצעות מחקרים של 25 סנפיר החזה. ניצן סנפיר חזה דג הזברה הוא הומולוגי לניצן forelimb ב -30 העכבר וחומוס 31. יש ניצן איבר חוליות שני צמתים איתות חיוניים: אזור פעילות קיטוב (ZPA) שקובע את הציר הקדמי-אחורי ל- דרך הביטוי של קיפוד סוניק (ששש) ומטרות גן קופסא מבנה במורד הזרם,ורכס ectodermal הפסגה (AER) נכח בקצה איבר הניצן, הפועל להקמה הפרוקסימלי לזהות הדיסטלי של האיבר דרך ביטוי של גורמי גדילת פיברובלסטים (Fgfs). על ידי השתלת microbeads FGF נספג מוטציות גנטיות ששש דג הזברה, חוקרים זיהה FGF כחיוני להתקדמות מחזור התא והצמיחה של איבר החוליות 25. בנוסף ל מפלים FGF ושש מאותת כי לבסס את זהות positional, מחקריו החלוציים באמצעות ניצן איבר החומוס מזוהה חומצה רטינואית (RA) כמולקולה שיכול לחקות את הפעולה של אזור הקיטוב להקים קדמי לאחוריים זהות 32. ניסויים אלה מעורבים הצבת רצועות קטנות של נייר Whatman ספוג-RA לאיבר החומוס להעריך דפוסי ספרה 32. יתר על כן, חוקרים ביצעו מחקרים אלגנטיים אחרים המעסיקים את השימוש בmicrobeads, השתלת תאים, ואקסוגנייםטיפולי דלקת מפרקים שגרונית בדג הזברה לקבוע כי RA פועל למתן רמזי positional ארוך טווח במוח האחורי והמזודרם 28 דג הזברה. עם זאת, כיום שאלות רבות נותרו על התפקידים של איתות גורמים כמו FGF ודלקת מפרקים שגרוני בהיבטים רבים של פיתוח חוליות. השפעות האיתות של דלקת מפרקים שגרונית, מתנהג כמו מורפוגן, להשפיע איברים רבים 33, כמו לב פיתוח 34 ואבות הכליות, דלקת מפרקים שגרונית שבי מציין תאי כליה הפרוקסימלי הקלד גורל 35-39. הבנה נוספת של נושאים כגון יכולה להפיק תועלת משמעותית ממחקרי ניסויים תוך שימוש בטכניקות מניפולציה רקמות והשתלת microbead.
בעוד פחות מחקרים שבוצעו עם השתלת microbead בדג הזברה, בהשוואה לדגמים כמו החומוס, אלה שבוצעו היו מאוד אינפורמטיבי. אחת סיבות למיעוט השתלת microbead המבוסס על מחקר בעובר דג הזברה היא likely הרעיון שיש אתגרים טכניים קשים, בהתבסס על הגודל של העובר, המהווה מכשול לביצוע מניפולציות בהצלחה כזו. עם זאת, השתלת microbead בעוברי דג הזברה ניתן ללמוד עם תרגול וסיוע באמצעות תצפית חזותית של הטכניקה, ולכן יכולה להיות רדוף כאמצעי לחקור את המנגנונים של פיתוח. הנה, אנחנו מדגימים את היישום המדויק של microbead לעובר דג הזברה, אשר יכול להיות מנוצל לביצוע מגוון רחב של מבחני על היווצרות רקמה והמורפוגנזה סלולרית.
Protocol
הנהלים לעבודה עם עוברי דג הזברה מתוארים בפרוטוקול זה אושרו על ידי ועדת הטיפול ושימוש בבעלי חיים המוסדיים באוניברסיטת נוטרדאם.
פתרון ההכנה של 1. רינגר
- הפוך פתרון של 116 מ"מ NaCl, 2.9 מ"מ KCl, 3.6 מ"מ CaCl 2, ו 5 Hepes מ"מ עם H 2 O ultrapure באמצעות ערבוב מתמיד כדי למנוע כל משקעים מלח.
- לאחר הוספת מלחים ואילו הפתרון עדיין ערבוב, להוסיף 100 יחידות / פניצילין לכל מ"ל ולכל מיליליטר 100 מיקרוגרם סטרפטומיצין.
- לאחר הוספת כל האנטיביוטיקה ומלחים, לבצע עיקור מסנן של הפתרון והחנות במכל סטרילי.
הערה: N-Phenylthiourea ניתן להוסיף (1-פניל-2-thiourea) או PTU לפתרון של רינגר לחסום את ההיווצרות של פיגמנט בעוברים מושתלים חרוז ללא השלכות שליליות לבריאות עובר. כדי להכין פתרון החסימה / פיגמנטציה רינגר, להשתמש concentration של PTU 0.003%. בשל הריכוז הנמוך של PTU יש להוסיף מומלץ כי נפח גדול יותר של תמיסת רינגר להתבצע, L לפחות 1, כדי להימנע מהוספת כמויות זעירות של אבקת PTU. להוסיף PTU בשלב 1.2, ואילו פתרון ערבוב.
2. Tricaine פתרון הכנה
- הוסף 2 גרם של אתיל-3 aminobenzoate מלח methanesulfonate (Tricaine) לליטר של פתרון בתוספת 0.1 M טריס, ממניות 1 M מאוזנים לpH של 9.5 ועשה עם ultrapure H 2 O.
הערה: Tricaine ישמש להרדים את עוברי דג הזברה בנקודת הזמן הרצוי לassay פנוטיפים השתלת חרוז.
3. E3 פתרון הכנה
- הפוך פתרון של 0.25 M NaCl, 10 מ"מ KCl, 12.5 מ"מ CaCl 2, ו16.6 מ"מ MgSO 4-1 ליטר מים ultrapure ליצור 1 ליטר של E3.
- הוסף 200 μl של מתילן בלו לפתרון E3 לעכב פטריית צמיחה.
4. מחטי משיכת להעברת Microbead
- השתמש זכוכית בורוסיליקט אש מלוטשת עם נימה בOD: 1.0 מ"מ, מזהה: 0.5 מ"מ, באורך של 10 סנטימטר.
- מניחים זכוכית borosilicated לחולץ micropipette להכין מחטים עדינות.
הערה: ארבעה הממדים הבאים יכולים לשמש כנקודת התחלה כדי למשוך את המחטים: החום = 540, משוך = 245, מהירות = 200, והזמן = 125. - לאחר שהפיל מספר מספיק של מחטים, חנות בפלסטיק מכוסה פטרי מנות, ממוקמות על רצועות של פלסטלינה או דבק כדי למנוע שבירת קצה המחט, עד לשימוש.
- לקצץ את קצה המחט לגודל הרצוי משעמם, להשתמש זוג מלקחיים בסדר להבקיע סופו של המחט.
הערה: גודל שעם מחט ישתנה בהתאם לגודל microbead מנוצל כמו גם העדפות טיפול משתמש. נקודת התחלה טובה היא גדלים נשאו מלאכה בטווח שבין 100 ל -200 מיקרומטר אם microbeads החל 50-100 מיקרומטר ישמש. - PRIOr להשתמש, להכניס את המחט הגזוז לבעל צינור נימי אופנה מכשיר העברת microbead הושלם.
5. זיף / לאש כלי הכנה
- להשיג זיף, להשתלח, או חתיכה עדיין חברה קטנה אחרת של חוט שיער טבעי או סינטטי. חותך ליד הבסיס של החוט בזווית של 45 מעלות. לדבוק הזיף לקצה micropipette P-1000 באמצעות דבק דבק ברור קבוע.
6. Microbead השרשה מגש הכנה
- מערבבים 2 גרם של agarose עם פתרון של E3 100 מיליליטר לעשות 2% agarose ג'ל E3.
- מחממים את פתרון agarose 2% 1 דקות ו -30 שניות בארלנמייר 250 מיליליטר, מתערבל את הבקבוק כל 30 שניות כדי למנוע את הג'ל ממבעבע מעל.
- קח את המכסה של צלחת פטרי x 15 מ"מ 60 מ"מ ומניח אותו בצלחת גדולה יותר 150 מ"מ x 15 מ"מ עם הפנים כלפי מעלה.
- יוצקים את הג'ל agarose החם לתוך צלחת פטרי x 15 מ"מ 150 מ"מ, והקפד לעגן אתהמכסה של הצלחת קטנה עם האצבע.
הערה: אפשר בשכבה דקה של agarose מתחת למכסה של הצלחת קטנה יותר כדי להסיר עיבוי שיהווה בעת מזיגת ג'ל; זה יהפוך את חרוזים קלים יותר לראות תחת מיקרוסקופ לנתיחה. - כagarose מתקרר, אבל לפני שהוא מבצרים, למקם את התבנית היטב בג'ל. זה יאפשר למיקום קל של העוברים.
- שים לב: על מנת למנוע בועות בבארות, הנח את התבנית לאט בזווית עד שהוא צף על גבי ג'ל.
- באמצעות microspatula, להסיר בזהירות את התבנית היטב פעם ג'ל יש הקרושה. להוסיף פתרון E3 ולאחסן ב 4 מעלות צלזיוס.
אוסף 7. העובר
- הכן תאי הזדווגות, מופרדים על ידי מחיצות, על ידי מילוי אותם עם מים במערכת, ולאחר מכן הצבת זכר בוגר דג הזברה (ים) וזוגות נשים (ים) בתאים O / N.
- לאסוף ביצים מופרות באמצעות מסננת רשת תיל דקה (שלבים עובריים ישתנו מעט).
- להפקיד את הביציות המופרות ב, צלחת פטרי בקוטר 10 סנטימטרים נקייה על ידי הפיכת המסננת הפוכה ושטיפתו עם זרם עדין של E3 עד אין ביצים שנותרו במסננת, ויש כ 25 מיליליטר של תמיסת E3 בצלחת.
- לאחר איסוף, לחלק את הביצים לכמה מנות (כ 50-60 ביצים לכל צלחת), כדי למנוע צפיפות, אשר עלול להוביל לאי-סנכרון התפתחותית בתוך המצמד ולעשות איסוף נקודות פעמים הרצויות קשה.
- דגירה עובר בפתרון E3 על 28.5 מעלות צלזיוס, כדי לאפשר הערכה התפתחותית על פי סדרת בימוי דג הזברה סטנדרטית 40.
הערה: עובר צריך להיות מועבר לE3 / PTU ב 24 שעות שלאחר הפריה (hpf) כדי למנוע התפתחות פיגמנט אם מניפולציות בשלבים מבוגרים מחייבות בהירות אופטית.
8. חרוז השרשה
- דגירה microbeads בריכוז מולקולת מבחן רצוי או של הרכב המקבילolution למועד שנקבע בנפח מתאים.
הערה: החוקר יכול להשתמש בכלים סטריליים פטרי הנעים 3-6 סנטימטר קוטר, או צלחות רב גם, אשר שניהם מאפשרות הדמיה של microbeads בתוך הפתרון. זמן עשוי להשתנות בהתאם לסוג והכמות של מולקולה של עניין, והחוקר צריך להתייחס ליצרן או המלצות שפורסמו לתקופת דגירה והיבטים אחרים, כגון רגישות לאור וטמפרטורה. - ברגע שעובר הגיע לנקודת הזמן ההתפתחותי הרצויה, להסיר את העוברים מchorions שלהם באמצעות מלקחיים בסדר.
- דגירה עובר בפתרון רינגר המסונן עם אנטיביוטיקה במשך 10 דקות כדי להסתגל להם הפתרון.
- בעוד עוברי הסתגלות, להעביר את microbeads לתוך צלחת microbead שוכנת בתוך מגש ההשתלה ולשטוף אותם בפתרון רינגר במשך 10 דקות.
הערה: שתל חרוזים בתוך 50 דקות לאחר שהגיע נקודה זו. w זהחולה להקטין את הסבירות לכך שאחד יהיה להשתיל חרוז עם ריכוז קטן של המולקולה של עניין. - מערך העוברים לתוך הבארות של מגש השתלת microbead, דואג לכוון אותם כל כך באזור של עניין שבו microbead יהיה מושתל הוא נגיש.
- לעשות חתך קטן בעובר באמצעות מחט טונגסטן.
- העבר את microbead על העובר באמצעות פיפטה העברת microcapillary: מדכאת את הנורה של פיפטה, משוך בעדינות את microbead לטור הנימים, ולאחר מכן שחרר את הלחץ להעביר את microbead ביעד הרצוי.
- השתמש בכלי זיף / שוט כדי למקם את microbead בתוך העובר. הערה: הקפד למקם את microbead לתוך הרקמה מהאתר של חתך כך microbead לא יגורש מן העובר כפי שמרפא.
תוצאות
כמה סוגים של כלי מניפולציה שימושיים לטיפול בmicrobeads ביישומי מחקר (איור 1). בנוסף, עובש agarose פשוט עם בארות קטנות יכול להיות מנוצל כדי להחזיק את עובר דג הזברה, שהוא חיוני לביצוע ניסויים אלה במועד והיעיל (איור 1). השתלת microbead יכולה להתבצע במיקום המרחבי ושלב זמני של ריבית, המאפשר לחוקרים כדי לצמצם חלון ספציפי של פעולה למולקולה של עניין.
כאן, microbeads אחת הושתלו לתוך עוברי דג הזברה בשלב ניצן זנב או בנקודות זמן מאוחר יותר במהלך שלבי somitogenesis (איור 3). שני microbeads בגדלים שונה, שטף עם הפתרון של רינגר לבד, שימש בהפגנת פרוטוקול זה (איור 3 א, 3 ב ו3C). השתלת microbead זה בהעדר כל מצומדותמולקולות קטנות מוכיחות כי השתלת חרוז יכולה להיות מושגת ללא תופעות מורפולוגיות גולמית במהלך ההתפתחות התקינה של עובר דג הזברה (איור 4).
בניסויים עלולים להיתקל בקשיים בתמרון microbead לתוך חור ניקוב נעשה על ידי מחט טונגסטן גבי העובר. כדי להשיג טיפול טוב יותר של microbead להציב פעם אחת בעובר על ידי מיקרו-המחט, ניתן להשתמש זיף / כלי שוט. זה יכול להיות בעל מבנה עם באופן טבעי לשפוך חתולים או כלבי שפם, למרות שיכולים להיות מנוצל חוטי שוט טבעי או סינטטי אחרים (איור 1). דחיפה עדינה של microbead גם עם מחט טונגסטן או כלי הזיף צריכה לראות את microbead לשקוע הפתרון של רינגר של העובש. ברגע שmicrobead שקע לתוך תבניתו יש להעביר למרחקים גדולים במידת צורך באמצעות מחט טונגסטן ופעם אחת על גבי עובר כלי המחט או זיף יכול לשמש לposition microbead לעובר. ההצלחה של השתלת microbead ניתן למדוד באופן מיידי באמצעות הדמיה בסטראו, כחרוז יישאר ממוקמת ביציבות ברקמות. כדי להעריך את עמדת חרוז לאורך זמן, כל דגימת עובר ניתן הדמיה באמצעות צילום בזמן קורס בשידור חי או בדיקה במרווחים תקופתיים (כמתואר באיור 4) כדי להבטיח שמיקום חרוז לא עבר על משך הניסוי בשל רקמת אנדוגני המורפוגנזה. הבנת עמדתו של חרוז לאורך הזמן היא קריטית לפרשנות מושכלת ביותר של תוצאות, כגון הערכת ההשפעה של מולקולה קטנה ברקמות יעד או תהליך התפתחותי.
השימוש בצעדים מעל אלה יספקו סביבה אידיאלית שבלהשתיל microbeads לעובר דג הזברה בזמן ומיקום רצויים. מניסיוננו, למשתמשים מתחילים בפרוטוקול השתלת microbead זה בדרך כלל צברו ne המיומנותcessary לבצע השתלה כירורגית עקבית של microbeads לעובר דג הזברה לאחר שבוע אחד של כ בפועל.
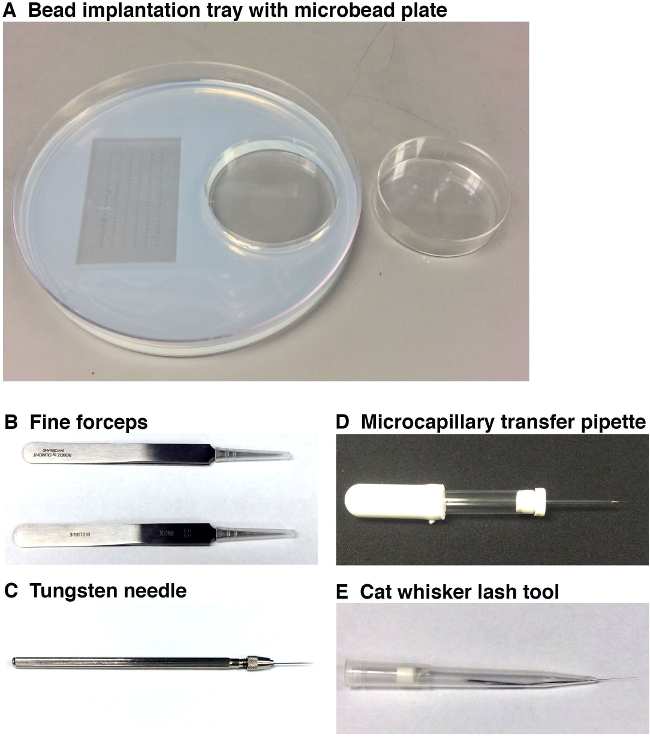
כלי 1. איור משמשים לביצוע השתלת microbead. () מגש השתלת חרוז (משמאל, בקוטר 15 סנטימטרים) עם תבניות עובר (משמאל) ומגש דגירה microbead (בצד ימין, 6 סנטימטרים קוטר). מגש עבודה זו מאפשר לחוקר מניח את העוברים לכיוון הרצוי להשתלת microbead, ויש לי microbeads מוכן להשתלה בסמיכות לתחנת מיקרוסקופ. Microbeads צריך להיות מודגרות במולקולה קטנה (ים) ו / או כלי רכב ולאחר מכן לשטוף בצלחת microbead נפרדת (מימין) לפני הצבה אותם לתוך מגש השתלת חרוז שממוקם מתחת לתחנת מיקרוסקופ. (ב) שני זוגות מלקחיים בסדר ישמשו כדי להסיר את Choriעל מקיף כל עובר דג הזברה וגם לשבור את סופו של מחט microcapillary. (ג) מחט טונגסטן יועסק לעשות לנקב יפה מאוד לעובר דג הזברה שלמצב microbead. (ד) פיפטה העברת microcapillary תשמש להרים ולמקם microbead על גבי עובר דג הזברה בסמוך למקום לנקב. (ה) הזיף / כלי השוט יאפשר המיצוב העדין של microbead לאתר החתך בתוך העובר שנעשה בעבר על ידי מחט טונגסטן. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
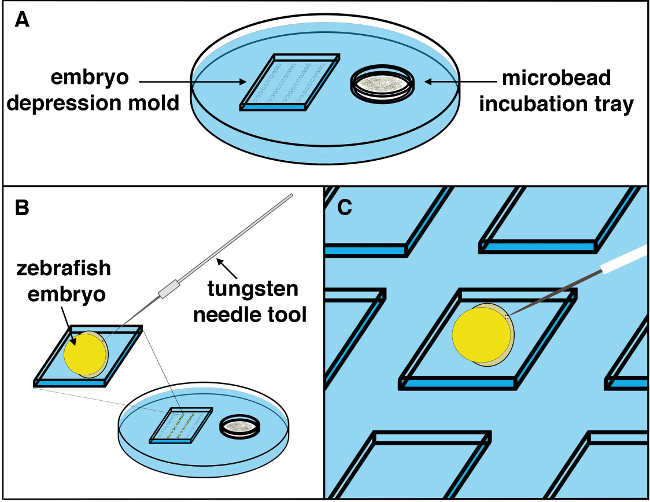
איור 2. סכמטי של הליך השתלת microbead. () מגש השתלת microbead עם soaki microbeadsng בפתרון לשטוף הרצוי שהוקם לפי תחנת סטראו, ואת העוברים ממוקמים ברקמות תפנינה כלפי מעלה. (ב) באמצעות מחט טונגסטן, חתך קטן לעובר יכול להתבצע עם תנועה עדיין תקיפה קלה. (ג) בעזרת פיפטה העברת microcapillary, microbead הרצוי ניתן לאסוף מתא הדגירה microbead במגש, ממוקם בצד הימין, והובא לתא השמאלי שבו אזור העבודה העובר נמצא. Microbead צריך להיות מופקד בסמוך למקום החתך, אז ממוקם בעדינות לתוך אתר החתך שנעשה על ידי מחט טונגסטן באמצעות הזיף / כלי השוט. ברגע שmicrobead הוא תמרן באתר החתך, זה צריך להיות תחוב לתוך הרקמה (מהחתך) למצב ביציבות microbead ולמנוע התנועה הבאה מהעובר כפיתוח ממשיך. Pלחכור לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
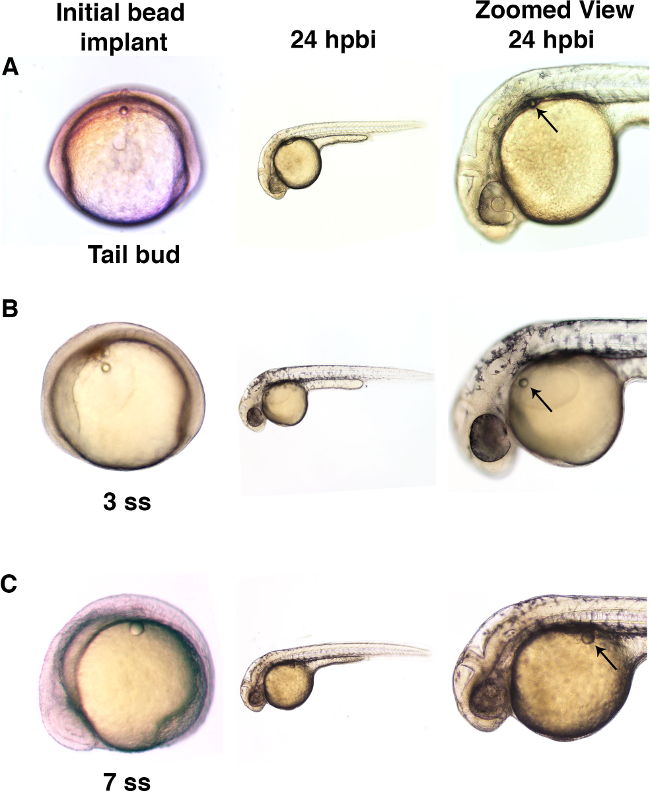
יכול להיות מושתל microbeads 3. איור לעוברי בשלבי התפתחות שונה. () עוברי דג הזברה הושתלו עם microbead (קוטר של כ -50 מיקרומטר) לתא המטען בשלב ניצן זנב. כשבדק בשתל 24 שעות שלאחר חרוז (hpbi), העוברים שהתפתחו בצורה נורמלית וmicrobead הראה תנועה מינימאלית בחלוף זמן התפתחותי. עוברי דג הזברה (ב) מושתלים עם microbeads (בקוטר של כ 50 מיקרומטר) לתוך שק החלמון בשלב 3 somite (SS) מוצגים התפתחות תקינה עם תנועת חרוז קטנה יחסית לאורך זמן. (ג) microbeads גדול יותר (בקוטר של כ 70 מיקרומטר) הושתלו לתוך עובר 7 ss דומה הראה התפתחות תקינה שלאחר מכן, כמו גם מיניmal אם תנועה כלשהי מהאתר של השתלה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
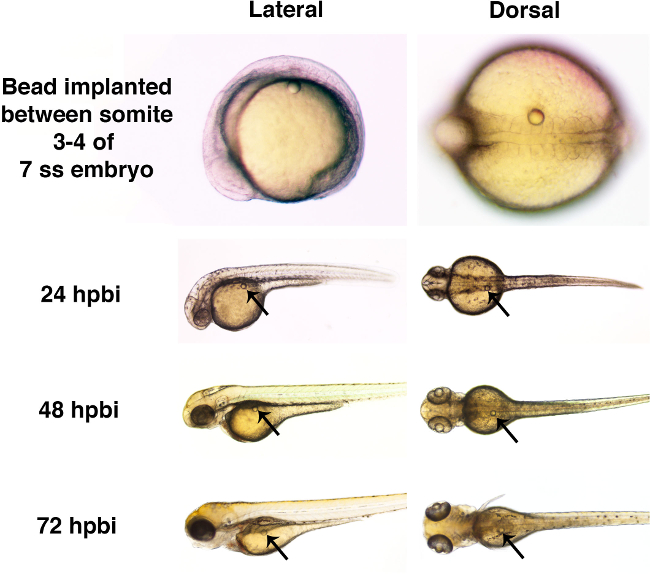
איור 4. פיתוח ברוטו של עובר דג הזברה הוא מוטרד מהנוכחות של microbead דרך 72 hpbi. עוברי דג הזברה הושתלו עם microbeads הספוג בתמיסת רינגר (בקוטר של כ 50 מיקרומטר) בשלב 7 somite (SS). כל microbead הוכנס בניתוח לתא המטען, בין somites 3 ו -4 הנוכחות של חרוז לא הייתה קשורה לפגמים גלויים התפתחותית בשתל לאחר חרוז 24 שעות (hpbi), 48 hpbi, או 72 hpbi. אנא לחץ כאן לצפייה גרסה גדולה יותר של דמות זו.
Discussion
במאה השנים האחרונות, את ההבנה של דפוסי תכנית הגוף וorganogenesis עברה התקדמות מונומנטלית. טכניקות מניפולציה רקמה היו קריטיות בחשיפת מידע חשוב על תהליכים החיוניים אלה. הנדסה גנטית היא אחת מהשיטות הנפוצות ביותר לבירור תפקוד גן, ושיטות ניתוח פסיפס, כגון השתלת תאים, מספקות גישות שימושיות להבין אוטונומיה של תפקוד גן. השתלת Microbead מספקת מקום אחר לחקור כיצד מולקולות מסוימות לשנות דינמיקה התפתחותית, כשיטת זו מאפשרת לחוקר לשנות סביבת רקמות מקומית על ידי החדרת מולקולות או מעכבי איתות. מגוון של microbeads שונה זמין מסחרי, שבגדלים שונים ומאפיינים פיזיים אחרים קיימים (למשל, תשלום) כך שהם יכולים להיות מועסקים על מנת לתנאי הניסוי של עניין. לכן, על ידי השתלת microbeads שהם ספוגים בחלבון או חמיקאל של עניין בתוך האורגניזם, חוקרים יכולים לחקור השפעות מקומיות במהלך פיתוח ולמצוא קשרים בין הגן או המולקולה של עניין ופנוטיפ המסוים הביולוגי (ים).
מחקרים כמו זה שבוצע על ידי ואדה ועמיתיו השתמש השתלת microbead כדי להעריך את ההשפעה של איתות הקיפוד גדל בדפוסי שלד בneurocranium הקדמי (ANC) בדג הזברה 23. מחקרים קודמים הראו כי שישה נדרשים להיווצרות ANC 14. חוקרי microbeads מצופה ששש שימוש זיהו שאות זו מקדמת היווצרות סחוס בANC. תהליך השתלת microbead שימש כדי להדגים קשר ברור בין איתות הקיפוד והיווצרות סחוס בANC. דוגמא נוספת מפתח של טכניקת המניפולציה רקמה זו בדג הזברה הוא ציינה במחקרים שבם מדענים חקרו את שליטת תעתיק של Erythroblastoma עשרים והשש f (ETS) תחוםמולקולה קשורה-ETS שחקנים (ERM) וactivator Polyoma משפר 3 (Pea3) על ידי איתות FGF במהלך התפתחות מוח דג הזברה מוקדמת 19. באמצעות ניסויי השתלת microbead, הם הצליחו להראות שFgf8 וFgf3 ectopically יכולים להפעיל ביטוי של ERM וpea3. הדוגמות הללו ממחישות את התועלת של microbeads לספק תובנות מנגנוני ההתפתחות שמשתפים פעולה במהלך היווצרות רקמה, שיכול להיות מאופיין היטב על ידי השימוש בשיטות להערכת ביטוי גנים 41. לפיכך, השתלת microbead יכולה להיות שיטת קיימא לחקור רקמות אחרות, כגון המזודרם ביניים (IM) אשר נותן עלייה לכליות. באופן ספציפי, זה יסייע במחקרים התפתחותיים כליות, כדי לחקור כיצד מולקולות שונות משפיע נפרון פילוח 42 וtubulogenesis 43,44, תהליכים שהם הבינו רק באופן שטחי בהווה. יתר על כן, השתלת microbead החלה לשמש להרבעהתהליכי התחדשות y בדג הזברה 29] ויכולים להיות מותאמים לשימוש עם כל מספר של דגמי התחדשות איבר, כגון אבלציה הלייזר הבאה של רקמות עובריות כמו נפרון 45 או בשילוב עם שיטות שגובשו לבצע מחקר עם המבנים המבוגרים המקבילים 46-49. לבסוף, יש השתלת microbead הפוטנציאל לשמש במודלים של מחלות אנושיות, כגון סרטן 50,51 או רקמת ניוון 52,53.
בפרוטוקול הנוכחי, אנחנו מדגימים את השיטה של השתלת microbead בעוברי דג הזברה, שגם תוארה באופן דומה על ידי חוקרים אחרים, אבל לא הראתה באמצעות פרוטוקולי וידאו 1. בעזרת תרגול מינימאלי הצלחנו להשתיל microbeads בשיעור של כ 8-10 עוברים / שעה, המתייחס הכדאיות של הליך זה פעם אחת החוקר יש קצת ניסיון. התוצאות הראו במסמך זה מדגימות חרוזים של ד השוניםיכול להיות מושתל imensions בשלבים מוקדמים, וכי עם טיפול, טכניקת מניפולציה רקמה זו יכולה להיות מיושמת עם הפרעה פיזית מינימאלית לעובר. שיפור אחד שיש להדגיש הוא השימוש בכלי זיף / שוט כדי למקם את microbead לעובר. חתיכה זולה יחסית ופשוטה זו של ציוד היא בערך באותו הקוטר כמו microbead, קל להשיג ומסייע להאיץ את תהליך ההשתלה. הזיף / השוט ניתן לחתוך לאורך רצוי כדי לייצר חברה עדיין כלי טיפול בחרוז עדין, תלוי במיומנות חוקר והעדפה. לבסוף, בעוד שתארנו כאן כיצד לתפעל פיזי microbeads ועוברי דג הזברה לבצע השתלה, פרוטוקול זה אינו מתאר נהלי טיפול ספציפיים לסמים או פפטידים שונים. באופן כללי, צריך להיות מושתל microbeads טיפול כימי לבעלי החיים עם האינטרס של המשטר, כדי למנוע תופעות לא רצויות באזורים אחרים של האורגניזם, וחוקרים צריכים להיות גם בנוצר על חששות בטיחות האפשריים הקשורים בכימיקלים כגון לפני ביצוע מחקריהם.
לסיכום, יש לנו הפגנו שיטת השתלת microbead יחסית פשוטה ויעילה עם מגוון רחב של יישומים תוך שימוש בחומרים שאינם זמינים במעבדה. סופו של דבר, אנו מקווים שמדריך זה יסייע לחוקרים הטבע העדין של מניפולציה רקמות דג הזברה.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי DP2OD008470 מענק NIH.
Materials
| Name | Company | Catalog Number | Comments |
| Sodium Chloride | American Bioanalytical | AB01915 | |
| Potassium Chloride | American Bioanalytical | AB01652 | |
| Calcium Chloride | American Bioanalytical | AB00366 | |
| HEPES | Sigma Life Science | H4034 | |
| Penicillin-Streptomycin solution | Sigma-Aldrich | P4333-20ML | |
| N-Phenylthiourea (PTU) | Aldrich Chemistry | P7629 | |
| Ethyl 3-aminobenzoate (Tricaine) | Fluka Analytical | A5040 | |
| Borosilicate glass | Sutter Instruments Co. | BF100-50-10 | |
| Flaming/Brown Micropipette puller | Sutter Instruments Co. | Mo. P097 | |
| UltraPure Agarose | Invitrogen | 15510-027 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| 250 ml Erlenmeyer Flask | Fischer Scientific | FB-500-250 | |
| Falcon Diposable Petri Dishes, Sterile | Corning | 430167 | |
| 60 mm x 15 mm | VWR | 25373-085 | |
| 100 mm x 15 mm | VWR | 25373-100 | |
| 150 mm x 15 mm | VWR | 25373-187 | |
| Saint-Gobain Chemware Microspatula | Fischer Scientific | 21-401-50B | |
| P-1000 Micropipette tips | Fischer Scientific | 2707402 | |
| Low Temperature Incubator | Fischer Scientific | 11 690 516DQ | |
| Dimethly Sulfoxide | American Bioanalytical | AB00435 | |
| Microbeads (45-106 µm) | Biorad | 140-1454 AG1-X8 | |
| Microbeads (45 µm) | Polysciences | 7314 | |
| Micro Dissecting Tweezer | Roboz Surgical Instruments Co. | RS-5010 | |
| Tungsten Needle | Roboz Surgical Instruments Co. | RS-6065 | |
| Capillary tube holder | Globe Scientific Inc. | 51674 |
References
- Picker, A., et al., Lieschke, G. J., et al. Tissue micromanipulation in zebrafish embryos. Zebrafish, Methods in Molecular Biology. 546, (2009).
- Wilson, J., Tucker, A. S. Fgf and Bmp signals repress the expression of Bapx1 in the mandibular mesenchyme and control the position of the developing jaw joint. Dev Biol. 266, 138-150 (2004).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Invest. 122, 2337-2343 (2012).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341 (2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Haffter, P., Nüsslein-Volhard, C. Large scale genetics in a small vertebrate, the zebrafish. Int J Dev Biol. 40, 221-227 (1996).
- Amsterdam, A., Hopkins, N. Mutagenesis strategies in zebrafish for identifying genes involved in development and disease. Trends Genet. 22, 473-478 (2006).
- Pickart, M. A., Klee, E. W. Zebrafish approaches enhance the translational research tackle box. Transl Res. 163, 65-78 (2014).
- Kroeger, P. T., Poureetezadi, S. J., McKee, R., Jou, J., Miceli, R., Wingert, R. A. Production of haploid zebrafish embryos by in vitro fertilization. J Vis Exp. 89, e51708 (2014).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21, 48-64 (2011).
- Auer, T. O., Del Bene, F. CRISPR/Cas9 and TALEN-mediated knock-in approaches in zebrafish. Methods. 69, 142-150 (2014).
- Peterson, R. T., Link, B. A., Dowling, J. E., Schreiber, S. L. Small molecule developmental screens reveal the logic and timing of vertebrate development. Proc Natl Acad Sci USA. 97, 12965-12969 (2000).
- Lessman, C. A. The developing zebrafish (Danio rerio): A vertebrate model for high-throughput screening of chemical libraries. Birth Defects Res C Embryo Today. 93, e52063 (2011).
- Donahue, E. K., Wingert, R. A. A manual small molecule screen approaching high–throughput using zebrafish embryos. J Vis Exp. , 52063 (2014).
- Hyatt, G. A., Schmitt, E. A., Marsh-Armstrong, N., McCaffery, P., Dräger, U. C., Dowling, J. E. Retinoic acid establishes ventral retinal characteristics. Development. 122, 195-204 (1996).
- Picker, A., Brand, M. Fgf signals from a novel signaling center determine axial patterning of the prospective neural retina. Development. 132, 4951-4962 (2005).
- Reifers, F., Walsh, E. C., Leger, S., Stainier, D. Y. R., Brand, M. Induction and differentiation of the zebrafish heart requires fibroblast growth factor 8 (fgf8/acerebellar.). Development. 127, 225-235 (2000).
- Raible, F., Brand, M. Tight transcriptional control of the ETS domain factors Erm and Pea3 by Fgf signaling during early zebrafish development. Mech Dev. 107, 105-117 (2001).
- Reim, G., Brand, M. spiel-ohne-grenzen/pou2. mediates regional competence to respond to Fgf8 during zebrafish early neural development. Development. 129, 917-933 (2002).
- Jaszai, J., Reifers, F., Picker, A., Langenberg, T., Brand, M. Isthmus-to-midbrain transformation in the absence of midbrain-hindbrain organizer activity. Development. 130, 6611-6623 (2003).
- Hirati, Y., Okamoto, H. Canopy1, a novel regulator of FGF signaling around the midbrain-hindbrain boundary in zebrafish. Curr Biol. 16, 421-427 (2006).
- Wada, N., Javidan, Y., Nelson, S., Carney, T. J., Kelsh, R. N., Schilling, T. F. Hedgehog signaling is required for cranial neural crest morphogenesis and chondrogenesis at the midline in the zebrafish skull. Development. 132, 3977-3988 (2005).
- Abe, G., Ide, H., Tamura, K. Function of FGF signaling in the developmental process of the median fin fold in zebrafish. Dev Biol. 304, 355-366 (2007).
- Prykhozhij, S. V., Neumann, C. J. Distinct roles of Shh and Fgf signaling in regulating cell proliferation during zebrafish pectoral fin development. BMC Dev Biol. 8, 91 (2008).
- Scholpp, S., Brand, M. Endocytosis controls spreading and effective signaling range of Fgf8 protein. Curr Biol. 14, 1834-1841 (2014).
- Hardt, S., et al. The Bmp gradient of the zebrafish gastrula guides migrating lateral cells by regulating cell-cell adhesion. Curr Biol. 17, 475-487 (2007).
- White, R. J., Nie, Q., Lander, A. D., Schilling, T. F. Complex regulation of cyp26a1 .creates a robust retinoic acid gradient in the zebrafish embryo. PLoS Biol. 5, e2522-e2523 (2007).
- Brittijn, S. A., et al. Zebrafish development and regeneration: new tools for biomedical research. Int J Dev Biol. 53, 835-850 (2009).
- Niswander, L., Jeffrey, S., Martin, G. R., Tickle, C. A positive feedback loop coordinates growth and patterning in the vertebrate limb. Nature. 371, 609-612 (1994).
- Laufer, E., Nelson, C. E., Johnson, R. L., Morgan, B. A., Tabin, C. Sonic hedgehog and Fgf-4 act through a signaling cascade and feedback loop to integrate growth and patterning of the developing limb bud. Cell. 79, 993-1003 (1994).
- Tickle, C., Alberts, B., Wolpert, L., Lee, J. Local application of retinoic acid to the limb bud mimics the action of the polarizing region. Nature. 296, 564-566 (1982).
- Samarut, E., Fraher, D., Laudet, V., Gibert, Y. ZebRA: an overview of retinoic acid signaling during zebrafish development. Biochimica et Biophysica Acta. 1849, 73-83 (2015).
- Lengerke, C., et al. Interactions between Cdx genes and retinoic acid modulate early cardiogenesis. Dev Biol. 354, 134-142 (2011).
- Wingert, R. A., et al. The cdx and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom., and Notch signaling. Dev Biol. 386, 111-122 (2014).
- Cheng, C. N., Wingert, R. A. Nephron proximal tubule patterning and corpuscles of Stannius formation are regulated by the sim1a. transcription factor and retinoic acid in the zebrafish. Dev Biol. 399, 100-116 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J Vis Exp. , e51604 (2014).
- Cheng, C. N., Wingert, R. A., Carver, E., Lessman, C. Chapter 9: Renal system development in the zebrafish: a basic nephrogenesis model. Zebrafish: Topics in Reproduction & Development. , (2014).
- Gerlach, G. F., Wingert, R. A. Zebrafish pronephros tubulogenesis and epithelial identity maintenance are reliant on the polarity proteins Prkc iota .and zeta. Dev Biol. 396, 183-200 (1016).
- McKee, R., Gerlach, G. F., Jou, J., Cheng, C. N., Wingert, R. A. Temporal and spatial expression of tight junction genes during zebrafish pronephros development. Gene Expr Patterns. 16, 104-113 (2014).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. , e2845 (2011).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. 54, e2839 (2011).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Analysis of nephron composition and function in the adult zebrafish kidney. J Vis Exp. , e51644 (2014).
- McCampbell, K. K., Springer, K., Wingert, R. A. Atlas of cellular dynamics during zebrafish adult kidney regeneration. Stem Cells Int. In press, (2015).
- Lee, S. L., et al. Hypoxia-induced pathological angiogenesis mediates tumor cell dissemination, invasion, and metastasis in a zebrafish tumor model. Proc Natl Acad Sci USA. 106, 19485-19490 (2009).
- Rouhi, P., et al. Hypoxia-induced metastasis model in embryonic zebrafish. Nat Prot. 5, 1911-1918 (2010).
- Cao, R., Jensen, L. D. E., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3, e2748 (1371).
- Cao, Z., et al. Hypoxia-induced retinopathy model in adult zebrafish. Nat Prot. 5, 1903-1910 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved