Method Article
Microbead Implantation im Zebrafischembryo
In diesem Artikel
Zusammenfassung
The zebrafish is an excellent model system for genetic and developmental studies. Bead implantation is a valuable tissue manipulation technique that can be used to interrogate developmental mechanisms by introducing alterations in local cellular environments. This protocol describes how to perform microbead implantation in the zebrafish embryo.
Zusammenfassung
Der Zebrafisch wurde als wertvolle genetische Modellsystem für die Untersuchung der Entwicklungsbiologie und Krankheit entstanden. Zebrabärbling teilen einen hohen Grad an genomischer Erhaltung sowie Ähnlichkeiten in zellulären, molekularen und physiologischen Prozessen, mit anderen Wirbeltieren einschließlich des Menschen. Während der frühen Ontogenese sind Zebrafischembryonen optisch transparent, so dass die Forscher die Dynamik der Organogenese mit einem einfachen Stereomikroskop sichtbar zu machen. Microbead Implantation ist eine Methode, die Gewebemanipulation durch die Veränderung der Faktoren in lokalen Umgebungen ermöglicht. Dies ermöglicht es den Forschern, die Auswirkungen von einer beliebigen Anzahl von Signalmolekülen von Interesse, wie zum Beispiel sezerniert Peptide, in bestimmten räumlichen und zeitlichen Punkte innerhalb des sich entwickelnden Embryos zu testen. Hier haben wir ausführlich ein Protokoll für die, wie man während der frühen Zebrafischentwicklung manipulieren und Implantat-Perlen.
Einleitung
Entwicklungsbiologie Forscher nutzen eine Vielzahl von zellularen, molekularen und genetischen Methoden, um die Mechanismen, wie ein Organismus gebildet Kontrolle aufzudecken. Unter diesen Ansätzen ist Gewebemanipulation ein wichtiges Instrument bei der Entschlüsselung komplexer Fragen über das Schicksal der Zelle, Zellbewegung und der Organisation der Gewebe. Ein Weg, um eine lokale Gewebeumgebungen verändert ist durch die chirurgische Anwendung von Mikroperlen, die verwendet werden, um eine fokale Quelle von Proteinen oder anderen Signalmolekülen 1 zu liefern. Diese Art der experimentelle Manipulation wurde in großem Stil in die klassische Wirbel Embryologie Modelle, wie der Frosch und Küken 2 implementiert.
Der Zebrafisch ist zu einem wichtigen Wirbelmodellorganismus für das Studium der Organentwicklung und bietet auch viele einzigartige Vorteile für Krankheit Modellierung 3-5, da sie hohe genetische Erhaltung mit 6 Menschen zu teilen. Insbesondere ist die optische Transparenz und exinterne Entwicklung des Zebrafischembryo bietet eine unvergleichliche Sicht für die Beobachtung von Gewebe Ontogenese 3-5. Die Umsetzung des groß angelegten vorn genetischen Screens hat eine leistungsstarke Sammlung von Zebrafisch-Mutanten-Stämme für die weitere Untersuchung 7,8, und die Identifizierung von alternative Screening-Verfahren, die effizient in verkleinertem Maßstab in einzelnen Laboratorien durchgeführt werden können 9,10 erzeugt. Weitere experimentelle Arbeit mit Zebrafisch hat durch Fortschritte in transgenen Methoden erleichtert und Reverse genetische Ansätze 11,12, sowie chemische Genetik 13-15.
Gewebemanipulationstechniken, wie die Umsetzung von Mikroperlen, wurden nicht wie in dem Zebrafisch weithin verwendet, aber dennoch ein nützliches Mittel, um die Zellsignalisierung während der Entwicklung weiter zu verstehen. Microbead Implantation verwendet wurde, um die Prozesse der Organbildung im Zebrafisch Retina abzufragen16,17, 18 Herz, Gehirn 19-22, Neuralleiste 23 und fin 24,25. In diesen und anderen Untersuchungen wurde Kügelchen während der Entwicklung aufgebracht wurde, um die Diffusion von Signalmolekülen 26, wie Gradienten beeinflussen Zellmigration 27 und axiale Strukturierung 28 zu verstehen. In jüngerer Zeit wurden Mikrokügelchen verwendet werden, um Regenerationsmechanismen im Zebrafisch Erwachsenen 29 auszuwerten. In Entwicklungsstudien, zum Beispiel Zebrafisch-Mikrokügelchen Arbeit Einblicke in die Mechanismen der Bildung Extremität durch Studien der Brustflosse 25 zur Verfügung gestellt. Der Zebrafisch Brustflosse Knospe ist homolog zu den Vordergliedmaße Knospe in der Maus 30 und 31 Küken. Die wirbelGliedmaßenKnospe hat zwei wesentliche Signalknoten: die Zone polarisierender Aktivität (ZPA), die den vorderen zu hinteren Achse durch den Ausdruck der Sonic hedgehog etabliert (Shh) und nachgelagerten Hox Gen-Targets,und der apikalen ektodermalen Leiste (VRE) an der Spitze der Extremitätenknospe, die proximal zum distalen Identität des Gliedes durch Expression von Fibroblasten-Wachstumsfaktoren (FGFs) herzustellen Akten präsentieren. Durch die Implantation Fgf getränkt Mikrobeads in Zebrabärbling Shh genetische Mutanten Ermittler identifiziert Fgf als wesentlich für das Fortschreiten des Zellzyklus und das Wachstum des Vertebraten Schenkel 25. Neben dem FGF und Shh-Signalkaskaden, die Positionsfeststellung der Identität, bahnbrechenden Studien mit dem Küken Gliedmaßenknospe identifiziert Retinsäure (RA) als ein Molekül, das die Wirkung des Polarisationsbereich imitieren könnten anterior nach posterior 32 Identität zu etablieren. Diese Experimente beteiligt Platzierung kleine Streifen von RA-getränkte Whatman-Papier in die Küken Extremität zu stelligen Strukturierung 32 zu bewerten. Ferner haben die Forscher weitere Studien mit elegant die Verwendung von Mikrokügelchen durchgeführt, Zelltransplantation und exogeneRA-Behandlungen in Zebrafisch, um festzustellen, dass RA wirkt, um Positionsfern Cues innerhalb des Zebrafisch-Hinterhirn und Mesoderm 28 bereitzustellen. Gegenwärtig ist jedoch bleiben viele Fragen über die Rolle von Signalfaktoren wie FGF und RA während zahlreiche Aspekte der Wirbeltierentwicklung. Die Signalisierungs Wirkungen von RA als Morphogen wirkende Einflüsse auf viele Organe 33, wie beispielsweise die Entwicklung von Herz 34 und den Nieren Vorläufern, wobei RA spezifiziert proximalen Nierenzellen vom Typ Schicksal 35-39. Weitere Verständnis solcher Themen wesentlich von experimentellen Studien mit Gewebemanipulation und Mikrokügelchen Implantationstechniken profitieren.
Während weniger Studien wurden mit Mikrokügelchen Implantation im Zebrafisch, verglichen mit Modellen wie das Küken durchgeführt wurden, sind diejenigen, die durchgeführt wurden sehr informativ. Ein Grund für den Mangel an Mikrokügelchen Implantation der Basis-Forschung im Zebrafischembryo ist likely die Vorstellung, daß es schwierige technische Herausforderungen auf der Grundlage der Größe des Embryos, die ein Hindernis für die erfolgreiche Durchführung solcher Manipulationen darstellen. Allerdings können Mikrokügelchen Implantation in Zebrafischembryonen mit der Praxis erlernt werden und durch visuelle Beobachtung der Technik unterstützt wird, und kann daher als ein Mittel, um die Mechanismen der Entwicklung verhören verfolgt werden. Hier zeigen wir die präzisen Anwendung eines Mikrokügelchens in den Zebrafischembryos, die für die Durchführung einer Vielzahl von Tests an der Gewebebildung und Zell Morphogenese genutzt werden kann.
Protokoll
Die Verfahren für die Arbeit mit in diesem Protokoll beschriebenen Zebrafischembryonen wurden von der Institutional Animal Care und Verwenden Committee an der University of Notre Dame genehmigt.
1. Ringer-Lösung Vorbereitung
- Stellen eine Lösung von 116 mM NaCl, 2,9 mM KCl, 3,6 mM CaCl 2 und 5 mM Hepes mit ultrareinem H 2 O unter ständigem Rühren durch jede Salzfällung vermeiden.
- Nach der Zugabe von Salzen und, während die Lösung immer noch unter Rühren, Zugabe von 100 Einheiten / Penicillin pro ml und 100 ug Streptomycin pro ml.
- Nachdem Sie alle Antibiotika und Salze, führen Sterilfiltration der Lösung und Store in der sterilen Behälter.
Anmerkung: N-Phenylthioharnstoff (1-Phenyl-2-thioharnstoff) oder PTU kann Ringer-Lösung hinzugefügt, um die Bildung des Pigments in Perlen implantierten Embryos ohne negative Folgen für die Embryonengesundheits blockieren. Um Ringer / Pigmentierung Blockierlösung herzustellen, verwenden Sie eine Konzentration von 0,003% PTU. Aufgrund der geringen Konzentration von PTU zuzugebenden ist es ratsam, dass eine größere Menge Ringerlösung hergestellt werden, mindestens 1 L, Hinzufügen winzigen Mengen von PTU Pulver zu vermeiden. Hinzuzufügen PTU während Schritt 1.2, während die Lösung gerührt.
2. Tricaine Herstellung der Lösung
- 2 g Ethyl-3-aminobenzoat Methansulfonatsalz (Tricaine) pro Liter Lösung plus 0,1 M Tris, aus einer 1 M Stammlösung ausgeglichen auf einen pH von 9,5 und mit ultrareinem H 2 O hergestellt
Hinweis: Tricaine wird verwendet, um die Zebrafischembryonen am gewünschten Zeitpunkt einschläfern zu Wulst Implantation Phänotypen zu untersuchen sein.
3. E3 Herstellung der Lösung
- Stellen eine Lösung von 0,25 M NaCl, 10 mM KCl, 12,5 mM CaCl 2 und 16,6 mM MgSO 4-1 L von Reinstwasser auf 1 Liter des E3 erstellen.
- Fügen Sie 200 ul Methylenblau in die E3-Lösung, um das Pilzwachstum zu hemmen.
4. Ziehen Nadeln für Microbead Überweisung
- Feuer poliert Borosilikatglas mit Filament bei einer OD: 1,0 mm, ID: 0,5 mm, bei einer Länge von 10 cm.
- Zeigen Borosilikatglas Glas in eine Mikropipette Abzieher zu feinen Nadeln vorzubereiten.
Hinweis: Die folgenden vier Dimensionen können als Ausgangspunkt verwendet werden, um die Nadeln zu ziehen: Wärme = 540, Ziehen = 245, Velocity = 200, und Time = 125. - Nach dem Ziehen eine ausreichende Anzahl von Nadeln, lagern in abgedeckten Petrischalen aus Kunststoff, auf Streifen aus Knetmasse oder Klebeband brechen die Nadelspitze zu verhindern, positioniert ist, bis zur Verwendung.
- Um die Nadelspitze auf die gewünschte Bohrung schneiden, verwenden Sie einen feinen Pinzette, um das Ende der Nadel punkten.
Hinweis: Needle Bohrung wird in Abhängigkeit von der Mikroperlengröße ausgenutzt sowie Benutzer Handhabung Vorlieben variieren. Ein guter Ausgangspunkt ist es, Handwerk Bohrungsgrößen in einem Bereich zwischen 100 und 200 & mgr; m, wenn Mikrokügelchen im Bereich von 50-100 um wird, verwendet werden. - Prior zu verwenden, legen Sie die Nadel in die getrimmten Kapillarrohrhalter, um den fertigen Mikrokügelchen Transferinstrument Mode.
5. Whisker / Lash Werkzeugvorbereitung
- Besorgen Sie sich einen Whisker, peitschen, oder andere kleine, aber feste Stück natürliches oder synthetisches Haar Filament. Schneiden der Nähe der Basis des Filaments in einem 45 ° -Winkel. Halten Sie die Whisker zu einem P-1000 Mikropipettenspitze unter Verwendung von Permanent klare Klebstoff Leim.
6. Microbead Implantation Tray Vorbereitung
- Mix 2 g Agarose mit 100 ml E3 Lösung, um eine 2% E3 Agarosegel machen.
- Erhitzen Sie die 2% igen Lösung für 1 min und 30 s in einem 250 ml Erlenmeyer-Kolben, Schwenken des Kolbens alle 30 Sekunden, um das Gel aus sprudelnden zu vermeiden.
- Nehmen Sie den Deckel eines 60 mm x 15 mm Petrischale und legen Sie sie in einem größeren 150 mm x 15 mm-Schale mit dem Inneren nach oben zeigt.
- Gießen Sie die heiße Agarose-Gel in die 150 mm x 15 mm Petrischale, achten Sie darauf, verankern sichder Deckel des kleineren Schale mit dem Zeigefinger.
Hinweis: Lassen Sie eine dünne Schicht von Agarose unter dem Deckel der kleineren Schale, um Kondensation, die beim Gießen des Gels wird zu entfernen; das macht die Perlen leichter unter einer Dissektionsmikroskop sehen. - Da die Agarose kühlt, aber bevor es erstarrt, legen Sie ein gut Form auf dem Gel. Dies wird zur leichteren Plazierung der Embryonen ermöglicht.
- Hinweis: Um Blasen in den Vertiefungen zu vermeiden, legen Sie die Form langsam in einem Winkel bis er oben auf dem Gel schwimmt.
- Unter Verwendung eines Mikros, entfernen Sie vorsichtig die Form gut, sobald das Gel erstarrt ist. In E3-Lösung und bei 4 ° C.
7. Embryonen
- Bereiten Paarungskammern durch Trennwände getrennt sind, indem sie mit System Wasser, und dann platzieren erwachsenen Zebrafisch männlichen (n) und Frau (en) Paare in den Kammern O / N.
- Sammeln befruchtete Eier mit einem feinen Drahtgeflecht Sieb (embryonalen Stadien wird leicht variieren).
- Abzuscheiden die befruchteten Eier in einem sauberen, mit 10 cm Durchmesser Petrischale durch Drehen des Siebes auf den Kopf und Spülen mit einem feinen Strahl von E3 bis keine Eier im Sieb gelassen, und etwa 25 ml Lösung E3 in die Schüssel.
- Nach dem Sammeln, teilen Sie die Eier in mehrere Gerichte (etwa 50-60 Eier pro Schale), um Überbelegung, die Entwicklungs Asynchronität innerhalb der Kupplung führen können und machen das Sammeln gewünschten Zeitpunkten schwer zu vermeiden.
- Embryonen in E3 Lösung Inkubation bei 28,5 ° C, um Entwicklungs Beurteilung nach dem Standard Zebrafisch-Staging-Serie 40 zu ermöglichen.
Hinweis: Die Embryonen zu E3 / PTU bei 24 Stunden nach der Befruchtung (HPF) übertragen, um Pigment Entwicklung zu verhindern, wenn Manipulationen bei älteren Stadien erfordern optische Klarheit werden.
8. Bead Implantation
- Der Mikrokügelchen in gewünschten Testmolekül-Konzentration oder das entsprechende Fahrzeug s inkubierenolution für die erforderliche Zeit in einem geeigneten Volumen.
Hinweis: Der Forscher kann sterile Petrischalen im Bereich von 3 bis 6 cm im Durchmesser, oder Multi-Well-Platten, von denen beide Visualisierung der Mikrokügelchen in der Lösung aktivieren. Zeit kann in Abhängigkeit von der Art und der Menge des interessierenden Molekül variieren und sollte der Forscher an den Hersteller oder veröffentlichten Empfehlungen zur Dauer der Inkubation und andere Aspekte beziehen, wie beispielsweise Empfindlichkeit gegenüber Licht und Temperatur. - Sobald die Embryonen das gewünschte Entwicklungszeitpunkt erreicht, entfernen Sie die Embryonen aus ihrem Chorion mit feinen Pinzette.
- Inkubiere die Embryonen in dem gefilterten Ringerlösung mit Antibiotika für 10 Minuten, um sie zu der Lösung akklimatisieren.
- Während die Embryonen akklimatisieren, übertragen Sie die Mikrokugeln in die Mikrokügelchen Platte innerhalb der Implantation Wanne eingebettet und spülen Sie sie in Ringer-Lösung für 10 min.
Hinweis: Implantieren Sie die Perlen innerhalb von 50 min nach dem Erreichen dieses Punktes. Dies wdie Wahrscheinlichkeit, daß man einen Wulst mit einer kleineren Konzentration des Moleküls von Interesse zu implantieren schlecht verringern. - Array die Embryonen in die Vertiefungen der Mikrokügelchen Implantation Tablett, kümmert sich um sie so zu orientieren den Bereich von Interesse, wo der Mikrokügelchen wird implantiert werden zugänglich ist.
- Machen Sie einen kleinen Schnitt an der Embryo mit der Wolfram-Nadel.
- Übertragen einer Mikroperle auf den Embryo mit der Mikrokapillare Transferpipette: Niederdrücken der Kolben der Pipette vorsichtig die Mikrokügelchen in die Kapillarsäule, und lassen Sie den Druck auf die Mikrokügelchen auf das gewünschte Ziel zu übertragen.
- Verwenden Sie die Whisker / Wimpern Werkzeug, um die Mikrokügelchen innerhalb des Embryos zu positionieren. Hinweis: Achten Sie darauf, um die Mikrokügelchen in das Gewebe entfernt von der Stelle der Schnitt zu positionieren, so dass die Mikrokügelchen nicht aus dem Embryo ausgewiesen werden, wie es heilt.
Ergebnisse
Verschiedene Arten von Bearbeitungswerkzeuge eignen sich zur Handhabung von Mikrokügelchen während der Forschungsanwendungen (Abbildung 1). Darüber hinaus kann eine einfache Agarose-Form mit kleinen Brunnen genutzt werden, um die Zebrafischembryo, die lebenswichtig, diese Experimente in einem rechtzeitig und effizient (Abbildung 1) durchzuführen ist, zu halten. Die Implantation einer Mikroperle kann die räumliche und zeitliche Position der Bühne von Interesse, dass die Forscher ein bestimmtes Fenster der Aktion für das Molekül von Interesse eingrenzen können durchgeführt werden.
Hier wurden einzelne Mikrokügelchen in Zebrafischembryonen im Schwanzknospenstadium oder zu späteren Zeitpunkten während Somitogenese Stufen (Abbildung 3) implantiert. Zwei unterschiedliche Größe Microbeads mit Ringer-Lösung allein gespült wurden in diesem Protokoll Demonstration (3A, 3B und 3C) eingesetzt. Diese Mikrokügelchen Implantation in Abwesenheit eines konjugiertenkleinen Molekülen zeigt, dass Perle Implantation kann ohne grobe morphologische Effekte während die richtige Entwicklung des Zebrafischembryo (Abbildung 4) erzielt werden.
Der Experimentator kann Schwierigkeiten mit dem Manövrieren des Mikrokügelchen in das Einstichloch durch eine Wolfram-Nadel oben auf den Embryo gemacht begegnen. Um eine bessere Handhabung der Mikroperle einmal auf den Embryo durch die Mikronadel platziert zu erreichen, kann ein Haar / Wimpern Werkzeug verwendet werden. Dies kann mit natürlich vergossen felinen oder caninen Whisker in Handarbeit gemacht werden, obwohl auch andere natürliche oder synthetische Peitsche Filamente können verwendet werden (Abbildung 1). Ein sanfter Druck auf den Mikrokügelchen entweder mit dem Wolfram-Nadel oder der Whisker-Tool sollte sehen, die Mikrokügelchen in der Ringerlösung der Form sinken. Sobald die Mikrokügelchen in die Form versenkt es sollte große Abstände gegebenenfalls verschoben mit der Wolframnadel und einmal oberhalb des Embryos die Nadel oder Whisker Werkzeug zu positio verwendet werdenn die Mikrokügelchen in den Embryo. Der Erfolg des Mikrokügelchens Implantation kann unmittelbar durch Visualisierung auf einem Stereomikroskop gemessen werden, da die Sicke wird stabil in dem Gewebe positioniert bleiben. Zu Wulst Position im Laufe der Zeit zu bewerten, kann jede Embryo Probe durch Live-Zeitverlauf Fotografie abgebildet oder überprüft in regelmäßigen Abständen (wie in Abbildung 4 dargestellt), um sicherzustellen, dass der Wulst Lage hat sich nicht über die Dauer des Experiments durch körpereigenes Gewebe verschoben werden Morphogenese. Verständnis der Position der Wulst über die Zeit ist für die meisten informiert Interpretation der Ergebnisse, wie die Bewertung der Wirkung eines kleinen Moleküls an ein Zielgewebe oder Entwicklungsprozesses.
Die Verwendung dieser oben genannten Schritte wird eine ideale Umgebung für die Mikrokügelchen in den Zebrafischembryos zu einem gewünschten Zeitpunkt und Stellung einzubetten. Nach unserer Erfahrung Anfänger dieser Mikrokügelchen Implantation Protokoll typischerweise gewann die Fähigkeit newendig, um konsistente chirurgischen Implantation von Mikroperlen in das Zebrafischembryo nach ca. einer Woche der Praxis durchzuführen.
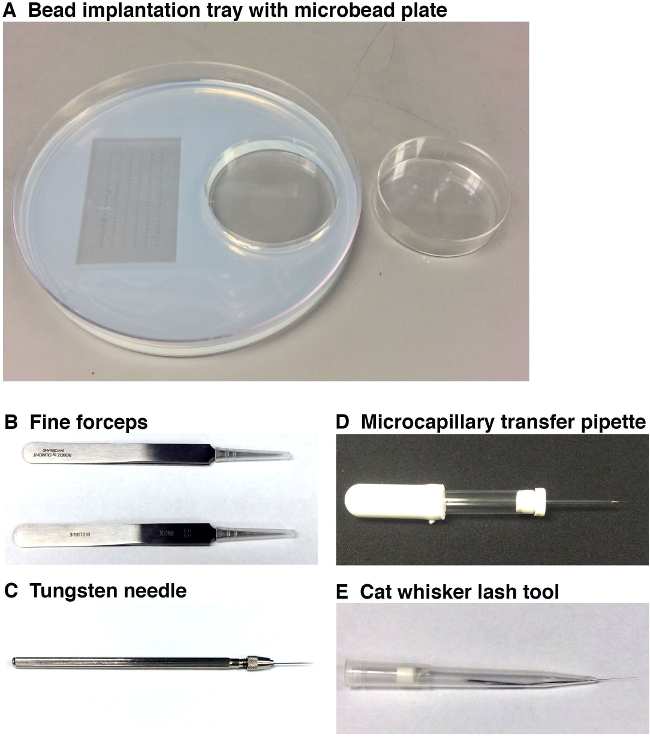
Abbildung 1. Werkzeuge verwendet werden, um Mikrokügelchen Implantation durchzuführen. (A) Die Wulst Implantation Fach (links, 15 cm Durchmesser) mit Embryo Formen (links) und eine Mikroperle Inkubationswanne (rechts, 6 cm Durchmesser). Diese Arbeitsschale ermöglicht die Forscher, um die Embryonen in die gewünschte Ausrichtung für Mikrokügelchen Implantation zu stellen und die vorbereiteten Mikroperlen zur Implantation in unmittelbarer Nähe an der Mikroskopstation haben. Mikrokugeln sollten in kleinen Molekül (en) und / oder Fahrzeug inkubiert werden und dann, bevor sie in die Wulst Implantation Fach, das unter dem Mikroskop Station positioniert ist in einem separaten Mikrokügelchen Platte (rechts) gespült. (B) Zwei Paare von feinen Pinzette wird verwendet, um die chori entfernenauf um jede Zebrafischembryo und auch, um das Ende der Mikrokapillare Nadel abbrechen. (C) Ein Wolfram-Nadel verwendet werden, um eine sehr feine Punktion in dem Zebrafischembryo, in dem die Mikrokügelchen positioniert werden. (D) Die Mikrokapillare Transferpipette wird verwendet, zu erlernen und zu positionieren, ein Mikrokügelchen auf der Oberseite des Zebrafischembryo in der Nähe der Stelle der Punktion werden. (E) Die Whisker / Wimpern Tool wird die schonende Positionierung der Mikrokügelchen in die Einschnittstelle innerhalb des Embryos, die zuvor von der Wolfram-Nadel gemacht wurde zu ermöglichen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
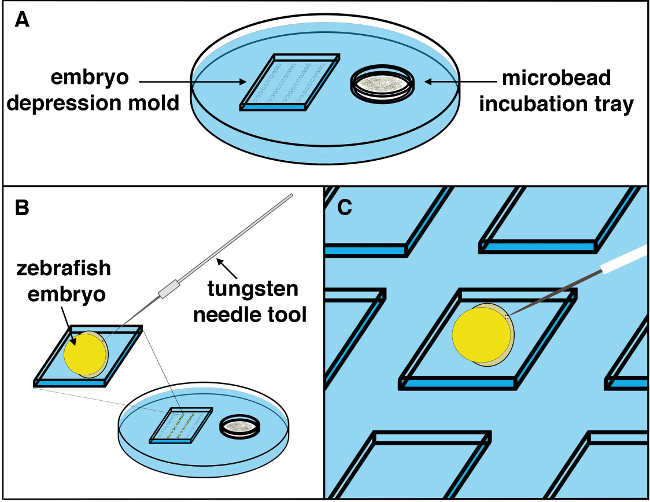
Abbildung 2. Schematische Darstellung der Mikrokügelchen Implantationsverfahren. (A) Ein Mikrokügelchen Implantation Tablett mit Mikroperlen soaking in der gewünschten Waschlösung wird unter einem Stereomikroskop Station gesetzt, und die Embryonen mit Gewebe nach oben positioniert. (B) Unter Verwendung einer Wolframnadel kann eine kleine Inzision in den Embryo mit einem leichten doch kraft Bewegung möglich. (C) Unter Verwendung einer Mikrokapillare Transferpipette kann die gewünschte Mikrokügelchen aus dem Mikrokügelchen Inkubationskammer in der Schale, auf der rechten Seite ausgewählt werden, und auf der linken Kammer, wo der Embryo Arbeitsbereich befindet gebracht. Die Mikrokügelchen sollten in der Nähe der Stelle des Einschnitts hinterlegt, dann vorsichtig in die Einschnittstelle durch die Wolfram Nadel mit der Whisker / Wimpern Werkzeug gemacht positioniert. Sobald ein Mikrokügelchen in die Einschnittstelle manövriert, sollte es in das Gewebe (weg vom Einschnitt) gesteckt, um die Mikrokügelchen stabil positionieren und anschließender Bewegung aus dem Embryo als Entwicklung geht weiter zu verhindern. Pmieten klicken Sie hier, um eine größere Version dieser Figur zu sehen.
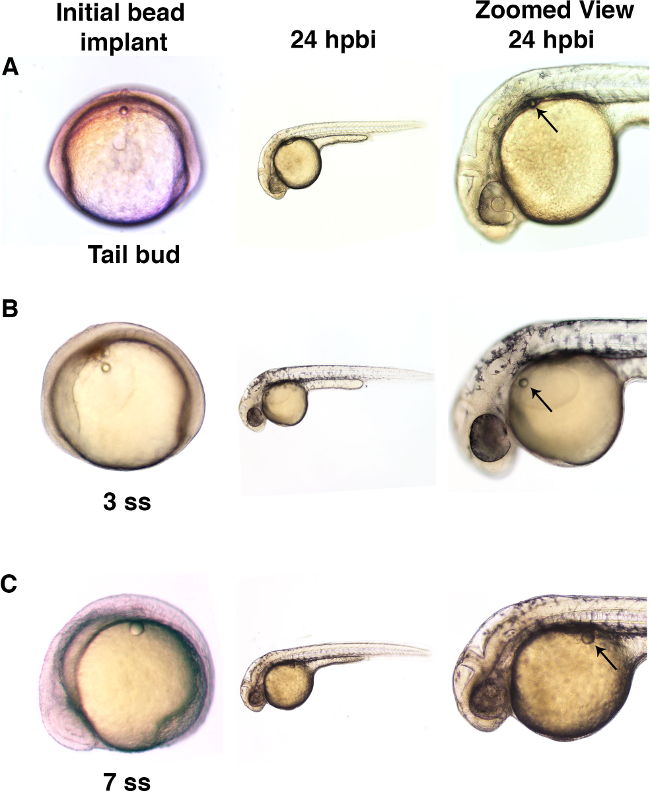
Abbildung 3. Mikroperlen können in Embryonen in verschiedenen Entwicklungsstadien implantiert werden. (A) Zebrafischembryos wurden mit einem Mikrokügelchen (Durchmesser von ca. 50 um) in den Kofferraum an der Schwanzknospenstadium implantiert. Wenn an der 24 h nach der Sicke Implantat (HPBI) untersucht, hatten die Embryonen normal entwickelt und die Mikrokügelchen zeigten minimale Bewegung während des Durchgangs der Entwicklungszeit. (B) Zebrabärblingembryonen implantiert mit Mikrokügelchen (mit einem Durchmesser von etwa 50 um) in den Dottersack an der 3 Somitenstufe (ss) angezeigt normalen Entwicklung mit relativ geringfügigen Wulst Bewegung über die Zeit. (C) größer Mikroperlen (Durchmesser von ca. 70 & mgr; m) wurden in den 7 ss Embryos implantiert ähnlich zeigten normale spätere Entwicklung sowie minimal, wenn eine Bewegung von der Implantationsstelle. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
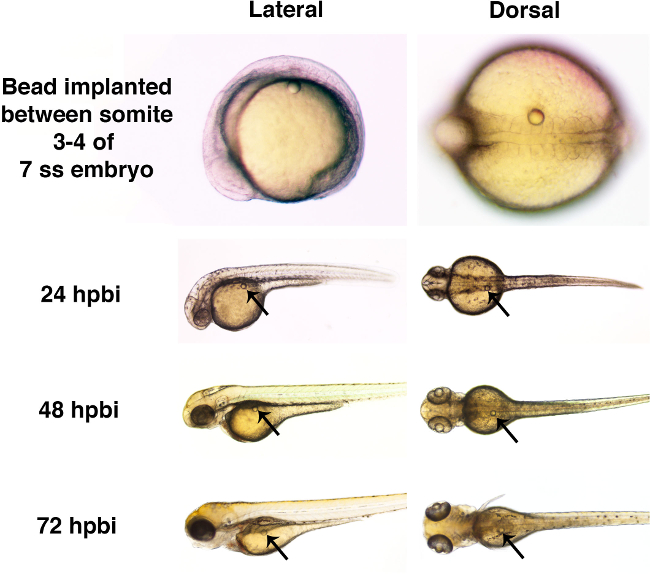
Abbildung 4. Gross Entwicklung des Zebrafischembryo ist ungestörten durch die Anwesenheit eines Mikrokügelchen durch 72 HPBI. Zebrabärblingembryonen wurden mit Mikroperlen in Ringer-Lösung eingetaucht (mit einem Durchmesser von etwa 50 & mgr; m) an der 7-Somitenstufe (ss) implantiert. Jeder Mikrokügelchen wurde chirurgisch in den Kofferraum zwischen den Somiten 3 und 4 eingesetzt ist, die Anwesenheit der Raupe wurde nicht mit offenen Entwicklungsstörungen bei 24 Stunden nach der Wulst-Implantat (HPBI), 48 HPBI oder 72 HPBI verbunden sind. Bitte klicken Sie hier, um einen Blick Größere Version der Figur.
Diskussion
Im Laufe des letzten Jahrhunderts hat sich das Verständnis von Körper Plan Strukturierung und Organogenese monumentale Fortschritte durchgemacht. Gewebemanipulationstechniken waren entscheidend bei der Aufdeckung wichtige Informationen über diese lebenswichtige Prozesse. Genetische Modifikation ist eine der am häufigsten verwendeten Methoden zur Ermittlung der Genfunktion und Verfahren zur Mosaikanalyse, wie Zelltransplantation nützliche Ansätze Autonomie der Genfunktion zu verstehen. Microbead Implantation bietet eine weitere Ort, um abzufragen, wie bestimmte Moleküle verändern Entwicklungsdynamik, da diese Methode ermöglicht es dem Forscher, um eine lokale Gewebeumgebung durch die Einführung von Signalmolekülen oder Inhibitoren verändern. Eine Reihe von unterschiedlichen Mikrokügelchen sind im Handel erhältlich, die unterschiedliche Größen und andere physikalische Eigenschaften haben, bestehen (zB Ladung), so daß sie für den experimentellen Bedingungen von Interesse verwendet werden. Somit kann durch Implantieren Mikrokugeln in einem Protein oder chemisch getränktencal von Interesse innerhalb eines Organismus können die Forscher lokalisierte Effekte während der Entwicklung zu untersuchen und Zusammenhänge zwischen dem Gen oder Molekül von Interesse und bestimmten biologischen Phänotyp (n).
Studien wie die von Wada geführt und Kollegen verwendeten Mikrokügelchen Implantation, um die Wirkung einer erhöhten Hedgehog-Signalisierung im Skelett Strukturierung im vorderen neurocranium (ANC) in Zebrafisch-23 zu beurteilen. Frühere Studien haben gezeigt, dass Shh für ANC Formation 14 erforderlich. Verwendung Shh beschichteten Mikrokügelchen Forscher festgestellt, dass dieses Signal fördert Knorpelbildung in der ANC. Die Mikrokügelchen-Implantationsprozess wurde verwendet, um eine klare Verbindung zwischen Hedgehog-Signalisierung und Knorpelbildung in der ANC zu demonstrieren. Ein weiteres wichtiges Beispiel für diese Gewebemanipulationstechnik in Zebrafisch wird in Studien beobachtet, wo Wissenschaftler untersuchten die Transkriptionskontrolle des Erythroblastoma Twenty-Six (ETS) Domain-fSchauspieler ETS-verwandtes Molekül (ERM) und Polyoma-Enhancer Aktivator 3 (Pea3) von FGF-Signal während der frühen Zebrafischgehirnentwicklung 19. Durch Mikrokügelchen Implantationsexperimenten konnten sie zeigen, dass Fgf8 und FGF3 können ektopisch Ausdruck erm und PEA3 aktivieren. Diese Beispiele zeigen die Nützlichkeit der Mikrokügelchen, um Einblicke in die Entwicklungsmechanismen, die bei der Gewebebildung zusammenarbeiten, die gut charakterisiert sein kann durch die Verwendung von Methoden, die Genexpression 41 bewerten. Somit können Mikrokügelchen Transplantation eine praktikable Methode, um in anderen Geweben, wie beispielsweise die Zwischen Mesoderm (IM), die zu der Niere verursacht erforschen. Insbesondere wäre es in Nierenentwicklungsstudien zu unterstützen, zu untersuchen, wie verschiedene Moleküle beeinflussen nephron Segmentierung 42 und Tubulogenese 43,44, Prozesse, die nur oberflächlich zur Zeit verstanden. Außerdem Mikrokügelchen Implantation begonnen hat, verwendet werden, um Gestüt werdeny Regenerationsprozesse im Zebrafisch 29] und konnte für die Verwendung mit einer beliebigen Anzahl von Organregeneration Modelle wie folgt Laserablation embryonaler Gewebe wie Nephron 45 oder in Verbindung mit Verfahren, die formuliert wurden, um die Forschung mit den entsprechenden Strukturen auch Erwachsenen angepasst werden 46-49. Schließlich weist Mikrobead Implantation das Potential, in Modellen der menschlichen Krankheit, wie Krebs oder Gewebedegeneration 50,51 52,53 verwendet werden.
Im vorliegenden Protokoll zeigen wir die Methode der Mikrokügelchen Implantation in Zebrafischembryonen, die wurde auch in ähnlicher Weise von anderen Forschern beschrieben, aber nicht durch Video-Protokolle 1 gezeigt. Mit minimalen Praxis konnten wir Mikrokügelchen mit einer ungefähren Geschwindigkeit von 8-10 Embryonen / h, die die Machbarkeit dieses Verfahrens betrifft, sobald der Forscher hat einige Erfahrung zu implantieren. Die Ergebnisse zeigen, dass die hier gezeigten Perlen verschiedener dbmessungen kann in einem frühen Stadium eingepflanzt werden kann und daß mit Sorgfalt kann diese Gewebemanipulationstechnik mit minimalen physikalischen Störung des Embryos eingeführt werden. Eine Verbesserung, die hervorgehoben werden sollten, ist die Verwendung eines Whisker / Wimpern Werkzeug, um die Mikrokügelchen in den Embryo zu positionieren. Diese relativ preiswerten und einfachen Gerät etwa dem gleichen Durchmesser wie die Mikrokügelchen, leicht zu erhalten und hilft Beschleunigung des Implantationsprozesses. Die Whisker / Peitsche auf eine gewünschte Länge geschnitten werden, um eine feste produzieren aber feinen Wulst-Handhabungswerkzeug, je nach Forscher Geschicklichkeit und Vorlieben. Schließlich, während wir hier, wie Sie physisch zu manipulieren Mikroperlen und Zebrafischembryonen der Implantation durchführen beschrieben, dieses Protokoll nicht skizzieren bestimmte Handhabungsverfahren für verschiedene Medikamente oder Peptide. Im allgemeinen sollte chemisch behandelten Mikrokügelchen in das Tier mit Zweckmäßigkeit implantiert werden, zu unerwünschten Effekten in anderen Bereichen des Organismus zu vermeiden, und Forscher sollte gut sein,über die möglichen Sicherheitsbedenken mit solchen Chemikalien vor Beginn ihres Studiums verbunden sind gebildet.
Zusammengefasst haben wir eine relativ einfache und effiziente Mikrokügelchen Implantationsverfahren mit einer Vielzahl von Anwendungen unter Verwendung von Materialien, die im Labor leicht verfügbar sind gezeigt. Letztendlich hoffen wir, dass dieses Handbuch werden die Forscher mit dem zarten Wesen der Zebrafisch Gewebemanipulation unterstützen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde vom NIH Zuschusses DP2OD008470 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium Chloride | American Bioanalytical | AB01915 | |
| Potassium Chloride | American Bioanalytical | AB01652 | |
| Calcium Chloride | American Bioanalytical | AB00366 | |
| HEPES | Sigma Life Science | H4034 | |
| Penicillin-Streptomycin solution | Sigma-Aldrich | P4333-20ML | |
| N-Phenylthiourea (PTU) | Aldrich Chemistry | P7629 | |
| Ethyl 3-aminobenzoate (Tricaine) | Fluka Analytical | A5040 | |
| Borosilicate glass | Sutter Instruments Co. | BF100-50-10 | |
| Flaming/Brown Micropipette puller | Sutter Instruments Co. | Mo. P097 | |
| UltraPure Agarose | Invitrogen | 15510-027 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| 250 ml Erlenmeyer Flask | Fischer Scientific | FB-500-250 | |
| Falcon Diposable Petri Dishes, Sterile | Corning | 430167 | |
| 60 mm x 15 mm | VWR | 25373-085 | |
| 100 mm x 15 mm | VWR | 25373-100 | |
| 150 mm x 15 mm | VWR | 25373-187 | |
| Saint-Gobain Chemware Microspatula | Fischer Scientific | 21-401-50B | |
| P-1000 Micropipette tips | Fischer Scientific | 2707402 | |
| Low Temperature Incubator | Fischer Scientific | 11 690 516DQ | |
| Dimethly Sulfoxide | American Bioanalytical | AB00435 | |
| Microbeads (45-106 µm) | Biorad | 140-1454 AG1-X8 | |
| Microbeads (45 µm) | Polysciences | 7314 | |
| Micro Dissecting Tweezer | Roboz Surgical Instruments Co. | RS-5010 | |
| Tungsten Needle | Roboz Surgical Instruments Co. | RS-6065 | |
| Capillary tube holder | Globe Scientific Inc. | 51674 |
Referenzen
- Lieschke, G. J., et al. Tissue micromanipulation in zebrafish embryos. Zebrafish, Methods in Molecular Biology. 546, (2009).
- Wilson, J., Tucker, A. S. Fgf and Bmp signals repress the expression of Bapx1 in the mandibular mesenchyme and control the position of the developing jaw joint. Dev Biol. 266, 138-150 (2004).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Invest. 122, 2337-2343 (2012).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341(2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Haffter, P., Nüsslein-Volhard, C. Large scale genetics in a small vertebrate, the zebrafish. Int J Dev Biol. 40, 221-227 (1996).
- Amsterdam, A., Hopkins, N. Mutagenesis strategies in zebrafish for identifying genes involved in development and disease. Trends Genet. 22, 473-478 (2006).
- Pickart, M. A., Klee, E. W. Zebrafish approaches enhance the translational research tackle box. Transl Res. 163, 65-78 (2014).
- Kroeger, P. T. Jr, Poureetezadi, S. J., McKee, R., Jou, J., Miceli, R., Wingert, R. A. Production of haploid zebrafish embryos by in vitro fertilization. J Vis Exp. 89, e51708(2014).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21, 48-64 (2011).
- Auer, T. O., Del Bene, F. CRISPR/Cas9 and TALEN-mediated knock-in approaches in zebrafish. Methods. 69, 142-150 (2014).
- Peterson, R. T., Link, B. A., Dowling, J. E., Schreiber, S. L. Small molecule developmental screens reveal the logic and timing of vertebrate development. Proc Natl Acad Sci USA. 97, 12965-12969 (2000).
- Lessman, C. A. The developing zebrafish (Danio rerio): A vertebrate model for high-throughput screening of chemical libraries. Birth Defects Res C Embryo Today. 93, e52063(2011).
- Donahue, E. K., Wingert, R. A. A manual small molecule screen approaching high–throughput using zebrafish embryos. J Vis Exp. , 52063(2014).
- Hyatt, G. A., Schmitt, E. A., Marsh-Armstrong, N., McCaffery, P., Dräger, U. C., Dowling, J. E. Retinoic acid establishes ventral retinal characteristics. Development. 122, 195-204 (1996).
- Picker, A., Brand, M. Fgf signals from a novel signaling center determine axial patterning of the prospective neural retina. Development. 132, 4951-4962 (2005).
- Reifers, F., Walsh, E. C., Leger, S., Stainier, D. Y. R., Brand, M. Induction and differentiation of the zebrafish heart requires fibroblast growth factor 8 (fgf8/acerebellar.). Development. 127, 225-235 (2000).
- Raible, F., Brand, M. Tight transcriptional control of the ETS domain factors Erm and Pea3 by Fgf signaling during early zebrafish development. Mech Dev. 107, 105-117 (2001).
- Reim, G., Brand, M. spiel-ohne-grenzen/pou2. mediates regional competence to respond to Fgf8 during zebrafish early neural development. Development. 129, 917-933 (2002).
- Jaszai, J., Reifers, F., Picker, A., Langenberg, T., Brand, M. Isthmus-to-midbrain transformation in the absence of midbrain-hindbrain organizer activity. Development. 130, 6611-6623 (2003).
- Hirati, Y., Okamoto, H. Canopy1, a novel regulator of FGF signaling around the midbrain-hindbrain boundary in zebrafish. Curr Biol. 16, 421-427 (2006).
- Wada, N., Javidan, Y., Nelson, S., Carney, T. J., Kelsh, R. N., Schilling, T. F. Hedgehog signaling is required for cranial neural crest morphogenesis and chondrogenesis at the midline in the zebrafish skull. Development. 132, 3977-3988 (2005).
- Abe, G., Ide, H., Tamura, K. Function of FGF signaling in the developmental process of the median fin fold in zebrafish. Dev Biol. 304, 355-366 (2007).
- Prykhozhij, S. V., Neumann, C. J. Distinct roles of Shh and Fgf signaling in regulating cell proliferation during zebrafish pectoral fin development. BMC Dev Biol. 8, 91(2008).
- Scholpp, S., Brand, M. Endocytosis controls spreading and effective signaling range of Fgf8 protein. Curr Biol. 14, 1834-1841 (2014).
- Hardt, S., et al. The Bmp gradient of the zebrafish gastrula guides migrating lateral cells by regulating cell-cell adhesion. Curr Biol. 17, 475-487 (2007).
- White, R. J., Nie, Q., Lander, A. D., Schilling, T. F. Complex regulation of cyp26a1 .creates a robust retinoic acid gradient in the zebrafish embryo. PLoS Biol. 5, e2522-e2523 (2007).
- Brittijn, S. A., et al. Zebrafish development and regeneration: new tools for biomedical research. Int J Dev Biol. 53, 835-850 (2009).
- Niswander, L., Jeffrey, S., Martin, G. R., Tickle, C. A positive feedback loop coordinates growth and patterning in the vertebrate limb. Nature. 371, 609-612 (1994).
- Laufer, E., Nelson, C. E., Johnson, R. L., Morgan, B. A., Tabin, C. Sonic hedgehog and Fgf-4 act through a signaling cascade and feedback loop to integrate growth and patterning of the developing limb bud. Cell. 79, 993-1003 (1994).
- Tickle, C., Alberts, B., Wolpert, L., Lee, J. Local application of retinoic acid to the limb bud mimics the action of the polarizing region. Nature. 296, 564-566 (1982).
- Samarut, E., Fraher, D., Laudet, V., Gibert, Y. ZebRA: an overview of retinoic acid signaling during zebrafish development. Biochimica et Biophysica Acta. 1849, 73-83 (2015).
- Lengerke, C., et al. Interactions between Cdx genes and retinoic acid modulate early cardiogenesis. Dev Biol. 354, 134-142 (2011).
- Wingert, R. A., et al. The cdx and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom., and Notch signaling. Dev Biol. 386, 111-122 (2014).
- Cheng, C. N., Wingert, R. A. Nephron proximal tubule patterning and corpuscles of Stannius formation are regulated by the sim1a. transcription factor and retinoic acid in the zebrafish. Dev Biol. 399, 100-116 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J Vis Exp. , e51604(2014).
- Cheng, C. N., Wingert, R. A. Chapter 9: Renal system development in the zebrafish: a basic nephrogenesis model. Zebrafish: Topics in Reproduction & Development. Carver, E., Lessman, C. , Nova Scientific Publishers. (2014).
- Gerlach, G. F., Wingert, R. A. Zebrafish pronephros tubulogenesis and epithelial identity maintenance are reliant on the polarity proteins Prkc iota .and zeta. Dev Biol. 396, 183-200 (1016).
- McKee, R., Gerlach, G. F., Jou, J., Cheng, C. N., Wingert, R. A. Temporal and spatial expression of tight junction genes during zebrafish pronephros development. Gene Expr Patterns. 16, 104-113 (2014).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. , e2845(2011).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. 54, e2839(2011).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Analysis of nephron composition and function in the adult zebrafish kidney. J Vis Exp. , e51644(2014).
- McCampbell, K. K., Springer, K., Wingert, R. A. Atlas of cellular dynamics during zebrafish adult kidney regeneration. Stem Cells Int. In press, (2015).
- Lee, S. L., et al. Hypoxia-induced pathological angiogenesis mediates tumor cell dissemination, invasion, and metastasis in a zebrafish tumor model. Proc Natl Acad Sci USA. 106, 19485-19490 (2009).
- Rouhi, P., et al. Hypoxia-induced metastasis model in embryonic zebrafish. Nat Prot. 5, 1911-1918 (2010).
- Cao, R., Jensen, L. D. E., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3, e2748(1371).
- Cao, Z., et al. Hypoxia-induced retinopathy model in adult zebrafish. Nat Prot. 5, 1903-1910 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten