Method Article
Microbead Имплантация в данио рерио эмбрионов
В этой статье
Резюме
The zebrafish is an excellent model system for genetic and developmental studies. Bead implantation is a valuable tissue manipulation technique that can be used to interrogate developmental mechanisms by introducing alterations in local cellular environments. This protocol describes how to perform microbead implantation in the zebrafish embryo.
Аннотация
Данио стала ценным генетическим модельной системы для изучения биологии и болезни развития. Данио рерио имеют высокую степень геномной сохранения, а также сходство в клеточном, молекулярном и физиологических процессов, с других позвоночных, включая человека. Во время раннего онтогенеза, эмбрионы рыбок данио оптически прозрачны, что позволяет исследователям визуализировать динамику органогенеза, используя простой стереомикроскопа. Microbead имплантация метод, который позволяет манипуляции ткани через изменение факторов в местных условиях. Это позволяет исследователям для анализа последствий любого количества сигнальных молекул интереса, таких как, выделяемых пептидов, в определенных пространственных и временных точках в пределах развивающегося эмбриона. Здесь мы подробно протокол о том, как манипулировать и имплантатов шарики в начале данио развития.
Введение
Развивающие исследователи биологии используют широкий спектр клеточных, молекулярных и генетических методов, чтобы раскрыть механизмы, которые определяют, как формируется организм. Среди этих подходов, манипуляции ткани ключевым инструментом в расшифровке сложные вопросы о судьбе клеток, клеточное движение, и организации тканей. Один из способов, чтобы изменить среду местные ткани через хирургический применения микрогранул, которые используются для доставки фокусное источник белков или других сигнальных молекул 1. Этот тип экспериментальной манипуляции широко реализованы в классических позвоночных моделей эмбриологии, таких как лягушки и цыпленка 2.
Данио стал важным позвоночных модельный организм для изучения органогенеза, а также предоставляет множество уникальных преимуществ для моделирования заболевания 3-5, поскольку они разделяют высокий генетический сохранение с людьми 6. В частности, оптической прозрачностью и эксвнешнее развитие зародыша данио предлагает непревзойденную зрения для наблюдения тканей онтогенеза 3-5. Реализация крупномасштабных вперед генетических экранов породила мощный хранилище данио мутантных штаммов для дальнейшего исследования 7,8 и выявлению альтернативных методов скрининга, которые могут быть эффективно проведенного в уменьшенном масштабе в отдельных лабораториях 9,10. Дальнейшая экспериментальная работа с данио способствовало благодаря достижениям в трансгенных методик и обратного генетические подходы 11,12, а также химические генетики 13-15.
Методы манипулирования тканей, таких как осуществление микросфер, не было так широко используется в данио, но тем не менее является полезным инструментом для дальнейшего понимания клеточной сигнализации в процессе разработки. Microbead имплантация была использована, чтобы допросить процессы формирования органов в сетчатке рыбок данио16,17, сердце 18, мозг 19-22, нервного гребня 23 и плавник 24,25. В этих и других исследований, бусы были применены в процессе разработки, чтобы понять распространение сигнальных молекул 26, как градиенты влияют на миграцию клеток 27 и осевой паттерна 28. Совсем недавно, микросферы были использованы для оценки механизмов регенерации в данио взрослых 29. В исследованиях развития, например, рыбки данио Microbead работы была для понимания механизмов формирования конечностей через исследований грудного плавника 25. Данио грудной плавник бутон гомологичны передних конечностей почки в мыши 30 и 31 кур. Позвоночных конечности бутон имеет два существенных узлов сигнализации: зона поляризующей активности (ЗПА), который устанавливает ось передне-задней-на через выражение Еж Соник (Тсс) и нижестоящих мишеней гена Hox,и верхушечные эктодермальной хребет (AER) присутствует на кончике зачатка конечности, которая действует, чтобы установить проксимальнее дистальной идентичности конечности через выражение фибробластов факторов роста (Fgfs). По имплантации Fgf смоченные микрогранулы в данио Shh мутантов генетических, следователей определены, как Fgf необходимо прогрессии клеточного цикла и роста позвоночных конечности 25. В добавок к Fgf и Shh сигнальных каскадов, которые устанавливают личность позиционную, пионерские исследования с использованием куриных бутон конечностей определены ретиноевой кислоты (РА) в качестве молекулы, которые могут имитировать действие поляризационного региона создать спереди назад идентичность 32. Эти эксперименты, связанные размещения малых полосы РА-пропитанной ватмане в куриных конечности оценить значный паттерна 32. Кроме того, исследователи провели другие исследования с использованием элегантных использование микросфер, трансплантация клеток и экзогенныеЛечения РА у рыбок данио, чтобы определить, что действует РА, чтобы обеспечить долгосрочные позиционные сигналы в мозге рыбок данио и мезодермы 28. Тем не менее, в настоящее время многие вопросы остаются о роли таких факторов, как Fgf и РА сигнализации во время многочисленных аспектах развития позвоночных. Сигнальные эффекты RA, действуя в качестве морфогена, воздействовать на многие органы 33, например, развивающегося сердца 34 и почечных клеток-предшественников, где указывает РА проксимальные почечные клетки типа Fates 35-39. Дальнейшее понимание таких вопросов может существенно выиграть от экспериментальных исследований с использованием манипуляции ткани и Microbead имплантации методы.
В то время как меньше были проведены исследования с микрогранулами имплантации у рыбок данио, по сравнению с моделями, как цыпленок, те, которые были проведены были весьма информативны. Одной из причин недостатка Microbead имплантации, основанной-исследований в данио эмбриона likelу понятие, что есть трудные технические проблемы, в зависимости от размера зародыша, которые составляют препятствие для успешного выполнения таких манипуляций. Тем не менее, Microbead имплантация эмбрионов данио в можно узнать с практикой и помощь путем визуального наблюдения техники, и, таким образом, может быть реализовано в качестве средства для допросить механизмы развития. Здесь мы показывают точное нанесение Microbead в данио эмбриона, которые могут быть использованы для проведения широкого спектра анализов на формирование ткани и клеточного морфогенеза.
протокол
Процедуры для работы с данио эмбрионов, описанных в этом протоколе были одобрены Комитетом по уходу и использованию животных в институциональная в университете Нотр-Дам.
Подготовка Решение 1. Рингера
- Сделайте раствор из 116 мм NaCl, KCl 2,9 мм, 3,6 мм CaCl 2, и 5 мм Hepes с сверхчистой H 2 O путем постоянного перемешивания, чтобы избежать какой-либо соли осадков.
- После добавления соли и, пока раствор еще перемешивании, добавляют 100 ед / мл пенициллина за и 100 мкг стрептомицина на мл.
- После добавления всех антибиотики и соли, выполнить фильтр стерилизации раствора и хранить в стерильный контейнер.
Примечание: N-фенилтиомочевины (1-фенил-2-тиомочевины) или ПТУ может быть добавлен в раствор Рингера, чтобы блокировать образование пигмента в бортовых имплантированных эмбрионов без негативных последствий для здоровья эмбриона. Для подготовки / пигментации блокирующий раствор Рингера, использовать концентратрация 0,003% ПТУ. Из-за низкой концентрации ПТУ быть добавлены он сообщил, что более высокий объем раствора Рингера быть, по крайней мере, 1 л, чтобы избежать добавления незначительный количество ПТУ порошка. Добавить ПТУ на этапе 1.2, в то время как раствор перемешивании.
2. Подготовка Tricaine Решение
- Добавьте 2 г этил 3-аминобензойной кислоты и метансульфоновой кислоты (Tricaine) на литр раствора с 0,1 М Трис, с 1 М наличии сбалансированного до рН 9,5 и сделал сверхчистой H 2 O.
Примечание: Tricaine будет использоваться для эвтаназии данио эмбрионов в нужной точке времени для анализа бортовых имплантации фенотипы.
3. Подготовка Е3 Решение
- Сделать раствор 0,25 М NaCl, 10 мМ KCl, 12,5 мМ CaCl 2, и 16,6 мМ MgSO 4 к 1 л воды высшей степени очистки, чтобы создать 1 л E3.
- Добавить 200 мкл метиленового синего в растворе E3 ингибировать рост грибков.
4. Тяговые Иглы для MicroBead передачи
- Используйте огонь полированной боросиликатного стекла с нити на OD: 1,0 мм, ID: 0,5 мм, при длине 10 см.
- Поместите borosilicated стекло в микропипетки съемник для подготовки тонких игл.
Примечание: Следующие четыре размеры могут быть использованы в качестве отправной точки, чтобы вытащить иглы: тепло = 540, Pull = 245, Скорость = 200, и времени = 125. - После извлечения достаточного количества игл, в крытых пластика не чашки Петри, расположенные на полосах пластилина или клейкой лентой, чтобы предотвратить нарушение кончик иглы, до использования.
- Чтобы обрезать кончик до нужного размера отверстия иглы, используйте пару тонких щипцов забить конец иглы.
Примечание: диаметр отверстия иглы будет меняться в зависимости от размера Microbead быть использованы, а также систему предпочтений пользователя. Хорошая отправная точка для размеров судов отверстие в диапазоне между 100 и 200 мкм, если будет использоваться микросферы, начиная от 50-100 мкм. - ПриоR Чтобы использовать вставьте обрезанную иглу в держатель капилляра моде заполненную передачи Microbead инструмент.
5. Баки / Лэш Подготовка инструмента
- Получить усом, хлестать, или другой небольшой, но фирма кусок натурального или синтетического волоса нити. Вырезать у основания нити под углом 45 °. Придерживайтесь ус к наконечником микропипетки P-1000 с использованием постоянного четкое клей клей.
6. Microbead Имплантация лоток Подготовка
- Смешайте 2 г агарозы с 100 мл раствора E3, чтобы сделать 2% агарозном геле E3.
- Нагреть 2% -ный раствор агарозы в течение 1 мин и 30 сек в 250 мл колбу Эрленмейера, закрученной в колбу каждые 30 сек, чтобы избежать гель с барботированием через.
- Возьмите крышку от 60 мм х 15 мм чашки Петри и поместите его в большем 150 мм х 15 мм блюдо с интерьера вверх.
- Залить горячим агарозном геле в 150 мм х 15 мм чашки Петри, убедившись, что якорь внизКрышка сосуда с меньшим указательного пальца.
Примечание: Разрешить тонкий слой агарозы ниже крышки меньшего тарелки для удаления конденсата, который будет образовывать при заливке геля; это сделает бусы легче увидеть под микроскопом рассечение. - В агарозном охлаждает, но прежде, чем он затвердевает, а поместить форму на геле. Это позволит легче размещения эмбрионов.
- Примечание: Для того чтобы избежать пузырьков в лунках, разместить пресс-формы медленно под углом, пока она не плавает на верхней части геля.
- Использование microspatula, тщательно удалить плесень хорошо, как только гель затвердевает. Добавить решение E3 и магазин на 4 ° C.
7. эмбрионов
- Подготовка спаривания камеры, разделенные перегородками, заполнив их с системой воды, а затем размещения взрослых данио мужчина (ы) и женщин (ы) пар в камерах O / N.
- Сбор оплодотворенных яиц, используя фильтр тонкой проволочной сетки (эмбриональные стадии будет незначительно отличаться),
- Депозит оплодотворенные яйца в чистом, диаметром 10 см Петри поворотом фильтр вниз и промывки его тонкой струйкой Е3 пока нет яиц осталось в сито, и примерно 25 мл Е3 раствора в блюдо.
- После сбора, разделить яйца на несколько блюд (приблизительно 50-60 яиц на чашку), чтобы избежать переполненности, которая может привести к асинхронности развития в кладке и сделать сбор требуемых раз баллов трудно.
- Выдержите эмбрионов в растворе E3 на 28,5 ° C, чтобы включить оценку с развитием в соответствии со стандартом данио промежуточной серии 40.
Примечание: Эмбрионы должны быть переданы E3 / ПТУ на 24 ч после оплодотворения (ФВЧ), чтобы предотвратить развитие пигмента при манипуляции в старших возрастах необходимость оптическую прозрачность.
8. бисера имплантация
- Инкубируйте микрогранулы в требуемой концентрации тест молекулы или соответствующий автомобиль Sспособность по в течение необходимого времени в соответствующем объеме.
Примечание: исследователь может использовать стерильные чашки Петри, начиная от 3-6 см в диаметре, или мульти-луночных, оба из которых позволяют визуализацию микросфер в растворе. Время может варьироваться в зависимости от типа и количества представляющей интерес молекулы, и исследователь должен обратиться к производителю или опубликованных рекомендаций по продолжительности инкубации и другие аспекты, такие как чувствительность к свету и температуре. - После того, как эмбрионы достигли желаемой точки времени развития, удалить эмбрионов из своих хорионов использованием тонких щипцов.
- Инкубируйте эмбрионов в отфильтрованный раствор Рингера с антибиотиками в течение 10 мин, чтобы акклиматизироваться их к раствору.
- В то время как эмбрионы акклиматизации, передавать микрошарики в микрогранулами пластины расположенный внутри имплантации лоток и промыть их в растворе Рингера в течение 10 мин.
Примечание: Имплантат шарики в течение 50 мин после достижения этой точки. Это жболен уменьшить вероятность того, что один будет имплантировать шарик с меньшей концентрацией интерес молекулы. - Массив эмбрионы в лунки Microbead имплантации лоток, заботясь, чтобы ориентировать их так, область интереса, где Microbead будет имплантирован доступна.
- Сделайте небольшой надрез на эмбрион, используя вольфрамовой иглы.
- Передача MicroBead на эмбрион, используя передачи микрокапиллярных пипетки: Нажатие лампы пипетки, осторожно потяните MicroBead в капиллярной колонки, а затем отпустите давление на передачу MicroBead в нужное место.
- Используйте инструмент ус / ресниц позиционировать MicroBead внутри эмбриона. Примечание: Убедитесь, что для размещения MicroBead в ткани от места разреза, так Microbead не будет исключен из эмбриона, как он лечит.
Результаты
Несколько видов инструментов манипуляции полезны для обработки микрогранулы во время исследовательских приложений (рисунок 1). Кроме того, простой в агарозном формы с небольшими скважин могут быть использованы для проведения данио эмбрион, который является жизненно важным для выполнения этих экспериментов в своевременной и эффективной (рис 1). Имплантация Microbead может быть выполнена в пространственном положении и временном этапе интерес, что позволяет исследователи, чтобы сузить конкретного окна действий для представляющей интерес молекулы.
Вот, одиночные микросферы были имплантированы в данио эмбрионов на стадии хвостовой почки или на более поздних временных точках во время сомитогенеза этапов (рисунок 3). Два разных размеров микрошарики, промывают только раствор Рингера, были использованы в данном протоколе демонстрации (Фигура 3А, 3В и 3С). Это Microbead имплантации в отсутствие какого-либо конъюгированногомалые молекулы показывает, что шарик имплантация может быть достигнуто без грубых морфологических эффектов во время нормального развития эмбриона данио (рисунок 4).
Экспериментатор может столкнуться с трудностями маневрирования MicroBead в отверстие прокола, сделанного вольфрамовой иглы на вершине эмбриона. Для достижения лучшей управляемости в MicroBead После размещения на эмбрион на микро-иглы, усов / ресниц инструмент может быть использован. Это может быть сделан с естественно пролить кошачьих или собачьих усы, хотя другие природные или синтетические волокна ресниц можно использовать (Рисунок 1). Нежный толчок в MicroBead либо с вольфрамовой иглы или инструмента усов должны увидеть Microbead погрузиться в растворе Рингера формы. После Microbead затонуло в форму его следует перенести на большие расстояния, если необходимо, с помощью вольфрамовой иглы и один раз на вершине эмбриона игла или бакенбард инструмент может быть использован, чтобы Positioп MicroBead в зародыше. Успех микрогранулами имплантации может быть измерена непосредственно с помощью визуализации на стереомикроскопа, как шарик будет оставаться стабильно позиционируется в ткани. Чтобы оценить положение шарика в течение долгого времени, каждый образец эмбрионов могут быть отображены с помощью живой времени курс фотографии или проверены в периодических интервалах (как показано на рисунке 4), чтобы гарантировать, что расположение борта не смещается по времени эксперимента за счет эндогенного ткани морфогенез. Понимание положение шарика с течением времени имеет решающее значение для наиболее информированного интерпретации результатов, таких как оценки эффекта малой молекулы на ткани-мишени или процесса развития.
Использование этих вышеупомянутых шагов обеспечит идеальную обстановку, в которой вложить микрогранулы в данио эмбриона в нужное время и место. По нашему опыту, начинающие пользователи этого протокола Microbead имплантации обычно приобрел навык пеобходимости выполнять последовательную хирургической имплантации микросфер в данио эмбриона примерно через одну неделю практики.
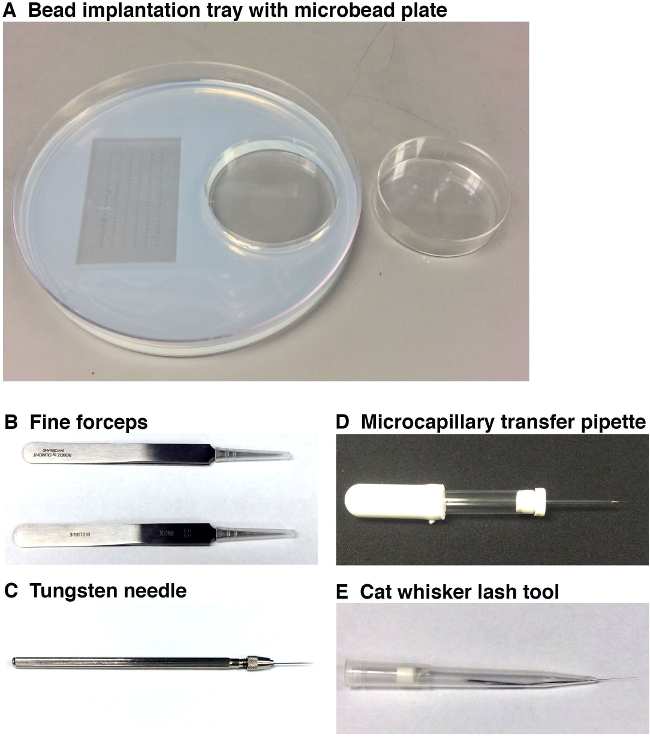
Рисунок 1. Инструмент используется для выполнения Microbead имплантации. (А) Имплантация лоток шарика (слева, диаметр 15 см) с эмбриона формы (слева) и Microbead инкубации лоток (справа, 6 см в диаметре). Это работает лоток позволяет исследователю разместить эмбрионов в требуемом направлении для микрогранулами имплантации, и иметь подготовленные микрогранулы для имплантации в непосредственной близости в микроскоп станции. Microbeads должны быть инкубировали в небольшой молекулой (ами) и / или транспортного средства, а затем ополаскивают в отдельной пластине микрогранулами (справа) перед помещением их в бисерной имплантации лоток, который расположен под микроскопом станции. (В) Две пары тонких щипцов будут использоваться для удаления CHORIна окружающую каждую данио эмбриона, а также нарушить конец микрокапиллярной иглы. (С) вольфрамовой иглы будет использоваться, чтобы сделать очень тонкой прокол в данио эмбриона, в котором позиционировать MicroBead. (D), передачи пипетки микрокапиллярных будет использоваться, чтобы забрать и позиционировать MicroBead сверху данио эмбриона рядом с местом прокола. (Е) ус / ресниц инструмент позволит нежный позиционирование MicroBead в месте разреза в зародыше, который ранее был сделанного вольфрамовой иглы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
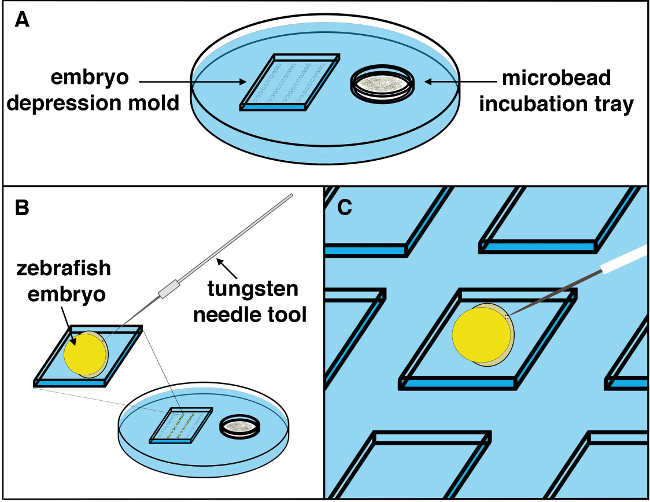
Рисунок 2. Схема процедуры Microbead имплантации. () Microbead имплантация поднос с Microbeads soakiнг в нужном промывочного раствора устанавливается под стереомикроскопа станции, и эмбрионы позиционируется ткани вверх. (Б) Использование вольфрама иглу, небольшой разрез в эмбрион может быть сделано с небольшим пока силового движения. (С) Использование передачи пипетки микрокапиллярных, желательно Microbead можно забрать из Microbead инкубационной камере в лоток, расположенный справа, и принес на левом отсеке, где рабочая зона эмбрион находится. Microbead должна быть переведена недалеко от места разреза, затем аккуратно позиционируется в месте разреза, сделанного вольфрамовой иглы, используя усов / ресниц инструмент. После Microbead маневрирует в месте разреза, оно должно быть заправлены в ткани (от разреза) стабильно позиционировать Microbead и предотвратить последующее движение из эмбриона, как развитие продолжается. Раренды нажмите здесь, чтобы посмотреть большую версию этой фигуры.
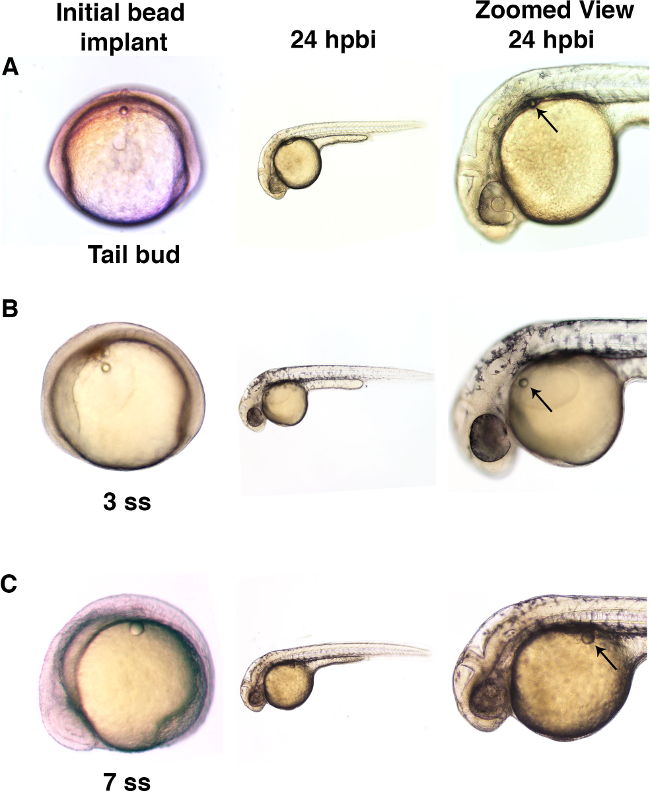
Рисунок 3. Microbeads могут быть имплантированы в эмбрионы на разных стадиях развития. (A) Эмбрионы рыбок данио были имплантированы с MicroBead (диаметр примерно 50 мкм) в багажнике на стадии хвостовой почки. При исследовании на 24 ч после борта имплантата (hpbi), эмбрионы были разработаны нормально и Microbead показал минимальное движение во время прохождения времени развития. (B) Эмбрионы рыбок данио, имплантированных микрогранул (с диаметром приблизительно 50 мкм) в желтка на стадии 3 сомитов (СС) отображается нормальное развитие с относительно небольшим движением шарика с течением времени. (С) Большие микрошарики (диаметр примерно 70 мкм) были имплантированы в 7 сс эмбриона аналогично показало нормальную последующее развитие, а также минимал, если любое движение от места имплантации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
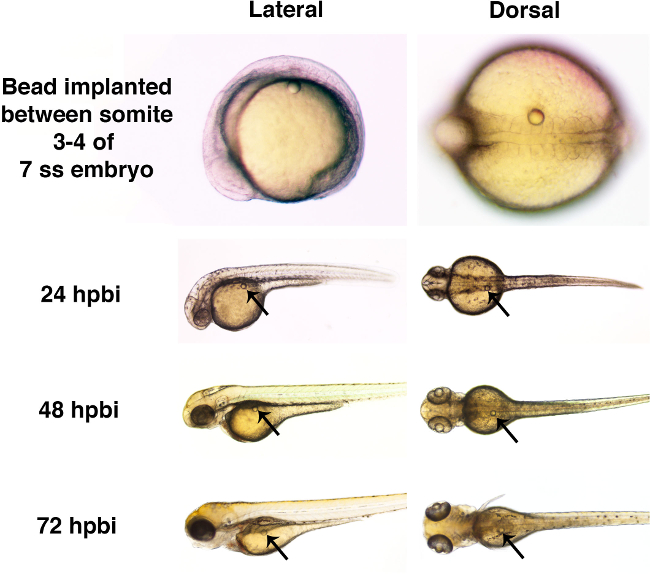
Рисунок 4. Брутто развитие эмбриона данио невозмущенной присутствии Microbead через 72 hpbi. Эмбрионы рыбок данио были имплантированы микрогранул, пропитанных раствором Рингера (с диаметром приблизительно 50 мкм) на стадии 7 сомитов (SS). Каждый Microbead хирургически вставляется в ствол, между сомитов 3 и 4. Наличие борта не было связано с явными дефектами развития в 24 ч после борта имплантата (hpbi), 48 hpbi или 72 hpbi. Пожалуйста, нажмите здесь, чтобы посмотреть крупная версия этой фигуры.
Обсуждение
За последнее столетие, понимание плана тело паттерна и органогенеза претерпела монументальные достижения. Методы манипулирования тканей были решающее значение в раскрытии ключевой информации об этих жизненно важных процессов. Генетическая модификация является одним из наиболее часто используемых методов для установления функции гена и методы анализа мозаики, например, трансплантации клеток, обеспечивают полезные подходы, чтобы понять автономность функции гена. Microbead имплантация обеспечивает другое место, чтобы допросить, как молекулы частности изменить динамику развития, так как этот метод позволяет исследователю изменить среду местных тканей путем введения сигнальных молекул или ингибиторов. Диапазон различных микрогранул являются коммерчески доступными, что имеют различные размеры и другие физические свойства существуют (например, заряд), так что они могут быть использованы, чтобы для экспериментальных условий, представляющих интерес. Таким образом, путем имплантации микрогранулы, которые замачивают в белке или химикокал интерес в организме, исследователи могут исследовать локализованные эффекты во время разработки и найти связь между геном или интерес молекулы и конкретного биологического фенотипа (ов).
Исследования, такие как один в исполнении Вада и его коллеги использовали MicroBead имплантации для того, чтобы оценить эффект повышения сигнализации Hedgehog в скелетных паттернов в передней мозгового (АНК) у рыбок данио 23. Предыдущие исследования показали, что Тсс требуется для формирования АНК 14. Использование Microbeads Тсс-с покрытием исследователи определили, что этот сигнал способствует формированию хряща в АНК. Процесс имплантации Microbead был использован, чтобы продемонстрировать четкую связь между сигнализацией Ежик и формирования хряща в АНК. Другим ключевым примером этого метода манипулирования ткани у рыбок данио наблюдается в исследованиях, где ученые исследовали транскрипционный контроль Erythroblastoma двадцати шести (ETS) домена еактеры ETS-родственная молекула (ERM) и энхансер полиомы активатор 3 (Pea3) с помощью передачи сигналов Fgf в начале данио развития мозга 19. Через MicroBead экспериментов имплантации, они были в состоянии показать, что Fgf8 и Fgf3 может эктопически активировать экспрессию ОУР и pea3. Эти примеры иллюстрируют полезность микрогранул, чтобы обеспечить понимание механизмов, которые взаимодействуют друг с развитием в процессе образования ткани, которые могут быть хорошо охарактеризованных с использованием методов оценки экспрессии генов 41. Таким образом, трансплантация Microbead может быть жизнеспособным методом исследовать другие ткани, такие как промежуточной мезодермы (IM), который приводит к образованию в почках. В частности, было бы помочь в почечных исследований развития, чтобы исследовать, как различные молекулы влияют нефрона сегментации 42 и тубулогенез 43,44, процессы, которые лишь поверхностно в настоящее время. Кроме того, имплантация Microbead начал использоваться для обиваютВосстановление у процессы в данио 29] и может быть адаптирован для использования с любым числом моделей регенерации органов, таких как следующий лазерной абляции эмбриональных тканей, таких как нефрона 45 или в сочетании с методами, которые были сформулированы для проведения исследований с соответствующими структурами взрослых 46-49. Наконец, Microbead имплантация имеет потенциал, чтобы быть использован в моделях болезни человека, такие как рак 50,51 или ткани дегенерации 52,53.
В настоящем протоколе, мы демонстрируем метод микрогранулами имплантации в данио эмбрионов, который также был аналогичным описанному другими исследователями, но не показан через видео протоколов 1. С минимальным практике мы смогли имплантировать микрогранулы с приблизительной скоростью 8-10 эмбрионов / ч, которая относится к возможности этой процедуры один раз исследователь имеет некоторый опыт. Результаты, показанные здесь, демонстрируют, что бусы из различных гimensions могут быть имплантированы на ранних стадиях, и с осторожностью, этот метод манипуляции ткани могут быть реализованы с минимальным ущербом для физического эмбриона. Одно усовершенствование, что следует подчеркнуть, является использование инструмента усов / ресниц позиционировать Microbead в эмбрион. Это относительно недорогой и простой кусок оборудования примерно такая же диаметра, что и MicroBead, легко получить и помогает ускорить процесс имплантации. Ус / ресниц можно вырезать до желаемой длины, чтобы произвести фирма еще тонкий шарик обработки инструмент, в зависимости от исследователя ловкости и предпочтений. Наконец, в то время как мы описали здесь, как физически манипулировать микрогранулы и эмбрионов данио выполнить имплантацию, этот протокол не определены конкретные процедуры обработки для различных наркотиков или пептидов. В общем, химически обработанные микрошарики должны быть имплантированы в организм животного с целесообразностью, чтобы избежать нежелательных эффектов в других областях организма, и исследователи должны быть хорошоформируется о возможных проблем безопасности, связанных с любыми такими химикатами до начала учебы.
В общем, мы продемонстрировали относительно простой и эффективный способ Microbead имплантации в широком диапазоне приложений, использующих материалы, которые легко доступны в лаборатории. В конечном счете, мы надеемся, что это руководство поможет исследователям деликатного характера данио манипуляции ткани.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Эта работа была поддержана NIH грант DP2OD008470.
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium Chloride | American Bioanalytical | AB01915 | |
| Potassium Chloride | American Bioanalytical | AB01652 | |
| Calcium Chloride | American Bioanalytical | AB00366 | |
| HEPES | Sigma Life Science | H4034 | |
| Penicillin-Streptomycin solution | Sigma-Aldrich | P4333-20ML | |
| N-Phenylthiourea (PTU) | Aldrich Chemistry | P7629 | |
| Ethyl 3-aminobenzoate (Tricaine) | Fluka Analytical | A5040 | |
| Borosilicate glass | Sutter Instruments Co. | BF100-50-10 | |
| Flaming/Brown Micropipette puller | Sutter Instruments Co. | Mo. P097 | |
| UltraPure Agarose | Invitrogen | 15510-027 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| 250 ml Erlenmeyer Flask | Fischer Scientific | FB-500-250 | |
| Falcon Diposable Petri Dishes, Sterile | Corning | 430167 | |
| 60 mm x 15 mm | VWR | 25373-085 | |
| 100 mm x 15 mm | VWR | 25373-100 | |
| 150 mm x 15 mm | VWR | 25373-187 | |
| Saint-Gobain Chemware Microspatula | Fischer Scientific | 21-401-50B | |
| P-1000 Micropipette tips | Fischer Scientific | 2707402 | |
| Low Temperature Incubator | Fischer Scientific | 11 690 516DQ | |
| Dimethly Sulfoxide | American Bioanalytical | AB00435 | |
| Microbeads (45-106 µm) | Biorad | 140-1454 AG1-X8 | |
| Microbeads (45 µm) | Polysciences | 7314 | |
| Micro Dissecting Tweezer | Roboz Surgical Instruments Co. | RS-5010 | |
| Tungsten Needle | Roboz Surgical Instruments Co. | RS-6065 | |
| Capillary tube holder | Globe Scientific Inc. | 51674 |
Ссылки
- Picker, A., et al., Lieschke, G. J., et al. Tissue micromanipulation in zebrafish embryos. Zebrafish, Methods in Molecular Biology. 546, (2009).
- Wilson, J., Tucker, A. S. Fgf and Bmp signals repress the expression of Bapx1 in the mandibular mesenchyme and control the position of the developing jaw joint. Dev Biol. 266, 138-150 (2004).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Invest. 122, 2337-2343 (2012).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341 (2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Haffter, P., Nüsslein-Volhard, C. Large scale genetics in a small vertebrate, the zebrafish. Int J Dev Biol. 40, 221-227 (1996).
- Amsterdam, A., Hopkins, N. Mutagenesis strategies in zebrafish for identifying genes involved in development and disease. Trends Genet. 22, 473-478 (2006).
- Pickart, M. A., Klee, E. W. Zebrafish approaches enhance the translational research tackle box. Transl Res. 163, 65-78 (2014).
- Kroeger, P. T., Poureetezadi, S. J., McKee, R., Jou, J., Miceli, R., Wingert, R. A. Production of haploid zebrafish embryos by in vitro fertilization. J Vis Exp. 89, e51708 (2014).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21, 48-64 (2011).
- Auer, T. O., Del Bene, F. CRISPR/Cas9 and TALEN-mediated knock-in approaches in zebrafish. Methods. 69, 142-150 (2014).
- Peterson, R. T., Link, B. A., Dowling, J. E., Schreiber, S. L. Small molecule developmental screens reveal the logic and timing of vertebrate development. Proc Natl Acad Sci USA. 97, 12965-12969 (2000).
- Lessman, C. A. The developing zebrafish (Danio rerio): A vertebrate model for high-throughput screening of chemical libraries. Birth Defects Res C Embryo Today. 93, e52063 (2011).
- Donahue, E. K., Wingert, R. A. A manual small molecule screen approaching high–throughput using zebrafish embryos. J Vis Exp. , 52063 (2014).
- Hyatt, G. A., Schmitt, E. A., Marsh-Armstrong, N., McCaffery, P., Dräger, U. C., Dowling, J. E. Retinoic acid establishes ventral retinal characteristics. Development. 122, 195-204 (1996).
- Picker, A., Brand, M. Fgf signals from a novel signaling center determine axial patterning of the prospective neural retina. Development. 132, 4951-4962 (2005).
- Reifers, F., Walsh, E. C., Leger, S., Stainier, D. Y. R., Brand, M. Induction and differentiation of the zebrafish heart requires fibroblast growth factor 8 (fgf8/acerebellar.). Development. 127, 225-235 (2000).
- Raible, F., Brand, M. Tight transcriptional control of the ETS domain factors Erm and Pea3 by Fgf signaling during early zebrafish development. Mech Dev. 107, 105-117 (2001).
- Reim, G., Brand, M. spiel-ohne-grenzen/pou2. mediates regional competence to respond to Fgf8 during zebrafish early neural development. Development. 129, 917-933 (2002).
- Jaszai, J., Reifers, F., Picker, A., Langenberg, T., Brand, M. Isthmus-to-midbrain transformation in the absence of midbrain-hindbrain organizer activity. Development. 130, 6611-6623 (2003).
- Hirati, Y., Okamoto, H. Canopy1, a novel regulator of FGF signaling around the midbrain-hindbrain boundary in zebrafish. Curr Biol. 16, 421-427 (2006).
- Wada, N., Javidan, Y., Nelson, S., Carney, T. J., Kelsh, R. N., Schilling, T. F. Hedgehog signaling is required for cranial neural crest morphogenesis and chondrogenesis at the midline in the zebrafish skull. Development. 132, 3977-3988 (2005).
- Abe, G., Ide, H., Tamura, K. Function of FGF signaling in the developmental process of the median fin fold in zebrafish. Dev Biol. 304, 355-366 (2007).
- Prykhozhij, S. V., Neumann, C. J. Distinct roles of Shh and Fgf signaling in regulating cell proliferation during zebrafish pectoral fin development. BMC Dev Biol. 8, 91 (2008).
- Scholpp, S., Brand, M. Endocytosis controls spreading and effective signaling range of Fgf8 protein. Curr Biol. 14, 1834-1841 (2014).
- Hardt, S., et al. The Bmp gradient of the zebrafish gastrula guides migrating lateral cells by regulating cell-cell adhesion. Curr Biol. 17, 475-487 (2007).
- White, R. J., Nie, Q., Lander, A. D., Schilling, T. F. Complex regulation of cyp26a1 .creates a robust retinoic acid gradient in the zebrafish embryo. PLoS Biol. 5, e2522-e2523 (2007).
- Brittijn, S. A., et al. Zebrafish development and regeneration: new tools for biomedical research. Int J Dev Biol. 53, 835-850 (2009).
- Niswander, L., Jeffrey, S., Martin, G. R., Tickle, C. A positive feedback loop coordinates growth and patterning in the vertebrate limb. Nature. 371, 609-612 (1994).
- Laufer, E., Nelson, C. E., Johnson, R. L., Morgan, B. A., Tabin, C. Sonic hedgehog and Fgf-4 act through a signaling cascade and feedback loop to integrate growth and patterning of the developing limb bud. Cell. 79, 993-1003 (1994).
- Tickle, C., Alberts, B., Wolpert, L., Lee, J. Local application of retinoic acid to the limb bud mimics the action of the polarizing region. Nature. 296, 564-566 (1982).
- Samarut, E., Fraher, D., Laudet, V., Gibert, Y. ZebRA: an overview of retinoic acid signaling during zebrafish development. Biochimica et Biophysica Acta. 1849, 73-83 (2015).
- Lengerke, C., et al. Interactions between Cdx genes and retinoic acid modulate early cardiogenesis. Dev Biol. 354, 134-142 (2011).
- Wingert, R. A., et al. The cdx and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, 1922-1938 (2007).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom., and Notch signaling. Dev Biol. 386, 111-122 (2014).
- Cheng, C. N., Wingert, R. A. Nephron proximal tubule patterning and corpuscles of Stannius formation are regulated by the sim1a. transcription factor and retinoic acid in the zebrafish. Dev Biol. 399, 100-116 (2015).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203, 253-310 (1995).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J Vis Exp. , e51604 (2014).
- Cheng, C. N., Wingert, R. A., Carver, E., Lessman, C. Chapter 9: Renal system development in the zebrafish: a basic nephrogenesis model. Zebrafish: Topics in Reproduction & Development. , (2014).
- Gerlach, G. F., Wingert, R. A. Zebrafish pronephros tubulogenesis and epithelial identity maintenance are reliant on the polarity proteins Prkc iota .and zeta. Dev Biol. 396, 183-200 (1016).
- McKee, R., Gerlach, G. F., Jou, J., Cheng, C. N., Wingert, R. A. Temporal and spatial expression of tight junction genes during zebrafish pronephros development. Gene Expr Patterns. 16, 104-113 (2014).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. , e2845 (2011).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. 54, e2839 (2011).
- McCampbell, K. K., Springer, K. N., Wingert, R. A. Analysis of nephron composition and function in the adult zebrafish kidney. J Vis Exp. , e51644 (2014).
- McCampbell, K. K., Springer, K., Wingert, R. A. Atlas of cellular dynamics during zebrafish adult kidney regeneration. Stem Cells Int. In press, (2015).
- Lee, S. L., et al. Hypoxia-induced pathological angiogenesis mediates tumor cell dissemination, invasion, and metastasis in a zebrafish tumor model. Proc Natl Acad Sci USA. 106, 19485-19490 (2009).
- Rouhi, P., et al. Hypoxia-induced metastasis model in embryonic zebrafish. Nat Prot. 5, 1911-1918 (2010).
- Cao, R., Jensen, L. D. E., Söll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3, e2748 (1371).
- Cao, Z., et al. Hypoxia-induced retinopathy model in adult zebrafish. Nat Prot. 5, 1903-1910 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены