Method Article
תבניות נימי פעולה ייחודית על ידי מיקרו-ערוצים בעצמות כמו-יכולות לשפר את הגיוס של תאים לשיקום גדול גרמי פגם
In This Article
Summary
A step-by-step generic process to create a bone-like template with engineered micro-channels is presented. High absorption and retention capabilities of the template are demonstrated by capillary action via micro-channels.
Abstract
ללא אוכלוסייה פעילה, משגשגת תא שמופצת היטב ויציבות מעוגנת לתבנית הוכנסה, התחדשות עצם חריגה אינה מתרחשת. עם תבניות קונבנציונליות, העדר תוצאות מיקרו-ערוצים פנימיים בחוסר חדירת תא, הפצה, וinhabitance עמוק בתוך התבניות. לפיכך, תבנית נקבובית ביותר ואחיד ביניהם trabecular-כמו עצם במייקרו-ערוצים (תבנית מייקרו-סביבה הביוגניים; BMT) פותחה כדי לטפל במכשולים הללו. BMT הרומן נוצר על ידי מושגים חדשניים (פעולת נימים) ומפוברק עם טכניקת ציפוי ספוג-תבנית. BMT מורכב מכמה רכיבים מבניים: עיקרי-נקבוביות בין מחוברים (300-400 מיקרומטר) המחקים את הנקבוביות בעצמות trabecular, מיקרו-ערוצים (25-70 מיקרומטר) בתוך כל טרבקולה, וnanopores (100-400 ננומטר) ב פני השטח כדי לאפשר לתאים לעגן. יתר על כן, BMT תועד על ידי מחקר בדיקה מכאני שיש SIMתכונות חוזק מכאני ilar לאלה של עצם trabecular האנושי (~ 3.8 MPA) 12.
BMT הציג גבוהה קליטה, שימור, ומגורים של תאים בתבניות בצורת הגשר (Π) (גובה 3 סנטימטר ואורך 4 סנטימטרים). התאים שהיו בתחילה זורעים לתוך קצה אחד של התבניות התגייסו מייד לקצה השני (מרחק 10 סנטימטרים) על ידי פעולת נימים של BMT בתקשורת הסלולרי. לאחר 4 שעות, התאים כבושים homogenously כל BMT והציגו התנהגות סלולרית רגילה. פעולת הנימים היוותה החדירה של התאים תלויים בתקשורת וההפצה (הגירה פעילה) ברחבי BMT. לאחר שצפה ביכולות של BMT אלה, אנו צופים כי BMTs יספוג תאי מח עצם, גורמי גדילה, וחומרים מזינים מהפריפריה בתנאים פיסיולוגיים.
BMT עשוי לפתור מגבלות הנוכחיות באמצעות חדירה מהירה, הפצה הומוגני וinhabitaNCE של תאים בתבניות גדולות, נפח לתקן פגמי שלד מסיביים.
Introduction
The ultimate goal of bone tissue engineering with synthetic constructs is the incorporation of the constructs into the host bone, repopulation of the constructs with host cells, and reconstitution of gas and body fluid exchanges to restore normal bone function. Considerable research has been reported over the last decade in the use of polymeric and ceramic biomaterials for producing scaffolds1,2. However, the ideal material and fabrication technique for optimal bone tissue regeneration has yet to be identified. In addition, there is an overall lack of success in bringing these technologies to the clinic, especially for the reconstruction and restoration of large bone defects. Therefore, restoring critical sized bony defects still remains a clinical challenge1-5.
Ideally, the scaffolds for bone tissue regeneration should exhibit biocompatibility without causing inflammatory responses or foreign body/toxic reactions, have closely matched mechanical properties when compared to those of native bone, and possess a mechanism to allow diffusion and/or transport of ions and nutrients. Strong bonding with the host bone, dynamic bone growth, vascular ingrowth, and biodegradation of the scaffolds are equally desirable. Although the use of biodegradable polymer scaffolds has exhibited progress in terms of tissue ingrowth, there are controversies over their use for bone regeneration.
Notwithstanding these extensive efforts, the highly organized structural synthetic constructs still have limited potential in overcoming the obstacle of passive cell penetration. Most of these approaches have resulted in the in vitro tissue ingrowth with cross-sections of less than a few µm to several mm from the external surface, an incomplete integration with host bone, and only partial bone regeneration in vivo6,7. The pioneering cells do not migrate deeply into the constructs because of the lack of an initial force that pulls them inside before cell colonization begins. Consequently, cell colonization strictly occurs at the scaffold periphery, becoming an obstruction from the periphery to the center of the scaffold. Thus, the diffusion of oxygen and nutrients into the inner parts of the templates becomes limited8. Therefore, it is clear that the architecture of the scaffolds (pore size, porosity, interconnectivity, and permeability) that affect the transport and diffusion of substances throughout the scaffolds is critical for achieving well-distributed cell proliferation and differentiation9,10. Although calcium phosphates have been used in the past for scaffold fabrication, different processes and procedures have often resulted in calcium phosphate scaffolds with varying architectures. Thus, the selection of the manufacturing process becomes important in dictating the scaffold architecture needed for successful bone tissue regeneration.
In conclusion, there are still two major shortcomings of bone tissue engineering that need to be addressed: the initial cell recruitment into the template prior to cell attachment and colonization and the quality of substance flow both into and out of the template.
Protocol
1. פוליאוריתן (PU) ספוג הכנה כתבנית
- השתמש בספוגי פו לייצר תבניות hydroxyapatite מכילות נקבוביות מקשרים. השתמש בכל ספוג לספק trabeculae העיקרי להיווצרות של תבנית התמוכות כמו גם ההיווצרות של מיקרו-ערוצים בתוך trabeculae.
- לגזור ולקצץ 80 ppi (נקבוביות לאינץ ') ספוגים לגשר-2 צורות עם ממדים של 3.5 סנטימטר בגובה X 5 ס"מ אורך x 1.5 ס"מ רוחב.
הערה: ניתן לבחור המידות וצורות על פי הגודל הנקבובית העיקרי הרצוי: 100 ppi, 80 ppi, ו -60 ppi. - הפוך של 4% 100 מיליליטר (w / v) פתרון NaOH באמצעות כוס 150 מיליליטר; אז לטבול ולסחוט עד ספוגים מוכנים הם ספוגים לגמרי.
- לאחר ההשריה, להניח את הכוס עם ספוגים בultrasonicator (42 קילוהרץ).
- Ultrasonically מראש לטפל בספוגי פו במשך 15-20 דקות ללא חום לשנות את מאפייני פני השטח.
- לשטוף עם מים מזוקקיםמים למשך 5-10 דקות. בעוד השטיפה, לסחוט ספוגים ולאפשר להם להרחיב את 5 עד 7 פעמים כדי להסיר את NaOH השייר בתוך ספוגים.
- לסחוט ספוגים עם מגבות נייר כדי להסיר את עודפי מים; לאחר מכן לייבש אותם בתנור על 60-80 מעלות צלזיוס.
2. Hydroxyapatite (HA) Slurry הכנה לציפוי
- לפני ביצוע slurry HA, למדוד את המשקל של כוס עם בר ומערבבים מגנטי. מדידה זו תשמש לחישוב יחס אבקה / נוזל.
- מדוד 10 גרם של אבקת HA בגודל ננו.
- להוסיף 20 מיליליטר של מים מזוקקים לתוך כוס 50 מיליליטר. חום ל120-140 מעלות צלזיוס ומערבבים בעזרת בוחש מגנטי חמה צלחת.
- להוסיף 0.3 גרם (3% w / w) של אלכוהול פוליוויניל (PVA) (89,000-98,000 MW) לאבקה במים מזוקקים תוך ערבוב ב300-400 סל"ד.
- מערבבים עד PVA נמס לגמרי. הפתרון צריך להיות ברור לאחר פירוקה של PVA מלא.
- הפעל off האש ומוסיפה 0.1 גרם (1% w / w) של תאית carboxymethyl נתרן (CMC) (צמיגות נמוכה במיוחד) לאבקה תוך ערבוב ב400-500 סל"ד. הפתרון צריך להיות ברור לאחר פירוקה של PVA מלא.
- מערבבים עד CMC נמס לגמרי ולהתקרר לRT.
- להוסיף 0.3 גרם (3% w / w) של פיזור polyacrylate אמוניום לאבקה תוך ערבוב ב300-400 סל"ד. מערבבים עד שהיא נמסה לחלוטין.
- להוסיף 0.2 גרם (2% w / w) של גליצרין לאבקה תוך ערבוב ב300-400 סל"ד. מערבבים עד שהיא נמסה לחלוטין.
- לאט לפזר את אבקת HA לפתרון תוך ערבוב ב600-900 סל"ד וממשיך לערבב במשך 5 דקות.
- Sonicate במשך 5 דקות באמצעות ultrasonicator כדי להבטיח פיזור של כל מסכת של אבקת HA.
- להוסיף 5 מיליליטר נוסף של מים מזוקקים לתוך התערובת תוך ערבוב ב600-900 סל"ד וחום ב90-100 מעלות צלזיוס.
- ממשיך לערבב את התערובת באמצעות stirrer מגנטי ב600-800 סל"ד ב90-100 מעלות צלזיוס בORDאה להתאדות תוכן המים.
- מדוד את כל המשקל כולל הכוס ותערובת מהעת לעת עד יחס אבקה / נוזל של 1.75-1.8 מתקבל.
- עיצוב יחס אבקה / נוזל, לחלק את המשקל של האבקה על ידי המשקל הכולל של התערובת (2.14), כולל האבקה, חומרים כימיים, ומים, בניכוי המשקל של הכוס והבוחש (2.1), ובניכוי אבקת HA (2.2).
הערה: לדוגמא: אם (תערובת כולה כוללים אבקה, חומרים כימיים, ומים) היא 49.05 G, B (כוס עם בוחש) היא 33.5 גר ', ולאחר מכן C (אבקת HA) הוא 10 גרם.
C / (ABC) = 10 / (49.05-33.5-10) = 1,80 - לאפשר slurry להתקרר לRT לפני השימוש לציפוי.
3. HA ציפוי, ייבוש, וSintering
- מעיל ספוגים פו מוכנים עם תרחיף ציפוי HA בעזרת מרית נירוסטה עד slurry מופץ ברחבי homogenously ספוג PU על צלחת זכוכית.
הערה: לאחר הסרת ההשמצה העודפתר"י, חלק מהנקבוביות עדיין עשוי להיות סתום עם תרחיף בגלל צמיגות slurry הגבוהה. - כדי להבטיח קישוריות, אחידות, ונקבוביים פתוחים, מעט לפוצץ את תבניות HA המצופים באמצעות מדחס אוויר. תהליך זה מבטיח כי התבניות מצופות הומוגנית הן על המשטחים הפנימיים וחיצוניים של ספוג PU.
הערה: אם ציפוי הומוגנית לא יושג, התבניות המצופים HA יקרסו במהלך תהליך sintering וגם עלולה להיסדק בזמן הטיפול בשל חוזק מכאני נמוך. בנוסף, הציפוי הומוגנית הוא קריטי ביצירת מיקרו-ערוצים בתוך trabeculae. - ייבש את תבניות HA המצופים למינימום של 5 שעות בתנאי קירור (20-25 מעלות צלזיוס) עם זרימת אוויר עדינה. עם זאת, להאריך את זמן הייבוש מבוסס על הגודל של תבנית.
הערה: לאחר ייבוש, תבניות HA המצופים תהיה בדרך כלל לכווץ כ 8% עד 10% בכל ממד. - אחרי תהליך הייבוש, למקם את HAתבניות מצופים בכור היתוך אלומינה. לאחר מכן, למקם אותם בתנור בטמפרטורה גבוה ולהשתמש בפרופיל sintering שלב 8 הבא.
- חום 2 מעלות צלזיוס / דקה עד 230 מעלות צלזיוס.
- חום 1 ° C / דקה עד 280 מעלות צלזיוס.
- מחממים 0.5 מעלות צלזיוס / דקה עד 400 מעלות צלזיוס.
- חום 3 מעלות צלזיוס / דקה עד 600 מעלות צלזיוס. שמור ב 600 מעלות צלזיוס במשך שעה 1.
- חום 5 מעלות צלזיוס / דקה עד 1,230 מעלות צלזיוס. שמור 1,230 מעלות צלזיוס במשך 3 שעות.
- C / דקת 5 מעלות מגניב RT.
הערה: Sintering יתכווץ עוד יותר את התבניות הספוג HA המצופה בכ 22% - 25% בכל ממד.
4. Ingress וInhabitancy של תאים לתוך תבנית
- תרבות תאים טרום osteoblastic MC3T3 בתקשורת הלא-osteogenic בהיקף של α-ממ, בתוספת אנטיביוטיקה 10% שור עוברי סרום (FBS) ו -1% (סטרפטומיצין ופניצילין) על 37 מעלות צלזיוס באווירת humidified המכילה 5% CO 2 .
- הוסף 10 מיליליטרשל השעיה תא ב 2 x 10 6 צפיפות תאים לתוך באר בודד בתוך צלחת 6-היטב.
- מניחים את התבנית בצורת גשר 3 סנטימטרים X 4 סנטימטרים X 1 סנטימטר אנכי לתוך הצלחת 6 היטב. הנח רגל אחת של התבנית לצלחת המכילה את ההשעיה התא, והרגל השנייה ולריק סמוך.
- לאפשר את התבנית לספוג ההשעיה התא במשך 10 דקות.
- הוסף 5 מיליליטר של תקשורת לאחר מכן לטוב שהיה מלא במקור עם ההשעיה התא.
- לחדש הבינוני בשתי הבארות כל 2 או 3 ימים עד 7 ימים חלפו.
- לקבוע את היעילות של ניידות תא על ידי hematoxylin ו eosin מכתים 11.
- תקן את התאים והפיגום על ידי הטבילה בEtOH 100% במשך 20-30 דקות.
- כתם עם Hematoxylin במשך 1-2 דקות.
- יש לשטוף במים מזוקקים במשך 1-2 דקות לפעמים.
- מייבש על ידי טבילה ב- 70%, אז 95%, ולאחר מכן 100% EtOH במשך 1-2 דקות כל אחד.
- כתם עם Eosin במשך 20-30 שניות.
- יש לשטוף במים מזוקקים במשך 12 דקות לפעמים.
- מייבש על ידי טבילה ב- 70%, 80%, 90%, ו -100% EtOH במשך 1-2 דקות כל אחד.
- להטביע את הפיגום בשרף אקרילי עבור חתך והדמיה.
- לקבוע את כדאיות תא עם 3 [4,5-Dimethylthiazol-2-י.ל.] ברומיד assay -2,5-diphenyl tetrazolium (MTT) כדאיות תא וassay חיים / המת (ערכת מכתים תא חי / מת MPTP) זמן נקודות יום 3 ו -7 11.
הערה: ערכה של פרוטוקולי ייצור תבנית כמו עצם מיוצג במושב "נציגי תוצאות".
תוצאות
המבנה הכללי של BMT מציג תבנית תלת-ממדית ייחודית עם מבנים פנימיים כמו עצם trabecular. BMT מכיל מאקרו-נקבוביות, מיקרו-ערוצים, וננו-נקבוביות. תצורות ברורות של מקרו-נקבוביות ביניהם באופן מלא (בגודל ממוצע של 320 מיקרומטר), מיקרו-ערוצים (קוטר ממוצע של 50 מיקרומטר), וננו-נקבוביות (גודל ממוצע של 100 ננומטר) אומתו עם מיקרוסקופ אלקטרונים סורק (EVO-40; ZEISS), כמו גם באמצעות מיקרו-טומוגרפיה.
איור 1 מציג פרוטוקולים מפורטים בשלבים ביצירת BMT. באמצעות שליטה מדויקת של הפרוטוקולים מההכנה של ספוגים פו לתהליך sintering (P1 - P7; איור 1), ניתן להשיג את התכונות הבאות: משטח צפוף וחלק מאוד לאחר ציפוי HA וייבוש; בדיוק בצורה ובגודל 3-D תבנית; רשת מחוברת באופן מלא נקבובית trabecular דומה לזה של עצם trabecular; ושנינות מיקרו-ערוציםהין כל טרבקולה המחקה ערוצים תוך-גרמיים כגון תעלות Haversian והתעלות של פולקמן (איורים 2 ו -3). יתר על כן, חוזק מכאני גבוה יחסית (~ 3.8 MPA) דומה לזו של עצם trabecular אדם נמדד על ידי בדיקת חוזק לחיצה. פרמטרים histomorphometric מאוד דומים לאלה של אדם מותני חוליות עצם trabecular אושרו על ידי ניתוח מיקרו-CT 12. גדלים שונים של פעולת נימים הודגמו באמצעות קטרי נימים שונים באיור 4 באמצעות סימולציה חישובית. באמצעות הדמיות אלה, אנו צפויים כי BMT היה להציג שיעורי ספיגה משתנים בתוך העיקרי-נקבוביות (300-400 מיקרומטר) ומיקרו-ערוצים (25-70 מיקרומטר) המבוסס על הקטרים. נימים קטנות הציגו יכולות קליטה חזקות יותר. הנחה זו אומתה בניסוי זה, כפי שמוצג באיור 5.
BMT הציג יעיל מאודקליטת נוזלים ושימור דרך פעולת הנימים של מבני ערוץ מיקרו; הכתם הכחול של stevenel שימש כמדיום נוזל כדי לעקוב אחר הזרימה (איור 5) בקלות. בהתבסס על סימולציה חישובית, BMT עם תצורות אלה ראו לקלוט ולשמר השעיות תא עד 8.5 סנטימטר במרחק כולל בתוך 10 שניות. בשל פעולת נימים חזקה הנגרמת על ידי המבנים הפנימיים, הבינוני המוכתמים הגיע לקצה השני של 3 סנטימטר (גובה) x 4 סנטימטר (אורך) x 1 סנטימטר תבנית (רוחב) בצורת גשר בתוך דקות 1 ו -40 שניות. יתר על כן, גיוס פעיל תא ושילובם בBMT נצפה (איור 6). בהמשך לכך, גיוס התא הומוגנית והקובץ המצורף הביאו שגשוג משופר והיווצרות מטריצה בהיווצרות מופצת באופן שווה. יתר על כן, הגירה למרחקים ארוכים (~ 10 סנטימטרים) של תאים דרך BMT קבלה תוקף מייד לאחר השתלת מח העצם היה רוויה בהשעית התא. Se תאי eded שרדו במגזר התבנית שנחשף לאוויר ולא שקוע במדיום התרבות. בניסוי זה, מדיום התרבות הועמד לתאים על ידי באופן בלעדי בבארות נוגעות רק רגליים של הפיגום. פעולת הנימים הוצגה על ידי microchannels אז אפשרה למדיום חדש כדי להגיע לחלק מהפיגום העליון, הגשר. לאחר 3 ימים של תרבות, התבנית הפכה עסוקה בתאים במהירות מתרבים. לאחר 7 ימים של תרבות, כל טרבקולה הייתה עטופה במטריצות סלולריות נוספות ומשובץ עם תאים 13.
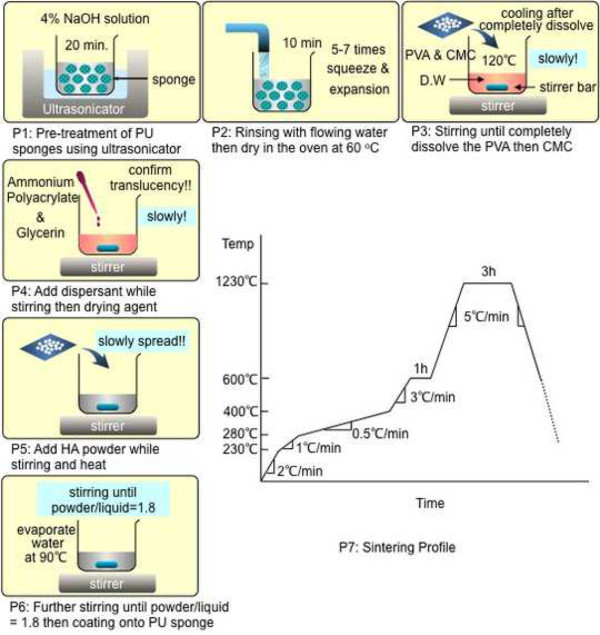
איור 1. הפרוטוקול הכולל כמו עצם ייצור תבנית מהטיפול המקדים של ספוג PU (P1) לטיפול הסופי חום (P7). שמירה על פרופיל sintering המדויק לאחר P7 הוא קריטי בהשגת חוזק מכאני טוב.f = יעד "https://www.jove.com/files/ftp_upload/52947/52947fig1large.jpg" = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

. איור 2 מיקרוסקופ סטריאו נציג (AmScope; SM-2TZ-M) תמונות (x4) של ppi 80 גודל ספוג PU (משמאל), HA מצופה ומיובש BMT (באמצע), וBMT sintered (מימין) (מידות: 3. סנטימטר בגובה x 4 סנטימטר באורך x 1 סנטימטר ברוחב). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

תמונות איור 3. SEM ומיקרו-CT של תבנית הביוגניים: (א) תמונה כוללת של תבנית הביוגניים, Rong> תמונות (B, C, D) למיקרו-ערוצים. על מנת להדגיש מיקרו-ערוצים ברורים בtrabeculae, התבנית הייתה מגורען. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
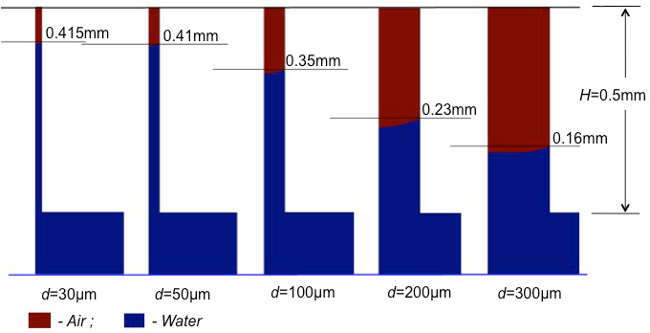
. איור 4. חישוב חישובית של פעולת נימים בקטרים ערוץ שונים באותה תקופת הזמן (0.4 ms), תוך הנימים הגדולות (D = 300 מיקרומטר: מתייחס לעיקרי-נקבובית) נספג בינוני (הכחול) עד 0.16 מ"מ ב גובה, הנימים הקטנות (ד = 30 מיקרומטר: מתייחס לערוץ מיקרו) נספגו הבינוני עד .415 מ"מ הגובה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5. תמונות הראו הבדלים ביכולות קליטה של פעולת נימים המבוססות על גדלים שונים של ראשוני-נקבוביות ומיקרו-ערוצים (גודל ראשוני נקבובית מתייחס לקוטר הממוצע: 60 ppi ≈ 470 מיקרומטר, 80 ppi ≈ 320 מיקרומטר, ≈ 100 ppi 200 מיקרומטר). הקווים הצהובים מייצגים את פעולת נימים הנגרמת על ידי השילוב של ראשוני-נקבוביות ומיקרו-ערוצים. הקווים האדומים מייצגים את פעולת נימים הנגרמת על ידי בעיקר מיקרו-ערוצים הציגו בכל טרבקולה. כפי שניתן לראות ב( F), תבנית 100 ppi מושרה פעולת נימים החזקה, וכתוצאה מכך הרוויה המלאה של התבנית בתוך 39 שניות. תבניות 80 ppi ו -60 ppi נבדקו לאחר מכן. (ב) 0 שניות, (ג) 0.5 שניות, (ד) 1.5 שניות, (E) 17.0 שניות, (F) 39.0 שניות, (G) 50.0 שניות, ודקות 1 18 שניות לאחר טבילה (H). (ממד תבנית: 1סנטימטר x 1 סנטימטר x 4 סנטימטר בcuboidal גובה). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
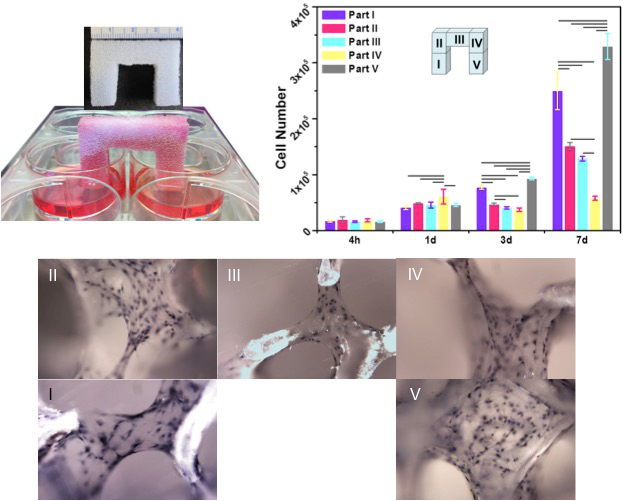
איור 6. כניסה וההגירה של תאים מהבארות זרע (חלק I) לבארות unseeded (חלק V) באמצעות התבניות הביוגניים הנגרמות על ידי פעולת נימים. תאי זרע בתחילה הגיעו לסוף רגל unseeded (חלק V) מייד לאחר רוויה מלאה. לאחר 3 ימים, נקודת המפגש של התאים היה ברורה לאורך כל התבנית. לאחר 7 ימים, היווצרות מטריצת קולגן spatiotemporal התרחשה בתוך אוכלוסיות תאים (כתם H & E). (ממד תבנית: 3 סנטימטר בגובה x 4 ס"מ אורך x 1 סנטימטר ברוחב). אנא CLאיכס כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
תבנית מרכיב רב כולל תאים, גורמי גדילה, חומרים מזינים, וכו 'יש צורך להתחדשות עצם מוצלח ושיקום תפקודי של פגמים קריטי עצם גדולים בגודל. בתוך גורמים אלה, מאפיינים ביולוגיים אנטומית conforming חיוניים. כדי להשיג פונקציונליות ביולוגית, התבנית חייבת להציג התאמה ביולוגית, osteoconductivity, שלמות מכאנית, שטח מספיק, מרקם פני השטח נאות, ואת האמצעים לחמצן וחומרים מזינים תחבורה. ברמה התאית, את התכונות הבאות הן קריטיות במיוחד לשיקום תפקודי של פגמי עצם מסיביים: חדירה הקלה לתוך תבנית (גיוס פעיל), הפצה אחידה בכל התבנית (השימור), התפשטות מואצת וכדאיות גבוהה (מגורים). לבסוף, ההיווצרות הבאה של מטריקס הסלולרי נוסף המשמעותי וליבוי ביטוי גנים הם חיוניים בתהליכים ביולוגיים חיוניים כגון כלי דם מהירOsteogenesis nd.
סוגים רבים ושונים של תחליפים סינטטיים הוצעו להחליף / allo- שתלי עצם אוטומטיים. עם זאת, ארגון הפיגום הנוכחי אינו התערוכה מייקרו-סביבה פנימית המכילה מיקרו-ערוצים וננו-נקבוביות, ולכן אינו פעיל להקל חדירת תא, הפצה, וinhabitance עמוק לתוך התחליפים סינטטיים שגודלם עולים על 10 מ"מ. הם לא מספקים רמזים פיזיים לחלוצי תאים ביעילות, במהירות, ואחיד להעביר עמוק לתוך תבנית העצם. במקום זאת, הגיוס הפסיבי המוגבל של תאים יוצר אוכלוסיות תאים מופצות בצורה לא שווה בין האזורים החיצוניים והפנימיים של הפיגום. זה לא רק מחריף את האתגר הראשוני של התאים שהגיעו לליבה הפנימית של התבנית, אלא גם מעכב את הזרימה תזונתית ותקשורת סלולארי עם הקצה השני של התחליף הסינתטי. סוג זה של תוצאות גיוס ואכלוס תא מידתי בד התאeath ועצם שלם צמיחה לאחר הפיגום כבר מושתלת לתוך הגוף 14,15.
לפיכך, יש לנו הצגנו את הרעיון של פעולת נימים כאות פיזית העיקרית לטפל במכשולים הללו. יש לנו מהונדס היטב מיקרו-ערוצים בBMT לגרום לפעולת נימים שתבאנה בחשבון את כוח הגרירה העיקרי באחריות לאופן פעיל בגיוס תאים עמוקים לתוך BMT.
טכניקת הציפוי הספוג PU מציגה מספר מאפיינים ייחודיים. ראשית, הוא מאפשר להכנה קלה של מבני trabecular נקבוביים מבוקרים היטב, אשר בעצמם תלויים במבני התבנית מוגדר מראש (כלומר, 80 נקבובית לתבנית אינץ 'עבור 300-400 מיקרומטר). זה חשוב מאוד לייעול גודל נקבובית לחדירת תא עצם 15. שנית, הטכניקה מאפשרת הבנייה של מיקרו-ערוצים מחוברים, המהווים את התפקיד המשמעותי של אתחול התא רילוקיישן 11. שלישית, אין כמעט מגבלות בעת שימוש בספוג PU במונחים של יצירת צורות מותאמות אישית וגדלים של התבניות. היצרנית יכולה להשתמש מספריים לצורות פשוטות או חיתוך לייזר אפילו שמחושב לגיאומטריות מורכבות. תוך שימוש בטכנולוגיות מבוקרות בדיוק אלה, יצרנו BMT. HA נבחר כחומר מוצא בשל יכולת ההתאמה הביולוגית וosteoconductive 17.
במחקר זה, יש כמה שלבים קריטיים שצריך להיות מודגשים. במהלך הכנת תרחיף HA, אם הטמפרטורה גבוהה מדי ומהירות ערבוב היא נמוכה מדי, תרחיף HA יהפוך תקוע בקצה תחתון של הכוס ולהתייבש. לאחר תהליך הציפוי כאשר מכבים את תרחיף HA העודף, גבוה מדי של לחץ אוויר יכול לגרום לסדקים על פני השטח של BMT. חשוב לשמור על לחץ האוויר נמוך יחסית לאוורר כראוי slurry HA העודף בלבד. לבסוף, הצעדים שני והשלישי של תהליך sinteringהם קריטיים ביותר (חום 1 ° C / דקה עד 280 מעלות צלזיוס והחום 0.5 מעלות צלזיוס / דקה עד 400 מעלות צלזיוס). בטווח טמפרטורות זה, ספוג PU ישרוף לחלוטין בזמן HA הופך צפוף. אם פרוטוקול זה לא אחריו מקרוב, BMT יהיה התמוטט או התפורר לאחר sintering.
BMT המתואר במחקר זה מציע מספר יתרונות. ראשית, מקרו-הנקבוביות בין מחוברים (300-400 מיקרומטר) לחקות את אלה של עצם trabecular האנושי ומאפשר לזרימת מח עצם חלקה. שנית, התבניות מורכבות ממייקרו-ערוצים (25-50 מיקרומטר) בתוך כל מחיצת trabecular להאיץ את החדירה הראשונית של תאי עצם באמצעות פעולת נימים. כפי שהודגם באמצעות סימולציה חישובית 13, אם התבנית הייתה רק 300 מיקרומטר נקבוביות (נקבוביות ראשוני) ולא microchannels, פעולת הנימים תהיה מספיקה לרוויה המלאה של התבנית עם מח עצם. זה במיוחד יחזיק אמיתי לפגמי גודל גדולים שיחייבו lתבניות גודל arge. תערוכת מיקרומטר בגודל ערוצי קליטת נוזלים יעילה מאוד, ולכן אנו צפויים מיקרו-הערוצים להיות אחראים בעיקר על פעולת נימים במחקר שלנו. שלישית, BMTs במיקום אסטרטגי ננו-נקבוביות. נתונים מהספרות מצביעים על כך שהתאים רגישים במיוחד לננו-תבניות 18,19; לכן, אנו צפויים ננו-נקבוביות על הקירות של מיקרו-הערוצים לשחק תפקיד בהגדלת מצורף תא. נקבוביות בגודל ננו (100-400 ננומטר) על פני השטח של septa trabecular אפשר משותק תאים לעגן. בסך הכל, ההשפעות המשולבות של שלושת מבנים הפנימיים אלה הביאו לגיוס משופר תא והידבקות בכל התבנית. עם זאת, ישנן מספר מגבלות של הפרוטוקול והשלבים הקריטיים לפברק BMT המושלם. לדוגמא, לעתים קרובות יש כמות גדולה של תרחיף HA מוכנה בשל הקושי בשמירת צמיגות הומוגנית ואילו ציפוי. כמו כן קיימת מגבלה בקבלתתבניות של יותר מ -5 סנטימטר 3 בנפח בשל זמן עבודה תוך ציפוי. עובי הציפוי הוא קריטי אשר משתנה בהתאם לטכניקות של היצרנית.
ממצאי המחקר שלנו מצביעים על כך שהשתלת מח העצם מסוגל לקלוט ושמירת תאים יציעו יתרונות פוטנציאליים על alloplastic הקונבנציונלי (או סינטטי) פיגומים. מחקר פרוספקטיבי נשקלת כדי לאמת את היתרונות של BMT בOsteogenesis ו / או אנגיוגנזה יחד עם גורמים הקשורים לצמיחת עצם. לכן, אנו טוענים כי הפיגום המומלץ הייחודי שלנו BMT יכול לטפל בחסמים העיקריים של חדירת מח עצם מספיק למבנים סינטטיים והתחדשות עצם שלמה בפגמים גדולים.
המטרה הסופית של מחקר זה היא לפשט את הפרדיגמה הנוכחית של ביו-הנדסה בשיקום עצם ושיקום תפקודי בפגמים גרמיים קריטיים בגודל על ידי ביטול צורך סטרומה מח עצם גוזלת זמן / עתיר עבודהתהליכי בידוד תאי L והתרחבות. לבסוף, אנו שואפים לנצל אנטומית העומדים 3D-בונה עם מיקרו-ערוצים וננו-נקבוביות, שגורמים לספיגה מהירה של תאים, חלוקה הומוגנית, וinhabitance לבנייה מחדש של עצם.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors have no acknowledgements.
Materials
| Name | Company | Catalog Number | Comments |
| polyurethan sponge | Plastifoam | PU-3215 | |
| Sodium Hydroxide | Sigma-Aldrich | 167176 | |
| Hydroxyapatite Powder | Ossgen | ||
| Polyvinyl Alcohol | Sigma-Aldrich | 341584 | |
| Carboxymethyl cellulose sodium salt | Sigma-Aldrich | 360384 | |
| ammonium polyacrylate | Vanderbilt | DARVAN 821A | |
| Glycerin | Sigma-Aldrich | G2289 |
References
- Petrie Aronin, E. C., et al. Comparative effects of scaffold pore size, pore volume, and total void volume on cranial bone healing patterns using microsphere-based scaffolds. J Biomed Mater Res A. 89 (3), 632-641 (2009).
- Guzmán, R., et al. Chitosan scaffolds containing calcium phosphate salts and rhBMP-2: in vitro and in vivo testing for bone tissue regeneration. PLoS One. 9 (2), e87149 (1371).
- Cha, J. K., et al. Sinus augmentation using BMP-2 in a bovine hydroxyapatite/collagen carrier in dogs. J Clin Periodontol. 41 (1), 86-93 (2014).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Fisher, M. B., Mauck, R. L. Tissue engineering and regenerative medicine: recent innovations and the transition to translation. Tissue Eng Part B Rev. 19 (1), 1-13 (2013).
- Manassero, M., et al. Regeneration in Sheep Using Acropora Coral, a Natural Resorbable Scaffold, and Autologous Mesenchymal Stem Cells. Tissue Eng Part A. 19 (13-14), 1554-1563 (2013).
- Reichert, J. C., et al. A tissue engineering solution for segmental defect regeneration in load-bearing long bones. Sci Transl Med. 4 (141), 141ra93 (2012).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on The Application of Solid Freeform Fabrication Technology to The Production of Tissue Engineering Scaffolds. Eur Cell Mater. 5, 29-40 (2003).
- Woodard, J. R., et al. The mechanical properties and osteoconductivity of hydroxyapatite bone scaffolds with multi-scale porosity. Biomaterials. 28 (1), 45-54 (2007).
- Correia, C., et al. . Acta Biomater. 8 (7), 2483-2492 (2012).
- Wang, H., Li, Y., Zuo, Y., Li, J., Ma, S., Cheng, L. Biocompatibility and osteogenesis of biomimetic nano-hydroxyapatite/polyamide composite scaffolds for bone tissue engineering. Biomaterials. 28 (22), 3338-3348 (2007).
- Oh, D. S., et al. Bone marrow absorption and retention properties of engineered scaffolds with micro-channels and nano-pores for tissue engineering: a proof of concept. Ceram Int. 39 (7), 8401-8410 (2013).
- Hong, M. H., Kim, Y. H., Ganbat, D., Kim, D. G., Bae, C. S., Oh, D. S. Capillary action: enrichment of retention and habitation of cells via micro-channeled scaffolds for massive bone defect regeneration.J. Mater Sci Mater Med. 25 (8), 1991-2001 (2014).
- Volkmer, E., et al. Hypoxia in static and dynamic 3D culture systems for tissue engineering of bone. Tissue Eng. Part A. 14 (8), 1331-1340 (2008).
- Malda, J., Klein, T. J., Upton, Z. The roles of hypoxia in the in vitro engineering of tissues. Tissue Eng. 13 (9), 2153-2162 (2007).
- Macchetta, A., Turner, I. G., Bowen, C. R. Fabrication of HA/TCP scaffolds with a graded and porous structure using a camphene-based freeze-casting method. Acta Biomater. 5 (4), 1319-1327 (2009).
- Cox, S. C., Thornby, J. A., Gibbons, G. J., Williams, M. A., Mallick, K. K. 3D printing of porous hydroxyapatite scaffolds intended for use in bone tissue engineering applications. Mater Sci Eng C Mater Biol Appl. 47, 237-247 (2015).
- Wan, Y., et al. Adhesion and proliferation of OCT-1 osteoblast-like cells on micro- and nano-scale topography structured poly(l-lactide). Biomaterials. 26 (21), 4453-4459 (2005).
- Zhao, L., Mei, S., Chu, P. K., Zhang, Y., Wu, Z. The influence of hierarchical hybrid micro/nano-textured titanium surface with titania nanotubes on osteoblast functions. Biomaterials. 31 (19), 5072-5082 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved