Method Article
骨様テンプレートでのマイクロチャネルによって独特の毛細管現象は大骨欠損の回復のために細胞の動員を強化することができます
要約
A step-by-step generic process to create a bone-like template with engineered micro-channels is presented. High absorption and retention capabilities of the template are demonstrated by capillary action via micro-channels.
要約
よく分散され、安定的に挿入されたテンプレートに固定されているアクティブな、繁栄細胞集団がなければ、例外的な骨再生は発生しません。従来のテンプレートでは、深いテンプレート内部の細胞浸潤、分布、およびinhabitanceの欠如で内部マイクロチャネル結果の欠如。したがって、マイクロチャネル(生体微小環境テンプレート; BMT)を有する高度に多孔質で均一に相互接続された小柱骨のようなテンプレートは、これらの障害に対処するために開発されました。新規BMTは、革新的なコンセプト(毛管作用)によって作成され、スポンジテンプレートコーティング技術を用いて作製しました。相互接続された一次細孔(300〜400ミクロン)に骨梁の細孔、各骨梁内のマイクロチャネル(25-70ミクロン)、およびナノ細孔(100〜400 nm)を模倣する:BMTは、いくつかの構造のコンポーネントで構成され細胞が固定できるように表面。また、BMTは、SIMを持っているために機械的試験研究によって立証されています人間の骨梁(〜3.8 MPa)と12のものとILAR機械的強度特性。
BMTは、ブリッジ状の(Π)テンプレート(3センチ、高さ4センチ長)を通じて、高吸収、保持、および細胞の居住を示しました。最初にあった細胞はすぐに細胞培地にBMTの毛管作用によってもう一方の端(10cmの距離)に動員テンプレートの一端に播種。 4時間後、細胞が均一に全体BMTを占領し、正常な細胞挙動を示しました。毛細管現象は、メディアとBMTを通じて配布(アクティブ移行)中に懸濁させた細胞の浸潤を占めました。 BMTのこれらの機能を観察したが、我々はBMTsは、生理学的条件下で周囲から骨髄細胞、成長因子、及び栄養素を吸収することが突出しています。
BMTは急速な浸透、均一な分布とinhabitaを介して電流制限を解決することがあります巨大な骨格欠損を修復するための大規模な、体積テンプレート内のセルのNCE。
概要
The ultimate goal of bone tissue engineering with synthetic constructs is the incorporation of the constructs into the host bone, repopulation of the constructs with host cells, and reconstitution of gas and body fluid exchanges to restore normal bone function. Considerable research has been reported over the last decade in the use of polymeric and ceramic biomaterials for producing scaffolds1,2. However, the ideal material and fabrication technique for optimal bone tissue regeneration has yet to be identified. In addition, there is an overall lack of success in bringing these technologies to the clinic, especially for the reconstruction and restoration of large bone defects. Therefore, restoring critical sized bony defects still remains a clinical challenge1-5.
Ideally, the scaffolds for bone tissue regeneration should exhibit biocompatibility without causing inflammatory responses or foreign body/toxic reactions, have closely matched mechanical properties when compared to those of native bone, and possess a mechanism to allow diffusion and/or transport of ions and nutrients. Strong bonding with the host bone, dynamic bone growth, vascular ingrowth, and biodegradation of the scaffolds are equally desirable. Although the use of biodegradable polymer scaffolds has exhibited progress in terms of tissue ingrowth, there are controversies over their use for bone regeneration.
Notwithstanding these extensive efforts, the highly organized structural synthetic constructs still have limited potential in overcoming the obstacle of passive cell penetration. Most of these approaches have resulted in the in vitro tissue ingrowth with cross-sections of less than a few µm to several mm from the external surface, an incomplete integration with host bone, and only partial bone regeneration in vivo6,7. The pioneering cells do not migrate deeply into the constructs because of the lack of an initial force that pulls them inside before cell colonization begins. Consequently, cell colonization strictly occurs at the scaffold periphery, becoming an obstruction from the periphery to the center of the scaffold. Thus, the diffusion of oxygen and nutrients into the inner parts of the templates becomes limited8. Therefore, it is clear that the architecture of the scaffolds (pore size, porosity, interconnectivity, and permeability) that affect the transport and diffusion of substances throughout the scaffolds is critical for achieving well-distributed cell proliferation and differentiation9,10. Although calcium phosphates have been used in the past for scaffold fabrication, different processes and procedures have often resulted in calcium phosphate scaffolds with varying architectures. Thus, the selection of the manufacturing process becomes important in dictating the scaffold architecture needed for successful bone tissue regeneration.
In conclusion, there are still two major shortcomings of bone tissue engineering that need to be addressed: the initial cell recruitment into the template prior to cell attachment and colonization and the quality of substance flow both into and out of the template.
プロトコル
1.ポリウレタン(PU)を鋳型としてスポンジの準備
- 相互接続孔を含むハイドロキシアパタイトのテンプレートを生成するためのPUスポンジを使用してください。テンプレートストラットの形成だけでなく、骨梁内のマイクロチャネルを形成するための主要な骨梁を提供するために、それぞれのスポンジを使用してください。
- 切り取り、長さ幅×1.5 cm単位×5 cm高さ3.5cmの寸法で2ブリッジ形状に(1インチ当たりの細孔)スポンジを80 PPIをトリミング。
注:100 PPI、80 PPIおよびPPI 60:寸法及び形状は、所望の一次細孔サイズに応じて選択することができます。 - 150 mlのビーカーを使用してNaOH溶液(w / v)の4%の100ミリリットル作ります。準備されたスポンジが完全に浸漬するまで、浸すと絞ります。
- 浸漬した後、超音波破砕(42キロヘルツ)でスポンジを入れたビーカーを置きます。
- 超音波表面特性を変更するために熱することなく、15〜20分間のPUスポンジを前処理します。
- 蒸留ですすいでください5〜10分間水。すすぎながら、スポンジを絞るとそれらをスポンジ内部の残留水酸化ナトリウムを除去するために5〜7回を拡大することができます。
- 余分な水分を除去するためにペーパータオルでスポンジを絞ります。その後60〜80℃のオーブンでそれらを乾燥させます。
コーティング2.ヒドロキシアパタイト(HA)スラリー調製
- HAスラリーを行う前に、磁気撹拌棒をビーカーの重量を測定します。この測定は、粉末/液体比を計算するために使用されます。
- ナノサイズのHA粉末10gを測定します。
- 50ミリリットルビーカーに20mlの蒸留水を追加します。 120〜140°Cと攪拌ホットプレートマグネチックスターラーを使用するための熱。
- 300-400 rpmで撹拌しながら蒸留水に粉末当たりポリビニルアルコール(PVA)(MW 89,000-98,000)を0.3g(w / wの3%)を加えます。
- PVAが完全に溶解するまで攪拌します。解決策は、PVAが完全に溶解した後に明確にする必要があります。
- O回し熱FFおよび400-500 rpmで撹拌しながら、粉末、ナトリウムカルボキシメチルセルロース(CMC)(超低粘度)を0.1g(1%重量/重量)を加えます。解決策は、PVAが完全に溶解した後に明確にする必要があります。
- CMCが完全に溶解するまで撹拌し、室温まで冷却します。
- 300〜400 rpmで攪拌しながら、粉末あたりのポリアクリル酸アンモニウム分散剤0.3グラム(10%w / wの)を追加します。完全に溶解するまで撹拌します。
- 300〜400 rpmで攪拌しながら、粉末あたりグリセリン0.2グラム(2%w / wの)を追加します。完全に溶解するまで撹拌します。
- ゆっくり600-900 rpmで撹拌しながら、溶液中にHA粉末を分散し、5分間撹拌し続けます。
- HA粉末のいずれかの凝集の分散を確実にするために超音波処理を用いて5分間超音波処理。
- 90〜100℃で600〜900回転数と熱で撹拌しながら混合物に蒸留水の余分な5ミリリットルを追加します。
- ORDで90〜100℃、600〜800 rpmでマグネチックスターラーを用いて混合物を攪拌し続けますERは、水分を蒸発させます。
- 1.75から1.8の粉末/液体比が得られるまでの時間までの時間からビーカーとの混合物を含む全体の重量を測定します。
- 粉末/液体比をフォーマット、粉末、試薬、水、マイナスビーカーおよび攪拌機(2.1)の重量、およびマイナスHA粉末を含む混合物(2.14)の合計重量の粉末の重量を割ます(2.2)。
注:例:(粉末、試薬、および水を含む混合物全体)は49.05グラムである場合、B(攪拌機付きビーカー)は33.5 gであり、その後、C(HA粉末)は10 gです。
C /(ABC)= 10 /(49.05-33.5-10)= 1.80 - スラリーは、コーティングのために使用する前に室温まで冷却させます。
3. HAコーティング、乾燥、及び焼結
- コートスラリーを均一にガラス板上にPUスポンジ全体に分散されるまで、ステンレス製スパチュラを用いてHAコーティングスラリーを用いて調製PUスポンジ。
注意:過剰スラーを除去した後RY、細孔の一部は依然として高いため、スラリー粘度のスラリーで目詰まりすることができます。 - 少し空気圧縮機を使用して、HAコーティングされたテンプレートを吹く、相互接続性、均一性、および開気孔を確保するために。このプロセスは、テンプレートが均一PUスポンジの内部及び外表面の両方にコーティングされることを保証します。
注:均質な被覆が達成されない場合は、HAコーティングしたテンプレートは、焼結プロセスの間に崩壊し、低い機械的強度のために処理している間にも亀裂もよいです。さらに、均質なコーティングは、骨梁内のマイクロチャネルを作成する上で重要です。 - 穏やかな空気循環と冷却条件の下で5時間(20〜25℃)の最小のHAコーティングされたテンプレートを乾燥させます。しかし、テンプレートの大きさに基づいて、乾燥時間を延長します。
注意:乾燥した後、HAコーティングされたテンプレートは、典型的には、各次元で約8%〜10%縮小します。 - 乾燥工程の後に、HAを配置アルミナ坩堝にコーティングされたテンプレート。そして、高温炉の中に置いて、次の8段階の焼成プロファイルを使用しています。
- 230℃までのヒート2℃/分。
- 280℃までのヒート1℃/分。
- 400°Cまで0.5℃/分加熱します。
- 600°Cまでの加熱3℃/分。 1時間600℃で保管してください。
- 1230゜Cまで熱5℃/分。 3時間1230℃で保管してください。
- RTに冷却し、5℃/分。
注意:焼結は、さらに約22%のHAコーティングされたスポンジテンプレートを縮小します - 各次元で25%。
テンプレートへの細胞の4入力および居住
- 5%のCO 2を含む加湿雰囲気中、37℃で、10%ウシ胎児血清(FBS)および1%抗生物質(ストレプトマイシン及びペニシリン)を補充したα-MEMからなる非骨形成培地での培養は、プレ骨芽細胞MC3T3細胞。
- 10ミリリットルを追加します。6ウェルプレート内の単一のウェルに2×10 6細胞密度で細胞懸濁液。
- 6ウェルプレートに垂直に3センチメートルX 4センチメートル×1センチブリッジ形のテンプレートを置きます。隣接する空のウェルに細胞懸濁液を含むプレートに、テンプレート、および他の脚部の一方の脚部を配置します。
- テンプレートを10分間、細胞懸濁液を吸収できるようにします。
- その後、もともと細胞懸濁液を充填したウェルにメディアの5ミリリットルを追加します。
- 7日が経過するまで2〜3日ごとに両方のウェルに培地を補充します。
- ヘマトキシリンおよびエオシン染色11によって細胞の移動の有効性を決定します。
- 20〜30分間、100%エタノールに浸漬することによって、細胞と足場を固定してください。
- 1-2分間ヘマトキシリンで染色。
- 二回のために1〜2分間蒸留水で洗い流してください。
- 1~2分毎に、次いで100%エタノール、95%、次いで、70%に浸漬することによって脱水します。
- 20〜30秒間エオシンで染色。
- 二回、12分間蒸留水で洗い流してください。
- 1~2分ごとに70%、80%、90%、および100%エタノールに浸漬することによって脱水します。
- 切片およびイメージング用のアクリル樹脂に足場を埋め込みます。
- 時点で、3- [4,5-ジメチルチアゾール-2-イル] -2,5-ジフェニルテトラゾリウムブロミド(MTT)細胞生存率アッセイおよび生/死アッセイ(生/死細胞染色キットMPTP)での細胞生存率を決定します3日目の7 11。
注意:骨様テンプレート製造プロトコルのスキームは、「代表的な結果」のセッションで表されます。
結果
BMTの全体的な構造は、海綿骨のような内部構造を持つユニークな3次元テンプレートを示します。 BMTは、マクロ細孔、マイクロチャネル、およびナノ細孔を含有。完全に相互接続されたマクロ孔の明確な構成(320ミクロンの平均サイズ)、マイクロチャネル(50ミクロンの平均直径)、及びナノ気孔(100nmの平均サイズ)EVO-40(走査型電子顕微鏡で確認しました。 ZEISS)ならびにマイクロトモグラフィーを通じ。
図1は 、BMTの作成 に段階的に詳細なプロトコルを示しています。焼結工程へのPUスポンジ(P1 - P7;図1)の製造からプロトコルの正確な制御により、以下の機能を実現することができます:非常に緻密で滑らかな表面のHAコーティング、乾燥後、精密な形状の3次元テンプレートの大きさ。海綿骨と同様の完全に相互接続多孔質小柱網;そして、マイクロチャネルのウィットヒンなどハバース運河やフォルクマンの運河( 図2&3)などの骨内のチャンネルを模倣する各梁。さらに、ヒト海綿骨と同様の比較的高い機械的強度(〜3.8 MPa)を圧縮強度試験により測定しました。骨梁椎骨ヒト腰椎のものと非常に類似した組織形態計測パラメータは、マイクロCT分析12により確認されました。毛管作用の異なる大きさは、計算機シミュレーションを用いて、 図4で別の毛細管径を通じて実証されました。これらのシミュレーションを通じ、BMTは、一次細孔(300〜400ミクロン)と直径に基づいて、マイクロチャネル(25〜70ミクロン)内で変化の吸収率を示すであろうと予測。より小さな毛細血管が強い吸収能力を示しました。 図5に示すように、この仮定は、この実験で検証しました。
BMTは非常に効果的に発揮しましたマイクロチャネル構造の毛細管作用を通じた流体の吸収及び保持。 stevenelの青い汚れが簡単に流れます (図5)を追跡するために、流体媒体として使用しました。計算機シミュレーションに基づいて、これらの構成を持つBMTは吸収し、10秒以内に総距離8.5 cmの細胞懸濁液を保持するために見られました。原因内部構造により誘導される強い毛細管現象に、染色された媒体は、3センチメートル(高さ)の反対側の端に到達した4センチメートル(長さ)が1分40秒以内に1センチメートル(幅)ブリッジ形のテンプレートをX X。また、BMTへの活性細胞の動員および取り込みは( 図6)が観察されました。その後、均質な細胞動員及びアタッチメントは、均一に分布形成の増強増殖及びマトリックス形成をもたらしました。また、BMTを通じて細胞の長距離(約10 cm)の移行は、BMTを細胞懸濁液で飽和させた直後に検証しました。セ eded細胞は空気に曝露し、培養液中に浸漬されていなかったテンプレートセグメントに生存しました。この実験では、培地は、排他的にウェル中の足場の脚だけをタッチすることにより細胞に提供されました。マイクロチャネルによって示される毛管作用は、その後、足場の上、ブリッジ部に到達するために新鮮な培地を可能にしました。培養の3日後、テンプレートは急速に増殖する細胞で占められなりました。培養7日後に、各梁は、細胞外マトリックスによって包まれ、細胞13が埋め込 まれました。
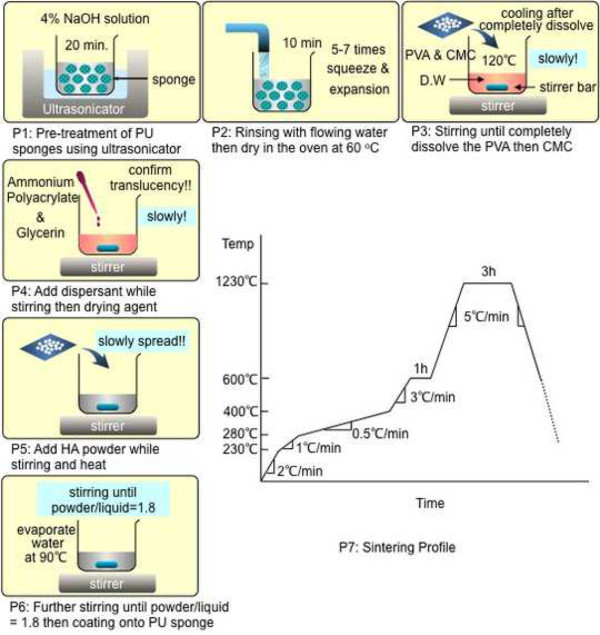
最終熱処理(P7)にPUスポンジ(P1)の前処理の全体の骨のようなテンプレートの製造プロトコル1.図。P7は、良好な機械的強度を達成する上で重要である焼結した後、正確なプロファイルを維持します。F =「https://www.jove.com/files/ftp_upload/52947/52947fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

。 図2代表的実体顕微鏡、80 PPIの(AmScope SM-2TZ-M)の画像(×4)は、PUスポンジが(左)、HAコーティングし、BMT(中央)、焼結BMT(右)乾燥なサイズ (寸法:3。幅×1 cmの長さ×4センチ、高さセンチ)。 この図の拡大版をご覧になるにはこちらをクリックしてください。

生体テンプレートの図3 SEMマイクロCT画像(A)生体テンプレートの全体像、 栄>マイクロチャネルのために(B、C、D)の画像。小柱の明確なマイクロチャネルを強調するために、テンプレートを造粒した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
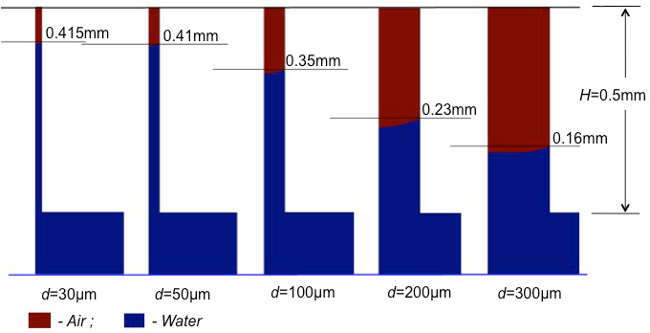
図4.異なるチャネル径の毛細管現象の計算計算同じ期間(0.4秒)以内に、最大のキャピラリー(D = 300ミクロン:一次細孔を指す) している。中に0.16ミリメートルまでの培地(青)を吸収高さは、最小の毛細血管:高さ0.415ミリメートルまでのメディアを吸収(D =30μmのマイクロチャネルを指します)。 この図の拡大版をご覧になるにはこちらをクリックしてください。

470ミクロン、80 PPI≈320ミクロン、100のPPI≈≈60 PPI:図5.画像は、一次細孔及びマイクロチャネル(一次細孔径が平均直径を意味の異なるサイズに基づいて、毛管作用の吸収能力の差を示しました200ミクロン)。黄色の線は、一次細孔及びマイクロチャネルの組み合わせによって誘導される毛管作用を表します。赤い線は、各梁に展示主にマイクロチャネルによって誘発される毛管作用を表します。 (F)に示すように、100 PPIテンプレートは39秒以内に、テンプレートの完全な飽和を生じる、最も強い毛管作用を誘導しました。 80 PPIと60 PPIテンプレートは、その後試験しました。 (B)0秒、(C)0.5秒、(D)1.5秒、(E)17.0秒、(F)39.0秒、(G)50.0秒、及び(H)の浸漬後の1分18秒。 (テンプレートの寸法:1高さ立方cmで×1センチ×4センチ)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
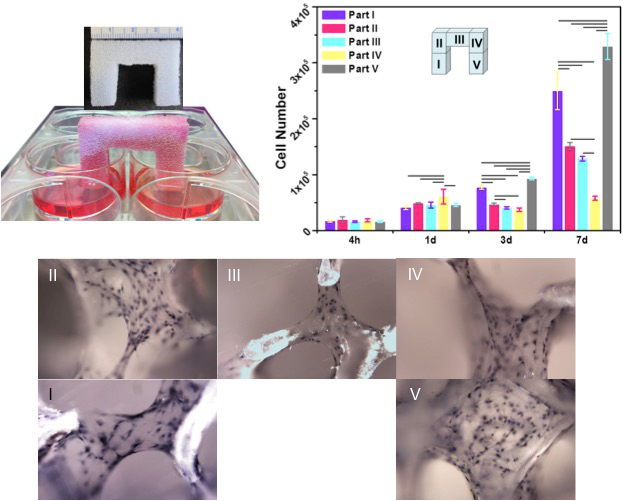
毛管作用によって誘発される生体テンプレートを通じて播種していないウェル(パートV)に播種したウェル(パートI)からの細胞の侵入や移民6.図。最初に播種した細胞は、直後に播種していない足(パートV)の最後に到達完全な飽和。 3日後、細胞の合流はテンプレート全体を通して明らかになりました。 7日後、時空間コラーゲンマトリックスの形成は、細胞集団(H&E染色)内で発生しました。 (テンプレートの寸法:幅X 1センチメートル長さは高さ×4 CMで3センチメートル)。CLくださいこの図の拡大版を表示するには、こちらICK。
ディスカッション
細胞、成長因子、栄養素などを含む多成分テンプレートが成功した骨再生及び臨界サイズの大きな骨欠損の機能回復のために必要とされます。これらの要因の中で、解剖学的に適合生物学的特性が不可欠です。生物学的機能を達成するために、テンプレートは、生体適合性、骨伝導性、機械的完全性、十分な表面積、十分な表面テクスチャ、および酸素および栄養輸送のための手段を示さなければなりません。容易に浸透テンプレートに(アクティブ募集)、テンプレート(保持)全体に均一に分布し、加速増殖と高い生存性(居住):細胞レベルでは、次の機能は、大規模な骨欠損の機能回復のために特に重要です。最後に、実質的に細胞外マトリックスの形成およびその後の遺伝子発現の誘発は、迅速な血管新生Aと本質的な生物学的プロセスにおいて重要ですND骨形成。
合成の代替の多くの異なるタイプの自動/同種骨移植片を置換するために提案されています。しかし、現在の足場組織は、マイクロチャネルおよびナノ細孔を含む内部微小環境を示さないので、積極的に深い10ミリメートルよりも大きい合成代替への細胞浸潤、分布、およびinhabitanceを容易にしません。彼らは効率的に、迅速に、かつ均一に骨テンプレートに深く移行する細胞を開拓するための物理的な手がかりを提供していません。代わりに、細胞の限られた受動的な動員は、足場の外側と内側の領域との間に不均等に分布する細胞集団を作成します。これは、テンプレートの内部コアに到達する細胞の最初の挑戦を悪化させるだけでなく、合成の代替の他端に栄養素の流れと、細胞の通信を妨げるだけでなく。セルDにおける不均衡な細胞動員と生息結果このタイプの足場後eathと不完全な骨の成長は、体14,15に移植されました。
そこで、これらの障害に対処するための主要な物理的な合図として、毛管作用の概念を導入しています。私たちは徹底的に積極的に深いBMTに細胞を募集するための責任を主要ドラッグ力を占めるようになる毛管作用を誘導するためにBMTでマイクロチャネルを設計しています。
PUスポンジコーティング技術は、いくつかのユニークな特性を示します。まず、それ自体が事前に定義されたテンプレートの構造( すなわち、300〜400ミクロンのためのインチテンプレートごとに80の細孔)に依存して十分に制御された多孔質の骨梁構造の容易な調製を可能にします。これは、骨芽細胞の浸潤15孔径を最適化するために非常に重要です。第二に、この技術は、細胞の再配置11を初期化する重要な役割を占めて相互接続されたマイクロチャネルの構築を可能に。カスタムシェイプとテンプレートのサイズを作成するという点で、PUスポンジを使用した場合第三に、ほとんど制限があります。メーカーは、単純な形状または複雑な形状のためであっても計算されたレーザー切断用ハサミを使用することができます。これらの精密に制御技術を使用して、我々はBMTを作成しました。 HAは、その生体適合性および骨伝導容量17の出発材料として選ば れました。
本研究では、強調表示される必要があるいくつかの重要なステップがあります。温度が高すぎると、攪拌速度が低すぎるHAスラリーの調製時に、HAスラリーをビーカーの底端部でスタックになり、アップ乾燥します。過剰HAスラリーを吹き付けコーティング処理の後、空気の圧力が高すぎるBMTの表面にクラックを誘導することができます。これは、適切にのみ過剰のHAスラリーを空気に比較的低い空気圧を保つことが重要です。焼結工程の最後に、第二および第三段階(400°Cまで280℃と熱0.5℃/分までヒート1℃/分)は最も重要です。 HAが密になりながら、この温度範囲では、PUスポンジが完全に燃焼します。このプロトコルは密接に従わない場合は、BMTは、焼結後に崩壊または崩れされます。
本研究で説明BMTはいくつかの利点を提供しています。まず、相互接続されたマクロ細孔(300〜400ミクロン)は、ヒト骨梁のものを模倣し、円滑な骨髄の流れを可能にします。次に、テンプレートは、毛管作用を介して、骨細胞の最初の進入を促進するために、各小柱隔膜内のマイクロチャネル(25-50ミクロン)で構成されています。テンプレートはわずか300ミクロンの孔(プライマリ毛穴)なしマイクロチャネルを持っていた場合、計算機シミュレーション13を用いて実証されているように、毛管作用は、骨髄とテンプレートが完全に飽和するのには不十分であろう。これは、特にリットルを必要とする大型の欠陥についても当てはまるだろうARGEサイズのテンプレート。マイクロメートルサイズのチャンネルを呈する非常に効果的な水分の吸収、とはこのように私たちは、マイクロチャネルは、私たちの研究では、毛管作用の主な原因であることが期待します。第三に、私たちのBMTsは戦略的にナノ空孔を配置しています。文献からのデータは、細胞は、ナノパターン18,19に特に敏感であることを示しています。従って、我々は、細胞付着を増加させる役割を果たして、マイクロチャネルの壁上のナノ細孔を期待しました。固定化された細胞は、固定することができ小柱隔膜の表面にナノサイズの細孔(100〜400ナノメートル)。全体として、これらの3つの内部構造の複合効果は、テンプレート全体で強化された細胞の動員および付着をもたらしました。しかし、プロトコルのいくつかの制限と完璧なBMTを製造する重要なステップがあります。例えば、コーティングしながら均質な粘度を維持する難しさのために調製したHAスラリーの多量がしばしば存在します。また、製造するのには限界がありますコーティングしながら、作業時間にボリュームが5cm 3より大きいテンプレート。コーティング厚さは、メーカーの技術に依存して変化する重要です。
私たちの研究の結果は、足場の細胞を吸収し、保持することができるBMTは、従来のアロプラスト(または合成)上での潜在的な利点を提供することを示唆しています。前向き研究は、骨に関連する成長因子とともに骨形成および/または血管新生にBMTのメリットを検証するために検討されています。そのため、私たちは私たちのユニークな機能を備えたBMTの足場は大きな欠陥で合成構築物及び不完全骨再生に不十分な骨髄浸潤の主要な障壁に対処することができると主張しています。
本研究の究極の目標は、時間/労働集約型の骨髄間質の必要性を排除することによって、重要なサイズの骨欠損に骨再建と機能回復に生体工学の現在のパラダイムを簡素化することですL細胞の単離および拡張プロセス。最後に、我々は、骨の再構築のために迅速な細胞吸収、均質な分布、およびinhabitanceを誘発するマイクロチャネル及びナノ孔を有する3D構築物を準拠解剖学的に活用することを目指しています。
開示事項
The authors have nothing to disclose.
謝辞
The authors have no acknowledgements.
資料
| Name | Company | Catalog Number | Comments |
| polyurethan sponge | Plastifoam | PU-3215 | |
| Sodium Hydroxide | Sigma-Aldrich | 167176 | |
| Hydroxyapatite Powder | Ossgen | ||
| Polyvinyl Alcohol | Sigma-Aldrich | 341584 | |
| Carboxymethyl cellulose sodium salt | Sigma-Aldrich | 360384 | |
| ammonium polyacrylate | Vanderbilt | DARVAN 821A | |
| Glycerin | Sigma-Aldrich | G2289 |
参考文献
- Petrie Aronin, E. C., et al. Comparative effects of scaffold pore size, pore volume, and total void volume on cranial bone healing patterns using microsphere-based scaffolds. J Biomed Mater Res A. 89 (3), 632-641 (2009).
- Guzmán, R., et al. Chitosan scaffolds containing calcium phosphate salts and rhBMP-2: in vitro and in vivo testing for bone tissue regeneration. PLoS One. 9 (2), e87149 (1371).
- Cha, J. K., et al. Sinus augmentation using BMP-2 in a bovine hydroxyapatite/collagen carrier in dogs. J Clin Periodontol. 41 (1), 86-93 (2014).
- Karageorgiou, V., Kaplan, D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 26 (27), 5474-5491 (2005).
- Fisher, M. B., Mauck, R. L. Tissue engineering and regenerative medicine: recent innovations and the transition to translation. Tissue Eng Part B Rev. 19 (1), 1-13 (2013).
- Manassero, M., et al. Regeneration in Sheep Using Acropora Coral, a Natural Resorbable Scaffold, and Autologous Mesenchymal Stem Cells. Tissue Eng Part A. 19 (13-14), 1554-1563 (2013).
- Reichert, J. C., et al. A tissue engineering solution for segmental defect regeneration in load-bearing long bones. Sci Transl Med. 4 (141), 141ra93 (2012).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on The Application of Solid Freeform Fabrication Technology to The Production of Tissue Engineering Scaffolds. Eur Cell Mater. 5, 29-40 (2003).
- Woodard, J. R., et al. The mechanical properties and osteoconductivity of hydroxyapatite bone scaffolds with multi-scale porosity. Biomaterials. 28 (1), 45-54 (2007).
- Correia, C., et al. . Acta Biomater. 8 (7), 2483-2492 (2012).
- Wang, H., Li, Y., Zuo, Y., Li, J., Ma, S., Cheng, L. Biocompatibility and osteogenesis of biomimetic nano-hydroxyapatite/polyamide composite scaffolds for bone tissue engineering. Biomaterials. 28 (22), 3338-3348 (2007).
- Oh, D. S., et al. Bone marrow absorption and retention properties of engineered scaffolds with micro-channels and nano-pores for tissue engineering: a proof of concept. Ceram Int. 39 (7), 8401-8410 (2013).
- Hong, M. H., Kim, Y. H., Ganbat, D., Kim, D. G., Bae, C. S., Oh, D. S. Capillary action: enrichment of retention and habitation of cells via micro-channeled scaffolds for massive bone defect regeneration.J. Mater Sci Mater Med. 25 (8), 1991-2001 (2014).
- Volkmer, E., et al. Hypoxia in static and dynamic 3D culture systems for tissue engineering of bone. Tissue Eng. Part A. 14 (8), 1331-1340 (2008).
- Malda, J., Klein, T. J., Upton, Z. The roles of hypoxia in the in vitro engineering of tissues. Tissue Eng. 13 (9), 2153-2162 (2007).
- Macchetta, A., Turner, I. G., Bowen, C. R. Fabrication of HA/TCP scaffolds with a graded and porous structure using a camphene-based freeze-casting method. Acta Biomater. 5 (4), 1319-1327 (2009).
- Cox, S. C., Thornby, J. A., Gibbons, G. J., Williams, M. A., Mallick, K. K. 3D printing of porous hydroxyapatite scaffolds intended for use in bone tissue engineering applications. Mater Sci Eng C Mater Biol Appl. 47, 237-247 (2015).
- Wan, Y., et al. Adhesion and proliferation of OCT-1 osteoblast-like cells on micro- and nano-scale topography structured poly(l-lactide). Biomaterials. 26 (21), 4453-4459 (2005).
- Zhao, L., Mei, S., Chu, P. K., Zhang, Y., Wu, Z. The influence of hierarchical hybrid micro/nano-textured titanium surface with titania nanotubes on osteoblast functions. Biomaterials. 31 (19), 5072-5082 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved