Method Article
ריאקטורים סיבים חלולים עבור
In This Article
Summary
ההתנהגות התפקודית של תאים בתרבית ניתן לשפר על ידי culturing בלמעלה in vivo-כמו 3 ממדי סביבות תרבות 16-21. כתב יד זה מתאר את פעולת הגדרה ושל מערכת bioreactor סיבים חלולה עבור in vivo-כמו בתרבית רקמה יונקת.
Abstract
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Introduction
בתרבית רקמה היא טכניקה הוקמה לצמיחה ו / או התחזוקה של תאים נוצלו במשך 100 שנים 1,2. הנוחות של לימוד תאים ותגובות vivo לשעבר מרחיקה לכת יתרונות המאפשרים ניסויים שאחרת היה מאתגר מאוד אם לא בלתי אפשרי, למשל הדור של שורות תאים מהונדסות גנטי ושימוש תאי כתב מבחני מיון תפוקה גבוהה 3. לאחרונה בתרבית הרקמה הצמיחה בתחום הנדסת רקמות, לייצור מודלים במבחנת רפואת שיקום. בעזרת יישומים אלה, עניין מערכות התרבות דינמית 3-ממדי (3D) גדל באופן משמעותי.
3D שיטות תרבות (מוגדר כאן כמו מצע תרבות 3D ו / או את ההקדמה של זרימה דינמית כיוונית) טוב יותר לשחזר את הארכיטקטורה של סביבת הסלולר in vivo, חשובה להשגהתפקוד פיזיולוגי דמוי יותר. היכולת לחלץ, לגדול, להבדיל ותאי השתלה במטרה לתקן רקמה חולה ופגועה היא תחום המחקר ויש לו פוטנציאל אדיר לטובת מטופל הזדמנות מסחרית. לדוגמה השימוש קרטינוציטים עצמיים לטיפול בכוויות (ראה 4) ושימוש טיפולים מבוססי תאים לטיפול בשבץ (ראה 5). כמו כן, שוק מודלים במבחנה משתרע גילוי תרופות ליישומים ברפואה מרובדת. הכנס בתרבית רקמה במקביל גדלתי מספרם של סוגי תאים תלויים חסידים או למעגן על פני שטח 2-הממדים (2D) של בקבוק בתרבית רקמה. בעוד מקובל כיום כתקן זהב במסגרת מחקרית, הריבית האחרונה יישומי הנדסת רקמות הדגישה את העובדה כי הסביבה בתרבית רקמת 2D הנוכחית אינה מספקת עבור מדרוג כלפי מעלה נדרש בתא ייצור 6.
עבור סוגי תאים חסידים scaffolד נדרש, אשר ישתנה בהתאם לשימוש הסופי, הן מבחינת הרכב כימי ותכונות מכאניות. חלק מהמערכות להעסיק פיגומים וכן צלחת מוסיף מורכב המטריצה הנקבובית ביותר נוצרה בניית תבנית אמולסיה בשלב פנימית גבוהה (ראה 7) או סיבי electrospun (ראה 8) הדורשים הסתגלות מינימום מ טכניקות תרבות 2D קונבנציונליות. תאים יכולים להיות זורעים על microcarriers של קומפוזיציות שונות גדלו במיכלים שיעוורו לספק חומרים מזינים מולקולות איתות, ולבצע משם פסולת (להסעת המונים) באמצעות בסביבה מעורבת דינמית גם 9. עם זאת, מערכות אלו מוגבלים בסביבתם in vivo-כמו ושיפורים נוספים יכולים להתבצע לגבי לגמלן עלויות. Bioreactors סיבים חלולים (HFBs) הוא מערכת תרבות 3D מורכבת של סיבים קבועים לתוך מודול עם תאים בדרך כלל זרע על החלק החיצוני של הסיבים בתווך הנקבוביים מועברים דרך לומן הסיבים (הנסקרת ב 10) (איור 1). HFBs להציע סביבת in vivo-כמו עם הסיבים מחקו נימי דם ואת מגן על התאים מפני לחצי הגזירה הקשורות למשלוח תקשורת דינמי, תוך מתן אפשרות גזירה מוגדרת להיות מיושמת לתאים בוויה זרימת נוזל דרך היציאות בצד אם ירצה בכך. זה יוצר מערכת התרבות צדדית עם להסעת המונים מעולה שבו צפיפות תא גבוה ניתן להגיע 11. מערכת HFB היא גם מתאימה לשמירה על סוגי תאים תלויים למעגן ויש בו נעשתה שימוש לתרבות מגוון של תאים כולל איי עכברוש לבלב לנגרהנס 12, עכבר β-TC-3 שורת תאי אינסולינומה 12, hepatocytes אדם מן המעלה הראשון 13, עצמות אדם תאי mononuclear מח 14, תאי כליה כלביים מדין דארבי (MDCK) 15 ו קאקו-2 תאים 16 עד כמה שם.
בנוסף היכולות של העברת מסה מדרוג כלפי מעלה, מתאים הגדלים 3D tisמערכות התרבות לתבוע נוטות להיות יותר in vivo-כמו במורפולוגיה ועוד תגובה לרמזים ניסיוניים. לדוגמה להלשין hepatocytes העיקרי להראות מורפולוגיה cuboidal יותר, כדאיות גדלה, אינדוקציה יותר של פעילות אנזים ציטוכרום-P450 ורגישות מוגברת רעיל אקמול כאשר גדל פיגום קלקר זמין מסחרי לעומת תאי גדלים בתרבית 2D 17. שימוש באותו פיגום הקו הסלולרי hepatocarcinoma HepG2 הוכח גם כדי להגביר את ייצור אלבומין 18 ולהראות יותר in vivo-כמו בתגובה methotrexate לעומת תאים בתרבית 2D 19. Hepatocytes אדם מן המעלה הראשון הפגין dedifferentiation המושהית, פעילות ציטוכרום P450-גבוהה וגדילת אישור עבור 4/5 תרכובות נבדקות מערכת התרבות זלוף 20. גזע עצבי אדם תא עצב שמקורם גליה בתרבית פיגום קלקר זמין מסחרי הציגו הוא גבוה (פוטנציאל פעולה) ונמוך-frequency (פוטנציאל שדה מקומי) פעילות ספונטנית אך לא נעשה פעילות עצבית זוהה בתאי 2D התרבותיים 21. קאקו-2 תאים הפגינו בידול משופר בתוך HFB לעומת תרבות 2D נמדדת phosphatase אלקליין גדל, γ-glutamyltransferase ופעילות P-glycoprotein וביטוי גבוה של F-יקטין zona occludens-1 חלבון 16. למרות היתרונות, את culturing השגרתית של תאים במערכות מלבד משטח בקבוק בתרבית רקמת 2D היא עדיין לא התאמנה במעבדות רבות, אם כי מספר פרסומים בצטטו תרבית תאי 3D צומח (עלייה של 8-פי ב -10 השנים האחרונות. מקור : 'תוצאות לפי שנת PubMed כלי ומישש עם' תרבות 3D ').
כתב יד זה מתאר את ההגדרה ותנאי הפעלה של מערכת HFB עבור תרבית תאי יונקים והדגים השירות שלה culturing הקו הסלולרי hepatocarcinoma HepG2 / C3A. מטרת השיטה היא תרבות התאיםיותר מערכת תרבות בעיצומו-כמו אשר שומרת מספיק פשטות כדי להפוך אותו נוחה לאלה שחדשים מערכות תרבות 3D. הרציונל העומד מאחורי שימוש HFBs ביישום מתואר כאן, אשר הוא לשפר את יכולת החיזוי של מודלים כבדים היא כי זה אפשרי תיאורטית לחקות סינוסואידה כבד בתוך סביבת HFB 22. זה לא ריאלי כרגע עם מערכות תרבות אחרות.
Protocol
1. סיבים
- ייצור הסיב ידי ספין היפוך פאזה יציקה (ספינינג). פרטים של שיטה זו ניתן למצוא 23,24.
הערה: עבור עבודה זו הסיבים מיוצרים ללא צורך במיקור חוץ באמצעות פולימר קניינית בלתי מתכלה, NMP כמו ממס ו- H 2 O כמו הלא-ממס. פרטים של פולימרים מתאימים אחרים ניתן למצוא בדיון. הסיבים המשמשים במערכת המתוארת כאן הם 1.05mm קוטר חיצוני בקוטר לומן 600-700 מיקרומטר. הסיבים הם נקבוביים בקטרים נקבוביים מדידים 2.28 מיקרומטר ± 1.5 מיקרומטר (ממוצע ± סטיית תקן). זה נועד כדי להפריד תאים מעדכון תקשורת לומן הסיבים, משכפל את הכבד sinusoid או בכלי דם של רקמות אחרות. סיבים ניתן לרכוש גם מהספקים קרום כגון מל.
2. ייצור מודול
הערה: מודולים שימוש במחקר זה עשויה 1 מ"מ זכוכית בורוסיליקט עבה עם 2 יציאות בצד(איור 2 א). הסיבים במודול המתואר כאן יש שטח המשטח החיצוני של 4.95 ס"מ 2 שהינו שווה ערך של כ חצי גם צלחת 6 באר.
- מודולים Siliconize לפני השימוש הראשון על ידי ציפוי פני השטח הפנימי עם Sigmacote (טבלה 1) ומאפשר להתייבש במנדף. החיטוי (121 ° C, 1 כספומט, 20 דק ') כדי להגדיל את חיי הטיפול.
- באמצעות אזמל לחתוך 75 סיבים מ"מ באורך והכנס שלושה סיבים לתוך כל מודול עוזב ~ 7 מ"מ אורך עודף בכל (איור 3 א) בסוף.
- מקום ~ 0.5 מ"ל של דבק סיליקון (טבלה 1) לתוך סירה במשקל. השתמש קצה פיפטה P200 להרים כמות קטנה של סיליקון ולעבוד הדבק לתוך הקצוות של מודול ברחבי סיבים לטופס תקע 3-5 מ"מ (איור 3 ב). לייבוש> 3 שעות.
- באמצעות אזמל לחתוך את סומק סיליקון עם קצות מודול זכוכית (איור 3 ג).
- לעטוףכמות קטנה (~ 4 שכבות) של polytetrafluoroethylene (PTFE) קלטת סביב יציאת צד אחד.
3. הגדרה ועיקור מערכת
הערה: משאבה צינורות ומודולים עם סיבים אינם autoclaved והם עיקור באמצעות אתנול 70%. החוקרים ממליצים כיול צינורות המשאבה עם המשאבה לשמש. ההליך שלהלן מתבצע במנדף זרימה למינרית.
- חיטוי (כמו בסעיף 2.1) כל הרכיבים autoclavable לפני הגדרה.
- להכין
- מקום 10 מיליליטר אתנול 70% לבקבוק מאגר הגדרת בקבוק המאגר, כובע Q-Series, צינור הזנה, משאבת צינורות שאיבה ודחיסה (טבלה 1) כמו באיור 4.
- רופף למקם כובע בסוף מעל הנמל בצד מוקלט PTFE. חלק את הקצוות של L / S16 מחברי מודול על הקצוות מודול ויציאה בצד חינם. חבר קטע 40 מ"מ של צינורות L / S13 למחבר מודול הקרוב לנמל בצד כתרים (טבלה 1) כמו באיור 2B .
- חבר את המודול בצינור המשאבה, הבטיח להתמצא מודול כך הנמל בצד הכתרים קרוב המשאבה.
- חבר את קו לפעפע וקו retentate למחברי מודול ואת L / S14 של מחבר ה- Y על הבקבוק המאגר (טבלה 1). ודא כי ההגדרה דומה השרטוטים באיור 4.
- סְטֶרִילִיזַציָה
- משאבת אתנול באמצעות מודול ב 800 μl / hr (267 μl / hr לכל סיבים) עבור מספיק זמן כדי לטפל רכיבי unautoclaved עבור> 30 דק '(להתאים פעמים אם שיטות חיטוי אחרים משמשות, ראה 25).
- לִשְׁטוֹף
- כדי לשטוף את אתנול מחוץ למערכת, תחילה לכבות את משאבת ניקוז צינורות. ראשית, לנתק את צינורות המשאבה מן צינורות מתאם מודול. החזק את מודול באוויר כדי לנקז את אתנול מחוץ לקו סיבים retentate, חזרה לבקבוק המאגר. סר הכובע בסוף הנמל בצד ממודול לנקז האתנול דואר ממודול עצמה, וקו לפעפע. חבר מחדש את הכובע בסוף הנמל בצד. הפוך את זרימת התקשורת על משאבת ניקוז צינורות משאבת קו הזנה של אתנול. כבה את המשאבה, ולחבר את צינור המשאבה למתאם מודול.
- פתחו את הברגת הבקבוק אתנול ממכסה ולהחליף עם בקבוק המכיל 10 מ"ל של מדיום הגידול התא (כגון EMEM, GMEM, DMEM או RPMI) ללא בסרום. משאבת המדיום דרך המערכת ב 800 μl / hr עד קו retentate מלא תקשורת. הצמד את קו retentate לכפות חלחול של התקשורת דרך סיבי לשטוף את מודול. לשטוף עבור ~ 2 שעות.
4. מתזמן
הערה: המדיה והתוספים להשתמש בפרוטוקול זה צריך להיות אלה מבוססים על סוג התא הרצוי. עיין בספרות, האוסף האירופי של תרביות תאים (ECACC) ואמריקן סוג תרבות האוסף (ATCC) לקבלת מידע נוסף. לפני תאי שיטה זו צריכות להיות maintaשאינו עומד על פי פרוטוקולים הוקמו עבור סוג התא הרצוי. עבור עבודה זו הקו הסלולרי hepatocarcinoma HepG2 / C3A subclone היו מתוחזקים בהתאם להמלצות מפיצים (ATCC).
הערה: פרוטוקול זריעת מובא להלן משמשת גם מראש תרבות המודול עם תרבית תאים בינוני לפני צמיחת תאים. האם א-תרבות הפרה נרחבת יותר תידרש אז זה צריך להתבצע לפני זריעת מודול ידי ניקוז התקשורת לשטוף מהמערכת, החלפה עם תקשורת צמיחת מחלחל זו באמצעות מודול עבור כמה שעות. ראה סעיף 7.5.2.1 לפרטים על החלפת תקשורת במערכת.
- כן השעית תא בודד על ידי trypsinization פי פרוטוקולים הוקמו עבור סוג התא הרצוי. פרוטוקול כללי עבור תרבות T75 הוא כדלקמן:
הערה: מספר תאים לשימוש בשלב הזריעה יש לקבוע באופן אמפירי עבור סוג התא הרצוי שלך. Bioreactors המתואר כאן הם זורעים בכל cel 35 גבוה פיצפיפות ls (תא / 2 ס"מ) מאשר בשימוש בפלסטיק בתרבית רקמה 2D עבור תרבות 7 יום.- שוטפים את התאים על ידי הוספת 10 מ"ל פוספט בופר (PBS), לשאוב, ואז מוסיפים חומצה 3 מ"ל 0.05% טריפסין ethylenediaminetetraacetic (EDTA) (מספיק כדי לכסות את התאים) ו לדגור על 37 מעלות צלזיוס, 5% CO 2 למשך 5 דקות.
- קציר תאים בתקשורת צמיחה 7 מ"ל בתוספת 10% בסרום שור העובר (FBS) כדי לנטרל את טריפסין. מערבבים היטב, מוסיפים 10 μl לתא של hemocytometer ולספור את התאים.
- צנטריפוגה ב XG 200 במשך 5 דקות עד גלולת התאים.
- לשאוב את התאים supernatant ו resuspend ב 4x10 6 / ml בתקשורת צמיחה שיושלם כנדרש עבור סוג התא הרצוי.
- כבה את המשאבה ולנקז את הזנת צינור מודול כמו 3.4.1.
- לנתק את מודול מהמחברים מודול ולצרף כמוסות סוף מודול (טבלה 1) טרום מעוקרים באתנול 70%, שעזב את הנמל צד אחד חינם.
- העבר ~ 500 μl של ההשעיה תא (2x10 6 תאים) (4.1.4) למודול באמצעות מזרק מחט 18 G ו 1 מ"ל, מקפיד למנוע היווצרות בועה ולא לפגוע סיבים.
- כיסוי או יציאת הצד באמצעות כובע בסוף. דגירת התאים ב 37 מעלות צלזיוס, 5% CO 2 עבור 2-4 שעות עם מפנה הידני של מודול ידי 180 ° כל 5 דקות. לחלופין המודולים יכול להיות מצורף הכתף צינור עם ההגדרה ערבוב לסירוגין (טבלה 1).
- בעקבות זריעה, לצרף כובע בסוף על יציאת הזרקה (טבלת 1) מראש לעקר ב 70% אתנול, ולצרף זה ליציאה בצד המוקלט PTFE. סר הכובע בסוף נמל הצד השני ולאט לאט לנקז את התאים על ידי הזרקת אוויר ליציאת ההזרקה המצורפת באמצעות מזרק 27 G מחט 1 מיליליטר.
- החלף את פיית ההזרקה עם כובע בסוף. לאט למלא את מודול עם התקשורת באמצעות יציאת הצד בחינם מחט 18 G עם מזרק 1 מ"ל. רמתיve כמוסת סוף מודול ולצרף את המודול הצינורות באמצעות מחברי מודול.
- החלף את בקבוק התקשורת לשטוף עם אחד המכיל 50 מיליליטר תקשורת צמיחה ותוספי ביצוע ההליך המפורט 7.5.2.1. לשאוב את תקשורת הצמיחה באמצעות המערכת ב 800 μl / hr.
הפצת נשק 5.
הערה: הסיבים המשמשים במערכת המחקר המתואר כאן נקבעים לחלחל ב ~ 80 μl / שעה, עם שיעור להאכיל 800 μl / hr.
- השתמש סיבים לגדל את התאים לתקופות של עד 7 ימים בתוך חממה humidified נקבע על 37 מעלות צלזיוס, 5% CO 2.
הערה: ניטור של חומרים מזינים מטבוליטים במהלך שלב הצמיחה יכול לספק מידע שימושי על התפשטות, ספיגת מטבוליות פלט של תאים מזין המטבוליט רמות בתקשורת. לדוגמא גלוקוז שימוש וייצור לקטט. ערכות זמינות מספק שונה שיכול לכמת הגורמים הללו מן המדיה (ראה לוח 1 עבור אלו ששימשו במחקר זה). יציאות הזרקה ניתן להוסיף הצינורות להרוות retentate ומדיה שנדגמו באמצעות מחט מזרק 27 G, ומדיה ניתן לדגום מבקבוק מאגר התקשורת. זה נותן מידע תזונתי וחילוף חומרים עבור הקלט שני זרמי הפלט. דגימה צריכה להתבצע במנדף זרימה למינרית. לעקר יציאות הזרקה לפני הדגימה ידי החזקת גליל כחול ספוג אתנול נגד בנמל> 30 שניות.
כריתה 6.
הערה: סיבים ניתנים ניכרים ממודול בסוף הניסוי לניתוח.
- נתק ומסננים את HFB.
- הכנס סכין מיקרו אזמל / (טבלה 1) להב בין הזכוכית סיליקון. סובבו את מודול כדי לחתוך את הסיליקון מהזכוכית. חזור על הליך זה בשני קצותיו של מודול.
- באמצעות להב לחבר את התקע סיליקון מקצה אחד ומשוך בעדינות. ודא כי הסיבים שמגיעים עם זה.
ניתוח נייד 7.
- מספרים סלולריים
הערה: לקבלת התאים C3A השתמשו במחקר זה בכל נקודות הזמן בתוך תקופת הצמיחה 7 יום מתאימים לשימוש בחישוב זה כמו שיעורי צמיחה לא משמעותי להשתנות על פני צפיפות התא מושגת בתוך פרק זמן זה.- לאחר כריתה (סעיף 6) טובלים את סיבי לתוך PBS לשטוף ולחתוך אותם לתוך צינור 1.5 מ"ל המכיל 0.5 מ"ל טריס EDTA (TE) חיץ. נושא זה לשני מחזורים להקפיא להפשיר בתוך מקפיא -80 מעלות צלזיוס. מדוד את תוכן DNA באמצעות PicoGreen ולקבוע מספרים סלולריים על ידי השוואת הערך הזה כדי עקום סטנדרט עשו עם סוג התא הרצוי 26.
- שיעורי התפשטות תאים
- באמצעות המספרים הסלולריים מחושבים בשתי נקודות זמן שונות לחשב את שיעור הצמיחה הספציפי μ (משוואה 1) איפה Ln (X1) הוא היומן הטבעי של המספר הסלולרי בנקודת הזמן הראשונה Ln (X2) הוא היומן הטבעי של התא מספר בנקודת הזמן השנייה.
μ = (ln (X2) -Ln (X1)) / זמן (שעה) (1)
מכאן לחשב את זמני הכפלת האוכלוסייה (DT) (משוואת 2) שם μ הוא שיעור הצמיחה הספציפי.
dT = LN2 / μ (2)
- באמצעות המספרים הסלולריים מחושבים בשתי נקודות זמן שונות לחשב את שיעור הצמיחה הספציפי μ (משוואה 1) איפה Ln (X1) הוא היומן הטבעי של המספר הסלולרי בנקודת הזמן הראשונה Ln (X2) הוא היומן הטבעי של התא מספר בנקודת הזמן השנייה.
- כדאיות התא
- לאחר כריתה (סעיף 6) טובלים את סיבי לתוך PBS לשטוף ולחתוך אותם לתוך צינור 1.5 מ"ל המכיל 500 μl 0.05% טריפסין חומצה ethylenediaminetetraacetic (EDTA). לדגור על 37 מעלות צלזיוס למשך 10 דקות.
- מערבבים ומוסיפים 10 μl של השעיה תא 10 μl trypan כחול. טען 10 μl על גבי haemocytometer ולספור את המספר (כחול) מת תאים בחיים.
- הַדמָיָה
- לאחר כריתה לטבול הסיבים לתוך PBS לשטוף ולהשתמש מספריים לחתוך אותם לחתיכות באורך קטן לתוך צלחת 24 גם. להוסיף 400 μl paraformaldehyde 4% (ב PBS) ו לדגור על RT במשך 20 דקות.
- לשטוף עם PBS על ידי pipetting 400 μl לסירוגין. תי חזורים צעד עם PBS הטרי.
- להוסיף 400 μl 4 ', 6-diamidino-2-phenylindole (DAPI) מדולל PBS כ. 100 ng / ml לדגור על RT במשך 20 דקות. להגן מפני אור.
- פעמיים לשטוף עם PBS (כמו 7.3.2) ופעם עם H 2 O. הוספת הרכבה בינוני קרינה לכסות סיב התמונה באופן מיידי כדי לאסוף נתונים לפני הדגימות היבשות (לשעבר DAPI / em; 359/461 ננומטר).
- צלם תמונות על מטוסי מוקד שונים ולהשתמש 'להתמקד לערום' תוכנה (למשל, ערימת תוסף focuser עבור ImageJ, להלן) כדי להפוך תמונה מורכבת מראה לעומק התרחב מאוד של שדה. זה נדרש כמו הסיבים אינם שטוחים.
- הורד ImageJ (http://imageJ.nih.gov/ij/) ואת תוסף 'מחסנית-focuser' (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- ב ImageJ לפתוח את התמונות כדי להיערם. ואז בתפריט 'תמונה' ללכת 'סטאקס' - 'תמונות כדי סטאק ". בתפריט 'תוספים' ללכת 'סטאק Focuser'. ציין n עבור הקרנל nxn. ניסוי וטעייה עם 'n' עשוי להידרש כדי ליצור תמונה עם "רעש" קצת. ערכים בין 11 & 77 נוטים לעבוד היטב.
- הפרשת אלבומין
הערה: זהו מבחן תפקוד התא hepatocyte ולא מבחן כללי של תפקוד התא.- תאי זרע (HepG2 / C3A) על פלסטיק בתרבית רקמה 2D ב 10,667 / 2 ס"מ גדל במשך 6 ימים. HFBs זרע כמתואר בסעיף 4 ולגדול במשך 6 ימים.
- לאחר תקופת הסתגלות התפשטות זו לשנות את התקשורת והתרבות (EMEM + 10% FBS, 1x גלוטמין & 1x פניצילין / סטרפטומיצין) עבור פלסטיק בתרבית רקמה ו HFB על תקשורת חופשית בסרום וויליאמס E בתוספת גלוטמין 1x ו 1x פניצילין / סטרפטומיצין למשך 24 שעות:
- מסננים את מודול צינורות HFB ביצוע השלבים המפורטים 3.4.1. פתח את הברגת בקבוק המאגר ולהחליף את זה באמצעות בקבוק המכיל תקשורת E וויליאמס. משאבה זו דרך HFB בשעה 800 μl / hr.
- בעקבות 24 שעות, לקחת דגימות תקשורת. לכמת אלבומין המופרש ELISA פי הוראות היצרן (טבלה 1). לדלל תקשורת דגימות 1 ב 10 עד 1 ב 40 לפני השימוש כדי להביא ריכוזי אלבומין בטווח של עקומת הסטנדרט.
תוצאות
זריעת תאים הוא שלב קריטי. היכולת של התאים לדבוק סיבים בתוך הגדרת 3D הוא הרבה פחות מזה שנראה עבור פלסטיק בתרבית רקמה 2D. זהו ככל הנראה בשל זמן מגע המופחת בין תא ואת המצע. בשנות ה HFB התאים נופלים דרך מודול במהלך שלבי סטטי של זריעה. אלה קצרים יותר באופן משמעותי בזמן לעומת השלב הרציף סטטי אחד המשמש 2D. תאים צריכים ליצור קשרים למצע בזמן הזה. בנוסף, בשל האופי המעוגל של סיבי אין משטח שטוח עבור התאים לנוח ולעשות קשרים כמו שיש בתרבות 2D. אמנם זה יכול להיות מורכב על ידי הכימיה של הסיבים מועסקים שאנחנו יודעים זה לא יהיה המקרה עבור הפולימר מועסק במחקר זה (מידע לא מוצג). הגדלת זמן זריעת צפיפות תאי זריעת המוביל להיווצרות של אגרגטים תא שנופל באמצעות מודול במהלך שלבי סטטי בכל r מהראכול יותר תאים בודדים מצמצם עוד יותר את זמן המגע בין תאים ואת המצע. הגדלת הזמן להביא הצהבה של התקשורת יש צפיפות גבוהה של תאים ולא חילופי תקשורת במהלך שלב זה. שימוש בתנאים המתוארים בשיעורי זריעת תאים סעיף 4 של ~ 15% מושגות באופן עקבי עם תאי HepG2 / C3A (איור 5 א). אמנם זה עשוי להיחשב חלק נמוך יש מספיק תאים כדי ליצור סיבים-מיושבים היטב עניין של ימים (5B הדמוי 6); לאחר תקופת התפשטות שבעת ימים את צפיפות התאים שהושגה HFB מתקרבת 3x10 5/2 סנטימטר. זוהי צפיפות מתאימה מבחני רבי ניצול hepatocytes ויכולים להיחשב לכת מפגש.
שיעורי ההתפשטות שהושגו HFB הם איטיים בהשוואה לזו שהושגה תרבית תאי 2D (איור 5 ג). זהו unצפוי להיות עקב אובדן של תאים בזרימה הדינמית של המערכת כמו ספירת תאים בתקשורת נמוכה (ממוצע ± SEM: 20,343 תאים ± 3,674 תאים לכל 24 שעות בנקודת המפגש, החלו ב -4% מכלל התאים הכוללים) וזה לא גדל בעת שיעור החלחול מופעל עד 400 μl / hr (מידע לא מוצג). זה גם לא סביר שיהיה בשל ירידת כדאיות והאובדן הבא של תאים (ראה איור 5D ומטה). זה עשוי להיות מוסבר, לפחות בחלקו על ידי העובדה שורות התאים נגזרו clonally מ HepG2 נבחרות על יכולתה להראות עיכוב קשר של התפשטות תאים. תאי HFB הם זורעים ב 6x הצפיפות של תאי 2D דבר שעלול להוביל שיעורי התפשטות איטיים.
כדאיות נותרת גבוהה לאורך HFB עם תאים מפגינים> 90%. אמנם יש ירידה קלה כדאית בסוף לשקע לעומת המפרצון זה לא נמצא מובהק (מבחן t p = 0.22).
ניטור של צריכת גלוקוז ייצור חומצה לקטית נעשה שימוש כדי לכוון את עוצמת הקול שיעור ומדיה להאכיל התקשורת במערכת. באמצעות 800 μl / hr נפח תקשורתי מוחלט של 50 מיליליטר גלוקוז ורמות חומצה לקטית נשמרים מעל ומתחת (בהתאמה) שרואה בתרבות פלסטיק בתרבית רקמה סטנדרטית.
הפרשת אלבומין היא פונקציה כבדה מפתח שבצעה hepatocytes. זה מופרש לתוך הסרום שבו היא משחקת כמה תפקידים בתחבורה הומאוסטזיס. הפרשת אלבומין ידי תאי גדלי HFB היא 15 גבוה פי מזו תאים שגודלו על 2D (איור 7). זה מדגים את התאים הם פונקציונליים HFB ולפחות במקרה של הפרשת אלבומין, פונקציה זו היא גבוהה ב HFB.
jpg "/>
איור 1. סביבת vivo-כמו של HFB. תאים הם זורעים על החלק החיצוני של הסיבים הנקבוביים. מדיה מועברת דרך לומן סיבים, מחקה נימי דם. (א) חתך לאורך של סיבים (לא בקנה מידה). (ב) חתך של כור סיבים 3. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. מודול HFB. (א) הממדים של המודול השתמשו במחקר זה. הממדים נבחרו כדי להתאים 3 סיבים ולמלא את הצרכים של פרויקט המחקר הנוכחי. יכול להיות מיוצר ומותאם בגדלים שונים עבור מערכות סיבים בודדים. (ב) תצלום של מ 'odule עם מחברי מודול כובע וסיום מצורפים. נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
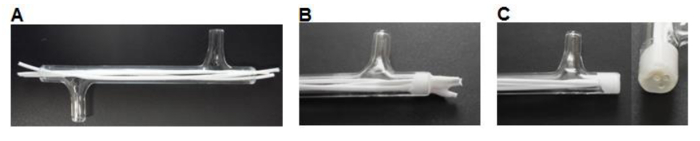
סיבי איור 3. ייצור מודול. (א) נחתכים לגודל מוכנסים לתוך מודול. סיבים (B) מודבקים לתוך מודול, להתייבש. (ג) הקצוות נחתכים מיושרים עם הזכוכית. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
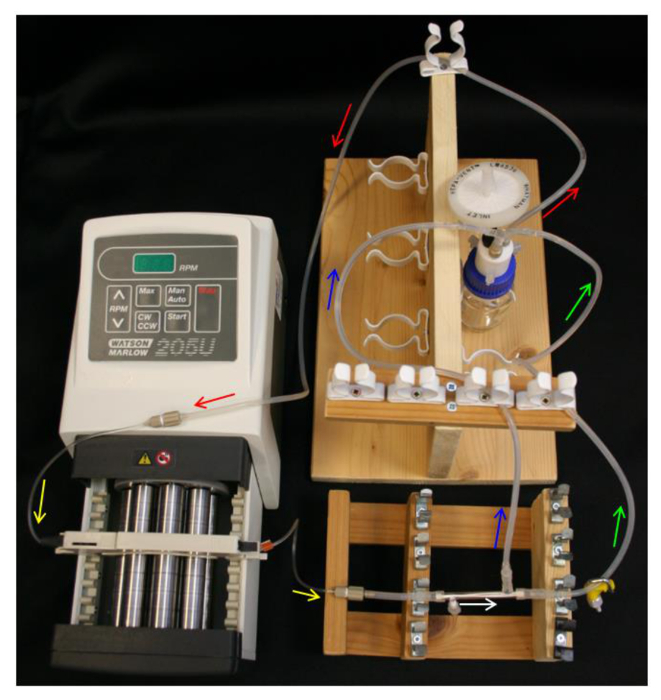
מערכת איור 4. HFB הגדרה. חצים מצביעים בכיוון של זרימת מדיה. צינור אדום = הזנה. צהוב = משאבת tuלִהיוֹת. מודול לבן = HFB. צינור ירוק = retentate עם מהדק. = כחול לחלחל צינור. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
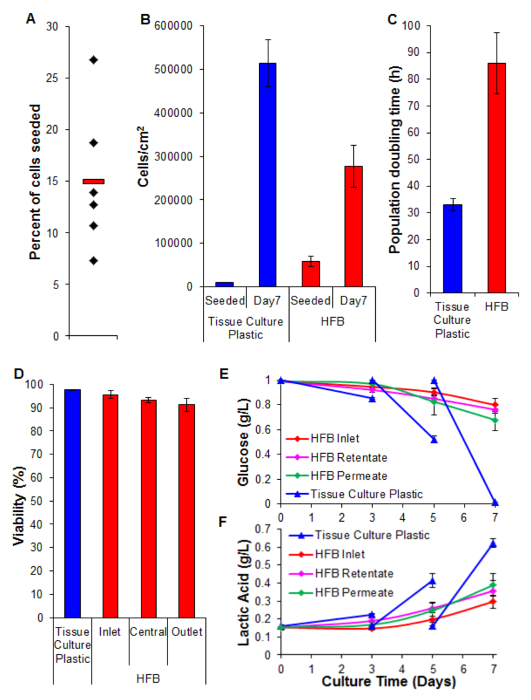
איור 5. מתזמן, התפשטות, ויכולת קיום לאנליזה ביוכימית. (א) אחוז תאי זרע. יהלומים שחורים מייצגים HFBs הפרט. הבר האדום הוא מתכוון. (ב) תאים צפיפות בבית זריעה ולאחר תקופת התפשטות 7 יום. מספרים סלולריים 2D נקבעו על ידי trypsinization ועוד היד נטויה באמצעות haemocytometer. מספרים סלולריים HFB נקבעו באמצעות assay PicoGreen ואת עקומת סטנדרט המיוצר מתאי C3A 26. n = 5-6. ברים = SEM. (C) אוכלוסיית הכפלת פעמים. n = 5-7. ברים = SEM. (ד) הכדאיות נקבעת על ידי Trypהחרגה כחול בסוף ריבוי 7 יום. מפרצון, מרכז לשקע מייצגים אזורים בתוך HFB. n = 3-5. ברים = SEM. (E & F) צריכת גלוקוז וייצור חומצה לקטית. רמות נוטרו על בקבוק המאגר (כניסה) וכן retentate ותחלחלנה שקעים compered לתרבות שיגרתית על פלסטיק בתרבית רקמה (תקשורת השתנתה ביום 3 ו -5). n = 3-5. ברים = SEM. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
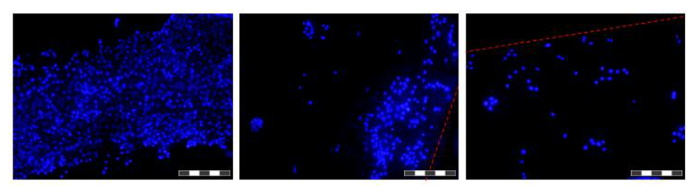
איור 6. תמונות של תאים שגודלו על סיבים בתוך HFB. תאים היו זורעים גדלו במשך 48 שעות לפני הסיבים היו ניכרים, לרחוץ PBS, קבועות paraformaldehyde 4%, לרחוץ PBS גרעיני מגואלות DAPI. כל תמונה היא צירוף של 12 'פוקוס מוערם' imaGES על מנת להגדיל את עומק השדה של התמונה המתקבלת. תחומי צפיפות תא גבוהה ונמוכה נמצאים לאורך הסיבים בנקודת זמן זו מוצגים. איפה גבולות סיבים נוכחיים מסומנים עם קו מקווקו אדום. תמונות צולמו על מיקרוסקופ פלואורסצנטי הפוך. מטרת תמונה = 10X. בר = 200 מיקרומטר. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
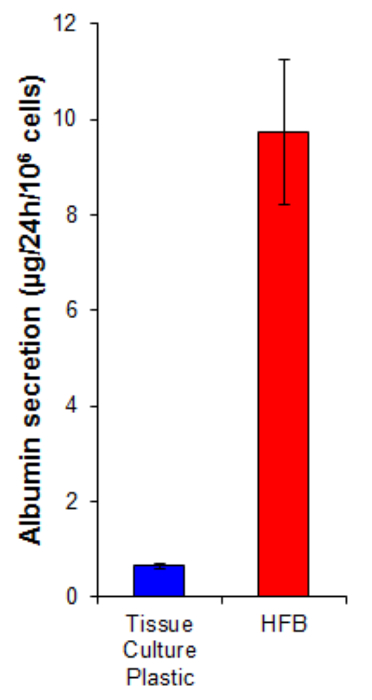
איור 7. אלבומין הפרשת. התאים היו זורעים על פלסטיק בתרבית רקמה על 10,667 / 2 ס"מ והן HFB כמפורט בסעיף 4. תאים היו התרבו במשך 6 ימים. לאחר תקופת הסתגלות התפשטות זו תרבות פלסטיק HFB בתרבית רקמה התקשורת שונתה עבור תקשורת חופשית בסרום וויליאמס E בתוספת גלוטמין ו פניצילין / streptomycin למשך 24 שעות. דגימות מדיה נלקחו וכן אלבומין לכמת ידי ELISA על פי הוראות מייצרות (טבלה 1). n = 5-6. ברים = SEM. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| סָעִיף | שם ציוד | חֶברָה | חתול. לא. | הערות | תמונות |
| 2 | מודול זכוכית HFB | מדעי Soham | --- | פריט מותאם אישית. | |
| 2.1 | Sigmacote® | סיגמא אולדריץ | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | Silicדבק אחד. | |
| 2.5 | קלטת PTFE | סיגמא אולדריץ | Z104388 | ||
| 3.2.1 | בקבוק Reservoir | דַיָג | 11972619 | ||
| כובע Q-Series | נִיעוּת | 00932Q-3V | PTFE חוטי הבורג של מתאמי אגוז הולם. צרף את הכובע Q-Series. צרף קטע 8.5 ס"מ של צינורות PTFE מסופק תחת מתאם 1 מ"מ וקטע 4 ס"מ מתחת מתאם 3 מ"מ. |  | |
| מתאם, זכר, 1.0 מזהה מ"מ | נִיעוּת | 008NB10-KD5L | |||
| מתאם, זכר, 3.0 מזהה מ"מ | נִיעוּת | 008NB30-KD5L | |||
| אגוז הולם | נִיעוּת | U-350 | |||
| צינורות Neoprene | דַיָג | 10366344 | צרף פילטר HEPA עד 6 ס"מ של צינורות ניאופרן ולצרף זה אל 'אגוז הולם ". צרף סעיפי 2x 30 מ"מימ של L / צינורות S14 לשתי עקיצות העליונות של המחבר-Y וקטע 3 סנטימטר של צינורות L / S16 לתחתית. צרף זו עקיצה של מתאם 3 מזהה מ"מ. (סעיף 3.2.1) |  | |
| HEPA-vent | דַיָג | 11374634 | |||
| Y-מחבר, דוקרני | קול בן זוג | OU-06,295-10 | |||
| צינורות L / S16 סיליקון | קול בן זוג | OU-96,410-16 | |||
| צינורות L / S14 סיליקון | קול בן זוג | WZ-96,410-14 | |||
| צינורות L / S13 סיליקון | קול בן זוג | OU-96,410-13 | 80 ס"מ לחיבור מתאם דוקרני 1.0 מ"מ על כובע Q-Series באמבטיה משאבת ing = צינור הזנה. | ||
| משאבת WM 205U / CA | דַיָג | 1248-6300 | |||
| צינורות משאבת WM, PVC, כחול-כתום, 0.25 מ"מ נשא | דַיָג | 12416310 | PTFE את הבורג חוט של מתאם זכר ולחבר את מתאם נקבה. עבוד בצינור המשאבה מעל אחד העקיצות. חזור על פעולה זו הגדרה בקצה השני של הצינור. (סעיף 3.2.1) |  | |
| מתאם, זכר, 1.0 מזהה מ"מ | נִיעוּת | 008NB10-KD5L | |||
| מתאם, נקבה, 1.0 מזהה מ"מ | נִיעוּת | 008NB10-KD2L | |||
| 3.2.2 | כובע נקבה Luer | קול בן זוג | WZ-45,508-64 | כמוס סוף יציאת סייד. | blefig4.jpg "/>  |
| צינורות L / S13 סיליקון | קול בן זוג | OU-96,410-13 | סעיף 40 מ"מ לחיבור צינורות המשאבה למחבר מודול. | ||
| צינורות L / S16 סיליקון | קול בן זוג | OU-96,410-16 | 3x 30 מ"מ של L / S16 מצויד 3x מחברים מודול reducers =. (סעיף 3.2.2) | ||
| כמפחית דוקרני 1/8 "x 1/16" | קול בן זוג | 30,616-43 | |||
| 3.2.4 | צינורות L / S13 סיליקון | קול בן זוג | OU-96,410-13 | סעיף 55 ס"מ לחיבור retentate אל L / S14 של Y-מחבר על כובע Q-Series. |  |
| צינורות L / S13 סיליקון | קול בן זוג | OU-96410-13 | סעיף 45 ס"מ לחיבור לפעפע אל L / S14 של Y-מחבר על כובע Q-Series. | ||
| איגוד תיל ישר | קול בן זוג | WZ-30,612-43 | צרף עד הסוף של L / S13 שיחבר עם L / S14 של מחבר ה- Y. | ||
| 3.4.2 | מַהְדֵק | VWR | 229-0609 | ||
| 4.3 | 4 מ"מ צינורות סיליקון | דַיָג | FB68858 | מקפל מעל קטע של צינורות 40 מ"מ ובטוח עם כובע בסוף כבל עניבה = מודול. (סעיף 4.3) |  |
| עניבה בכבלים | דַיָג | 12326377 | |||
| 4.4 | מסובבי צינור MACSmix | Miltenyi ביוטק | 130-090-753 | עיבוד עשוי להידרש attach המודולים. | |
| 4.5 | נמל הזרקת Leur | מדעי Thistle | IB-10,820 | צרף את הכובע בסוף לנמל ההזרקה. (סעיף 4.5) | |
| כובע נקבה Luer | קול בן זוג | WZ-45,508-64 | |||
| 5 | ערכת חומצה L-לקטית | Megazyme | K-LATE | ||
| 5 | ערכת D- גלוקוז | Megazyme | K-GLUC | ||
| 6.2 | אזמל / סכין מיקרו | InterFocus | 10,315-12 | ||
| 7.4.3 | אלבומין ELISA | מעבדות Bethyl | E80-129 |
טבלה 1. רכיבים של הגדרת HFB. חלק הטקסט הרלוונטי לכל רכיב ניתן בטור 1.
Discussion
כתב יד זה מתאר את הפעולה Set-up and של bioreactor סיבים חלולים (HFB) מערכת עבור תרבית תאים יונקים השירות שלה באה לידי ביטוי מתרבים הקו הסלולרי hepatocyte HepG2 / C3A. המערכת נועדה להתאים על המדף של חממה סטנדרטית ההגדרה שלה הוא פשוט מספיק כדי להתבצע על ידי כל ביולוג של תא מוסמך מכיר טכניקה מזוהמת.
הסיבים המשמשים במערכת המחקר המתואר כאן מיוצרים בבית על ידי ספין היפוך פאזה יציקה (ספינינג) באמצעות פולימר קניינית מתכלות. זה אפשרי לעשות סיבים ידי ספינינג ממגוון חומרים המתאימים תרבית תאים, הן מתכלות ובלתי מתכלים, למשל; polycaprolactone (PCL) 27, חומצה פולי-L-lactide (PLLA) 28, פולי (לקטית-שיתוף גליקולית וחומצה) (PLGA) 29, פוליסולפון (PSU) 12 ו polyetheretherketone (פיק) 13. לכל מאפיינים שונים בתnd צריך להיבחר בהתבסס על הצרכים של המערכת. בדוק את התאימות של הסיבים המועסקים עם אתנול המשמש צעד העיקור. PLGA ידוע plasticize עם אתנול דבר המחייב טיפול אלטרנטיבי כגון פתרון אנטיביוטי / antimycotic 25.
הממדים של מודולים הזכוכית משמשים כאן נבחרו בהתבסס על הצרכים של המחקר הנוכחי. בגדלים שונים יכול להיעשות על ידי כל חברה נושבת זכוכית מכובדת. שיקול בגודל מודול הוא מספר התאים, אשר קשור למספר הסיבים במודול וספיקות סבירות. ככל תאים יש המודול שבו הספיקות גבוהות צריכות להיות על מנת לשמור על תנאי תרבות חיוביים בסוף היצוא של bioreactor. זה יגיע מגבלה כמה נקודות וכמה ניסוי וטעייה עשויים להידרש עם ניטור של תנאי התקשורת לפעפע מודול. מודלים מתמטיים עשויים לספק כמה תובנה לתוך דימן מודול נדרשוהצטרפויות וספיקות 22.
הממדים של המנגנון המשמש כאן נועד כדי להתאים אותו מדף חממה. אורכו של הצינור מוכתב על ידי אורך צורך להגיע בין המחברים בזמן גם מה שמאפשר מספיק תנועה של רכיבים כדי לאפשר הגדרה ותפעול. אם הדגימה כמובן זמן נדרש, למשל ניטור של תנאי התקשורת במודול לחלחל ואז יציאות הזרקה ניתן להוסיף גם את retentate ויחלחל קווים כדי להקל על זה.
תנאי מוקדם לכל מערכת תרבית תאים הוא לשמור על תאים בחיים וברוב המקרים גדלו. לאור המחקרים מפגינים יותר in vivo-כמו פנוטיפ בתאים גדלים במערכת תרבות 3D זה גם נראה חשוב לספק סביבה תחקה את הסביבה vivo נתקלה ידי התאים. נקודה אחרונה זו לעיתים קרובות מוזנחת תרבית תאים 2D לטובת נוחות מערכת התרבות הזאת מציעה. Tהוא HFB מחק ברשתות נימי vivo על ידי מתן חומרים מזינים את התאים דרך לומן של סיבים. את חומרי הפסולת יוסרו גם מהמערכה ידי הזרימה הדינמית. זה יוצר מערכת in vivo-כמו תרבית תאים, וכזה המחקה את הסביבה vivo בעיני hepatocytes, מה שהופך מערכת זו בחירה טובה יותר לעומת פלסטיק בתרבית רקמה 2D עבור culturing תאים אלה. הדברים מקבלים תימוכין גם עובדת התאים מפרישים 15-לקפל את כמות אלבומין, פונקציה כבדה חשובה, במערכת התרבות HFB בהשוואה לאלו גדלו על פלסטיק בתרבית רקמת 2D.
בעוד מערכת HFB מתאימה רוב אם לא כל סוגי התאים התלויים למעגן, הדוגמא כאן היא עבור hepatocytes כי קיים צורך אמיתי להיות מסוגל תרבות פונקציונלית, יותר in vivo-כמו hepatocytes לשימוש בפיתוח תרופות על ידי תעשיית התרופות ובמכשירי הכבד bioartificial על התמיכה extracorporealמחולים אי ספיקת כבד. צורך התאים פונקציונליים יותר חורג דוגמאות אלה, במיוחד כשדה של רפואת רגנרטיבית נכנס לשלב עבודת translational. היתרונות של סביבת תרבות יותר in vivo-כמו לא צריכים להתעלם.
Disclosures
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Acknowledgements
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
Materials
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
References
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved