Method Article
Полое волокно биореакторов для
В этой статье
Резюме
Функциональное поведение клеток в культуре может быть улучшена путем культивирования в более в естественных условиях -как 3-мерных сред для культивирования 16-21. Эта рукопись описывает настройку и работу полой волоконной системы биореактора для в естественных условиях -like млекопитающих культуре ткани.
Аннотация
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Введение
Тканевая культура является признанным методом для роста и / или поддержания клеток , которые были использованы в течение более 100 лет 1,2. Удобства изучения клеток и ответов исключая виво имеет далеко идущие преимущества позволит проводить эксперименты , которые иначе были бы чрезвычайно сложно , если не невозможно, например, поколение генетически сконструированных клеточных линий и использование репортерных клеток в высокопроизводительного скрининга анализов 3. Совсем недавно тканевой культуры привело к области тканевой инженерии, для создания моделей в пробирке и для регенеративной медицины. С помощью этих приложений, интерес в динамических системах культуры 3-мерные (3D) значительно вырос.
Способы культивирования 3D (определенные здесь в качестве субстрата 3D культуры и / или введения направленного динамического потока) лучше резюмировать архитектуру сотовой среды в естественных условиях, важно для достиженияболее физиологичным подобные функции. Способность извлекать, расти, дифференцировать и клетки после трансплантации с целью восстановления больных и поврежденных тканей является полем исследования, которое имеет огромный потенциал для пользы пациента и коммерческой возможности. Например, использование аутологичных кератиноцитов для лечения ожогов (см 4) и применение терапии на основе клеток для лечения инсульта (см 5). Кроме того, на рынке моделей в пробирке охватывает обнаружение наркотиков в стратифицированных применения лекарственных средств. Конвенция в тканевой культуре является рост прикрепленных или анкерными типов зависимых клеток на 2-мерном (2D) поверхности тканевой культуральной колбы. Хотя в настоящее время принят в качестве золотого стандарта в условиях исследования, в последнее время интерес в инженерных приложениях тканевых особо отметил тот факт , что текущая среда 2D культуры ткани недостаточно для необходимого расширения масштабов производства клеток 6.
Для адгезивных типов ячейки а scaffold требуется, которая будет варьироваться в зависимости от конечного использования, с точки зрения как от химического состава и механических свойств. Некоторые системы используют каркасы , как хорошо пластинчатые вкладыши , состоящие из высоко пористой матрицы , образованной из высокой внутренней фазы эмульсии шаблонам (см 7) или electrospun волокна (см 8) , требующие минимальной адаптации от традиционных методов 2D культуры. Клетки могут быть посеяны на микроносителями различного состава и выращивали в перемешиваемых резервуарах , которые поставляют питательные вещества и сигнальные молекулы, и уносят продукты отходов (перенос массы) с помощью динамической хорошо смешанной среде 9. Тем не менее, эти системы ограничены в их естественных условиях -like среды в и дальнейшие улучшения могут быть сделаны в отношении для расширения масштабов затрат. Полое волокно биореакторы (HFBs) представляют собой систему 3D культуры , которые состоят из волокон , закрепляются в виде модуля с клетками , как правило , посеянных на внешней стороне пористых волокон и средств массовой информации поступает через полость волокна (обзор в 10) (Рисунок 1). HFBs предлагают виво -подобных среду с использованием волокон , имитирующих капилляры и экранирующими клетки от сдвиговых напряжений , связанных с доставкой динамических средств массовой информации, позволяя при этом определенный сдвиг применяться к клеткам с помощью потока текучей среды через боковые порты , если это необходимо. Это создает универсальную систему культуры с превосходной массового транспорта , в которых высокая плотность клеток может быть достигнуто 11. Система HFB хорошо подходит для поддержания анкерными зависимых типов клеток и использовали для культуры различных клеток , включая клетки крысы панкреатических островках Лангерганса 12, мышиные β-ТС-3 инсулиноме клеточная линия 12, первичные гепатоциты человека 13, кости человека одноядерные клетки костного мозга 14, Madin Darby клетки собачьих почек (MDCK) 15 и Сасо-2 клетки 16 , чтобы назвать несколько.
В дополнение к системе Преимущества массопереноса и расширение масштабов, клетки, выращенные в 3D ТИССистемы культуры Sue имеют тенденцию быть более в естественных условиях -как в морфологии и более чутко реагировать на экспериментальных сигналов. Например крыс первичные гепатоциты показывают более шестигранника морфологию, повышенную жизнеспособность, большую индукцию активности фермента цитохром-Р450 и повышенную чувствительность к токсичности парацетамола при выращивании в коммерчески доступного полистирола помост по сравнению с клетками , выращенных в 2D культуре 17. Используя ту же леску гепатокарцинома линия клеток HepG2 также было показано увеличение производства 18 альбумина и показывают более в естественных условиях -как ответ на метотрексат по сравнению с 2D культивируемых клеток 19. Первичные гепатоциты человека продемонстрировали замедленное дедифференцировку, более высокую цитохром-Р450 активность и увеличение клиренса на 4/5 тестируемых соединений в системе 20 культуры перфузионной. Человек нейронные стволовые клетки, полученные нейроны и глия, культивируемые в коммерчески доступного полистирола эшафот выставлены как высокую (потенциал действия) и низким frequeNCY (локальный потенциал поля) спонтанной активности , тогда как не нейронную активность была обнаружена в 2D культивируемых клетках 21. Сасо-2 клетки продемонстрировали повышенную дифференциацию в HFB по сравнению с 2D - культуры , измеренной повышенной щелочной фосфатазы, гамма-глутамилтрансферазы и P-гликопротеина активности и более высокой экспрессии F-актина и Zona occludens-1 белка 16. Несмотря на преимущества, процедура культивирования клеток в других, чем 2D тканевой культуры колбы поверхности системы до сих пор не практикуется во многих лабораториях, хотя количество публикаций со ссылкой на 3D культуры клеток растет (8-кратное увеличение за последние 10 лет. Источник : PubMed 'Результаты по года' инструмент зондировали '3D культуры').
Эта рукопись описывает настройку и условия эксплуатации системы HFB для культуры клеток млекопитающих и демонстрирует его полезность в культивировании гепатокарцинома клеточной линии HepG2 / C3À. Цель этого метода состоит в культуре клеток вболее естественных условиях -как система культуры в том , что сохраняет достаточную простоту , чтобы сделать его доступным для тех , кто являются новыми для систем 3D - культуры. Обоснованием использованием HFBs в приложении описаны здесь, что улучшить предсказуемость моделей печени является то , что теоретически это возможно , чтобы имитировать печеночной синусоиду в среде HFB 22. Это в настоящее время не представляется возможным с другими системами культуры.
протокол
1. Волокна
- Производство волокон от фазоинверсии центробежного литья (прядение). Подробности этого метода можно найти в 23,24.
Примечание: Для этой работы волокна изготавливаются собственными силами , используя небиоразлагаемое запатентованную полимер, NMP в качестве растворителя и H 2 O в качестве осадителя. Подробная информация о других подходящих полимеров можно найти в обсуждении. Волокна, используемые в системе, описанной здесь, являются 1.05mm наружный диаметр с диаметром светового потока в 600-700 мкм. Волокна являются пористыми с диаметром пор 2,28 мкм измерения ± 1,5 мкм (среднее значение ± стандартное отклонение). Это сделано для того, чтобы отделить клетки от подачи носителя в просвете волокна, тиражирование синусоида печени или сосудистую сеть других тканей. Волокна также могут быть приобретены у мембранных поставщиков, таких как Pall.
2. Модуль Fabrication
Примечание: Модули, используемые в данном исследовании, изготовлены из толстого боросиликатного стекла толщиной 1 мм с 2 боковыми отверстиями(Рисунок 2А). Волокна в модуле , описанном здесь , имеют внешнюю площадь поверхности 4,95 см 2 , что эквивалентно примерно из половины лунки 6-луночного планшета.
- Силиконизированная модули перед первым использованием путем нанесения на внутреннюю поверхность с Sigmacote (таблица 1) и позволяя высохнуть в вытяжном шкафу. Автоклавы (121 ° С, 1 атм, 20 мин), чтобы увеличить срок службы лечения.
- Используя скальпель вырезать 75 мм длиной волокон и вставьте три волокна в каждый модуль оставляя ~ 7 мм избыточную длину на каждом конце (рис 3А).
- Место ~ 0,5 мл силиконового клея (таблица 1) в взвешенную лодочку. Используйте кончик пипетки Р200 подобрать небольшое количество силикона и работать клей на концах модуля вокруг волокон с образованием 3-5 мм штекер (фигура 3В). Дайте высохнуть в течение> 3 ч.
- Используя скальпель отрезать силиконовую заподлицо с модулем стекла концами (рис 3C).
- Обернитенебольшое количество (~ 4 слоя) из политетрафторэтилена (PTFE) ленты вокруг одной стороны порта.
3. Настройка системы и Стерилизация
Примечание: Насос трубы и модули с волокнами не автоклавированы и стерилизуют с использованием 70% этанола. Авторы рекомендуют калибровки трубки насоса с насосом для использования. Ниже описана процедура выполняется в колпаке с ламинарным потоком.
- Автоклавы (в разделе 2.1) все компоненты автоклавируемых до оператора для настройки.
- Настроить
- Поместите 10 мл 70% этанола в бутылью и настроенному на бутылью, Q-серии колпачок, подающую трубку, насос и насос трубки (таблица 1) , как на рисунке 4.
- Неплотно место концевой колпачок над PTFE-проклеены боковой порт. Вставьте концы разъемов L / модуль S16 над модулем концами и свободной стороне порта. Подключить раздел 40 мм L / S13 трубки к разъему ближайшего удаляемого бокового порта (таблица 1) , как на рисунке 2B .
- Подключение модуля к трубке насоса, обеспечивая сориентировать модуль таким образом, ограничен боковой порт, ближайший к насосу.
- Подключение линии пермеата и ретентата линии к разъемам модуля и L / S14 из Y-разъем на бутылью (таблица 1). Убедитесь в том, что установка напоминает схему на рисунке 4.
- стерилизация
- Насос этанола через модуль при 800 мкл / ч (267 мкл / ч на волокна) в течение достаточного количества времени для лечения unautoclaved компоненты в течение> 30 мин (время регулировки , если используются другие методы стерилизации, см 25).
- мыть
- Для того, чтобы вымыть этанол из системы, сначала выключите насос и слейте трубку. Во-первых, отсоединить трубку насоса от модуля адаптера трубки. Удерживая модуль вьсоте, чтобы осушить этанол из волокон и задерживаемого материала линии, обратно в бутылку резервуара. Снимите боковую крышку со стороны порта от модуля осушить тысе этанол из самого модуля, а также линии пермеата. Заново торцевой заглушки со стороны порта. Обратный поток средств массовой информации на насосе, чтобы слить трубку насоса и линию подачи этанола. Выключите насос и прикрепить трубку насоса к адаптеру модуля.
- Отвинтите бутылку этанола из крышки и заменить бутылку, содержащую 10 мл среды для роста клеток (например, EMEM, GMEM, DMEM или RPMI) без сыворотки. Насос среды через систему со скоростью 800 мкл / ч до задерживаемого линии не полна СМИ. Зажмите удерживаемого линию, чтобы заставить проникновение средств массовой информации через волокна, чтобы вымыть модуль. Промыть в течение ~ 2 ч.
4. Посев
ПРИМЕЧАНИЕ: Средства массовой информации и добавки, используемые в настоящем протоколе должны быть те, которые установлены для требуемого типа клеток. Пожалуйста, обратитесь к литературе, Европейская коллекция клеточных культур (ЕСАСС) и Американской коллекции типовых культур (АТСС) для получения дополнительной информации. До этого метода клетки должны быть maintaIned в соответствии с установленными протоколами для требуемого типа клеток. Для этой работы гепатокарцинома клеточная линия HepG2 / С3А подклон были сохранены в соответствии с рекомендациями дистрибьюторов (АТСС).
Примечание: Протокол высева представленный ниже, также служит для предварительной культуры модуль с клеточной культуральной среды до роста клеток. Если требуется более обширная предварительной культуры, то это должно быть осуществлено перед посевом модуля путем слива промывочной носителя из системы, заменяя питательной среды и проникая через этот модуль в течение нескольких часов. Смотрите раздел 7.5.2.1 Подробную информацию о замене средств массовой информации в системе.
- Подготовка суспензии отдельных клеток путем обработки трипсином в соответствии с установленными протоколами для требуемого типа клеток. Общий протокол для Т75 культуры выглядит следующим образом:
Примечание: Число ячеек для использования на стадии посевного должны быть определены эмпирически для нужного типа клеток. Биореакторы, описанные здесь, высевают в 35 раз выше, CELПлотность Ls (клеток / см 2) , чем используемый в 2D для тканевой культуры пластика для 7 - дневной культуры.- Промывают клетки путем добавления 10 мл фосфатно - буферным раствором (PBS), аспирация, затем добавляют 3 мл 0,05% трипсин этилендиаминтетрауксусной кислоты (ЭДТА) (достаточно , чтобы покрыть клетки) и инкубируют при температуре 37 ° С, 5% СО 2 в течение 5 мин.
- Урожай клеток в 7 мл культуральной среде с добавлением 10% фетальной бычьей сыворотки (FBS), чтобы нейтрализовать трипсина. Хорошо перемешать, добавить по 10 мкл в камере гемоцитометра и подсчета клеток.
- Центрифуга при 200 мкг в течение 5 мин для осаждения клеток.
- Аспирата супернатант и ресуспендируют клетки на 4х10 6 / мл в среде с добавлением по мере необходимости для желаемого типа клеток.
- Выключите насос и слейте трубку подачи и модуль, как и в пункте 3.4.1.
- Отсоедините модуль от разъемов модуля и прикрепить торцевые крышки модуля (таблица 1) , предварительно стерилизуют в 70% этанола, в результате чего одна сторона порт бесплатно.
- Передача ~ 500 мкл клеточной суспензии (2x10 6 клеток) (4.1.4) модулю с помощью 18 G иглы и 1 мл шприц, следя за тем, чтобы избежать образования пузырьков и , чтобы не повредить волокна.
- Закрывают боковой порт, используя боковую крышку. Инкубируйте клетки при 37 ° С в атмосфере 5% СО 2 в течение 2-4 ч с ручным поворотом модуля на 180 ° через каждые 5 мин. В качестве альтернативы модули могут быть присоединены к ротатора удлинительные трубки с прерывистым настройки смешивания (таблица 1).
- После засева, прикрепить торцевую заглушку на инжекционное отверстие (таблица 1) , предварительно стерилизуют в 70% этаноле, и прикрепить это к PTFE-приклеенный боковое отверстие. Удалите другой концевой стороне порта крышку и медленно истощать клетки путем вдувания воздуха в подключенную инъекционный порт с использованием 27 G иглы и 1 мл шприца.
- Заменить порт впрыска с торцевой крышкой. Медленно заполнить модуль с использованием средств массовой свободной стороне порта и 18 G иглу с 1 мл шприца. Remoве торцевые крышки модуля и прикрепить модуль к трубопроводу с помощью разъемов модуля.
- Замените промывочный СМИ бутылку с одной, содержащей 50 мл среды роста и добавки в соответствии с процедурой, описанной в 7.5.2.1. Насос питательной среды через систему со скоростью 800 мкл / ч.
5. Пролиферация
Примечание: Волокна, используемые в системе исследований, описанных здесь установлены пронизывать при ~ 80 мкл / ч, при скорости подачи 800 мкл / час.
- Используйте волокна для выращивания клеток в течение периода до 7 дней в увлажненном инкубаторе при 37 ° C, 5% CO 2.
Примечание: Мониторинг питательных веществ и метаболитов во время фазы роста может дать полезную информацию о распространении, метаболический поглощение и выход клеток и уровни питательных веществ и метаболитов в средствах массовой информации. Например глюкозы и лактата использование производства. Комплекты доступны от различных поставщиков, которые могут количественно оценить эти факторы из средств массовой информации (см Таблица 1 для тех , которые используются в данном исследовании). инжекционные отверстия могут быть добавлены к пермеата и ретентата труб и средств массовой дискретизированных через 27 G иглу и шприц, и носители могут быть выбраны из бутылки медиа резервуара. Это дает питательных веществ и метаболизма информацию для входа и оба выходных потоков. Отбор проб следует проводить в вытяжном шкафу с ламинарным потоком. Стерилизовать портов впрыска до взятия пробы путем проведения этанол пропитанной синий рулон против порт> 30 сек.
6. Иссечение
ПРИМЕЧАНИЕ: Волокна могут быть вырезан из модуля в конце эксперимента для анализа.
- Отключите и слейте HFB.
- Вставьте скальпель / микро нож (Таблица 1) лезвие между стеклом и силикона. Поверните модуль таким образом, чтобы отрезать силикон из стекла. Повторите эту процедуру на обоих концах модуля.
- Используя лезвие выведать силиконовую пробку с одного конца и осторожно потяните. Убедитесь в том, что волокна приходят с ней.
- количество клеток
Примечание: Для C3À клеток, используемых в данном исследовании, любые моменты времени в течение периода роста 7 дней пригодны для использования в данном расчете, как темпы роста существенно не меняются в течение плотности клеток, достигнутые за этот период времени.- После иссечения (раздел 6) окунуть волокон в PBS, чтобы вымыть и нарезать их в 1,5 мл пробирку, содержащую 0,5 мл Трис ЭДТА (ТЕ) буфера. Тема этого двух циклов замораживания-оттаивания в -80 ° C морозильнике. Измеряют содержание ДНК с использованием PicoGreen и определяют количество клеток путем сравнения это значение на стандартной кривой , полученной с желаемым типом 26 клеток.
- скорость пролиферации клеток
- Используя числа ячеек, рассчитанных на двух разных временных точках расчета удельная скорость роста μ (уравнение 1), где Ln (X 1) является натуральный логарифм числа клеток в первой точке времени и Ln (X2) натуральный логарифм клетки номер во второй момент времени.
μ = (Ln (Х2) -Ln (Х1)) / Время (ч) (1)
Исходя из этого расчета удвоения популяции раз (дт) (уравнение 2), где μ является удельная скорость роста.
дТ = Ln2 / μ (2)
- Используя числа ячеек, рассчитанных на двух разных временных точках расчета удельная скорость роста μ (уравнение 1), где Ln (X 1) является натуральный логарифм числа клеток в первой точке времени и Ln (X2) натуральный логарифм клетки номер во второй момент времени.
- Жизнеспособность клеток
- После иссечения (раздел 6) окунуть волокон в PBS, чтобы вымыть и нарезать их в 1,5 мл пробирку, содержащую 500 мкл 0,05% трипсина этилендиаминтетрауксусной кислоты (ЭДТА). Инкубируют при 37 ° С в течение 10 мин.
- Смешать и добавить 10 мкл клеточной суспензии в 10 мкл трипанового синего. Нагрузка 10 мкл на гемоцитометра и подсчитать количество мертвых (синий) и живых клеток.
- обработки изображений
- После иссечения окунуть волокон в PBS мыть и использовать ножницы, чтобы разрезать их на более мелкие длины в 24-луночного планшета. Добавить 400 мкл 4% параформальдегида (в PBS) и инкубируют при комнатной температуре в течение 20 мин.
- Мытье с PBS с помощью пипетки 400 мкл и выключается. Повторить Тхиs шаг со свежим PBS.
- Добавить 400 мкл 4 ', 6-диамидино-2-фенилиндола (DAPI), разведенного в PBS до прибл. 100 нг / мл и инкубируют при комнатной температуре в течение 20 мин. Защита от света.
- Мытье с PBS в два раза (как 7.3.2) и один раз H 2 O. Добавить флуоресцентного монтажную среду для покрытия волокна и изображения сразу для сбора данных до образцов сухих (DAPI ех / эм; 359/461 нм).
- Возьмите изображения на разных фокальных плоскостях и использовать 'фокус' штабелирования программное обеспечение (например, стек Фокусер плагин для ImageJ, ниже) , чтобы сделать составное изображение , показывающее значительно расширенную глубину резкости. Это необходимо, поскольку волокна не являются плоскими.
- Скачать ImageJ (http://imageJ.nih.gov/ij/) и "стек-фокусер 'плагин (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- В ImageJ открывать изображения для штабелирования. Затем в меню "Image" перейти к "Штабеля" - "Изображения для стека. В меню "Плагины" перейдите в раздел "Stack Сосредоточитель'. Укажите п для NxN ядра. Методом проб и ошибок с 'п' может потребоваться для того, чтобы сформировать изображение с небольшим «шумом». Значения между 11 и 77, как правило, работают хорошо.
- Альбумин секреции
Примечание: Это тестовая функция гепатоцитов клеток, а не общий тест функции клеток.- Семенной клетки (HepG2 / С3А) на 2D культуре ткани пластика на 10,667 / см 2 и выращивали в течение 6 дней. Семенной HFBs, как описано в разделе 4 и расти в течение 6 дней.
- После этого периода распространения изменения культуральной среды (EMEM + 10% FBS, 1x глютамин & 1x пенициллина / стрептомицина) для тканевой культуры пластической и HFB к бессывороточной Williams E, дополненной 1x глутамина и 1x пенициллина / стрептомицина в течение 24 часов:
- Слив трубопровода и HFB модуль согласно инструкциям, изложенным в пункте 3.4.1. Отвинтить бутылью и заменить это флакон, содержащий носитель Williams E. Насос это через HFB на 800 мкл / час.
- После 24 ч, берут образцы средств массовой информации. Количественно секретируемый альбумина с помощью ELISA в соответствии с инструкциями изготовителя (таблица 1). Развести образцы печатных носителей 1 в 10 до 1 в 40 перед использованием, чтобы привести концентрацию альбумина в диапазоне от стандартной кривой.
7. Анализ Cell
Результаты
Cell высева является важным шагом. Способность клеток придерживаться волокна в 3D набора параметров значительно меньше, чем наблюдаемое для 2D тканевой культуры пластика. Это, вероятно, из-за уменьшения времени контакта между клеткой и подложкой. В HFB клетки попадают через модуль во время статических фаз высева. Они значительно короче по времени по сравнению с одной непрерывной статической фазы, используемой в 2D. Клетки должны подключаться к подложке в это время. Кроме того, в связи с изогнутым природа волокон не плоская поверхность для ячейки, чтобы отдохнуть и сделать связи, как есть в 2D культуре. Хотя это может быть смешан по химии волокна использовали мы знаем, что это не имеет место для полимера, используемого в этом исследовании (данные не показаны). Увеличение времени посева и плотность посева клеток приводит к образованию агрегатов клеток, которые попадают через модуль во время статических фаз при более быстром Rпоел, чем отдельные клетки и дополнительно уменьшает время контакта между клетками и субстратом. Увеличение времени также приводит к пожелтению СМИ как существует высокая плотность клеток и никакого обмена медиа во время этого шага. Используя условия , описанные в разделе 4 скоростей клеток высева ~ 15% последовательно достигается с HepG2 / C3À клеток (рис 5А). Хотя это может рассматриваться как низкая фракция есть достаточное количество клеток для генерации хорошо густонаселенные волокон в течение нескольких дней (цифры 5B и 6); Следующий период распространения семидневный плотность клеток достигала в HFB приближается 3х10 5 / см 2. Это подходящий плотность для многих анализов с использованием печеночных клеток, и могут считаться достижения слияния.
Темпы распространения , достигнутые в HFB медленнее по сравнению с результатом , достигаемым в 2D культуре клеток (рис 5C). Это ипвероятно, связано с потерей клеток в динамическом потоке системы, как количество клеток в средствах массовой информации являются низкими (среднее ± SEM: 20,343 клетки ± 3674 клеток на 24 ч при стечении, что составляет 4% от общего числа клеток), и это не увеличивается, когда скорость проникновения повернута до 400 мкл / ч (данные не показаны). Кроме того , маловероятно, что из - за снижения жизнеспособности и последующей потерей клеток (смотри рисунок 5D и ниже). Это можно объяснить, по крайней мере, частично за счет того, что эта клеточная линия была клонированных полученного из HepG2 и выбранной на его способности демонстрировать контактное ингибирование пролиферации клеток. Клетки в HFB высевают на 6х плотность 2D-клеток, которые могут привести к замедлению темпов распространения.
Жизнеспособность остается на высоком уровне на протяжении всего HFB с клетками, проявляющих> 90%. Хотя существует некоторое снижение жизнеспособности на выходном конце по сравнению с входным отверстием в этом не было обнаружено существенного влияния (Т-тест р = 0,22).
Мониторинг потребления глюкозы и производства молочной кислоты используется для настройки громкости скорости подачи средств массовой информации и средств массовой информации в системе. С помощью 800 мкл / ч и общий объем носителя 50 мл уровни глюкозы и молочной кислоты сохраняются выше и ниже (соответственно), которые видели в стандартной тканевой культуры, пластической культуры.
Альбумин секреции является ключевой функцией печени осуществляется гепатоцитов. Он секретируется в сыворотке, где он играет несколько ролей в транспорте и гомеостаза. Альбумин секреции клетками , выращенными в HFB в 15 раз выше , чем в клетках , выращенных на 2D (рисунок 7). Это свидетельствует о том, что клетки функционируют в HFB и, по крайней мере, в случае альбумина секреции, эта функция повышается в HFB.
JPG "/>
Рисунок 1. В естественных условиях -как среды из HFB. Клетки высевают на внешнюю поверхность пористых волокон. Медиа доставляется через просвет волокон, имитируя капилляр крови. (A) , продольное сечение волокна (не в масштабе). (B) Поперечное сечение реактора 3 волокна. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2. HFB модуль. (А) Размеры модуля , используемого в данном исследовании. Размеры были выбраны, чтобы соответствовать 3 волокон и удовлетворять потребности нынешнего исследовательского проекта. Различные размеры могут быть изготовлены и приспособлены для отдельных систем и волокон. (Б) фотография мМОДУЛЬ с прикрепленными торцевой крышки и модуля разъемов. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
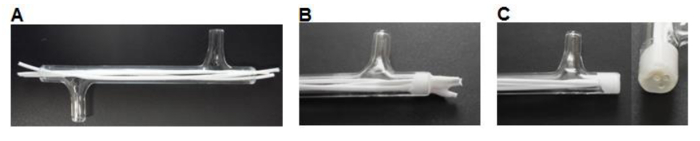
Рисунок 3. Изготовление модуля. (A) Волокна разрезают по размеру и вставляется в модуль. (B) Волокна склеиваются в модуле, дают высохнуть. (C) Концы срезают заподлицо со стеклом. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
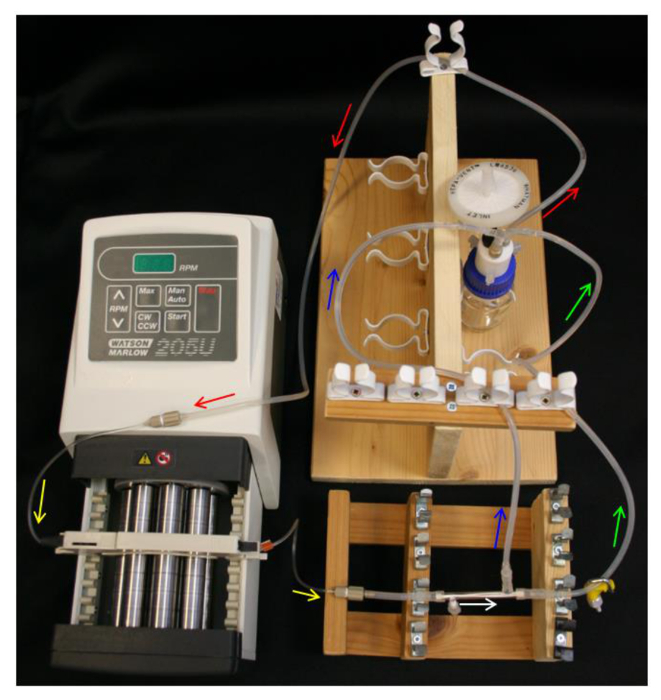
Рисунок 4. Система HFB настройки. Стрелки указывают направление потока среды. Красный = подающая трубка. Желтый = насос Tuбыть. Белый = модуль HFB. Зеленый = удерживаемый трубка с зажимом. Синий = пронизывать трубку. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
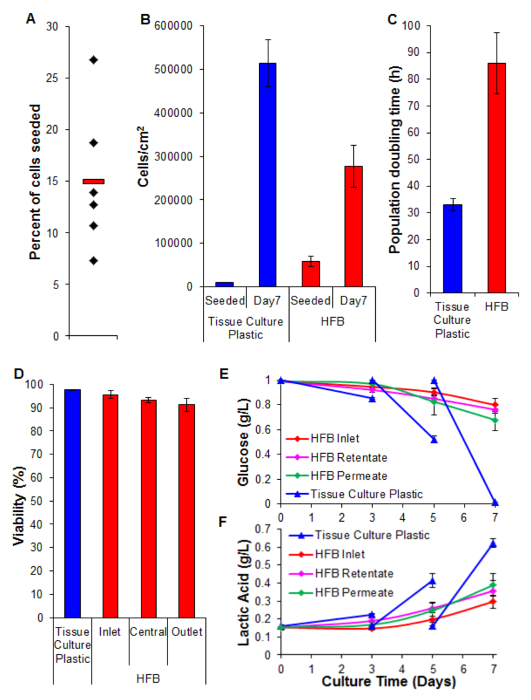
Рисунок 5. Посев, пролиферацию, жизнеспособность и биохимический анализ. (A) Процент клеток , посеянных. Черные алмазы представляют собой отдельные HFBs. Красная полоса является средним. (B) Клетки плотности при посеве и после периода пролиферации 7 дней. числа 2D-клеток определяли с помощью обработки трипсином и подсчет с использованием гемоцитометра. Числа HFB клеток определяли с помощью анализа PicoGreen и стандартную кривую , полученный из клеток C3À 26. п = 5-6. Bars = SEM. (C) удвоения популяции раза. п = 5-7. Bars = SEM. (D) Жизнеспособность определяется TRYPсиний исключение в конце пролиферации 7 дней. Вход, центральный и выход представляют регионы в пределах HFB. п = 3-5. Bars = SEM. (E & F) потребление глюкозы и производство молочной кислоты. Уровни контролировались на бутылью (на входе), а также ретентата и пермеата точек и compered к обычной культуре на культуре ткани пластика (СМИ изменились на 3 день и 5). п = 3-5. Bars = SEM. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
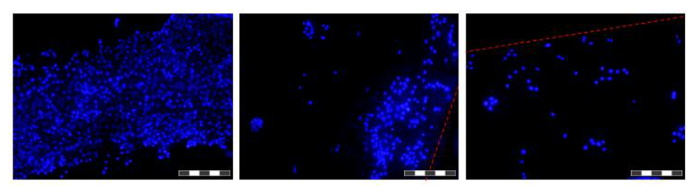
Рисунок 6. Изображения клеток , выращенных на волокнах в HFB. Клетки высевали и выращивали в течение 48 ч , прежде чем волокна были вырезаны, промывали в PBS, фиксировали в 4% параформальдегида, промывают в PBS и ядер окрашивали DAPI. Каждое изображение представляет собой совокупность 12 'фокус сложены "ИМАGES для того, чтобы увеличить глубину резкости результирующего изображения. Области более высокой и более низкой плотности клеток расположены вдоль волокна в этот момент времени и показаны. Там, где присутствуют границы волокна обозначены красной пунктирной линией. Изображения были взяты на перевернутой флуоресцентного микроскопа. Изображение = 10X цель. Bar = 200 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
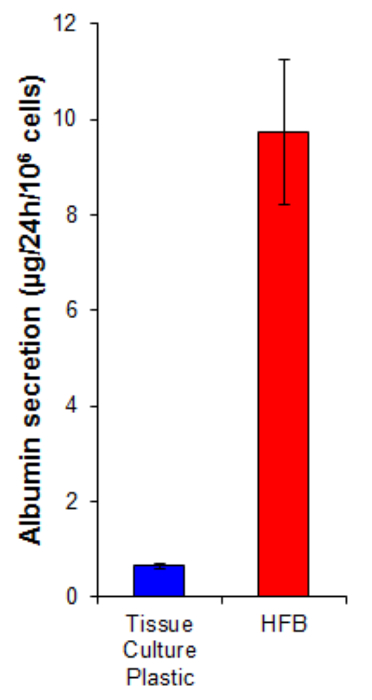
Рисунок 7. Альбумин секреции. Клетки высевали на культуре ткани пластика в 10,667 / см 2 и в HFB , как описано в разделе 4. Клетки пролиферируют в течение 6 дней. После этого периода распространения культуры ткани пластика и HFB культуры среду заменяли на бессывороточной Williams E, дополненной глутамином и пенициллином / streptomyciп в течение 24 часов. Медиа были взяты образцы и альбумин количественно с помощью ELISA в соответствии с инструкциями производителей (таблица 1). п = 5-6. Bars = SEM. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Раздел | Название оборудования | Компания | Кот. Нет . | Заметки | Изображений |
| 2 | Модуль Glass HFB | Сохам Scientific | --- | Пользовательский элемент. | |
| 2.1 | Sigmacote® | Sigma-Aldrich | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | кремниевуюодин клей. | |
| 2.5 | PTFE ленты | Sigma-Aldrich | Z104388 | ||
| 3.2.1 | бутылью | рыболов | 11972619 | ||
| Q-серия колпачок | кинез | 00932Q-3V | PTFE винтовой резьбой адаптеров и гайку крепления. Присоединить к крышке Q-серии. Приложите раздел 8.5 см поставляемого PTFE трубки под адаптером 1 мм и секцию 4 см под адаптер 3 мм. |  | |
| Адаптер, Мужской, 1,0 мм ID | кинез | 008NB10-KD5L | |||
| Адаптер, Мужской, 3,0 мм ID | кинез | 008NB30-KD5L | |||
| Место Гайка | кинез | U-350 | |||
| неопрен трубки | рыболов | 10366344 | Закрепить фильтр Hepa до 6 см из неопрена трубки и прикрепите к «фитинга гайки». Приложить 2x 30 мм секции L / S14 трубки с двумя верхними бородки на Y-образного соединителя и секции 3 см от L / S16 трубки к нижней части. Прикрепите это к заусеницы идентификационного адаптера 3 мм. (Раздел 3.2.1) |  | |
| HEPA-вентиляционный | рыболов | 11374634 | |||
| Y-разъем, колючая | Коул Пармер | НУ-06295-10 | |||
| L / S16 Силиконовые трубки | Коул Пармер | НУ-96410-16 | |||
| L / S14 Силиконовые трубки | Коул Пармер | WZ-96410-14 | |||
| L / S13 Силиконовые трубки | Коул Пармер | НУ-96410-13 | 80 см для подключения 1,0 мм колючая адаптер на Q-серии крышкой в бак насоса ИНГ = Труба подачи. | ||
| WM 205U / CA насос | рыболов | 1248-6300 | |||
| WM насос трубы, ПВХ, синий-оранжевый, 0,25 мм отверстие | рыболов | 12416310 | PTFE винтовая резьба охватываемой адаптера и подключите адаптер женский. Работа трубки насоса по одному из заусениц. Повторите эту настройку на другом конце трубки. (Раздел 3.2.1) |  | |
| Адаптер, Мужской, 1,0 мм ID | кинез | 008NB10-KD5L | |||
| Адаптер, Женщина, 1,0 мм ID | кинез | 008NB10-KD2L | |||
| 3.2.2 | Женский колпачок Luer | Коул Пармер | WZ-45508-64 | Боковые торцевые крышки порта. | blefig4.jpg "/>  |
| L / S13 Силиконовые трубки | Коул Пармер | НУ-96410-13 | 40 мм секция для подключения трубки насоса к разъему модуля. | ||
| L / S16 Силиконовые трубки | Коул Пармер | НУ-96410-16 | 3x 30 мм L / S16 установлен на 3x редукторы = разъемы модуля. (Раздел 3.2.2) | ||
| Колючая редуктор 1/8 "х 1/16" | Коул Пармер | 30616-43 | |||
| 3.2.4 | L / S13 Силиконовые трубки | Коул Пармер | НУ-96410-13 | 55 см раздел для подключения ретентата к L / S14 из Y-разъем на крышке Q-серии. |  |
| L / S13 Силиконовые трубки | Коул Пармер | НУ-96410-13 | 45 см раздел для подключения пермеата к L / S14 из Y-разъем на крышке Q-серии. | ||
| Прямой колючая союз | Коул Пармер | WZ-30612-43 | Присоединить к концу L / S13, который будет соединяться с L / S14 от Y-образного соединителя. | ||
| 3.4.2 | зажим | VWR | 229-0609 | ||
| 4.3 | 4 мм Силиконовые трубки | рыболов | FB68858 | Сложите по участку 40 мм трубки и закрепите с помощью кабельной стяжки = модуля торцевой крышке. (Раздел 4.3) |  |
| Кабельные стяжки | рыболов | 12326377 | |||
| 4.4 | ротатор труба MACSmix | Miltenyi Biotech | 130-090-753 | Адаптация может потребоваться АТТАКч модули. | |
| 4.5 | Инъекция порт Leur | Чертополох Scientific | IB-10820 | Прикрепите боковую крышку к порту впрыска. (Раздел 4.5) | |
| Женский колпачок Luer | Коул Пармер | WZ-45508-64 | |||
| 5 | Комплект L-молочной кислоты | Megazyme | K-ПОЗЖЕ | ||
| 5 | Комплект D-глюкозы | Megazyme | K-Gluc | ||
| 6.2 | Скальпель / микро нож | InterFocus | 10315-12 | ||
| 7.4.3 | Альбумин ELISA | Bethyl Labs | E80-129 |
Таблица 1. Компоненты HFB настройки. Текст раздела отношение к каждому компоненту дается в колонке 1.
Обсуждение
Эта рукопись описывает настройку и работу системы полых волокон биореактор (ОРБ) для культуры клеток млекопитающих и его полезность проявляется в пролиферирующих гепатоцитов клеточной линии HepG2 / C3À. Система предназначена для размещения на полке стандартного инкубатора и его настройки достаточно, чтобы быть выполнена любым компетентным клеточный биолог, знакомый с асептики простой.
Волокна, используемые в системе исследований, описанных здесь производятся в доме с помощью фазовой инверсии спина литья (вращение), используя небиоразлагаемое запатентованную полимер. Можно сделать волокна пр дением из различных материалов, пригодных для культивирования клеток, как биоразлагаемые и не биоразлагаемые, например; поликапролактон (ПКЛ) 27, поли-L-лактида кислота (ПЛМК) 28, поли (молочной-гликолевой кислоты) (PLGA) 29, полисульфон (PSU) 12 и полиэфирэфиркетона (PEEK) 13. Каждый из них имеет разные свойства аго следует выбирать исходя из потребностей системы. Проверьте совместимость используемого волокна с этанолом, используемого на стадии стерилизации. ПЛГА известно пластификации с этанолом что требует альтернативного лечения , таких как антибиотик / противогрибковым раствором 25.
Были выбраны размеры стеклянных модулей, используемых здесь, исходя из потребностей текущего исследования. Различные размеры могут быть сделаны любым авторитетными стеклодувные компании. Рассмотрение размера модуля является количество ячеек, которая связана с количеством волокон в модуле и вероятных скоростей потока. Чем больше клеток существуют в модуле тем выше скорость потока будет необходимо для того, чтобы поддерживать благоприятные условия культивирования на выходном конце биореактора. Это позволит достичь предела в какой-то момент и некоторые проб и ошибок может потребоваться с мониторингом условий СМИ в модуле пермеата. Математическое моделирование может обеспечить некоторое представление необходимых модулей Дименаsions и скорости 22 потока.
Размеры устройства, используемого здесь предназначен для установки на полке инкубатора. Длина трубки продиктована длины, необходимой для достижения между разъемами в то же время позволяя достаточное перемещение компонентов для обеспечения установки и эксплуатации. Если требуется время отбора проб, конечно, например, в мониторинге условий медиа в модуле пронизывают затем инжекционные отверстия могут быть добавлены к ретентата и пермеата линии, чтобы облегчить это.
Предпосылкой для любой системы клеточной культуры, чтобы сохранить клетки живыми и в большинстве случаев растет. В свете исследований , демонстрирующих более в естественных условиях -like фенотипа в клетках , выращенных в системах 3D культуры также представляется важным , чтобы обеспечить среду , которая точно имитирует окружающую среду в естественных условиях , с которыми сталкиваются клетки. Этот последний пункт часто пренебрегают в клеточной культуре 2D в пользу удобства эта система предлагает культура. Tон HFB мимику в естественных условиях капиллярных сетях, предоставляя питательные вещества к клеткам через просвет волокон. Эти отходы также удаляются из системы динамического потока. Это создает естественных условиях -like системы в культуре клеток для и тот , который точно имитирует среду в естественных условиях , увиденные гепатоцитов, что делает эту систему более широкий выбор по сравнению с 2D тканевой культуры пластика для культивирования этих клеток. Это подтверждается тем фактом, что клетки секретируют 15-кратное количество альбумина, важную функцию печени, в системе культуры HFB по сравнению с теми, выращенных на 2D тканевой культуры пластика.
В то время как система HFB подходит для большинства , если не всех якорных зависимых типов клеток, пример здесь для гепатоцитов , потому что есть реальная потребность , чтобы быть в состоянии функциональной культуры, более в естественных условиях -like гепатоцитов для использования в разработке лекарственных средств в фармацевтической промышленности и в биоискусственных устройствах печени для экстракорпоральной поддержкибольных печеночной недостаточности. Потребность в более функциональных клеток выходит за пределы этих примеров, в частности в области регенеративной медицины входит в фазу поступательной работы. Преимущества более естественных условиях -like культурной среды в не следует упускать из виду.
Раскрытие информации
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Благодарности
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
Материалы
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
Ссылки
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены