Method Article
에 대한 중공의 생물 반응
요약
배양 세포의 기능적 문제는 3 차원 배양 환경 16-21 -like 생체 내에서 배양함으로써 더욱 향상시킬 수있다. 이 논문은 생체 -like 포유 동물 조직 배양 용 중공 바이오 리액터 시스템의 셋업 및 동작을 설명한다.
초록
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
서문
조직 배양은 100 년 이상 1,2- 이용 된 세포의 성장 및 / 또는 유지 보수를 위해 확립 된 기술이다. 연구 세포 반응 생체 편리 멀리 달리 불가능하지는 않지만 매우 어려울 것이다 실험을 허용 장점 도달했다 예컨대 유전자 조작 된 세포주의 생성 및 고 처리량 스크리닝 분석법 3 리포터 세포의 용도. 보다 최근에는 조직 배양은 시험관 모델의 생성과 재생 의학, 조직 공학 분야에 상승을 부여하고있다. 이러한 애플리케이션으로 동적 인 3 차원 (3D) 배양 시스템에 대한 관심이 크게 증가하고있다.
(3 차원 배양 용 기재 및 / 또는 방향 동적 흐름의 도입으로 여기에 정의) 3D 배양 방법 나은을 달성하기위한 중요한 생체 셀룰러 환경의 아키텍처를 요점을 되풀이더 많은 생리 같은 기능. 병 및 손상된 조직을 복구의 목적으로 이식 세포를 추출, 성장, 차별화 할 수있는 능력은 환자의 이익과 상업 기회를위한 거대한 잠재력을 가지고 연구하는 분야이다. 예를 들어자가 화상 치료 각화 세포 (4) 및 뇌졸중의 치료를위한 세포 기반 치료법의 사용의 사용 (도 5 참조). 마찬가지로, 시험 관내 모델에 대한 시장은 층화 의학 애플리케이션 약물 발견에 걸쳐있다. 조직 배양에서 협약 조직 배양 플라스크의 2 차원 (2D)의 표면에 부착 또는 고정 의존성 세포 유형의 성장이다. 현재 연구 속에서 금을 표준으로 인정하는 동안, 조직 공학 분야에서 최근의 관심은 현재 차원 조직 배양 환경이 전지 생산 6 필요한 스케일 업 부적절하다는 점을 강조하고있다.
자기편 세포 유형 scaffol에 대한(D)는 화학 성분과 기계적 성질 모두의 관점에서, 최종 용도에 따라 달라질 수있는 요구된다. 일부 시스템은 높은 내부 상 에멀젼 템플릿으로부터 형성된 다공성 매트릭스로 구성된 웰 플레이트 인서트 (7) 또는 종래의 2 차원 배양 기술에서 최소의 적응을 필요로하는 전기 방사 섬유 (8 참조) 지지체를 이용한다. 세포는 다양한 조성의 마이크로 담체에 접종 및 영양분과 신호 분자를 제공 교반 탱크에서 성장하고, 동적 잘 혼합 환경 (9)를 통해 폐기물 (대중 교통)을 멀리 운반 할 수 있습니다. 그러나, 이러한 시스템들은 생체 -like 환경에 제한이 더욱 향상 스케일 업하는 비용과 관련 될 수있다. 중공 섬유 생물 반응기 (HFBs)는 일반적으로 섬유 루멘을 통해 전달되는 다공질 섬유 및 미디어의 외측에 시드 셀 모듈에 고정 된 섬유로 구성되어 3 차원 배양 시스템 (1 검토0) (그림 1). HFBs는 섬유 원한다면 정의 전단 측면 포트를 통해 유체 유동을 통해 셀에 적용 할 수 있지만, 모세 혈관을 모방 동적 미디어 전달과 관련된 전단 응력에서 세포 차폐와 생체 -like 환경을 제공한다. 이 높은 세포 밀도가 11에 도달 할 수있는 우수한 대량 수송과 다양한 문화 시스템을 만듭니다. HFB 시스템은 고정 의존성 세포 유형의 유지에 적합하고 배양 랑게르한스 12 마우스 β-TC-3 인슐린 종 세포주 12 차 인간 간세포 13 자가골의 쥐 췌장 포함한 다양한 세포 사용 된 골수 단핵 세포는 14 Madin 다비 개 신장 세포 (MDCK) 15 카코 2 셀 (16)는 몇 이름을 지정합니다.
물질 전달 및 스케일 업 시스템의 이점에 더하여, 셀은 3 차원 TIS 재배고소 문화 시스템은 실험 단서에 형태와 생체 -like보다 더 반응 경향이있다. 예를 들어 2 차원 배양 (17)에 성장 세포에 비해 시판 폴리스티렌 골격에서 배양 할 때 차 간세포 해열 독성에 더 입방 형태 증가 가능성 시토크롬-P450 효소 활성의 큰 유도 및 감도 증가를 보여 쥐. 간암 세포주 인 HepG2 또한 알부민 생산 (18)을 증가시키고 2D 배양 된 세포 (19)에 비해 메토트렉세이트에 반응 -like 생체 내에서 더 많은 것을 보여주기 위해 표시되었습니다 같은 지지체를 사용하여. 차 인간 간세포가 지연 탈분화, 높은 사이토 크롬 P450-활동을 입증하고 관류 문화 시스템 (20)에서 테스트 4/5 화합물에 대한 허가를 증가했다. 인간 신경 줄기 세포 시판되는 폴리스티렌 지지체에서 배양 유래 신경 세포와 교세포가 높은 (활동 전위)과 낮은 freque을 모두 전시ncy (로컬 필드 전위) 더 신경 활성 반면 자발적인 활동은 2 차원 배양 된 세포 (21)에서 검출되었다. 카코이 세포는 증가 알칼리 포스 파타 아제, γ-glutamyltransferase 및 P-당 단백질 활성 및 단백질 16 F - 굴지 및 조나-1 occludens의 높은 발현에 의해 측정 2D 문화에 비해 HFB에 강화 된 차별화를 보여 주었다. 3D 세포 배양을 인용 서적의 수는 지난 10 년 (8 배 증가 성장 하였지만 장점에도 불구하고, 2 차원 조직 배양 플라스크면 이외의 시스템에서의 셀의 루틴 배양 여전히 많은 실험실에서 실시되지 않는다. 소스 '3D 문화')와 프로브 도구 PubMed의 '연도 별 결과'.
이 논문은 포유 동물 세포 배양 용 HFB 시스템의 설치 및 작동 조건을 설명하고, 간암 세포주 인 HepG2 / C3A 배양에서의 유틸리티를 보여준다. 이 방법의 목적은 배양의 세포 인충분히 단순 유지보다 생체 -like 문화 시스템은 3D 문화 시스템을 처음 사용하는 사람들에게이 의무 확인합니다. 애플리케이션에 HFBs을 사용 뒤에 근거 간 모델의 예측은 HFB 환경 (22) 내에서 사인 곡선 간을 모방 이론적으로 가능하다는 것이다 개선되는, 여기에서 설명한다. 이것은 다른 문화 시스템과 현재 가능하지 않습니다.
프로토콜
1. 섬유
- 캐스팅 위상 반전 스핀에 의한 섬유 (회전)을 생산하고 있습니다. 이 방법의 세부 사항은 23, 24에서 찾을 수 있습니다.
주 :이 작업을 위해 섬유는 비 생분해 성 중합체를 사용 특허 자체 제조 한, NMP 용매 및 비 - 용매로서 H 2 O 등. 다른 적절한 폴리머의 세부 사항은 논의에서 찾을 수 있습니다. 여기에 설명 된 시스템에 사용되는 섬유는 600-700 μm의 내강 직경 1.05mm의 외경이다. 섬유는 (평균 ± 표준 편차) 기공 직경 μm의 ± 1.5 μm의 2.28를 측정 다공성이다. 이것은 다른 조직의 간 사인 곡선 또는 혈관을 복제, 섬유 루멘의 용지 공급에서 세포를 분리하도록 설계되었습니다. 섬유는 또한 폴과 같은 막 공급 업체에서 구입하실 수 있습니다.
2. 모듈 제작
참고 : 본 연구에 사용되는 모듈 (2) 측 포트에 1mm 두께의 붕규산 유리로 만들어진다(도 2A). 여기에 설명 된 모듈의 섬유는 6- 웰 플레이트의 웰의 절반 정도의 동등한 4.95 cm (2)의 외부 표면 영역을 갖는다.
- Sigmacote (표 1)과 내부 표면을 코팅하고 흄 후드에서 건조 할 수 있도록하여 처음 사용하기 전에 Siliconize 모듈. 오토 클레이브 (121 ℃, 1 기압, 20 분) 처리의 수명을 늘릴 수있다.
- 75mm 길이의 섬유를 메스를 잘라 사용하여 각각의 끝 (그림 3A)에서 ~ 7mm를 초과하는 길이를 떠나 각 모듈에 세 개의 섬유를 삽입합니다.
- 장소 ~ 계량 보트에 실리콘 접착제 (표 1)의 0.5 ml의. 섬유는 3-5 밀리미터 플러그 (도 3b)을 형성하기 위해 주위의 실리콘 소량 픽업 모듈의 단부에 접착제를 작동하도록 P200 피펫 팁을 사용한다. > 3 시간 동안 건조하도록 허용합니다.
- 메스를 사용하여 유리 모듈 단부 (도 3c)와 실리콘 플러시 잘랐다.
- 랩폴리 테트라 플루오로 에틸렌 (PTFE) 소량 (~ 4 층) 일측 포트 주위 테이프.
3. 시스템 설정 및 살균
참고 : 섬유와 펌프 호스 및 모듈은 멸균되지 않으며, 70 % 에탄올을 사용하여 살균된다. 저자는 펌프는 펌프 튜브가 사용되는 캘리브레이션 추천한다. 다음 절차는 층류 후드에서 수행된다.
- 오토 클레이브 (2.1 등) 모든 오토 클레이브 구성 요소는 사전 설정을합니다.
- 설정
- , Q 시리즈 캡, 공급 튜브, 펌프 및 펌프 호스 (표 1) 그림 4와 저장 병 및 설정 저장 병에 10 ml의 70 % 에탄올을 넣습니다.
- 느슨하게 PTFE-테이프 측 포트를 통해 엔드 캡을 배치합니다. 모듈 끝 무료 측 포트를 통해 L / S16 모듈 커넥터의 끝을 밀어 넣습니다. 도 2b에서와 같이 캡핑 측 포트 가까운 모듈 커넥터 L / S13 튜빙 (표 1)의 40mm 부분을 연결 룽.
- 캡핑 된 사이드 포트가 펌프에 가장 가까운 그래서 모듈을 찾으시는 보장, 펌프 호스에 모듈을 연결합니다.
- 모듈 커넥터와 L / 저장 병의 Y 커넥터의 S14 (표 1)에 투과 라인과 잔류 라인을 연결합니다. 셋업은 그림 4의 회로도 유사 있는지 확인합니다.
- 살균
- > 30 분간 unautoclaved 성분을 치료하기에 충분한 시간 동안 800 μL / 시간 (섬유 당 267 μL / HR)의 모듈을 통해 에탄올 펌프 (다른 살균 방법이 사용되는 경우 시간을 조정하고 25 참조).
- 빨래
- 첫째, 시스템에서 에탄올 세척 펌프를 끄고 튜브를 배출합니다. 첫째, 모듈 어댑터 튜브에서 펌프 호스를 분리합니다. 다시 저장 병으로, 섬유 및 잔류 라인에서 에탄올을 배출 위에 모듈을 잡습니다. 제 배수하는 모듈에서 측 포트 단부 캡을 제거모듈 자체와 투과 라인으로부터 전자 에탄올. 측면 포트 엔드 캡을 다시 연결합니다. 펌프 호스 에탄올 급전선 드레인 펌프 용지의 역류. 펌프의 전원을 끄고 모듈 어댑터 펌프 호스를 다시 연결합니다.
- 뚜껑에서 에탄올 병을 풀고 혈청없이 (예 : EMEM, GMEM, DMEM 또는 RPMI 등) 세포 성장 배지 10 ㎖를 포함하는 병으로 교체합니다. 800 μL의 시스템을 통해 매체를 펌프 / 시간은 잔류 줄 때까지 미디어 가득합니다. 모듈을 씻어 섬유를 통해 미디어의 침투를 강제로 잔류 라인을 클램프. ~ 2 시간 동안 씻으십시오.
4. 시드
참고 : 미디어 원하는 세포 유형에 대해 설정되는 것이어야이 프로토콜에 사용되는 보충. 문헌을 참조하시기 바랍니다, 자세한 내용은 셀 문화의 유럽 컬렉션 (ECACC)과 미국의 타입 컬쳐 컬렉션 (ATCC). 이전에이 방법 세포가 있어야합니다에 터 유지 보수이네 원하는 세포 유형의 설정 프로토콜에 따라. 이 작품의 경우 간암 세포주 인 HepG2 / C3A의 서브 클론은 유통 권고 (ATCC)에 따라 유지 하였다.
주 : 또한, 아래에 제시된 시드 프로토콜은 세포 성장에 앞서 세포 배양 배지와 배양 모듈에게 사전 작용한다. 더 광범위한 예비 배양 후 요구되어야 이것은 시스템에서 세척 매체를 배출 성장 배지로 교체하고 몇 시간 동안 모듈을 통해 투과하여 모듈의 시딩 이전에 수행되어야한다. 시스템에 미디어를 교체에 대한 자세한 내용은 섹션 7.5.2.1을 참조하십시오.
- 목적하는 세포 유형에 대해 설정 프로토콜에 따라 트립신 처리하여 단일 세포 현탁액을 준비한다. 다음과 같이 T75 문화에 대한 일반적인 프로토콜입니다 :
참고 : 세포의 수는 원하는 세포 유형에 대한 경험적으로 결정해야한다 시드 단계에서 사용합니다. 여기에 설명 된 생물 반응기는 35 배 더 높은 CEL에 씨앗을 품고있다7 일간 배양 차원 조직 배양 플라스틱에 사용되는 것보다 LS 밀도 (세포 / cm 2).- 10 ㎖의 인산염 완충 식염수 (PBS), 흡을 첨가하여 세포를 세척 한 후 3 ㎖의 0.05 % 트립신 에틸렌 디아민 테트라 아세트산 (EDTA)를 추가 (충분한 셀을 커버하기 위해) 5 분 동안 37 ℃, 5 % CO 2에서 배양한다.
- 7 ml의 성장 배지에서 수확 된 세포는 트립신을 중화하고, 10 % 소 태아 혈청 (FBS)으로 보충. 잘 혼합 혈구의 챔버에 10 μl를 추가하고 세포를 계산합니다.
- 세포 펠렛 5 분 동안 200 XG에 원심 분리기.
- 목적하는 세포 유형에 필요로 보충 된 성장 배지에서 4 × 6 / ㎖에 재현 탁하고 세포 상등액을 흡인.
- 펌프를 끄고 3.4.1에서와 같이 공급 튜브와 모듈을 배출.
- 자유 한쪽 포트를 떠나는 모듈 커넥터로부터 모듈을 분리하고 70 % 에탄올에 미리 멸균 모듈 엔드 캡 (표 1)에 부착.
- 섬유를 손상 기포 형성을 피하기 위해주의를 복용하지 18 G 바늘을 1 mL의 주사기를 이용하여 모듈의 세포 현탁액 (2 × 106 세포) (4.1.4)의 ~ 500 μl를 옮긴다.
- 단부 캡을 사용하여 측면 포트 모자. 180 매 5 분으로 모듈을 수동으로 회전 2-4 시간 동안 37 ℃로, 5 % CO 2에서 세포를 인큐베이션. 대안 모듈 간헐적 혼합 설정 (표 1)과 함께 회전 튜브에 부착 될 수있다.
- 접종 후, 70 % 에탄올에 미리 멸균 주입구 (표 1)에 단부 캡을 부착하고, PTFE-녹화 측 포트에이를 첨부. 다른 쪽 포트 단부 캡을 제거하고 천천히 27 G 바늘을 1 mL의 주사기를 사용하여 부착 주입구로 공기를 주입하여 세포를 소모.
- 엔드 캡으로 주입구를 교체합니다. 천천히 무료 측 포트와 1 ML의 주사기와 18 G 바늘을 사용하여 미디어와 모듈을 작성하십시오. 레모모듈 단부 캡 적이 상기 모듈 커넥터를 사용하여 튜브에 모듈을 부착.
- 7.5.2.1에 설명 된 절차에 따라 50 ㎖ 성장 미디어와 보충제를 포함하는 하나와 세탁 미디어 병을 교체합니다. 800 μL / 시간에 시스템을 통해 성장 배지 펌프.
5. 확산
주 : 여기에서 설명한 조사 시스템에 사용되는 섬유는 800 μL / 시간의 공급 속도로 80 μL / 시간 ~로 투과하도록 설정되어있다.
- 37 ° C, 5 % CO 2로 설정 가습 인큐베이터에서 최대 7 일의 기간 동안 세포를 성장 섬유를 사용합니다.
참고 : 성장 단계에서 영양분과 대사 산물의 모니터링 확산에 대한 유용한 정보, 대사 흡수 미디어의 세포와 영양 및 대사 산물 수준의 출력을 제공 할 수 있습니다. 예를 들어 사용 및 젖산 생산을 포도당. 키트 미디어에서 이러한 요소를 정량 할 수있는 다양한 공급 업체에서 사용할 수 있습니다 (참조 표 본 연구에 사용 된 1). 주입구는 투과하고 잔류 배관 및 27 G 바늘과 주사기를 통해 샘플링 된 배지에 첨가 할 수 있고, 미디어는 미디어 저장 병에서 샘플링 될 수있다. 이것은 입력과 두 출력 스트림에 대한 영양 및 대사 정보를 제공합니다. 샘플링은 층류 후드에서 수행되어야한다. > 30 초 동안 포트에 대한 에탄올 젖은 파란색 롤을 개최하여 샘플링하기 전에 주입 포트를 소독.
6. 절제술
주 : 섬유 분석 실험 끝에 모듈로부터 절단 될 수있다.
- 분리 및 HFB 드레인.
- 유리와 실리콘 사이의 메스 / 마이크로 칼 (표 1) 블레이드를 삽입합니다. 유리의 실리콘을 절단 할 수 있도록 모듈을 돌립니다. 모듈의 양쪽 끝이 절차를 반복합니다.
- 한쪽 끝에서 실리콘 플러그를 후크 부드럽게 당겨 블레이드를 사용. 섬유가 함께 있는지 확인합니다.
- 세포 수
주 : 성장률 대략이 기간에 얻어지는 세포 밀도에 걸쳐 변경되지 않는 한 7 일간 성장주기 내의 임의의 시점이 계산에서 사용하기에 적합한 본 연구에 사용 된 C3A 세포.- 절제 (6 절) 후 세척 및 0.5 ml의 트리스 EDTA (TE) 버퍼를 포함하는 1.5 ML 튜브로 잘라 PBS로 섬유를 찍어. A의 두 동결 해동 사이클이 대상이 -80 C의 냉동고 °. PicoGreen을 사용하여 DNA 함량을 측정하여 원하는 세포 유형 (26)으로 만들어진 표준 곡선이 값을 비교하여 세포 수를 결정한다.
- 세포 증식 속도
- 서로 다른 두 시점에서 계산하는 계산 된 셀 수를 사용하는 비 성장 속도 μ (식 1) (LN) (X1)가 제 1 시점과 LN (X2)의 세포 수의 자연 로그이고 세포의 자연 로그 인 제 시점 번호.
μ = (LN (X2) -ln (X1)) / 시간 (시간) (1)
이것에서 μ는 비 성장 속도 인 집단 배가 시간 (DT) (식 2)를 계산한다.
DT = LN2 / μ (2)
- 서로 다른 두 시점에서 계산하는 계산 된 셀 수를 사용하는 비 성장 속도 μ (식 1) (LN) (X1)가 제 1 시점과 LN (X2)의 세포 수의 자연 로그이고 세포의 자연 로그 인 제 시점 번호.
- 세포 생존
- 절제 (6 절) 후 세척 500 ㎕를 0.05 % 트립신 에틸렌 디아민 테트라 아세트산 (EDTA)를 포함하는 1.5 ML 튜브로 잘라 PBS로 섬유를 찍어. 10 분 동안 37 ℃에서 인큐베이션.
- 믹스 10 μL 트리 판 블루로 세포 현탁액의 10 μl를 추가합니다. 로드 10 μl의 혈구 위에 죽은 (파란색)과 살아있는 세포의 수를 계산합니다.
- 영상
- 절단 후 씻어 24 웰 플레이트에 작은 길이로 잘라 가위를 사용하여 PBS로 섬유를 찍어. (PBS)에 400 ㎕를 4 % 파라 포름 알데히드를 추가하고 20 분 동안 실온에서 품어.
- μL 및 오프 (400)을 피펫 팅하여 PBS로 세척. 반복 생신선한 PBS와의 단계.
- 약에 PBS에 희석 400 μL 4 ', 6-diamidino-2-페닐 인돌 (DAPI)를 추가합니다. 100 NG / ㎖, 20 분 동안 RT에서 배양한다. 빛으로부터 보호합니다.
- (7.3.2로) 두 번 PBS로 세척 한 번 H 2 O와 건조 시료 전에 데이터를 수집하기 위해 즉시 섬유와 이미지를 포함하는 형광 장착 매체를 추가 (DAPI의 예 / EM, 461분의 359 ㎚).
- 다른 초점 비행기에서 이미지를 가지고 '스태킹 초점'소프트웨어를 사용 (예를 들어, 아래 ImageJ에 대한 스택 포커서 플러그인) 필드의 크게 확장 된 깊이를 보여주는 합성 이미지를 만들 수 있습니다. 섬유는 평평하지이기 때문에이 필요합니다.
- 다운로드 ImageJ에 (http://imageJ.nih.gov/ij/)과 '스택-포커서를'플러그인 (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- ImageJ에에서 이미지가 누적 될 엽니 다. 그런 다음 '이미지'메뉴에서 '스택'로 이동 - '이미지는 스택에'. '플러그인'메뉴에서 스택 포커서 '로 이동'. NXN의 커널에 n을 지정합니다. 'N'으로 시행 착오가 작은 '잡음'에 의한 이미지를 생성하기 위해 요구 될 수있다. 11 & 77 사이의 값은 잘 작동하는 경향이있다.
- 알부민 분비
주 :이 간세포 세포 기능 시험 아닌 세포 기능의 일반적인 시험이다.- 종자 세포 10667 / cm 2에서 2 차원 조직 배양 플라스틱 상 (인 HepG2 / C3A), 6 일 동안 성장. 4 절에 설명 된 6 일 동안 성장 씨앗 HFBs.
- 이 증식 기간 배양 배지 (EMEM + 10 % FBS, 1X 글루타민 및 1X 페니실린 / 스트렙토 마이신)에 24 시간 동안 1X 글루타민 및 1X 페니실린 / 스트렙토 마이신이 보충 된 무 혈청 윌리엄스 E 배지에 조직 배양 플라스틱 HFB 대한 변경 다음 :
- 3.4.1에 규정 된 단계에 따라 튜브 및 HFB 모듈을 배출합니다. 저수지 병을 풀고 윌리엄스 E 미디어를 포함하는 병이 교체합니다. 8에서 HFB 통해 펌프00 μL / 시간.
- 24 시간 이후, 미디어 샘플을 채취. 제조업체의 지침 (표 1)에 따라 ELISA에 의해 분비 된 알부민을 정량화. 표준 곡선의 범위 내에 알부민 농도를 가지고하기 위해 사용하기 전에 10 내지 40에서 1 미디어 샘플 1 희석.
7. 세포 분석
결과
셀 시드 중요한 단계입니다. 차원 설정의 섬유에 부착 세포의 능력은 2D 조직 배양 플라스틱에 대해 알보다 상당히 작다. 이는 셀과 기판 사이의 접촉 시간을 감소 쉽다. HFB의 셀은 시드의 정적 위상 동안 모듈을 통하여 떨어진다. 이러한 차원에서 사용되는 하나의 연속 된 정적 위상에 비해 시간이 상당히 짧다. 세포는이 시간에 기판에 연결을해야합니다. 또한, 인해 섬유의 굴곡 특성으로 세포가 휴식과 2D 문화에서이 같은 연결을위한 더 평평한 표면이 없습니다. 이것은 섬유의 화학적 성질에 의해 배합 될 수있다 동안, 우리는이 연구에서 사용 된 중합체의 경우는 아니 알고 사용 (데이터는 보이지 않음). 파종시 및 세포 접종 밀도를 증가시키는 것은 더 빠른 (R)의 정적 위상 동안 모듈을 통해 낙하 세포 응집체의 형성을 유도하나의 세포보다 먹고 더 셀과 기판 사이의 접촉 시간을 줄일 수 있습니다. 세포 고밀도이 단계없이 매체 교환이 있기 때문에 시간을 늘리면 미디어 황변 리드. 15 % ~ 제 4 셀 시드 요금에 기술 된 조건을 사용하는 것은 지속적 인 HepG2 / C3A 세포 (그림 5A)로 달성된다. ;이 낮은 부분 고려 될 수있다 동안 일 (도 5B, 6)의 문제에 잘 인구 섬유를 생성하기에 충분한 세포가 칠일 증식 기간 HFB 도달 세포 밀도는 3 × 5 / cm 2 접근에 따라. 이것은 많은 분석법을 이용한 간세포와 합류에 도달 한 것으로 간주 될 수있는 적절한 밀도이다.
2D 세포 배양 물 (도 5c)에서 달성 것과 비교할 때 HFB 달성 증식 속도가 느리다. 이 취소됩니다이 : 미디어의 세포 수는 (3674 전체 세포의 4 %입니다 합류에 24 시간 당 세포, ± 20,343 세포 SEM ± 평균) 낮은로 인해 시스템의 동적 흐름 세포의 손실 될 가능성이 투과 속도를 400 μL / 시간까지 설정 될 때 증가하지 않는다 (데이터는 보이지 않음). 이 때문에 생존 능력의 감소 및 세포의 후속 손실 (아래 그림 5D와 참조) 또한 수 없을 수도 있습니다. 이 사실이 세포주 클론 적 HepG2 세포 유래의 세포 증식 억제 연락을 표시하는 기능에 의해 선택된 적어도 부분적으로 설명 될 수있다. HFB에서 세포 증식 6X에서 느린 속도로 발생할 수있는 2D 셀 밀도를 시딩 하였다.
생존은> 90 %을 나타내는 세포와 HFB에 걸쳐 높은 남아있다. 입구에 비해 출구 단부에서 생존에 약간의 감소가있는 반면,이 상당한 (t 테스트 P 것으로 발견되지 않았다 = 0.22).
글루코스 소비와 락트산 생산의 모니터링 시스템 조정의 용지 공급량 및 미디어 볼륨 사용되고있다. 800 μL / 시간 및 글루코스 및 젖산 수준 아래 (각각) 이상으로 유지되고, 50 ml의 총 부피 미디어 표준 조직 배양 플라스틱 배양 볼들을 사용.
알부민 분비 간세포에 의해 수행 키 간 기능이다. 그것은이 전송 및 항상성에서 여러 역할을 혈청으로 분비된다. HFB에서 자란 세포에 의한 알부민 분비는 2D에 성장 세포 (그림 7)에서보다 높은 15 배이다. 이것은 세포가 기능적 HFB 적어도 알부민 분비의 경우,이 함수는 HFB에서 상승되어 보여준다.
JPG "/>
그림 1. HFB의 생체 -like 환경을 제공합니다. 세포는 다공성 섬유의 외부에 씨앗을 품고있다. 미디어는 모세 혈관을 흉내 낸, 섬유 루멘을 통해 전달된다. (A) 섬유의 종단면 (일정한 축척에 따른 것은 아님). (B) 간은 3 섬유 반응기의 섹션. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2 HFB 모듈을 포함한다. (A) 본 연구에서 사용 된 모듈의 크기. 치수는 현재 연구 프로젝트의 요구를 세 섬유에 적합하고 이행하기 위해 선택되었다. 다른 크기는 제조 및 개별 시스템 및 섬유에 맞게 조정 할 수 있습니다. (B)이 m의 사진부착 된 엔드 캡 및 모듈 커넥터 듈 전 원 모 듈. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
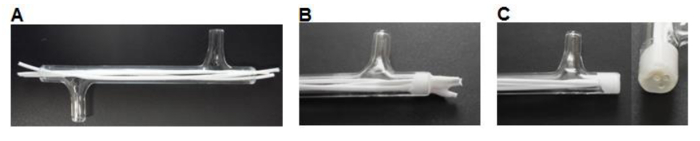
도 3은 모듈 제조. (A) 섬유의 크기로 절단하고 모듈에 삽입된다. (B) 섬유는 건조 허용 모듈에 접착된다. (C) 끝은 유리와 같은 높이가 절단된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
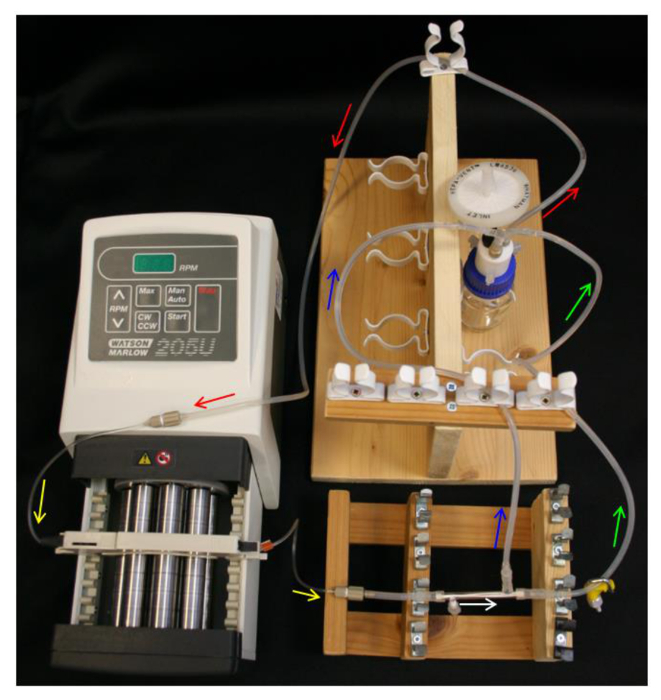
그림 4. HFB 시스템 설정. 화살표는 미디어 흐름의 방향을 나타냅니다. 빨간색 = 공급 튜브. 노란색 = 펌프 부엉있다. 화이트 = HFB 모듈. 클램프와 녹색 = 보유 튜브. 블루 = 튜브를 침투. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
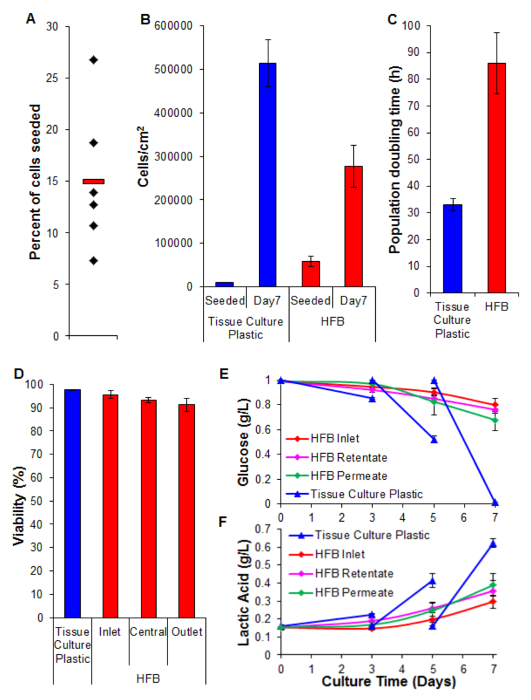
그림 5. 시드, 증식, 생존, 생화학 적 분석. 시드 세포의 (A) 비율. 블랙 다이아몬드는 개별 HFBs을 나타냅니다. 빨간색 막대는 평균이다. (B)에서 세포를 파종하고 7 일간 증식 기간 후에 밀도를. 2D 셀 번호는 트립신에 의해 혈구 계를 사용하여 계수를 측정 하였다. HFB 셀 번호는 PicoGreen 분석 C3A 및 셀 (26)에서 생성 된 표준 곡선을 사용하여 측정 하였다. N = 5-6. 바 = SEM. (C) 인구 회 배로. N = 5-7. 바 = SEM. (D) 생존은 트립에 의해 결정7 일간 증식 끝에 블루 배제. 입구는 중앙 및 출구는 HFB 내에서 영역을 나타냅니다. N = 3-5. 바 = SEM. (E 및 F) 포도당 소모와 락트산 생산. 레벨이 저장 병 (입구)뿐만 아니라 잔류 물에서 모니터와 콘센트를 침투 및 조직 배양 플라스틱에 일상적인 문화 compered했다 (미디어는 3 일 및 5에서 변경). N = 3-5. 바 = SEM은. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
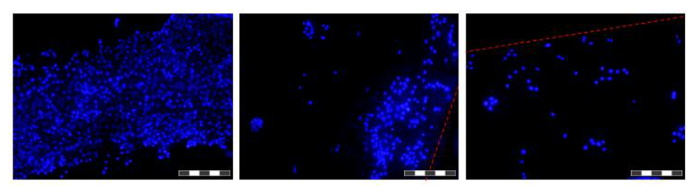
그림 6. HFB에서 섬유에 성장 세포의 이미지. 세포는 PBS와 DAPI로 염색 핵 세척, 4 % 파라 포름 알데히드에 고정, PBS 세척, 시드와 섬유가 적출되기 전에 48 시간 동안 성장했다. 각각의 이미지 (12)의 복합체 IMA '누적 기준'인순서 GES 결과 이미지의 필드의 깊이를 증가 시키는데. 높고 낮은 세포 밀도의 영역이 시점에서 섬유를 따라 발견과 같다. 어디에서 본 섬유의 경계는 빨간색 점선으로 표시된다. 이미지는 거꾸로 형광 현미경 촬영했다. 이미지 = 10X 목적. 바 = 200 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
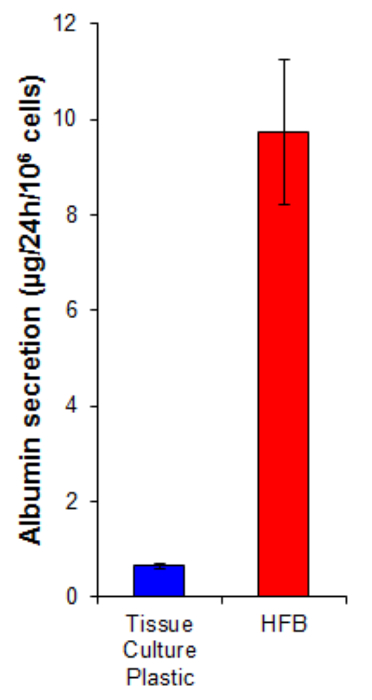
4. 세포를 6 일 동안 증식 된 섹션에 설명 된대로 그림 7. 알부민 분비. 세포는 10,667 / cm 2에서와 HFB에서 조직 배양 플라스틱에 접종 하였다. 이 확산 기간 후 조직 배양 플라스틱 및 HFB 문화 미디어 글루타민 및 페니실린 / streptomyci 보충 혈청 무료 윌리엄스 E 미디어에 대한 변경되었습니다24 시간 동안 N. 미디어 샘플이 취해진하고 알부민은 지침 (표 1) 제조에있어서 ELISA에 의해 정량화. N = 5-6. 바 = SEM은. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 섹션 | 장비의 이름 | 회사 | 고양이. 아니. | 노트 | 이미지 |
| 이 | 유리 HFB 모듈 | Soham 과학 | --- | 사용자 지정 항목. | |
| 2.1 | Sigmacote® | 알드리치 | SL2 | ||
| 2.3 | Silicoset (151) | Intertronics | ACCSS151 | Silic한 접착제. | |
| 2.5 | PTFE 테이프 | 알드리치 | Z104388 | ||
| 3.2.1 | 저수지 병 | 어부 | 11972619 | ||
| Q 시리즈 캡 | 운동성 | 00932Q-3V | PTFE 어댑터 및 피팅 너트의 나사산. 질문 시리즈 캡에 부착합니다. 1 밀리 어댑터에서 공급 PTFE 튜브의 8.5 cm 섹션과 3mm 어댑터에서 4 cm 섹션을 연결합니다. |  | |
| 어댑터, 남성 1.0 mm의 ID | 운동성 | 008NB10-KD5L | |||
| 어댑터, 남성, 3.0 mm의 ID | 운동성 | 008NB30-KD5L | |||
| 피팅 너트 | 운동성 | U-350 | |||
| 네오프렌 튜브 | 어부 | 10366344 | 네오프렌 튜브의 6cm에 헤파 필터를 장착하고 '피팅 너트'이 연결합니다. 은 Y 커넥터의 상단이 미늘과 바닥에 L / S16 튜브의 3cm 부분을 L / S14 튜브의 2 배 30mm 섹션을 연결합니다. 3 밀리미터 ID 어댑터의 미늘이 연결합니다. (3.2.1) |  | |
| HEPA-벤트 | 어부 | 11374634 | |||
| Y 커넥터, 가시 | 콜 파머 | OU-06295-10 | |||
| L / S16 실리콘 튜브 | 콜 파머 | OU-96410-16 | |||
| L / S14 실리콘 튜브 | 콜 파머 | WZ-96410-14 | |||
| L / S13 실리콘 튜브 | 콜 파머 | OU-96410-13 | 80cm 펌프 욕조에 Q 시리즈 캡에 1.0 mm 가시 어댑터를 연결합니다 ING는 = 공급 튜브. | ||
| WM 205U / CA 펌프 | 어부 | 1248-6300 | |||
| WM 펌프 튜브, PVC, 블루, 오렌지, 0.25 mm 보어 | 어부 | 12416310 | PTFE 나사 남성 어댑터의 스레드 및 여성 어댑터를 연결합니다. 미늘 중 하나에 펌프 호스를 작업 할 수 있습니다. 튜브의 타단이 설정을 반복한다. (3.2.1) |  | |
| 어댑터, 남성 1.0 mm의 ID | 운동성 | 008NB10-KD5L | |||
| 어댑터, 여성, 1.0 mm의 ID | 운동성 | 008NB10-KD2L | |||
| 3.2.2 | 여성 루어 캡 | 콜 파머 | WZ-45508-64 | 사이드 포트 엔드 캡. | blefig4.jpg "/>  |
| L / S13 실리콘 튜브 | 콜 파머 | OU-96410-13 | 40mm 섹션은 모듈 커넥터에 펌프 호스를 연결합니다. | ||
| L / S16 실리콘 튜브 | 콜 파머 | OU-96410-16 | 배 L의 30mm / S16은 감속기 = 모듈 커넥터를 3 배 장착. (3.2.2 절) | ||
| 철 감속기 1/8 "X 1/16" | 콜 파머 | 30616-43 | |||
| 3.2.4 | L / S13 실리콘 튜브 | 콜 파머 | OU-96410-13 | 55cm 섹션은 L 질문 시리즈 캡의 Y-커넥터 / S14에 잔류를 연결합니다. |  |
| L / S13 실리콘 튜브 | 콜 파머 | OU-96410-(13) | 45cm 섹션은 L 질문 시리즈 캡의 Y-커넥터 / S14에 투과를 연결합니다. | ||
| 스트레이트 가시 노동 조합 | 콜 파머 | WZ-30612-43 | 은 Y 커넥터의 L / S14 연결합니다 L / S13의 끝에 연결합니다. | ||
| 3.4.2 | 집게 | VWR | 229-0609 | ||
| 4.3 | 4mm 실리콘 호스 | 어부 | FB68858 | 튜브의 40mm 섹션을 통해 접어 케이블 타이 = 모듈 엔드 캡 고정합니다. (4.3 절) |  |
| 케이블 타이 | 어부 | 12326377 | |||
| 4.4 | MACSmix 튜브 회 | Miltenyi 사 생명 공학 | 130-090-753 | 적응은 ATTAC에 요구 될 수있다시간 모듈. | |
| 4.5 | Leur 주입구 | 엉겅퀴 과학 | IB-10820 | 주입 포트에 엔드 캡을 부착합니다. (4.5 절) | |
| 여성 루어 캡 | 콜 파머 | WZ-45508-64 | |||
| (5) | L 락트산 키트 | Megazyme | K-LATE | ||
| (5) | D 글루코스 키트 | Megazyme | K-GLUC | ||
| 6.2 | 메스 / 마이크로 칼 | InterFocus | 10315-12 | ||
| 7.4.3 | 알부민 ELISA | Bethyl 연구소 | E80-129 |
표 HFB 설정 1. 구성 요소. 각 구성 요소와 관련된 텍스트 부분은 열 1에 제시되어있다.
토론
이 논문은 포유 동물 세포 배양 용 중공 섬유 생물 반응기 (HFB) 시스템의 셋업 및 동작을 설명 및 유틸리티는 간세포 세포주 인 HepG2 / C3A 증식에서 입증된다. 이 시스템은 표준 보육과 셋업의 선반에 맞게 설계되어 무균 기술을 잘 알고있는 유능한 세포 생물 학자에 의해 수행 될 수있을만큼 간단하다.
여기에 설명 된 조사 시스템에 사용되는 섬유는 비 - 생분해 성 중합체를 사용 독점 (회전)을 주조 전상 스핀에 의해 집에서 제조된다. 예를 들어, 세포 배양 물에 적합한 두 생분해 성 및 비 생분해 성 재료의 다양한 방사하여 섬유를 만드는 것이 가능하다; 폴리 카프로 락톤 (PCL) 27, 폴리 -L- 락 티드 산 (PLLA) (28), 폴리 (락트산 - 코 - 글리콜 산) (PLGA) (29), 폴리 술폰 (PSU) 12 폴리 에테르 에테르 케톤 (PEEK) 13. 각각 다른 속성 A가 들어ND 시스템의 요구에 따라 선택되어야한다. 멸균 공정에 사용 된 에탄올로 사용될 섬유의 적합성을 확인한다. PLGA 에탄올 같은 항생제 / 항진균제 용액 (25)과 같은 대체 요법을 필요로 가소 화하는 것으로 알려져있다.
여기에 사용되는 유리 모듈의 크기는 현재 연구의 필요성에 기초하여 선택 하였다. 다른 크기는 임의의 평판 유리 부는 회사에 의해 제조 될 수있다. 모듈 크기를 고려 모듈의 섬유 가능성 유량의 개수에 연결된 셀들의 수이다. 더 많은 셀은 높은 유량 생물 반응기의 유출 단부에서 바람직한 배양 조건을 유지하기 위해서 필요한 것이다 모듈있다. 이 모듈 투과 미디어 조건의 모니터링 요구 될 수있는 몇 가지 포인트와 시행 착오 등의 한계에 도달 할 것이다. 수학적 모델링에 필요한 모듈 DIMEN에 몇 가지 통찰력을 제공 할 수있다sions 및 유속 22.
여기에 사용되는 장치의 치수를 인큐베이터 선반에 맞도록 설계된다. 튜브의 길이는 셋업 및 동작을 허용하도록 구성 충분한 이동을 허용하는 동안 커넥터 사이에 도달하는 데 필요한 길이에 의해 결정된다. 시간 경과 샘플링이 필요한 경우에는, 모듈의 미디어 환경을 모니터링, 예를 들어 다음 주입구 잔류 물에 첨가 될 수있는 투과 및이를 용이하게하기 위해 선을 투과.
모든 세포 배양 시스템을위한 필수 조건이 살아 있고 성장하는 대부분의 경우에 세포를 유지하는 것이다. 3 차원 배양 시스템에서 자란 세포 표현형 -like 생체 내에서 자세히 보여주는 연구에 비추어 또한 밀접 세포에 의해 발생하는 생체 내 환경을 모방 한 환경을 제공하기 위해 중요한 것 같다. 이 마지막 점은 종종 문화 시스템이 제공하는 편의 찬성 차원 세포 배양에서 무시됩니다. 티그 섬유의 루멘을 통해 세포에 영양분을 제공하여 생체 내 모세 혈관 망에서 모방 HFB. 노폐물은 동적 흐름에 의해 시스템으로부터 제거된다. 이는 이들 세포를 배양하기위한 차원 조직 배양 플라스틱에 비해이 시스템에게 더 나은 선택을하고, 세포 배양과 밀접하게 간세포 볼 생체 내 환경을 모방 한 대한 생체 -like 시스템을 만듭니다. 이는 세포가 분비하는 사실에 의해 뒷받침되는 15 배 차원 조직 배양 플라스틱에 성장 된 것과 비교하여 HFB 배양 계에서의 알부민의 양이 중요한 간 기능.
HFB 시스템은 대부분의 경우, 모든 고정 의존성 세포 유형에 적합 동안 제약 산업 기능 배양보다 생체 -like 신약 개발에 사용하기위한 간세포 할 수 있도록 실제 필요가 있기 때문에,이 예는 여기에서 간세포위한 및 체외 지원 bioartificial 간 장치에간 장애 환자. 기능적인 셀에 대한 필요성은 재생 의료 분야는 번역 작업 단계로 진입 특히, 이러한 실시 예를 넘어 연장된다. 보다 생체 -like 문화 환경의 장점은 간과해서는 안된다.
공개
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
감사의 말
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
자료
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
참고문헌
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유