A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מבוסס ELISA כריכה ותחרות שיטה במהירות לקבוע אינטראקציות ליגנד לרצפטור
In This Article
Summary
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
Abstract
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
Introduction
הבנה מקיפה של מסלולי איתות דורשת ידע מפורט על האינטראקציה ליגנד לרצפטור. רוב השיטות להערכת האינטראקציה של ליגנד מסוים עם קולטן המסוים שלה הם יקרים, זמן רב, עבודה אינטנסיביות דורשות ציוד ספציפי ומומחיות 1.
מאמר זה מתאר שני מהירים ואמין, נקודה אחר נקודת פרוטוקולים לחקור את אינטראקצית הקולטן ליגנד המבוססת על אנזים מקושר assay immunosorbent (ELISA): את assay האינטראקציה ליגנד לרצפטור הישירה (LRA) ואת LRA התחרות. ELISA היא טכניקה רגישה, מאוד ספציפית וזמינה, בשימוש שגרתי כמעט בכל מעבדה. ELISA יכול להתבצע ומותאם באופנה שונה. הפרוטוקולים שהוצגו ממוטבים עבור חקירת האינטראקציה בין אינטרפרונים למבדה שונים (INFLs) והקולטן שלהם.
לצבא LRA הישיר מאפשר quantificatiעל של קולטן ליגנד מחייב ביחס ריכוז ליגנד ובכך מניב עקום מחייב. באמצעות מודל מתאים האינטראקציה ליגנד לרצפטור, הנתונים ניתן לנתח עוד יותר להעריך את קבוע דיסוציאציה (K D).
בפרוטוקול שהוצג, משוואת היל הנפוצה מוחל מודל קולטן ליגנד מחייב. למרות שיטות אחרות כגון טכנולוגיית תהודת plasmon המשטח 2,3 לאפשר קביעת הזיקות המחייבות בין שני חלבונים, טכנולוגיה זו היא לעתים קרובות עבודה אינטנסיבית, יקרה, ודורשת ציוד מעבדה מיוחד.
לצבא LRA התחרות מאפשר הקרנת פפטידים מעכבים: קולטן ליגנד המחייב הוא לכימות ביחס ריכוז הפפטיד. זה מניב עקומת מנה-תגובה המתאר את ההשפעה המעכבת של הפפטיד. הנתונים ניתן לנתח עוד יותר להעריך את ריכוז מעכבות מקסימלי וחצי (IC 50 ) של הפפטיד החסימה.
שני פרוטוקולי ELISA קלים לשימוש וניתן להתאים למגוון רחב של שאלות מחקר. חלבונים רקומביננטי מכל סוג שהוא יכול לשמש באופן מהימן ומהיר לקבוע מהם חלקי אינטראקציה. בנוסף, LRA התחרות יכול לשמש כדי לקבוע אתרי אינטראקציה קריטיים של הליגנדים ואת הקולטנים באמצעות פפטידים חסימה, אשר נועדו לחקות או ליגנד או הקולטן. אם הפפטיד חסימת מראה עיכוב יעיל וספציפי, הפפטיד תופסת אתר אינטראקציה קריטי של ליגנד (אם הפפטיד מחקה הקולטן) או של ליגנד (אם הפפטיד מחקה ליגנד).
הפרוטוקול הראשון מתאר את נחישות ערך D K של INFLs השונה למקטע אלפא של הקולטן שלהם, כלומר, הקולטן interleukin-28 (IL28RA) באמצעות LRA הישיר. לאחר מכן, בפרוטוקול השני מראה כיצד לקבוע את היכולת של פפטיד ארוך חומצה 20 אמינולעכב את האינטראקציות INFL-IL28RA. הפפטיד נועד להתחרות עם IFNLs באתר מחייב הקולטן שלהם ובכך מאפשר הבנה מולקולרית של האינטראקציה. יתר על כן, פפטיד זה יכול לשמש כדי לחסום IL28RA בניסויים במבחנה כדי לקבוע את ההשפעה על במורד איתות אפקטים 4.
Protocol
1. הכנת מגיב
- כדי להכין חיץ ציפוי קרבונט, לפזר 0.36 g Na 2 CO 3 ו 0.84 גרם NaHCO 3 ב 100 מ"ל מים מזוקקים; סינון סטרילי למאגר באמצעות ואקום מונע 0.22 מיקרומטר polyethersulfone (PES) מסנן הממברנה ולאחסן ב RT עד השימוש.
- כן פתרון כביסה ידי הוספת 0.05% v / v Tween 20 בופר פוספט (PBS).
- הכן אלבומין 5% שור (BSA) (פתרון חסימה) בתמיסה PBS על ידי המסת 5 גרם BSA (≥98%) ב 100 מ"ל PBS ולאחסן ב 4 ° C..
- קולטן רקומביננטי, הליגנדים פפטידים חסימת
- Reconstitutethe למקטע אלפא קולטן interleukin אנושי רקומביננטי (IL28RA) ו ligands שלו מתויג רקומביננטי של האדם IFN (IFNL1-3) בהתאם להוראות וחנות של היצרן ב -80 מעלות צלזיוס. Synthetize חסימת פפטידים ומשומשים כפי שתואר לעיל 4. השתמש PBS להכין ריכוזים שונים של ליגנדים ופפטידים לשימוש המבחנים.
- כדי להכין את הנוגדן הראשוני, לדלל נוגדן חד שבטי עכבר 6x שלו ב- PBS עם 0.1% BSA ב 1: 1,000 דילול. כדי להכין את נוגדנים משני, לדלל peroxidase חזרת (HRP) מצומדות עז נגד העכבר IgG (H + L) ב- PBS עם 0.1% BSA ב 1: 10,000 דילול.
- כן פתרון TMB ידי ערבוב א ריאגנטים ו- B על פי הוראות היצרן.
- הכן להפסיק פתרון על ידי הוספת 5 N חומצה גופרתית (H 2 SO 4) במים מזוקקים חנות ב RT.
2. Enzyme-linked immunosorbent מבחנים (ELISAs)
הערה: האינטראקציה ליגנד לרצפטור ישירה ELISA (LRA ישירה, איור 1) ניתן להשתמש כדי למדוד את דיסוציאציה ליגנד לרצפטור קבוע (K D), כאמצעי של הזיקה מחייב ליגנד רצפטור. האינטראקציה ליגנד לרצפטור תחרות ELISA (LRA תחרות, איור 2) כלOWS הקרנת פפטידים (ותרכובות חסימה אחרות), אשר פועלים כדי להפריע את האינטראקציה בין ליגנד רצפטור. הפרוטוקול הבסיסי שפורסם בעבר 5 היה מותאם יותר.
הערה: בשני ELISA שיטות להשתמש פיפטה רבה להוספת פתרונות הבארות של צלחת 96-היטב בכל שלב. בשינה למזוג פתרון או צעדי כביסה, לזרוק פתרונות ישירות לתוך הכיור.
- ליגנד-קולטן אינטראקציה ישירה Assay (LRA ישיר)
הערה: לצורך המחשה של העבודה (ראה איור 1).- פלייט ציפוי עם קולטן רקומביננטי
- לדלל את הקולטן רקומביננטי חיץ קרבונט לריכוז סופי של 100 ng / μl. בארות מעיילות של צלחת microtitre 96-היטב עם ריכוז קולטני קבוע (100 ng / μl) על ידי pipetting 100 μl היטב כל באמצעות פיפטה רבה. אל תכלול קירות חיצוניים של הצלחת להימנע חפץ קצה היטב. מכסים את הצלחת עם מכסה דגירהצלחת ב 4 ° CO / N.
- חסימה והוספת הליגנדים
- למחרת, להסיר את פתרון הציפוי ידי הטיית הצליחה נגד לכיור לשטוף את הצלחת 3 פעמים עם פתרון כביסה (PBS + 0.05% v / v Tween 20).
- חסום באתרי מחייב הקולטן חינם בצלחת המצופית באמצעות 200 μl של פתרון BSA 5% לכל גם באמצעות פיפטה רבה דגירת הצלחת עבור שעה 2 ב RT.
- מחק את פתרון החסימה (ראה שלב 2.1.2.1.) ולשטוף את הצלחת 3 פעמים עם פתרון כביסה.
- הכן את רקומביננטי הליגנדים שלו מתויג בריכוזים שונים (למשל, 8 מיקרוגרם / מ"ל, 4 מיקרוגרם / מ"ל, 2 מיקרוגרם / מ"ל, 1 מיקרוגרם / מ"ל, 0.5 מיקרוגרם / מ"ל, 0.25 מיקרוגרם / מ"ל, 0.125 מיקרוגרם / מ"ל, 0.063 מיקרוגרם / מ"ל, 0.031 מיקרוגרם / מ"ל, 0.0 מיקרוגרם / מ"ל) ב PBS. הוסף רק PBS בבארות הריקות.
- הוספת 100 μl של ריכוז כל ליגנד אל הבארות כפולות דגירת הצלחת עבור שעה 2 ב RT המאפשר ליגנד רצפטוראינטראקציה.
- דגירה עם נוגדנים
- לאחר דגירה עם ליגנדים, לשטוף את הצלחת 3 פעמים עם פתרון כביסה.
- פיפטה 100 μl של פתרון נוגדן חד שבטי העכבר אנטי הראשוני שלו (1: 1,000) זה טוב.
- דגירה את הצלחת על RT עבור 2 שעות; לאחר דגירה, להשליך את פתרון הנוגדן (ראה שלב 2.1.2.1.) ולשטוף את הצלחת 3 פעמים עם פתרון כביסה.
- הוספת 100 μl של HRP מצמידים עז נגד העכבר פתרון נוגדנים משני IgG (1: 10,000) זה טוב. הדגירה הצליחה במשך 45 דקות ב RT.
- מחק את פתרון הנוגדן (ראה שלב 2.1.2.1.) ולשטוף את הצלחת 3 פעמים עם פתרון כביסה.
- תוספת של מצע ופיתוח
- תביא פתרונות מצע TMB כדי RT ולהכין TMB פתרון מצע ו- B ב 1: 1. הוספת 100 μl מוכנים טרי מצע זה טוב לשמור את הצלחת ב RT במשך 15-30 דקות. לאחר col מספיק או פיתוח להוסיף להפסיק פתרון 50 μl.
- קריאת ניתוח פלייט ונתונים
הערה: הפרוטוקול המתואר מבוסס על ההנחה כי האות הנמדד עולה מן ספציפי מחייב. זה עשוי להיות נחוץ כדי להעריך את התרומה של מחייב נוקבים לאות אבל זה מחוץ לתחום של פרוטוקול זה.- קראו את הספיגה (צפיפות אופטית, OD) ישירות ב -450 nm.
- הפחת את אות רקע מערכיה OD נמדדו לנרמל אותם. Transform כל הערכים של ריכוז ליגנד כדי סולם לוגריתמי (בסיס 10, להיכנס 10).
- מגרש את המנורמל ורקע תיקן ערכי OD (ציר ה- Y, תואם את השבריר של אתרי קישור לקולטן כבוש) נגד הלוגריתם של הריכוז ליגנד (ציר ה- X, יומן 10 בקנה מידה).
- לשם הערכת שווי D K, להתאים את הנתונים אל הטופס הבא של המשוואה היל:
tp_upload / 53,575 / 53575eq1.jpg "/>
הערה: כאן Y מציין את החלק היחסי של אתרי קישור לקולטן כבושים ו- Y מקסימום המקסימאלי שניתן מחייב; [יב] מציין את ריכוז ליגנד חופשי מקדם היל. אם יש רק אתר אחד מחייב ליגנד, מקדם היל הוא n = 1. עבור מערכות עם יותר מ מחייב אתר ליגנד אחד, cooperativity מחייבים המייצגים החיובי אם n> 1, cooperativity שלילי אם n <1 ולא cooperativity אם n = 1. קבוע דיסוציאציה המיקרוסקופי נקרא ומתאים לריכוז המקסימאלי חצי יעיל EC 50 6. קבוע דיסוציאציה לכאורה הוא K d = (K D) n. במקרה הפשוט ביותר כאשר n = 1, המקבילה הקבועה דיסוציאציה לריכוז ליגנד שבה המחצית של הקולטן אתרי קישור תפוס ו- K d = K D. מודל זה מניח המסות מחייב לפי תנאי שיווי משקל, כמו גם כי רק חלק קטן שלליגנד המוסף מאוגד הקולטן, כלומר, [יב] >> [RL].
- פלייט ציפוי עם קולטן רקומביננטי
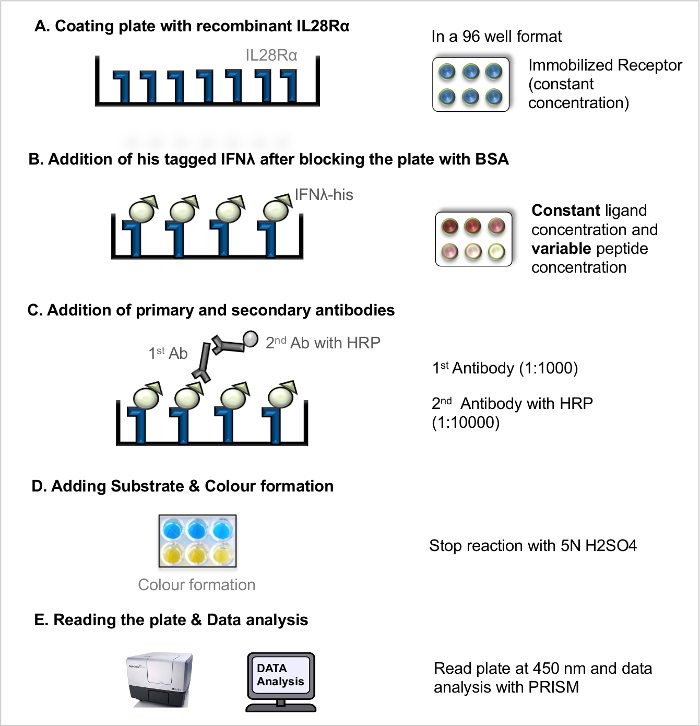
איור 1. assay-קולטן אינטראקציה ליגנד ישיר (LRA ישירה). צעד אחר צעד פרוטוקול LRA ישירה. נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- תחרות ליגנד-קולטן אינטראקציה Assay (LRA התחרות)
הערה:. כהדגמה של זרימת העבודה ראתה איור 2 הליך LRA התחרות כדלקמן את אותם צעדים כמו LRA הישירה (ציפוי הצלחת, דגירת נוגדן, פיתוח צלחת) למעט שינויים חשובים ליגנד ופפטידים צעד נוסף. שולט שלילי נכון חיוניים assay זה. במחקר הקרנה קודם 4, הפפטיד החסימה המקושקש לא הראה השפעות מנוגדות.- חסימה - תוספת של הליגנדים פפטידים חסימה
- למחרת, להסיר את פתרון הציפוי ולשטוף את הצלחת (ראה 2.1.2.1).
- חסום את הצלחת המצופית על ידי הוספת 200 μl של פתרון BSA 5% זה טוב הדגירה הצליחה במשך שעה 2 ב RT.
- הכן את הליגנדים שלו מתויג רקומביננטי (IFNL1-3) בריכוז קבוע (2x-20 ng / ml) ב PBS.
- הכן את הפפטיד החסימה (השווה לוח 3) עם ריכוזים שונים הנעים בין 10 ננומטר עד 100 מיקרומטר PBS להבטיח עקומת מנת תגובה.
הערה: זו מאפשרת קביעה בדיעבד של הערך 50 IC עבור הפפטיד החסימה. בשנת בארות שליטה, להוסיף ריכוז ליגנד קבוע בלבד ללא פפטיד לגזור מקסימאלי (100%) מחייב. את החסר, להוסיף PBS בלבד ללא ליגנד או הפפטיד. - הוסף 50 μl של ליגנדים (IFNL1-3) ו -50 μl של כל PEריכוז ptide אל בארות כפילויות.
- הדגירה הצליחה במשך שעה 2 ב RT.
- קריאת ניתוח פלייט ונתונים
הערה: הפרוטוקול המתואר מבוסס על ההנחה כי האות הנמדד עולה מן ספציפי מחייב. זה עשוי להיות נחוץ כדי להעריך את התרומה של מחייב נוקבים לאות אבל זה מחוץ לתחום של פרוטוקול זה.- קראו את הספיגה (צפיפות אופטית, OD) ישירות ב -450 nm.
- הפחת את אות רקע מערכיה OD נמדדו לנרמל אותם. Transform כל הערכים של ריכוז הפפטיד כדי סולם לוגריתמי (בסיס 10, להיכנס 10).
- מגרש את המנורמל ורקע תיקן ערכי OD (ציר ה- Y, תואם את השבריר של אתרי קישור לקולטן כבוש) נגד הלוגריתם של הריכוז ליגנד (ציר ה- X, יומן 10 בקנה מידה).
- לשם הערכה שווה 50 IC, להתאים את נתוני המשוואה הבאה:
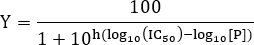
הערה: כאן [טז] הוא ריכוז הפפטיד והשיפוע היל. השיפוע היל מתאר את תלילות העקום מנה-תגובה. IC 50 תואם את הריכוז המעכב שבו 50 עיכובי% של מחייב בין ליגנד רצפטור הוא ציין.
- חסימה - תוספת של הליגנדים פפטידים חסימה

איור 2. תחרות ליגנד לרצפטור אינטראקציה assay (LRA תחרות). צעד אחר צעד פרוטוקול LRA תחרות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
תוצאות
קבועי דיסוציאציה בין INFL1-3 ו למקטע אלפא קולטן שלהם IL28RA נקבעו באמצעות LRA ישיר. התוצאות מוצגות באיור 3: את החלק היחסי של אתרי קישור כבושים זמם נגד הלוגריתם של ריכוז IFN בהתאמה. עלילת Scatchard של הנתונים מוצגת בפינה הימנית התחתונה. התוצאות ממחישות כי L...
Discussion
ELISA הוא תקן ושיטה ומבוססת למעבדות רבות. יש לנו שונה נוספים ושיפרנו 5,7 שיטה שפורסמו בעבר. צעד אחר צעד הפגין הפרוטוקול מראה כיצד ניתן להשתמש בו בצורה פשוטה כדי לקבוע את ערכי D K של אינטראקציות ליגנד לרצפטור. בנוסף, IC50 של פפטיד חסימת מפריע האינטראקציה ליגנד לרצ?...
Disclosures
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
Acknowledgements
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
References
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved