Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
ELISA на основе связывания и метод конкуренции быстро определить лиганд-рецепторных взаимодействий
В этой статье
Резюме
The presented protocols describe two enzyme-linked immunosorbent assay (ELISA) based techniques for the rapid investigation of ligand-receptor interactions: The first assay allows the determination of dissociation constant between ligand and receptor. The second assay enables a rapid screening of blocking peptides for ligand-receptor interactions.
Аннотация
A comprehensive understanding of signaling pathways requires detailed knowledge regarding ligand-receptor interaction. This article describes two fast and reliable point-by-point protocols of enzyme-linked immunosorbent assays (ELISAs) for the investigation of ligand-receptor interactions: the direct ligand-receptor interaction assay (LRA) and the competition LRA. As a case study, the ELISA based analysis of the interaction between different lambda interferons (IFNLs) and the alpha subunit of their receptor (IL28RA) is presented: the direct LRA is used for the determination of dissociation constants (KD values) between receptor and IFN ligands, and the competition LRA for the determination of the inhibitory capacity of an oligopeptide, which was designed to compete with the IFNLs at their receptor binding site. Analytical steps to estimate KD and half maximal inhibitory concentration (IC50) values are described. Finally, the discussion highlights advantages and disadvantages of the presented method and how the results enable a better molecular understanding of ligand-receptor interactions.
Введение
Полное понимание сигнальных путей требует детального знания о взаимодействии лиганд-рецептор. Большинство методов оценки взаимодействия конкретного лиганда с его специфическим рецептором являются дорогостоящими, отнимает много времени, трудоемкими и требуют специального оборудования и опыта 1.
В данной статье описываются два быстрых и надежных протоколов точка за точкой для исследования взаимодействия лиганд-рецептор на основе иммуноферментного анализа (ИФА): анализ на прямой лиганд-рецептор взаимодействия (LRA) и конкуренция LRA. ELISA является высокочувствительным, специфические и легко доступны метод, обычно используется почти в каждой лаборатории. ELISA, могут быть выполнены и адаптированы в различных модах. Представленные протоколы оптимизированы для изучения взаимодействия между различными интерферонами лямбда (INFLs) и их рецепторов.
Прямой LRA позволяет использовать quantificatiна лиганд-рецептор связывания в отношении концентрации лиганда и, таким образом, дает кривую связывания. С помощью соответствующего модели взаимодействия лиганд-рецептор, эти данные могут быть дополнительно проанализированы , чтобы оценить константу диссоциации (K D).
В представленном протоколе, обычно используется уравнение Хилла применяется для моделирования лиганд-рецептор связывания. Хотя другие методы , такие как поверхностного плазмонного резонанса технологии 2,3 позволяют определить аффинности связывания между двумя белками, эта технология часто трудоемкий, дорогой и требует специального лабораторного оборудования.
Конкурс LRA позволяет скрининг ингибирующих пептидов: лиганд-рецептор связывания количественно по отношению к концентрации пептида. Это дает кривую доза-ответ, описывающую ингибирующее действие пептида. Данные могут быть дополнительно проанализированы , чтобы оценить максимальную концентрацию ингибирования половину (IC 50 ) блокирующего пептида.
Оба протокола ELISA просты в использовании, и может быть адаптирован к широкому кругу вопросов исследования. Рекомбинантные белки любого типа могут быть использованы, чтобы надежно и быстро определить детали взаимодействия. Кроме того, конкуренция LRA может быть использован для определения критических участков взаимодействия лигандов и рецепторов с использованием блокирующих пептидов, которые предназначены для имитации либо лиганд, либо рецептор. Если блокирующий пептид показывает эффективное и специфическое ингибирование, пептид занимает критический сайт взаимодействие лиганда (если пептид имитирует рецептор) или лиганда (если пептид имитирует лиганд).
Первый протокол описывает определение K D значение различных INFLs и альфа - субъединицу их рецепторов, т.е. интерлейкин-28 - рецептора (IL28RA) с использованием прямого LRA. Далее, второй протокол показывает, как определить способность 20 аминокислот, длинного пептидаингибируют взаимодействие INFL-IL28RA. Пептид предназначен, чтобы конкурировать с IFNLs на их сайт связывания с рецептором и, таким образом, позволяет молекулярное понимание взаимодействия. Кроме того, этот пептид может быть использован для блокирования IL28RA в экспериментах в пробирке , чтобы определить влияние на нижестоящих сигнальных эффектов 4.
протокол
1. Подготовка реагентов
- Для получения карбонатного буфера для нанесения покрытия, растворения 0,36 г Na 2 CO 3 и 0,84 г NaHCO 3 в 100 мл дистиллированной воды; стерильный фильтр буфер с использованием вакуума не приводимый 0,22 мкм полиэфирсульфона (PES) мембранный фильтр и хранить при комнатной температуре до использования.
- Приготовьте моющий раствор путем добавления 0,05% об / об Твина 20 в фосфатном буферном растворе (PBS).
- Приготовьте 5% бычьего сывороточного альбумина (BSA) (блокирующий раствор) в растворе PBS растворением 5 г БСА (≥98%) в 100 мл PBS и хранят при температуре 4 ° С.
- Рекомбинантный Рецептор, лигандами и блокирующие Пептиды
- Reconstitutethe рекомбинантного человеческого рецептора интерлейкина альфа-субъединицы (IL28RA) и рекомбинантных His-помеченных лигандов человеческого IFN (IFNL1-3) в соответствии с инструкциями изготовителя и хранить при температуре -80 ° C. Синтезируют блокирующие пептиды и использовали , как описано выше 4. Используйте PBS для приготовления различных концентраций лигандаs и пептиды для использования в анализах.
- Для получения первичного антитела, разбавленные 6X Его мышиных моноклональных антител в PBS с 0,1% BSA в соотношении 1: 1000 разбавления. Для приготовления вторичного антитела, разбавленные с пероксидазой хрена (HRP), конъюгированное козье антитело против мышиных IgG (H + L) в PBS с 0,1% BSA в соотношении 1: 10000 разбавления.
- Приготовьте раствор ТМБ путем смешивания реагентов А и В в соответствии с инструкциями изготовителя.
- Подготовка стоп - раствора путем добавления 5 N серной кислоты (H 2 SO 4) в дистиллированной воде и хранят при комнатной температуре.
2. иммуноферментного анализа (ИФА)
Примечание: Прямое взаимодействие лиганд-рецептор - ELISA (прямая LRA, рисунок 1) может быть использован для измерения диссоциации рецептор-лиганд константа (K D), как меру рецептор-лиганд , сродство связывания. Взаимодействие конкуренции лиганд-рецептор ELISA (конкуренция LRA, рис 2) всеOWS скрининга пептидов (и других блокирующих соединений), которые действуют, чтобы помешать взаимодействию между лигандом и рецептором. Основной протокол , который ранее был опубликован 5 была оптимизирована.
Примечание: В обоих ИФА методы используют многоканальную пипетку для добавления растворов в лунки 96-луночного планшета в каждой стадии. В Декантируйте растворе или стадии промывки, выбрасывают решения непосредственно в раковину.
- Прямой лиганд-рецептор-Взаимодействие анализа (прямой LRA)
ПРИМЕЧАНИЕ: Для иллюстрации рабочего процесса (см рисунок 1).- Покрытие Тарелка с рецепторе Рекомбинантного
- Развести рекомбинантный рецептор в карбонатном буфере до конечной концентрации 100 нг / мкл. Coat лунки 96-луночного планшета для микротитрования с фиксированной концентрацией рецепторов (100 нг / мкл) с помощью пипетки 100 мкл в каждую лунку с помощью многоканальной пипетки. Исключить внешние стены пластины, чтобы избежать хорошо края артефакт. Закройте планшет крышкой и инкубироватьпластины при температуре 4 ° CO / N.
- Блокирование и добавление ЛИГАНДАМИ
- На следующий день, удалить раствор для покрытия путем наклона пластины к раковине и вымыть пластины 3 раза промывочным раствором (PBS + 0,05% об / об Твина 20).
- Блок свободные участки рецептора-связывания в пластине с покрытием с использованием 200 мкл 5% раствора БСА в каждую лунку с помощью многоканальной пипетки и инкубируйте в течение 2 ч при комнатной температуре.
- Откажитесь блокирующий раствор (см этап 2.1.2.1.) И мыть пластины 3 раза промывочным раствором.
- Готовят рекомбинантный His-меткой лигандов при различных концентрациях (например, 8 мкг / мл, 4 мкг / мл, 2 мкг / мл, 1 мкг / мл, 0,5 мкг / мл, 0,25 мкг / мл, 0,125 мкг / мл, 0,063 мкг / мл, 0,031 мкг / мл, 0,0 мкг / мл) в PBS. Добавьте только PBS в пустых лунок.
- Добавьте 100 мкл каждой концентрации лиганда в лунки в двух повторностях и инкубируйте в течение 2 ч при комнатной температуре позволяет рецептор-лигандвзаимодействие.
- Инкубационный с антителами
- После инкубации с лигандами, промыть пластины 3 раза промывочным раствором.
- Пипетка по 100 мкл первичного анти-His раствора антитела мышиного моноклонального (1: 1000) в каждую лунку.
- Инкубируйте планшет при КТ в течение 2 ч; после инкубации, вылейте раствор антител (смотри стадию 2.1.2.1.) и мыть пластины 3 раза промывочным раствором.
- Добавьте 100 мкл HRP в сочетании коза раствора вторичного антитела против мышиного IgG (1: 10000) в каждую лунку. Инкубируйте планшет в течение 45 мин при комнатной температуре.
- Выбросьте раствор антител (смотри стадию 2.1.2.1.) И мыть пластины 3 раза промывочным раствором.
- Добавление субстрата и развития
- Доведите растворы субстрата TMB до комнатной температуры и подготовки субстрата ТМВ раствора А и В в соотношении 1: 1. Добавляют 100 мкл свежеприготовленные субстрата в каждую лунку и держать планшет при комнатной температуре в течение 15-30 мин. После достаточного седловине или развитие добавляют 50 мкл раствора стоп.
- Чтение пластины и анализ данных
Примечание: Описанный протокол основан на предположении, что измеренный сигнал поднимается от специфического связывания. Это может быть необходимо, чтобы оценить вклад неспецифического связывания с сигналом, но это выходит за рамки данного протокола.- Измерить оптическую плотность (оптическая плотность, OD) непосредственно при длине волны 450 нм.
- Вычтите фоновый сигнал от измеренных значений ОП и нормализовать их. Преобразовать все значения концентрации лиганда в логарифмическом масштабе ( по основанию 10, log 10).
- Участок нормализовалась и фон скорректированного значения ОП (Y-ось, соответствует доле занятых связывания с рецептором сайтов) против логарифма концентрации лиганда (оси Х, логарифмическая шкала 10).
- Для оценки величины K D, соответствует данным в следующей форме уравнения Хилла:
tp_upload / 53575 / 53575eq1.jpg "/>
Примечание: Здесь Y обозначает долю занятых сайтов связывания рецепторов и Y макс максимального связывания; [L] обозначает концентрацию свободного лиганда и коэффициента Хилла. Если есть только один сайт связывания лиганда, коэффициент Хилла п = 1. Для систем с сайтом связывания более одного лиганда, связывание проявляет положительный кооперативности, если п> 1, отрицательная кооперативность, если п <1 и, если п не кооперативности = 1. микроскопическое константа диссоциации называется и соответствует половине максимальной эффективной концентрации EC 50 6. Кажущаяся константа диссоциации K d = (K D) п. В простейшем случае , когда п = 1, константы диссоциации соответствует концентрации лиганда , при которой половина рецептора сайтов связывания заняты и K d = K D. Эта модель предполагает связывание в условиях равновесия, а также, что лишь небольшая часть массовых действийдобавленный лиганд , связанный с рецептором, то есть, [L] >> [RL].
- Покрытие Тарелка с рецепторе Рекомбинантного
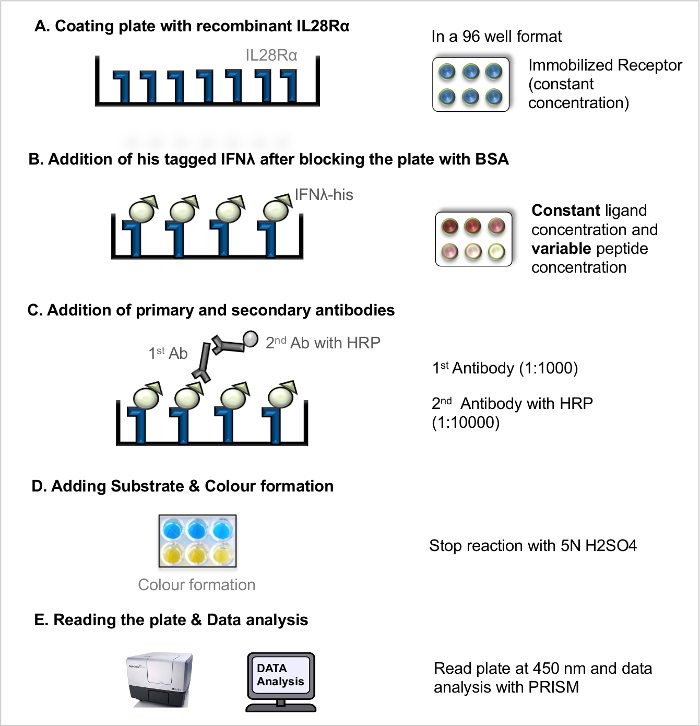
Рисунок 1. Анализ Прямой лиганд-рецептор-взаимодействие (прямое LRA). Шаг за шагом протокол для прямого LRA. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Конкурс лиганд-рецептор-Взаимодействие анализа (конкурс LRA)
Примечание:. Для иллюстрации рабочего процесса смотри Рисунок 2 Порядок проведения конкурсов LRA те же шаги, что и прямой LRA (нанесение покрытия на пластину, инкубирование антитела, развитие пластины) для важных изменений лиганда и пептидов , кроме стадии добавления. Надлежащие отрицательные контроли имеют важное значение для данного анализа. В предыдущем исследовании скрининга 4, зашифрованное блокирующий пептид не проявлял антагонистические эффекты.- Блокирование - Добавление ЛИГАНДАМИ и преграждать пептидами
- На следующий день, удалить раствор для нанесения покрытия и промойте пластину (см 2.1.2.1).
- Блок пластины с покрытием путем добавления 200 мкл 5% раствора БСА в каждую лунку и инкубируйте в течение 2 ч при комнатной температуре.
- Получения рекомбинантного His-маркированные лиганды (IFNL1-3) при фиксированной концентрации (2x-20 нг / мл) в PBS.
- Приготовьте блокирующий пептид (см Таблицу 3) с различными концентрациями в диапазоне от 10 нМ до 100 мкМ в PBS , чтобы гарантировать кривую доза-ответ.
Примечание: Это позволяет последующее определение значения IC 50 для блокирующего пептида. В контрольных лунках, добавьте только фиксированную концентрацию лиганда без пептида, чтобы получить максимальную (100%) связывания. В заготовке, добавляют только PBS без лиганда или пептида. - Добавьте 50 мкл лигандов (IFNL1-3) и 50 мкл каждого реptide концентрация в лунки в двух экземплярах.
- Инкубируйте планшет в течение 2 ч при комнатной температуре.
- Чтение пластины и анализ данных
Примечание: Описанный протокол основан на предположении, что измеренный сигнал поднимается от специфического связывания. Это может быть необходимо, чтобы оценить вклад неспецифического связывания с сигналом, но это выходит за рамки данного протокола.- Измерить оптическую плотность (оптическая плотность, OD) непосредственно при длине волны 450 нм.
- Вычтите фоновый сигнал от измеренных значений ОП и нормализовать их. Преобразовать все значения концентрации пептида в логарифмической шкале ( по основанию 10, log 10).
- Участок нормализовалась и фон скорректированного значения ОП (Y-ось, соответствует доле занятых связывания с рецептором сайтов) против логарифма концентрации лиганда (оси Х, логарифмическая шкала 10).
- Для оценки величины IC 50, соответствует данным следующему уравнению:
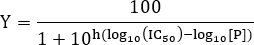
Примечание: Здесь [P] означает концентрацию пептида, а наклон Хилла. Склон холма описывает крутизну кривой доза-реакция. IC 50 соответствует концентрации ингибитора , при которой наблюдается 50% ингибирование связывания между лигандом и рецептором.
- Блокирование - Добавление ЛИГАНДАМИ и преграждать пептидами

Рисунок 2. Анализ конкуренции лиганд-рецептор-взаимодействия (конкуренция LRA). Шаг за шагом протокол для конкуренции LRA. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Результаты
Константы диссоциации между INFL1-3 и их рецептора альфа-субъединицы IL28RA определяли с использованием прямого LRA. Результаты показаны на рисунке 3: доля занятых участков связывания наносится на график логарифма соответствующей концентрации IFN. Скэтчарда данных ?...
Обсуждение
ELISA является стандартным и хорошо общепризнанный метод для многих лабораторий. Далее мы изменены и улучшены ранее опубликованного метода 5,7. Продемонстрировал шаг за шагом протокол показывает , как он может быть использован в простой способ для определения значений K D взаи?...
Раскрытие информации
A.E. was supported by a research grants from the "SNSF Ambizione Score" program (PZ00P3_154709), "Forschungsfond, Förderung strategischer Projekte" University of Basel, Stiftungsinfektionskrankheiten Basel, and Bangeter Rhyner Stiftung. J.L. acknowledges support by an iPhD fellowship of the SystemsX.ch initiative in systems biology program (9th call).
Благодарности
We thank Prof. J. Stelling (Department of Biosystems Science and Engineering, ETH Zurich and Swiss Institute for Bioinformatics, Basel, Switzerland) for his critical review of the manuscript.
Материалы
| Name | Company | Catalog Number | Comments |
| Nunc-Immunoplate (F96 Maxi sorp) | Thermo Scientific | 442404 | ELISA plate |
| Sodium carbonate (Na2CO3) | Merck | 497-19-8 | For ELISA plate coating buffer |
| Sodium hydrogen carbomnate(NaHCO3) | Merck | 144-55-8 | For ELISA plate coating buffer |
| Bovine Serum Albumin (BSA) | Sigma | A7030-100G | 5% BSA in PBS for Blocking |
| rhIL-28Rα/IFNλR1 | R&D systems | 5260-MR | Recombinant human interlukin-28 Receptor alpha |
| rhIL-29/IFNλ1 | R&D systems | 1598-IL/CF | Recombinant human interlukin-29/Carrier free/C-terminal 10-His tag |
| rhIL-28A/IFNλ2 | R&D systems | 1587-IL/CF | Recombinant human interlukin-28A/Carrier free/C-terminal 6-His tag |
| rhIL-28B/IFNλ3 | R&D systems | 5259-IL/CF | Recombinant human interlukin-28B/Carrier free/C-terminal 6-His tag |
| 6x His Monoclonal antibody (Mouse) | Clontech | 631212 | Primary antiboy to capture His tagged Ligands |
| Goat anti-Mouse igG (H+L) | Jackson Immuno Research | 115-035-166 | Horseradish Peroxidase conjucated secondary antibody |
| BDoptEIA TMB reagent set | BD Biosciences | 555214 | ELISA - TMB substrate solution |
| Sulfuric acid (H2SO4) | Fulka | 84720 | 5 N H2SO4 (Enzyme reaction stop solution) |
| Synergy/H1 - Microplate reader | BioTeK | ELISA plate reader |
Ссылки
- Schneider, P., Willen, L., Smulski, C. R. Tools and techniques to study ligand-receptor interactions and receptor activation by TNF superfamily members. Methods in enzymology. 545, 103-125 (2014).
- Rossi, G., et al. Biosensor analysis of anti-citrullinated protein/peptide antibody affinity. Analytical biochemistry. 465, 96-101 (2014).
- van der Merwe, P. A., Barclay, A. N. Analysis of cell-adhesion molecule interactions using surface plasmon resonance. Curr Opin Immunol. 8, 257-261 (1996).
- Egli, A., et al. IL-28B is a key regulator of B- and T-cell vaccine responses against influenza. PLoS Pathog. 10, e1004556 (2014).
- Rosenbluh, J., et al. Positively charged peptides can interact with each other, as revealed by solid phase binding assays. Analytical biochemistry. 352, 157-168 (2006).
- Goutelle, S., et al. The Hill equation: a review of its capabilities in pharmacological modelling. Fundamental & clinical pharmacology. 22, 633-648 (2008).
- Levin, A., et al. Peptides derived from HIV-1 integrase that bind Rev stimulate viral genome integration. PLoS One. 4, e4155 (2009).
- Egli, A., Santer, M. D., O'Shea, D., Tyrrell, D. L., Houghton, M. The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. Emerging infectious diseases. , e51 (2014).
- Gad, H. H., Hamming, O. J., Hartmann, R. The structure of human interferon lambda and what it has taught us. J Interferon Cytokine Res. 30, 565-571 (2010).
- Folch, B., Rooman, M., Dehouck, Y. Thermostability of salt bridges versus hydrophobic interactions in proteins probed by statistical potentials. Journal of chemical information and modeling. 48, 119-127 (2008).
- Yuzlenko, O., Lazaridis, T. Interactions between ionizable amino acid side chains at a lipid bilayer-water interface. The journal of physical chemistry. B. 115, 13674-13684 (2011).
- Tissot, A. C., Vuilleumier, S., Fersht, A. R. Importance of two buried salt bridges in the stability and folding pathway of barnase. Biochemistry. 35, 6786-6794 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены