Method Article
בידוד תזרים Cytometric ניתוח של תאים חיסוניים ממוח עכבר איסכמי
In This Article
Summary
Inflammation plays a central role in the pathogenesis of ischemic stroke. Increasing evidence suggests that it acts as a double-edged sword which exacerbates early brain injury, but also contributes to later repair. This protocol describes the isolation of immune cells from the ischemic brain and their subsequent flow cytometric phenotyping.
Abstract
שבץ איסכמי יוזם תגובה דלקתית חזקה שמתחילה בתא intravascular וכרוכה הפעלה מהירה של תאי תושב המוח. מנגנון מפתח של התגובה הדלקתית הזו, ההגירה של תאי החיסון למוח איסכמי בהנחייתם שחרור chemokine וביטוי מולקולות הדבקה מוגברת האנדותל. לויקוציטים פולשים-מוח ידועים תורם פגיעת איסכמית משנית בשלב מוקדם, אבל משמעותם עבור סיום הדלקת ותיקון המוח מאוחר יותר כבר שמה לב רק לאחרונה.
כאן, פרוטוקול פשוט עבור בידוד יעיל של תאים חיסוניים מהמוח העכבר איסכמי מסופק. לאחר זלוף transcardial, ההמיספרות של המוח הם גזור ו ניתק מכנית. עיכול אנזימטי עם Liberase ואחריו שיפוע צפיפות (כגון Percoll) צנטריפוגה להסיר המיאלין פסול תא. אחד היתרונות הגדולים של i בפרוטוקול זהזה הליך שיפוע צפיפות שכבה האחת אשר אינו דורש הכנה גוזלת זמן של מילויים וניתן לבצעו באופן מהימן. גישת מניב ספירת תאים לשחזור מאוד לכל בחצי כדור מוח ומאפשרת למדידת מספר לוחות הזרימה cytometry לשכפל אחד ביולוגי. אפיון וכימות פנוטיפי של לויקוציטים פולשים למוח לאחר שבץ ניסיוני עשוי לתרום להבנה טובה יותר של התפקידים הרבים שלהם לפגיעת איסכמית ותיקון.
Introduction
שבץ מוחי מעורר תגובה דלקתית מתמשכת שמתחילה במהירות לאחר הפסקת זרימת הדם המקומית וכרוכים כמעט כל חלקי המערכת החיסוניים. סימן ההיכר חשוב של תגובה דלקתית זה זרם מתוזמן של תאי מערכת חיסון אל המוח אשר מונעת על ידי ההפעלה של תאי אנדותל המוח, הפרשת chemokine משמעותית וגדילת יצוא אוהד 1-3. חדירת תא דלקתי נחשבה מזיקה בעבר השבץ איסכמי, עם זאת, ניסויים לטיפול למספר תוכנן ללא אבחנה לחסום יציאה לויקוציטים למוח הצליח לגרום תועלת קלינית מדידה 4. לאחרונה, התברר כי תאים מעורבים בתחילה נגזרות מונוציטים ב התקדמות ניזק איסכמי 5 עשויים גם לשחק תפקיד מרכזי עבור רזולוציה של רקמת דלקת ובעקבות תיקון 6.
הודות לזיהוי פנוטיפי functiההטרוגניות onal בין מונוציטים מקרופאגים, הידע על עצמו את התפקיד של פגוציטים mononuclear בפיתוח ברזולוציה של דלקת הרחיבה באופן משמעותי. בעכברים, מונוציטים במחזור ניתן לסווג לפחות שתי תת ברורים מבחינה תפקודית על פי ביטוי השטח שלהם מורכב 6 אנטיגן לימפוציטים (Ly-6C) 7. בעוד Ly-6C גבוהה monocytes''inflammatory הוצגה בבירור להיות חיוני על בקרת זיהומים חיידקיים 8, תפקידם פציעה סטרילית שנוי במחלוקת יותר. ב שבץ איסכמי, אבלציה סלקטיבית של מונוציטים CCR2 + Ly-6C גבוהים הביאה שינוי האוטם המורגי 6. עם זאת, באותה גישת הניסוי שפרה נכות חריפות לאחר תוך-מוחי דימום 9. באופן דומה, תת שונים של תאי T הם האמינו להפעיל או מזיק 10 או פעולות מגן 11 פגיעה מוחית איסכמי, עם זאת, הנתונים controversiאל 12,13 וכתבי אופציה חקירות נוספות. לאור מורכבות גובר, מתברר כי ידע עמוק על התפקידים של תאים חיסוניים המגוונים פגיעה איסכמית ותיקון חיוני תרגום ממצאי ניסוי לטיפולי מיקוד דלקת שבץ פוסט.
היום, הכלי החזק ביותר לניתוח תגובה חיסונית תאית חזקה הוא cytometry זרימה צבעוני. היא מאפשרת זיהוי וכימות של תת תאים שונים החיסונית באתר של דלקת ללא צורך להטות את המערכת על ידי תיוג in vivo או מניפולציה גנטית 14. מכתים סימולטני של סמנים פני תא עם נוגדנים נגד ציטוקינים תאיים 15 או שעתוק גורמי 16 בנוסף מספק מידע על מצב התפקודי של פרט, חוליות מזוהות phenotypically. כפי חיסרון אחד מרכזי, השעיות תא בודד נדרשים עבור מבחני תזרים cytometric ובכך מידע על localization של מחלחל הסלולר הולך לאיבוד. עם זאת, בעוד היסטולוגיה הוא אידיאלי כדי לקבל מידע מרחבי, היא מוגבלת במספר נוגדנים שיכולים לשמש בכל פעם מחדש לאפיין תת תא החיסון ברקמות בפרט. היום, שילוב של נוכחות וההיעדרות של סמני משטח שונים יש צורך חד משמעי לזהות תת תא חיסון נדיר, במיוחד אוכלוסיות תאים המובחנות נגזרות מונוציטים במהלך דלקת 17.
כאן אנו מתארים פרוטוקול יעיל לבודד מספר רב של לויקוציטים מהמוח העכבר postischemic באמצעות שיפוע צפיפות שכבה אחת פשוטה. מתלי התא המתקבלים ניתן לנתח באמצעות זרימה רבה ממדי cytometry או יותר להיות מועשר על ידי מיון תזרים cytometric או מבחר immunomagnetic לבצע ניתוחים במורד מאוד ספציפי. השיטה מפרט זלוף transcardial, הסרת ההמיספרות של המוח, דיסוציאציה של רקמת המוח לתוך תליוני תא בודדensions, צנטריפוגה שיפוע צפיפות להסרת המיאלין כמו גם מכתים נוגדן עבור ניתוח תזרים cytometric.
Protocol
כל הניסויים בבעלי חיים חייבים לעמוד בסטנדרטים פי עבור טיפול בבעלי חיים (למשל., את מדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי המכון הלאומי האמריקאי לבריאות, פרסום מס 'NIH 85-23, מתוקנת 1996) צריך להיות מאושר על ידי לרשות המתאימה.
1. הכנת ריאגנטים
- חיץ עיכול (1 מ"ל לכל מוחי): ממיסים תערובת סטנדרטית של אנזימי עיכול מטוהרים, למשל, Liberase עם ריכוז thermolysin נמוך (TL) לריכוז של מ"ל 2U / ב הנקס מאוזן תמיסת מלח (HBSS) סידן המכיל (Ca) ומגנזיום (Mg)
- חיץ כביסה עם DNAse: ממסי DNAse אני לריכוז של 666U / ml ב HBSS (Ca / Mg חינם) המכיל 10% נסיוב עגל העוברי (FCS)
- כביסה חיץ ללא DNAse: HBSS (Ca / Mg חינם) המכיל 10% של FCS
- בינוני שיפוע צפיפות (5 מ"ל לכל מוחי): להכין שיפוע צפיפות איזוטוני מניות0; בינוני (SIP; 100%) על ידי ערבוב לתשעה חלקים של מדיום שיפוע צפיפות עם חלק אחד 1.5 M נתרן כלורי. לדלל SIP צפיפות 25% על ידי הוספת נפח מתאים של HBSS (Ca / Mg חינם) המכיל 3% של FCS
- Cytometry זרימת חיץ (FC): כן פוספט בופר (PBS) המכיל 3% של FCS
2. ספיגה עורק חלוף תיכון מוחות
הערה: חסימת עורק המוח האמצעי חלוף (MCAO) באמצעות טכניקה תפר intraluminal בוצע כפי שתואר לעיל 18 ב 12-שבועות גבר בן C57BL / 6 עכברים.
- בקצרה, להרדים עכברים עם isoflurane 2.0% ב 100% חמצן. שמירה על טמפרטורת הגוף על 36.5 מעלות צלזיוס ± 0.5 מעלות צלזיוס על ידי מכשיר חימום משוב מבוקר.
- לאחר קשירת עורק התרדמה המשותף ואת העורק הראשי החיצונית, להציג monofilament-גומי סיליקון מצופה סטנדרטי בעורק התרדמה המשותף ולקדם אותה אל מקור של ג באמצעעורק erebral.
- אחרי 45 דקות להסיר את הנימה לאפשר reperfusion. אצל בעלי חיים דמה המופעלים, מיד למשוך את חוט להט אחרי שאטם את עורק המוח האמצעי, כדי למנוע איסכמיה.
3. Transcardial זלוף המוח Dissection
- כן משאבת זלוף peristaltic ידי טבילת קצה אחד של צינור לתוך HBSS קר כקרח (Ca / Mg חינם). תקן מחט 23 G בוטה אל הקצה השני של הצינור זלוף ולעבור על המשאבה כדי למלא את צינורות לחלוטין עם HBSS (Ca / Mg חינם).
- עמוק להרדים עכבר עם isoflurane 4% ו להרדים משאיפת CO 2.
- מניחים dorsally העכבר על קרש החיתוך מוטבע מגש פלסטיק. קדמי מורח ו כפותה אחורית רחב ככל האפשר ולתקן אותם על קרש חיתוך עם 20 מחטי G.
- תפוס עור הבטן עם מלקחיים 1 x 2 שיניים ישרות ולהשתמש איריס מספריים חדים לעשות חתך לרוחב דרך integument ואת דופן הבטן ולחשוף אתכָּבֵד.
- הרם את עצם החזה לחתוך את הסרעפת עם להב קהה מספריים איריס חדה / קהה. המשך לחתוך כלוב הצלעות לרוחב שני העמים בכיוון caudocranial. היזהר שלא לפצוע את הריאות, את הלב ואת העורקים החזי.
- הרם את דש העור עם מלקחיים בוטים ומהדק אותו על קרש חיתוך. שימוש במלקחיים בוטה סוף ומספריים להפריד בלב בקפידה מתוך רקמת חיבור.
- החזק לב עם מלקחיים בוטה סוף והכנס את קצה המחט 23 G בוטה עם הצינור זלוף המצורפת לתוך איפקס של החדר השמאלי. הערה: אל תכניס את המחט עמוק מדי לתוך החדר השמאלי, כדי למנוע פגיעה של מחיצת האף interventricular. במידת הצורך, לתקן את הצינורית במקום עם מלקחיים ישרים חדה.
- לחתוך את אטריום ימין עם מספריים איריס חדה ומיד להפעיל את המשאבה (קצב זרימה: 8 - 10 mL / min).
- המשך זלוף עד שהכבד מראה צבע קפה אור (~ 30 מ"ל של HBSS). בְּמֶשֶךזלוף, להימנע מכל היווצרות בועת אוויר בזהירות בצינור.
- לערוף את העכבר עם מספרי כירורגיות ישרות ממש מאחורי הגולגולת. השתמש במספריים איריס לעשות חתך קו האמצע של הקרקפת כדי לחשוף את הגולגולת.
- מניחים בקצה אחד של איריס מספריים חדים לתוך מגנום foramen וחותכים רוחבית לתוך הגולגולת. חזור על הפעולה עבור הצד השני.
- השתמש במספריים איריס חדה לחתוך בזהירות מאותו חלל את קו האמצע לכיוון האף. נסה לשמור על הסוף המספרי כמו שטחי ככל האפשר כדי למנוע פציעה של המוח.
- שימוש במלקחיים בסדר לקלף את עצמות הגולגולת בעדינות האונה כל המוח. הערה: רקמת אוטם עשויה לדבוק קרומי המוח או הגולגולת; לוודא שלא לאבד רקמת המוח עקב דיסקציה זהירה
- הרם את המוח עם מרית ולהשתמש איריס מספריים חדות לנתח סיבי עצב גולגולתי בזהירות כי לתקן את זה לגולגולת. מניחים את המוח לתוך צינור 15 מ"ל מלא 10 מ"ל של HBSS (+ Ca / Mg) ולשמור אותו shortly על הקרח.
4. דיסוציאציה של רקמות מוחין לתוך השעיות תא בודד
- מוציאים בזהירות גזע המוח ובמוח הקטן עם סכין גילוח נקי. השתמש סכין גילוח נקי Hemisect המוח וחותכים כל חצי הכדור במישור העטרה לשלוש חתיכות בגודל פחות או יותר שווה.
- בשר טחון גזור רקמות של האונה כל דרך מסננת תא 100 מיקרומטר בעזרת קצה הבוכנה של מזרק 5 מ"ל. ברציפות לשטוף את מסננת תא עם קרים כקרח HBSS (+ Ca / Mg). חנות דגימות הומוגני על הקרח.
- צנטריפוגה ב 286 XG ו- C 4 מעלות במשך 5 דקות, לבטל את supernatant בזהירות. Resuspend גלולה ב 1 מ"ל של חיץ העיכול ולהעביר את ההשעיה לתוך צינור 2 מ"ל. דגירת השעיה תחת הסיבוב רציף איטי ב 37 מעלות צלזיוס במשך שעה 1.
- ההשעיה תא מסננת דרך מסננת תא 70 מיקרומטר ו לשטוף היטב עם 3 מ"ל של חיץ כביסה המכיל DNAse ואחריו 15 מ"ל של חיץ כביסה ללא DNAse. צנטריפוגה ב 286 XG ו -18 מעלות צלזיוס למשך 5 דקות וזורקים supernatant. הערה: שימוש DNAse מבטל ריר DNA הנגרם על ידי תמוגה תא אשר עשויה להוביל צבירת תא להתפשר הישרדות תא.
צפיפות 5. Gradient צנטריפוגה הסרת המיאלין פסול תא
- גלולה תא גלולה ב 5 מ"ל של מדיום שיפוע צפיפות 25% ו פיפטה ההשעיה לצינור 15 מ"ל. מערבבים היטב על ידי pipetting חזר ועדין הימנעות היווצרות בועה. הערה: בינוני שיפוע צפיפות אמור לשמש ב RT כדי למנוע clumping התא.
- צנטריפוגה ב 521 XG ו -18 מעלות צלזיוס במשך 20 דקות. השתמש בפרופיל האצה הנמוך ביותר של הרוטור ולאפשר הרוטור לעצור ללא בלם. הוצא בעדינות את הצינורות מן צנטריפוגות בלי לרעוד. בזהירות לשאוב את המעיל המיאלין ואת supernatant תוך שמירה על התא גלולה בתחתית הצינור. הערה: הקפד להסיר את המעיל המיאלין כולו כמו כל שאריות יהיה impaiניתוח תזרים cytometric r.
- Resuspend גלולה ב 10 מ"ל של חיץ כביסה חינם DNAse ו פיפטה ההשעיה לצינור 15 מ"ל חדש. הערה: שלב כביסה זה חיוני מאז הסרה מספקת של מדיום שיפוע צפיפות תורמת באופן משמעותי את הכמות ואיכות של מדגם התא הסופי.
- צנטריפוגות שוב ב 286 XG ו -10 מעלות צלזיוס למשך 5 דקות וזורקים supernatant. Resuspend תאי 100 μl של חיץ כביסה קרה ולקבוע ספירת תאי כדאיות על ידי ההרחקה הכחולה trypan ב hemocytometer. חנות דגימות ב 4 מעלות צלזיוס, תהליך נוסף אותם במהירות.
6. מכתים נוגדן עבור ניתוח תזרים Cytometric
- לפני תיוג נוגדן, דגירה ההשעיה תא ב 4 מעלות צלזיוס במשך 10 דקות עם CD16 אנטי murine / CD32 מגיב חסימת FC-קולטן (ריכוז סופי של 2.5 מיקרוגרם / מ"ל, בדילול גורם 1: 200) כדי למנוע מחייב נוקבים.
- הוספת נוגדנים ראשוניים fluorophore מצומדות ב אריכוז ppropriate (כמצוין בטבלה 1) על השעיית תא דגירה על 4 מעלות צלזיוס למשך 20 דקות בחושך. הערה: דגימות בקרה אינה מוכתמות נוגדנים ראשוניים, אבל חוץ מזה יקבלו אותו היחס.
- שטפו תאים עם 2 מ"ל של חיץ צנטריפוגות FC ב XG 350 ו -10 מעלות צלזיוס למשך 7 min.Carefully לשאוב התא גלולה supernatant ו resuspend ב 200 μl של חיץ FC. חנות דגימות זמנית ב 4 ° C בחושך עד ניתוח תזרים cytometric.
7. כימותים מוחלטים על ידי ספירת חרוזי תפילה
- Reversely פיפטה 40 μl של חיץ FC ו- 10 μl של השעיה התא לתוך צינור הספירה ובו מספר ידוע של חרוזי ניאון. הערה: שימו לב כי טפטפות מכוילים לספק בדיוק 10 μl של המדגם חישוב בדיעבד של ספירת לויקוציטים מתייחס בספר זה.
- דגירת השעית תא עם נוגדן CD45 שכותרתו FITC (ריכוז סופי5 מ"ל מיקרוגרם /, דילול גורם 1: 100) בשעה 4 מעלות צלזיוס למשך 20 דקות בחושך.
- Reversely למלא את הצינור הספירה עם 200 μl של חיץ FC וללא שום צעד כביסה ישירות להקליט CD45 + תאים בזרימה cytometer.
8. זרימת Cytometric רכישה
הערה: כדי לנתח את לוח נוגדן המוצע, cytometer המתאים צריך להיות מצויד כחול (488 ננומטר), אדום (635 ננומטר) וסגול (405 ננומטר) לייזר ומתקנים לטיהור FITC, PE, PerCP Cy5.5, PECy7, APC-Cy7 ו AmCyan.
- התאם קדימה (FSC) ו הצידה (SSC) פיזור באמצעות תאים בלא כתם מתוך אונה איסכמי. להפלות כפילויות של תאים בודדים בתוך עלילת נקודה המציגה באזור וגובה של FSC.
- הצג את כל התאים בודדי היסטוגרמות פרמטר יחיד עבור כל ערוץ קרינה בשימוש ולהתאים את הצינור המכפיל (PMT) מתחים כך תאים בודדים מוצגים השמאלי של ההיסטוגרמה.
- השתמש CD45-FITC יחידמדגם מוכתם כדי לבדוק את הגדרות פיזור PMT עבור תאים של עניין על ידי backgating תאי חיסון גבוה CD45 בכל עלילה היסטוגרמה ולהתפזר. הערה: Adapt מתח PMT של FITC כך CD45 שלילי, ביניים (int) ותאי להביע גבוהה ניתן להבדיל בין זה לזה.
- השתמש חרוזי פיצויים שנתפסו נוגדן לבצע פיצוי מרובה צבעים. גדר שערי microglia (int CD45) ו לויקוציטים (CD45 גבוה) ולאחר מכן להגדיר תת-אוכלוסיות לויקוציטים פי אסטרטגית gating מוצג באיור 1.
תוצאות
איסכמיה מוחית יזמה בשנת 12 שבועות גבר בן C57BL / 6 עכברים באמצעות חסימת נימה חולפת של עורק המוח האמצעי שמאלה (MCAO). להפעלת דמה הנימה הוכנסה כדי לחסום את עורק המוח האמצעי שמאלה למשיכה מיידית כדי לאפשר reperfusion המיידית. חשוב לציין, neuroinflammation הסלולר ישנם הבדלים מהותיים בין דגמי שבץ מיושמים בדרך כלל 19. כך זה צריך לזכור במיוחד כאשר אקסטרפולציה ממצאים מניסויים בבעלי חיים בפתופיזיולוגיה הטרוגנית של שבץ אדם.
עכברים הוקרבו 24 שעות לאחר MCAO לנתח פלישת תא ראשונית של מערכת חיסון למוח איסכמי. ספירת תאי המתקבל האונה איסכמי (MCAO ipsi; 0.95 ± 0.25 x 10E6) לאחר צנטריפוגה שיפוע צפיפות היו דומות לאלו מחצי הכדור הנגדי (קונטרה MCAO; 1.09 ± 0.30 x 10E6) ואת ipsilateralבחצי כדור של עכברי דמה מופעל (ipsi דמה; 1.12 ± 0.18 x 10E6, חד סטרי ANOVA, p = 0.524). הכדאיות של תאים מבודדים נמדד על ידי הרחקה כחול trypan היה גבוה לא היו שונים משמעותית בין הקבוצות (דמה 96.85 ± 0.60%, MCAO קונטרה 97.12 ± 1.18%, MCAO ipsi 95.68 ± 2.04%, חד סטרי-ANOVA, p = 0.253 ).
הרכב של המוח להסתנן 24 שעות לאחר MCAO נקבע על ידי ניתוח תזרים cytometric. איור 1 מדגים את האסטרטגיה gating סכמטי (א) ו ב חיה שבץ נציג (B). הסתננות המוח לויקוציטים הוגדרו תאים גבוהים CD45 כי ניתן להבדיל בין microglia int CD45. בתוך האוכלוסייה גבוהה CD45, נויטרופילים polymorphonuclear (PMN) זוהו על ידי ביטוי Ly-6G, בעוד לימפוציטים מסוג T הותוו כמו CD45 גבוה CD3 + תאים. התאים הגבוהים הנותרים CD45 היו אז להבחיןed ידי CD19 (לימפוציטים מסוג B) וביטוי CD11b. השבר + CD11b היה מסווג יותר לתוך Ly-6C גבוהה `monocytes` דלקתית אוכלוסייה נמוכה Ly-6C שמקיפה מונוציטים, תאים דנדריטים (DC) ו מקרופאגים.
בשלב החריף של השבץ, תאי מערכת החיסון מיאלואידית להשתלט על המוח לחדור 3,20. נויטרופילים נכנסים למוח במהירות לאחר חסימת כלי ולקדם את extravasation של מונוציטים דלקתיים 21. איור 2A מציג את העלייה באחוז Ly6-G + נויטרופילים ב hr 24 אונה איסכמי לאחר MCAO לעומת הניתוח בחצי כדור ואת הדמה הנגדי. לעומת זאת, חלקם של התאים CD3 + T בחצי כדור איסכמי הוא (יחסית) נמוך יותר מאשר במוח הבריא. בתוך האוכלוסייה + CD11b, איסכמיה מסיט את האיזון לעבר יתרון חזק של מונוציטים דלקתיים גבוהים Ly-6C (איור2B).
בנוסף הפצות יחסית, צינורות לספור ששימשו לקביעת במספרים מוחלטים של תת תאים חיסוניים דגימות על בסיס אירועים חיוביים CD45 (איור 3). צינורות ספירה מכילים גלולת lyophilized אשר משחררים מספר הידוע של חרוזי ניאון. המספר המוחלט של תאים חיוביים במדגם יכול להיקבע על ידי הנוגע אירועים הסלולר כדי חרוז אירועים. כדי לחשב את מספר כדוריות דם לבנות גבוהות CD45 לכל בחצי כדור המשוואה נעשתה כדלקמן: תאים גבוהים CD45 לכל בחצי כדור = (x אירועים גבוהים CD45 חרוזה ספירת הכל / אירועי חרוז מדגם) x (נפח השעיה כוללת (100 μl) / נפח הדגימה (10 μl )). 24 שעות לאחר MCAO, ספירת לויקוציטים הכולל בחצי הכדור האוטם הוגדלו באופן משמעותי לעומת הניתוח בחצי הכדור ואת דמה הנגדי (איור 3D, חד סטרי ANOVA, p = 0.0004). עבירות של di תת תא stinct חיסוני (PMN, תאי T, B-תאי, Ly-6C גבוה Ly-6C מונוציטים נמוך) ניתן לחשב בקלות על ידי הכפלת התדר היחסי עם המספר לויקוציטים הכולל CD45 גבוה של מדגם בהתאמה.
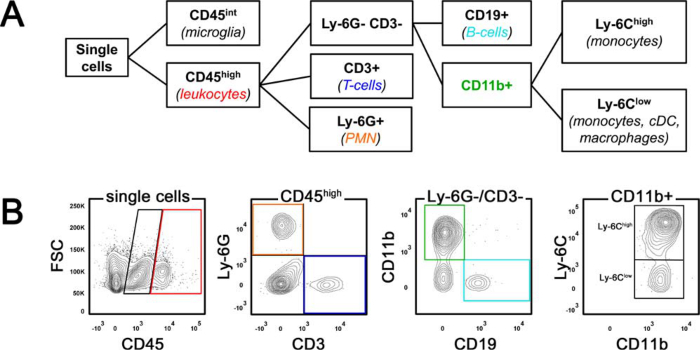
באיור 1. אסטרטגיה gating עבור cytometry זרימה. (א) איור סכמטי של האסטרטגיה gating. (ב) מראה ניתוח תזרים cytometric של לויקוציטים מבודד hr 24 במוח העכבר נציג אחרי חסימה עורק המוח האמצעי. FSC פיזור קדימה, נויטרופילים polymorphonuclear PMN, תאי דנדריטים קלסיים CDC. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ftp_upload / 53,658 / 53658fig2.jpg "/>
בידול איור 2. של תת תא חיסון. הפצה יחסית של Ly-6G + -neutrophils (א), תאי CD3 + T (A) לבין תת-מונוציטים מזוהים על ידי ביטוי הפרש של Ly-6C (B) ב ipsilateral (ipsi) ו נגדי ( קונטרה) בחצי כדור 24 שעות לאחר חסימת עורק מוח אמצעית (MCAO) או ניתוח דמה בהתאמה. אחוז אחד מהאוכלוסייה מותווה בשער. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
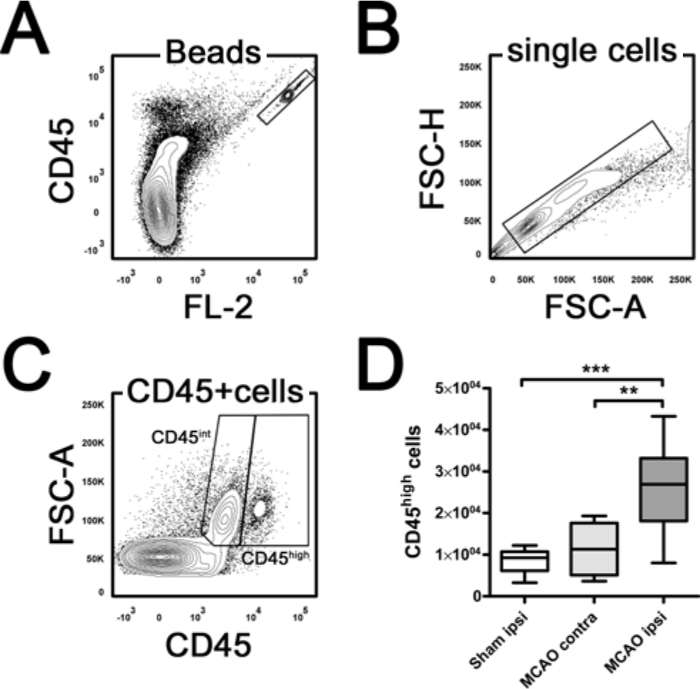
איור 3. כימות המוח Leukocytes ידי ספירת חרוזים. (א) מראה את השער חרוז פעמיים חיובי מאוד. בתוך האוכלוסייה תא בודד (B) microglia int CD45 ניתן להבדיל בין לויקוציטים גבוה CD45 (C). עבור כימות, במספר האירועים הגבוה מגודר CD45 היה מנורמל האירועים החרוזים נספרים. שים לב לויקוציטים הכולל (CD45 גבוה) ספירת עולה במידה ניכרת בחצי הכדור (ipsi) ipsilateral לעומת הניתוח הנגדי (קונטרה) בחצי הכדור ואת דמה 24 שעות לאחר חסימה עורק המוח האמצעי (MCAO). ** P <0.01, *** p <0.001 ידי ANOVA חד כיווני Tukey`s פוסט הוק הבדיקה להשוואות מרובות. n = 4 - 6 לכל קבוצה. FSC קדימה פיזור. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
| fluorochrome | FITC | פ | PerCP | PC7 | APC-Cy7 | V500 |
| (Cy5.5) | ||||||
| אַנְטִיגֵן | CD45.2 | CD3 | Ly-6G | CD19 | Ly-6C | CD11b |
| ריכוז סופי [מיקרוגרם / מ"ל] | 5 | 1 | 0.2 | 0.2 | 1 | 1 |
| גורם לדילול | 1/100 | 1/200 | 1 / 1,000 | 1 / 1,000 | 1/200 | 1/200 |
| Clone | 104 | 145-2C11 | 1A8 | 6D5 | AL-21 | M1 / 70 |
קוקטייל טבלה 1. נוגדן בסיסי עבור החיסון תא זיהוי במוח איסכמי.
Discussion
כאן, אנו מתארים שיטה פשוטה ויעילה עבור בידוד של לויקוציטים מהמוח בעכברים לאחר שבץ ניסיוני. הגישה באופן מהימן מניב ספירת תאים לשחזור מאוד לכל אונה במוח המאפשרת למדוד לוחות זרימה שונים לשכפל אחד ביולוגי.
ככל הנראה, הסרה חלקית של תאי מערכת החיסון בדם כולל תגרום השקפה מעוותת על הסכום בפועל של תאים דלקתיים שנכנסו המוח איסכמי. לפיכך, בעת השימוש בפרוטוקול זה לשים לב במיוחד זלוף transcardial היסודי על מנת למנוע זיהום של תאים חיסוניים הסתננו עם לויקוציטים במחזור הלא דלקתיים. מניסיון, את השימוש של מחטים בוטה ניקוב החדר השמאלי מפחיתה את הסיכון לפציעה של מחיצת האף interventricular אשר יעקפו זלוף של מחזור מערכתי. הופעתה של נוזל זלוף מהנחיריים סימן הוא כי זלוף pressureis גבוה מדי, וכך,ספיקות ריקות> 10 מיליליטר / דקה. בהיר עד צבע לבן של רקמת המוח מציין זלוף טוב בעוד צבע ורדרד הוא סימן זלוף עני.
עוד שלב קריטי של פרוטוקול זה הוא ניתוק יעיל של רקמת מוח שכולל פיצול מכאני, כמו גם עיכול אנזימטי. וקוצצים את רקמת דרך מסננת התא הוא קריטי כדי לספק יעילות משופרת של פרוטאזות. עם זאת, כאשר שמאחדים את הרקמות, למנוע לחץ מופרז כמו פגוציטים mononuclear רגישים מאוד autolysis 22. עבור TL Liberase עיכול אנזימטי מומלץ שהוא תערובת של לי collagenase נקיים במיוחד ו- II המכיל ריכוזים נמוכים של thermolysin פרוטאז ניטרלי. ההשוואה הישירה עם פרוטוקולי בידוד שתוארו לעיל 14,22,23 גילו התאוששות משמעותית גבוהה יותר של תאי קיימא על ידי טיפול Liberase TL (נתונים שלא פורסם ק''מ). לעומת collagenase שהוא מרבה להשתמשד עבור בידוד של תאים חיסוניים מהמוח, Liberase TL מכיל רמות זניחות של רעלן פנימי. זו היא בעלת חשיבות מיוחדת אם תאים מסודרים לניתוח במורד הזרם בגלל רמות גבוהות של רעלן פנימי עשוי לשנות את מצב ההפעלה של תאי מערכת החיסון 24 ולפגוע תרבית תאים קשות ותוצאות 25. חיסרון נוסף של collagenase המסורתית הוא הבדלים הרבה-אל-הרבה באופן מהותי את פעילות האנזים אשר מסכן שחזור של התוצאות מחייב קביעת ריכוז העבודה לכל מנה 26.
במוח בוגר, הסרת המיאלין על ידי צנטריפוגה שיפוע הצפיפות היא צעד הכרחי עבור יישומים במורד כגון cytometry זרימה או מחקרים נוספים על גן או ביטוי חלבון. אחד היתרונות הגדולים של הפרוטוקול הוא ההליך צפיפות שכבה אחת אשר אינה דורשת הכנה גוזלת זמן של הדרגתיים. יתר על כן, פרוטוקול ההפרדה מייצר תוצאה אמינהזה אפילו כאשר היא מבוצעת על ידי הנסיינים די מנוסים. זה נטול הדרגתי שכבתי עם צפיפויות קרובות אחד לשני שקשה פיפטה מבלי להפריע את הממשק בין.
בהתבסס על הביטוי של CD45 סמן המשטח, הפרוטוקול מניב לשלושה קטגוריות תאים עיקריות במוח איסכמי. הרוב המכריע של תאים שייכים לאוכלוסייה שלילית CD45 מורכב תאים עצביים, astroglia, ependymal ותאי האנדותל. הנוכחות בשפע שלהם מיוחסת שיפוע צפיפות שכבה האחת שמטרתה בעיקר הסרת המיאלין ופסולת יעילות. בנוסף, אוכלוסיית int CD45 מייצג microglia תושב 27 ניתן להבדיל בין אוכלוסייה גבוהה CD45 המכילה שחדר לויקוציטים hematogenous בעיקר. עם זאת, יש לציין כי microglia מופעל רשאי לאמץ את הפנוטיפ ותפקוד של תאי מיאלואידית יליד דם. לפיכך, המתוחכם החלים רקד טכניקות כגון parabiosis 28, מח עצם מפלצות 29 או מיפוי גורל ניתוח 30 לאפשר הבחנה ברורה בין שתי אוכלוסיות אלה במהלך דלקת.
ניתוח נתונים ב cytometry זרימת מוגבל לעתים קרובות החלוקה היחסית של אוכלוסיות תאים ספציפיים. עם זאת, כאשר משווים את אוטם אונה אל רקמת המוח הלא אוטם מידע זה יכול להיות מטעה, משום שהוא אינו רואה ספירה לויקוציטים מוחית מוחלט המוחלפות על ידי פגיעה איסכמית. לכן, כדי לצייר תמונה מלאה על העצמה ואת הפנוטיפ של המחלחל דלקתי לאחר הפצה יחסי שבץ של תת תא חיסון צריכה להיות כהשלמת מספרים מוחלטים לתא. בעת השימוש microbeads כמתואר בפרוטוקול זה, pipetting של נפח הדגימה מדויק הוא ממש חיוני כדי לקבל תוצאות אמינות. יתר על כן, pipetting הפוכה מומלץ מאוד כדי למנוע היווצרות קצף בצינור והיד עוד נטויה. הנובע בועות אוויריקטין את היקף microbeads הצפוי ומכאן להוביל יתר של ספירה לויקוציטים גבוה מוחלטת CD45 במדגם.
לסיכום, פרוטוקול זה מספק גישה קלה ואמינה כדי לבודד תאים חיסוניים מהמוח. זה יכול לשמש ככלי רב ערך כדי לנתח את המורכבות של התגובה הדלקתית כדי לשבץ איסכמי. יישומים עתידיים כולל חקירות על עצם את התפקיד תלוי זמן של תת מונוציטים ב התפשטות ורזולוציה של דלקת מוח איסכמי. באופן דומה, את התפקיד של מערכת חיסונית אדפטיבית לאחר השבץ הוא הבין היטב. ניתוח תזרים cytometric של תת-אוכלוסיות של תאי T שזוהו על ידי הביטוי של גורמי שעתוק ספציפי משנה או ציטוקינים באתרו עשוי לעזור להבהיר את השפיע על התאוששות לטווח ארוך לאחר שבץ ובכך שדרות הבטיח פתוחות לפיתוח גישות טיפוליות חדשות.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מודים Isabell שולץ לקבלת תמיכה טכנית מעולה.
Materials
| Name | Company | Catalog Number | Comments |
| Peri-Star Pro Peristaltic Pump, 4-channel | World precision instruments | PERIPRO-4LS | |
| Heracell 240i CO2 incubator | Thermo Scientific | ||
| MACSmix Tube Rotator | Miltenyi Biotec GmbH | ||
| Heraeus Multifuge 3SR+ | Thermo Scientific | ||
| FACS Canto II | Becton Dickinson | ||
| Isoflurane | Abbott | 4831850 | |
| Hank's buffered salt solution (HBSS) | Gibco/Life Technologies GmbH | 14175-129 | |
| HBSS with Calcium/Magnesium | Gibco/Life Technologies GmbH | 24020-091 | |
| Liberase TL | Roche Diagnostics GmbH | 5401020001 | |
| Percoll Plus | GE Healthcare Europe GmbH | 17-5445-01 | |
| Fetal bovine serum | PAN Biotech | 3302-P101003 | |
| Trypan blue | Gibco/Life Technologies GmbH | 15250-061 | |
| Trucount | BD Biosciences | 340334 | |
| Phosphate buffered saline | Biochrom AG | L 182-10 | |
| DNAse I | Roche Diagnostics GmbH | 11284932001 | |
| CD11b Horizon V500 | BD Biosciences | 562128 | |
| CD16/CD32 | eBioscience | 14-0161 | |
| CD45.2 FITC | eBioscience | 11-0454 | |
| CD3 PE | Biolegend | 100307 | |
| CD19 PE-Cy7 | Biolegend | 115519 | |
| Ly6C APC-Cy7 | BD Biosciences | 560596 | |
| Ly6G PerCP-Cy5.5 | BD Biosciences | 560602 | |
| Silicone Tubing, 1 m | World precision instruments | 503022 | |
| Fine Iris Scissors sharp | Fine Science Tools | 14094-11 | |
| Surgical Scissors | Fine Science Tools | 14130-17 | |
| Fine Iris Scissors sharp/blunt | Fine Science Tools | 14028-10 | |
| Straight 1 x 2 teeth forceps | Fine Science Tools | 11021-14 | |
| Blunt-end Forceps | Fine Science Tools | 11008-13 | |
| 5ml syringe plunger | Carl Roth GmbH (Braun) | EP96.1 | |
| Cell strainer, 100 µm | Dr. I. Schubert, BD | 2360-00 | |
| Omnican Fine dosage syringe 1 ml | Braun | TBD | |
| Cell strainer, 70 µm | Greiner Bio-One GmbH | 542 070 | |
| FACS Tubes | BD Bioscience GmbH | 352052 | |
| serological pipettes, 10 ml | Greiner Bio-One GmbH | 607180 | |
| serological pipettes, 10 ml | Sarstedt AG&Co | 861,254,025 | |
| serological pipettes, 25 ml | Greiner Bio-One GmbH | 760180 | |
| serological pipettes, 5 ml | Greiner Bio-One GmbH | 606180 | |
| serological pipettes, 25 ml | Sarstedt AG&Co | 861,685,020 | |
| serological pipettes,5 ml | Sarstedt AG&Co | 861,253,025 | |
| Tips, 0.1 - 10 µl | Corning B.V.Life Sciences | 4840 | |
| Tips, 100 - 1,000 µl | Greiner Bio-One GmbH | 740290 | |
| Tips, 10 - 200 µl | Greiner Bio-One GmbH | 739296 | |
| Reaction tubes 1.5 ml | Greiner Bio-One GmbH | 616201 | |
| Reaction tubes 2 ml | Greiner Bio-One GmbH | 623201 | |
| Bacteriological petri dish, 94 x 16 mm | Greiner Bio-One GmbH | 633180 | |
| Falcon 15 ml | Greiner Bio-One GmbH | 188271 | |
| Falcon 50 ml | VWR International GmbH (BD) | 734-0448 | |
| Neubauer hemocytometer | Biochrom AG | PDHC-N01 | |
| razor blade | Carl Roth GmbH | CK07.1 |
References
- Courties, G., et al. Ischemic stroke activates hematopoietic bone marrow stem cells. Circulation research. 116 (3), 407-417 (2015).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nature medicine. 17 (7), 796-808 (2011).
- Möller, K., Boltze, J., Pösel, C., Seeger, J., Stahl, T., Wagner, D. -. C. Sterile inflammation after permanent distal MCA occlusion in hypertensive rats. Journal of cerebral blood flow and metabolism. 34 (2), 307-315 (2014).
- Sughrue, M. E., Mehra, A., Connolly, E. S., D'Ambrosio, A. L., et al. Anti-adhesion molecule strategies as potential neuroprotective agents in cerebral ischemia: a critical review of the literature. Inflammation research. 53 (10), 497-508 (2004).
- Dimitrijevic, O. B., Stamatovic, S. M., Keep, R. F., Andjelkovic, A. V. Absence of the chemokine receptor CCR2 protects against cerebral ischemia/reperfusion injury in mice. Stroke. 38 (4), 1345-1353 (2007).
- Gliem, M., et al. Macrophages prevent hemorrhagic infarct transformation in murine stroke models. Annals of neurology. 71 (6), 743-752 (2012).
- Geissmann, F., et al. Blood monocytes: distinct subsets, how they relate to dendritic cells, and their possible roles in the regulation of T-cell responses. Immunology and cell biology. 86 (5), 398-408 (2008).
- Dunay, I. R., Fuchs, A., Sibley, L. D. Inflammatory monocytes but not neutrophils are necessary to control infection with Toxoplasma gondii in mice. Infection and immunity. 78 (4), 1564-1570 (2010).
- Hammond, M. D., et al. CCR2+ Ly6C(hi) inflammatory monocyte recruitment exacerbates acute disability following intracerebral hemorrhage. The Journal of neuroscience. 34 (11), 3901-3909 (2014).
- Shichita, T., et al. Pivotal role of cerebral interleukin-17-producing gammadeltaT cells in the delayed phase of ischemic brain injury. Nature medicine. 15 (8), 946-950 (2009).
- Liesz, A., et al. Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke. Nature medicine. 15 (2), 192-199 (2009).
- Kleinschnitz, C., Wiendl, H. Con: Regulatory T cells are protective in ischemic stroke. Stroke. 44 (8), 87-88 (2013).
- Hu, X., Li, P., Chen, J. Pro: Regulatory T cells are protective in ischemic stroke. Stroke. 44 (8), e85-e86 (2013).
- Möller, K., Stahl, T., Boltze, J., Wagner, D. -. C. Isolation of inflammatory cells from rat brain tissue after stroke. Experimental & translational stroke medicine. 4 (1), 20 (2012).
- Foster, B., Prussin, C., Liu, F., Whitmire, J. K., Whitton, J. L., Coligan, J. E. Detection of intracellular cytokines by flow cytometry. Current protocols in immunology. , (2007).
- Albu, D. I., Califano, D., Avram, D. Flow cytometry analysis of transcription factors in T lymphocytes. Methods in molecular biology. 647, 377-390 (2010).
- Prinz, M., Priller, J., Sisodia, S. S., Ransohoff, R. M. Heterogeneity of CNS myeloid cells and their roles in neurodegeneration. Nature neuroscience. 14 (10), 1227-1235 (2011).
- Wagner, D. -. C., et al. Allometric dose retranslation unveiled substantial immunological side effects of granulocyte colony-stimulating factor after stroke. Stroke. 45 (2), 623-626 (2014).
- Zhou, W., et al. Postischemic brain infiltration of leukocyte subpopulations differs among murine permanent and transient focal cerebral ischemia models. Brain pathology. 23 (1), 34-44 (2013).
- Gelderblom, M., et al. Temporal and spatial dynamics of cerebral immune cell accumulation in stroke. Stroke. 40 (5), 1849-1857 (2009).
- Soehnlein, O., Lindbom, L. Phagocyte partnership during the onset and resolution of inflammation. Nature reviews. Immunology. 10 (6), 427-439 (2010).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nature protocols. 1 (4), 1947-1951 (2006).
- Arac, A., et al. Systemic augmentation of alphaB-crystallin provides therapeutic benefit twelve hours post-stroke onset via immune modulation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13287-13292 (2011).
- Mattern, T., et al. Endotoxin and lipid A stimulate proliferation of human T cells in the presence of autologous monocytes. Journal of immunology. 153 (7), 2996-3004 (1950).
- Berney, T., et al. Endotoxin-mediated delayed islet graft function is associated with increased intra-islet cytokine production and islet cell apoptosis. Transplantation. 71 (1), 125-132 (2001).
- McShane, P., Sutton, R., Gray, D. W., Morris, P. J. Protease activity in pancreatic islet isolation by enzymatic digestion. Diabetes. 38, s126-s128 (1989).
- Ford, A. L., Goodsall, A. L., Hickey, W. F., Sedgwick, J. D. Normal adult ramified microglia separated from other central nervous system macrophages by flow cytometric sorting. Phenotypic differences defined and direct ex vivo antigen presentation to myelin basic protein-reactive CD4+ T cells compared. Journal of immunology. 154 (9), 4309-4321 (1950).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. a. b. i. o. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nature neuroscience. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Distinct and non-redundant roles of microglia and myeloid subsets in mouse models of Alzheimer's disease. The Journal of neuroscience. 31 (31), 11159-11171 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved