Method Article
İskemik Fare Beyin gelen Bağışıklık Hücreleri İzolasyon ve Akım Sitometrisi Analizi
Bu Makalede
Özet
Inflammation plays a central role in the pathogenesis of ischemic stroke. Increasing evidence suggests that it acts as a double-edged sword which exacerbates early brain injury, but also contributes to later repair. This protocol describes the isolation of immune cells from the ischemic brain and their subsequent flow cytometric phenotyping.
Özet
İskemik inme intravasküler bölmeye başlar ve beyin ikamet hücrelerin hızlı aktivasyonunu içerir sağlam bir inflamatuar yanıtı başlatır. Bu enflamatuar yanıtın temel mekanizma, kemokin Yayım ve artan endotel yapışma molekülü ifade edilmesiyle kolaylaştınlır iskemik beyin immün hücreleri, dolaşımdaki göç. Beyin işgal lökositler erken evre ikincil iskemik hasar katkıda iyi bilinir, ancak inflamasyon ve daha sonra beyin tamir sonlandırılması için önemleri ancak son zamanlarda fark edilmiştir.
Burada, iskemik fare beyin bağışıklık hücrelerinin etkili bir izolasyonu için basit bir protokol verilmektedir. transcardial perfüzyon sonra, beyin hemisfer disseke ve mekanik ayrışmış. Liberase ile enzimatik sindirim miyelin ve hücre debrisini uzaklaştırmak için yoğunluğu (örneğin Percoll gibi) gradyan santrifüj ile takip edilir. Bu protokol, i bir büyük avantajıgradyanlar zaman alıcı hazırlık gerektirmez ve güvenilir yapılabilir tek katmanlı yoğunluk gradyan prosedürü s. yaklaşım beyin yarımkürede başına yüksek tekrarlanabilir hücre sayıları verir ve bir biyolojik tekrarında birkaç akış sitometri panelleri ölçmek için izin verir. Deneysel İnme sonrası Fenotipik karakterizasyon ve beyin-işgalci lökositlerin ölçümü iskemik hasar ve tamir onların çok yönlü rolleri daha iyi anlaşılmasına katkıda bulunabilir.
Giriş
Serebral kontur hızlı lokal kan akışı kesildikten sonra başlar ve bağışıklık sisteminin hemen hemen tüm parçaları içeren bir sürekli inflamatuar yanıtı tetikler. Bu enflamatuar yanıtın önemli bir özelliğidir, beyin endotel hücreleri, büyük kemokin salgılanmasının aktivasyonu ile tahrik ve sempatik akışı 1-3 artar beyne bağışıklık hücreleri bir zaman ayarlı akışı olan. Inflamatuar hücre infiltrasyonu önceden iskemik inme zararlı kabul edildi, ancak, gelişigüzel beyne lökosit çıkışını engellemek üzere tasarlanmış çeşitli tedavi denemeleri ölçülebilir bir klinik yarar 4 ikna etmek için başarısız oldu. Daha yakın zamanda, ilk iskemik hasar 5 ilerlemesinde kapsanan monosit türevli hücreler, iltihabı ve daha sonra doku onarımı 6 çözülmesi için çok önemli bir rol oynadığını ortaya çıkmıştır.
fenotipik ve functi tanımlanması sayesindemonositler ve makrofajlar arasında Önal heterojenite, geliştirme ve inflamasyon çözümünde mononükleer fagositler rolü üzerine bilgiler önemli ölçüde genişletti. Farelerde, dolaşımdaki monositlerin lenfosit antijeni 6 kompleksi (Ly-6C) 7 yüzey ifadeye göre, en az iki fonksiyonel olarak farklı alt-grup halinde sınıflandırılabilir. LY-6C yüksek'inflammatory monocytes' açık bakteriyel enfeksiyonların 8 kontrolü için gerekli olduğu gösterilmiştir da steril yaralanmalara rolü daha tartışmalıdır. Iskemik inme olarak, CCR2 + Ly-6C yüksek monositlerin seçici ablasyon hemorajik infarkt transformasyon 6 sonuçlandı. Ancak, aynı deneysel yaklaşım intraserebral kanama 9 sonrası akut sakatlık düzeldi. Benzer şekilde, T-hücrelerinin, farklı alt-gruplar, iskemik beyin tahribatı ya 10 zarar verici ya da koruyucu eylem 11 uygulamak için inanılmaktadır, bununla birlikte, veri controversi olduğuEl 12,13 ve garanti ileri araştırmalar. Bu artan karmaşıklığı göz önüne alındığında, iskemik hasar ve tamir çeşitli bağışıklık hücrelerinin rolleri daha derin bilgi inme sonrası enflamasyonu hedefleyen terapiler içine deneysel bulgular çevirmek için son derece önemli olduğunu açık hale gelir.
Bugün, hücresel immün yanıtları analiz etmek için en güçlü araçtır polikromatik akış sitometri olduğunu. Bu sapma gereği, in vivo etiketleme veya genetik manipülasyon 14 sistem olmayan iltihap bölgesinde belirlenmesini ve çeşitli immün hücre alt ölçümü sağlar. Hücre içi sitokin 15 veya transkripsiyon karşı antikorlar ile hücre yüzeyi markerlerinin aynı anda boyama 16 ilave olarak tek tek, fenotipik olarak tespit hücrelerin fonksiyonel durumu hakkında bilgi sağlar faktörleri. bir büyük dezavantajı olarak, tek hücre süspansiyonları akış sitometrik deneyleri için gerekli olan ve loc üzerinde böylece bilgiHücresel infiltratlarının layan serbestleştirme kaybolur. Histoloji uzamsal bilgiler elde etmek için ideal bir Ancak, belirli bir dokuda immün hücre alt tipi karakterize etmek için tek seferde kullanılabilen antikorların sayısı ile sınırlıdır. Günümüzde, çeşitli yüzey markerlerinin varlığında ve yokluğunda bir kombinasyonu açıkça inflamasyon 17 esnasında ender immün hücre alt kümelerini, özellikle de tat monosit türevli hücre popülasyonlarının tanımlanması için gereklidir.
Burada, basit bir tek katmanlı yoğunluğu gradyanı kullanılarak postiskemik fare beyin lökositlerin yüksek sayıda izole edilmesi için etkin bir protokol açıklar. Elde edilen hücre süspansiyonları ya sitometrisi ya da daha fazla çok-boyutlu bir akış sitometrisi ile analiz edilebilir oldukça spesifik alt analizlerini gerçekleştirmek için akış sitometrik sıralama veya immünomanyetik seçimi ile daha da zenginleştirilebilir. yöntem tek hücre asmalar içine transcardial perfüzyon, beyin hemisfer kaldırılmasını, serebral doku ayrışmasını detaylarıensions, akış sitometrik analiz için miyelin çıkarılması için yoğunluk gradyanlı santrifüj gibi antikor boyama.
Protokol
Tüm hayvan deneyleri (Sağlık, NIH Yayın No: 85-23 ABD Ulusal Sağlık Enstitüleri tarafından yayınlanan Laboratuvar Hayvanları, Bakımı ve Kullanımı Kılavuzu 1996 revize örn.) Hayvan bakımı için uygun standartlara uygun ve onaylanmış olması gerekir uygun devlet otoritesi tarafından.
Reaktiflerin 1. Hazırlık
- Sindirim tamponu (hemisfer başına 1 mi), örneğin arıtılmış, sindirim enzimleri, standart bir karışımı eritilir, Liberase bir Hanks Dengeli Tuz Çözeltisi (HBSS) ihtiva eden kalsiyum 2U / ml konsantrasyonunda (Ca) ve magnezyum düşük termolisin konsantrasyonunun (TL) (Mg)
- DNAz ile yıkama tamponu: HBSS 666U / ml 'lik bir konsantrasyona kadar DNase I çözündürülür (Ca / Mg serbest) fetal dana serumu, 10% ihtiva eden (FCS)
- DNAz olmadan tampon Yıkama: HBSS (Ca / Mg ücretsiz) FCS% 10 içeren
- Yoğunluk degrade orta (yarımkürede başına 5 ml): stok izotonik yoğunluk gradiyenti hazırlamak0; ortamı (SIP% 100) bir bölümü, 1.5 M sodyum klorid ile yoğunluk gradyan ortamının dokuz kısım karıştırılarak. FCS% 3 ihtiva eden HBSS uygun bir hacmi (Ca / Mg Free) eklenerek% 25 yoğunluğa SIP seyreltin
- sitometrisi (FC) tampon akış: FCS% 3 ihtiva eden (PBS), fosfat tamponlu tuzlu su hazırlama
2. Geçici Orta Serebral Arter Tıkanıklığı
Not: 18 12-haftalık erkek C57BL / 6 fareleri, daha önce tarif edildiği gibi lümen içi bir dikiş tekniği ile geçici orta serebral arter oklüzyonu (MCAO) yapıldı.
- Kısaca,% 100 oksijen% 2.0 izofluran ile fareler uyutmak. 36.5 ° C 'de vücut ısısını korumak, bir geri-besleme ile kontrol edilen ısıtma aygıtı ile 0.5 ° C ±.
- karotis ve dış karotid arter ligasyonu sonra, orta c kökenli karotis ve önceden bunu bir standart silikon-kauçuk kaplı monofilament tanıtmakerebral arter.
- 45 dakika sonra reperfüzyona izin verecek şekilde filaman çıkarın. sham operasyonu hayvanlarda, hemen iskemi önlemek için orta serebral arter kapatılmasıy sonra filamanın çekme.
3. Transcardial Perfüzyon ve Beyin Diseksiyon
- (Ca / Mg Free) buzla soğutulmuş HBSS içine hortumun bir ucunu daldırılmasıyla peristaltik perfüzyon pompası hazırlayın. perfüzyon tüpünün diğer ucuna bir künt 23 G iğne düzeltmek ve tamamen HBSS (Ca / Mg ücretsiz) ile boru doldurmak için pompa açın.
- Derinden% 4 izofluran ile fare uyutmak ve CO 2 inhalasyon yoluyla euthanize.
- Bir plastik tepsi gömülü bir diseksiyon gemide fare dorsal yerleştirin. Yayılma ön ve mümkün olduğu kadar geniş ve 20 G iğne ile diseksiyon gemide bunları düzeltmek arka pençeleri.
- düz 1 x 2 diş forseps ile karın cildi kapmak ve kabuklarıyla ve karın duvarından bir yanal kesi yapmak için keskin iris makas kullanın ve maruzkaraciğer.
- sternum kaldırın ve keskin / künt iris makas künt bıçak ile diyafram insizyon. caudocranial doğrultusunun her iki yanında yanal göğüs kafesi kesmek için devam edin. akciğer, kalp ve göğüs arterleri zarar vermemek için dikkatli olun.
- künt forseps ile flep kaldırın ve diseksiyon gemide pin. dikkatle bağ dokusundan kalbi ayırmak için künt uç forseps ve makas kullanın.
- künt uç forseps ile kalbi tutun ve sol ventrikül apeksi içine ekli perfüzyon tüp ile künt 23 G iğne ucu yerleştirin. Not: interventriküler septum yaralanmaları önlemek için sol ventrikül içine çok iğne sokmayın. Gerekirse, bir düz keskin forseps ile yerine kanül düzeltmek.
- Keskin iris makası ile sağ atrium insizyon ve hemen pompa açmak (: - 10 ml / dak 8 debi).
- Karaciğer hafif kahve rengi (~ HBSS 30 ml) gösterene kadar perfüzyon devam edin. Boyuncaperfüzyon dikkatlice tüpün içinde herhangi bir hava kabarcığı oluşumunu önlemek.
- sadece kafatası arkasındaki düz cerrahi makas ile fare başını kesmek. kafatası açığa çıkarmak için kafa derisi orta hat kesi yapmak için iris makas kullanın.
- foramen magnum içine keskin iris makası biri ucu yerleştirin ve kafatası içine yanal kesti. diğer taraf için de tekrarlayın.
- Keskin iris makas kullanmak dikkatle burnuna doğru orta hatta kadar aynı boşluğundan kesmek için. Beynin yaralanmaları önlemek için mümkün olduğunca yüzeysel makas sonunu tutmaya çalışın.
- yavaşça her beyin yarımkürede kafatası kemikleri soymak için ince forseps kullanın. Not: infarkt doku menenjlerin veya kafatası yapışabilir; nedeniyle tedbirsiz diseksiyon beyin dokusunun kaybetmek değil emin olun
- bir spatula ile beyin kaldırın ve dikkatlice kafatasına bunu düzeltmek kranial sinir liflerini incelemek için keskin iris makas kullanın. HBSS (+ Ca / Mg), 10 ml ile dolu bir 15 ml'lik bir tüp içine beyin yerleştirin ve s tutmakhortly buz üzerinde.
Tek hücre süspansiyonları içine Serebral Doku 4. Ayrışma
- Dikkatle temiz bir jilet ile beyin sapı ve beyincik çıkarın. beyin Hemisect ve kabaca eşit büyüklükte üç parçaya koronal düzlem boyunca her yarımkürede kesmek için temiz bir jilet kullanın.
- Kıyma 5 ml şırınga pistonu ucunu kullanarak bir 100 um hücre süzgecinden her hemisfer doku kesilir. Sürekli buz gibi soğuk HBSS (+ Ca / Mg) ile hücre süzgeç durulayın. buz üzerinde homojenize örnekleri saklamak.
- 286 xg 5 dakika boyunca 4 ° C'de santrifüj dikkatlice süpernatant atılır. sindirim tamponu 1 ml pelet yeniden süspanse edin ve 2 ml'lik bir tüp içine süspansiyon aktarın. 1 saat süre ile 37 ° C 'de yavaş ve sürekli bir rotasyon altında süspansiyon inkübe edin.
- 70 mikron hücre süzgecinden Elek hücre süspansiyonu ve DNAse içermeyen yıkama tamponu, ardından 15 ml DNAz ihtiva eden yıkama tamponu 3 ml ile iyice yıkayın. 286 x g'de santrifüj ve 5 dakika boyunca 18 ° C ve supernatant atın. Not: Not: DNAz kullanımı hücre yaşamını tehlikeye hücre toplama yol açabilecek hücre parçalama neden olduğu DNA mukus ortadan kaldırır.
Miyelin ve hücre kalıntılarının uzaklaştırılmasından 5. yoğunluk dereceli santrifüj
- 5% 25 yoğunluk gradyan ortamının ml ve 15 ml tüp süspansiyonu pipetle tekrar süspansiyon hücre pelletini. kabarcık oluşumunu önlemek tekrarlanan ve Nazik pipetleme ile iyice karıştırın. Not: yoğunluk gradyan orta hücre topaklanma önlemek için oda sıcaklığında kullanılmalıdır.
- 521 x g'de santrifüj ve 20 dakika boyunca 18 ° C. Rotor düşük ivme profilini kullanın ve rotor Frensiz durdurmak için izin verir. Yavaşça sallayarak olmadan santrifüj tüpleri kaldırın. tüpün alt hücre pelet koruyarak dikkatli bir şekilde miyelin ceket ve süpernatant aspire. Not: Herhangi bir artık impai gibi tüm miyelin kat kaldırmak için emin olunr akım sitometri analizi.
- DNAz serbest Yıkama tamponu, 10 ml pelet yeniden süspanse edin ve yeni bir 15 ml'lik tüpe süspansiyonu pipetle. Not: yoğunluk gradyan ortamının yeterli çıkarılması önemli ölçüde nihai hücre örneği miktar ve kalitesine katkıda çünkü bu yıkama adım çok önemlidir.
- yine 286 xg'de ve 5 dakika boyunca 10 ° C ve süpernatant atın santrifüj. Soğuk Yıkama tamponu, 100 ul hücre yeniden süspanse edin ve bir hemositometrede tripan mavi dışlama hücre sayısı ve hücre canlılığı belirler. Mağaza 4 ° C'de örnekler ve hızlı bir şekilde bu işlem bundan başka, onları.
6. Antikor Boyama akım sitometri analizi için
- Spesifik olmayan bağlanma önlemek için, antikor etiketleme önce, anti-murin CD16 / CD32 FC-reseptörü bloke edici bir reaktif ile, 10 dakika (200 2.5 ug / ml nihai konsantrasyon, seyreltme faktörü 1), 4 ° C'de bir hücre süspansiyonu inkübe edilir.
- a at fluorofor-konjuge primer antikor ekleyinHücre süspansiyonuna (Tablo 1 'de gösterildiği gibi) ve karanlıkta 20 dakika boyunca 4 ° C'de inkübe ppropriate konsantrasyonu. Not: Kontrol numuneleri primer antikorlar ile boyanmış, ama başka türlü aynı tedavi edilmezler.
- 350 xg FC tamponu ve santrifüj 2 ml hücreleri yıkayın ve 7 min.Carefully 10 ° C FC tampon 200 ul süpernatan ve tekrar süspansiyon hücre pelletini aspire. akış sitometrik analiz edilinceye kadar karanlıkta geçici 4 ° C'de saklayın örnekleri.
Sayma Boncuk tarafından 7. Mutlak miktar tayini
- Ters FC tamponu 40 ul ve flüoresan boncuklar bilinen bir dizi ihtiva eden bir sayıcı tüp hücre süspansiyonu 10 ul pipetle. Not: pipetler lökosit sayımı sonraki hesaplama bu birime değinmektedir örnek tam 10 ul sunmak için kalibre edilmesi dikkat edin.
- FITC işaretli CD45 antikoru (nihai konsantrasyon hücre süspansiyonu inkübe100), 4 ° C'de karanlıkta, 20 dakika için iyi: 5 ug / ml, sulandırma faktörü 1.
- Ters herhangi bir yıkama aşaması olmadan FC tampon 200 ul sayma tüp girip doğrudan akış sitometresi olarak CD45 + hücreleri kaydeder.
8. Akım Sitometrisi Edinme
Not: Önerilen antikor paneli analiz etmek, uygun sitometresinin FITC, PE, PerCP Cy5.5, PECy7 kırmızı mavi (488 nm), (635 nm) ve mor (405 nm) lazer ve filtreler ile donatılmış olması olup, APC-Cy7 ve AmCyan.
- iskemik yarımkürede lekesiz hücreleri kullanarak ileri (FSC) ve yana (SSC) dağılım ayarlayın. FSC alanı ve yüksekliği gösteren bir nokta arsa tek hücrelerden ikilileri ayırt edebilir.
- kullanılan her floresan kanal için tek parametre histogramlar tüm tek hücre görüntüler ve photomultiplier tüp (PMT) tek hücre uzak histogram sol görüntülenir, böylece gerilimleri ayarlayın.
- Bir CD45-FITC tek kullanınHer histogram ve scatter plot CD45 yüksek bağışıklık hücrelerini backgating ile ilgi hücreleri için dağılım ve PMT ayarlarını kontrol etmek için lekeli örnek. Not: CD45 negatif, ara madde (int) ve yüksek ifade eden hücreler, birbirinden ayırt edilmesi, böylece FITC PMT gerilim ayarlayın.
- çok renkli tazminat gerçekleştirmek için antikor yakalanan tazminat boncuk kullanın. Şekil 1'de gösterilen yolluk stratejisine göre lökosit alt popülasyonları tanımlamak sonradan mikroglia (CD45 int) ve lökositler (CD45 yüksek) için kapıları ayarlayın ve.
Sonuçlar
Serebral işemi, sol orta serebral arter (MCAO) geçici oklüzyonu filament ile 12 haftalık erkek C57BL / 6 fareleri başlatılmıştır. Sham filament sol orta serebral arter tıkanması için eklenir ve anlık reperfüzyona izin verecek şekilde hemen geri çekilmiştir. Önemlisi, hücresel Nöroenflamasyon yaygın olarak uygulanan inme modelleri 19 arasında esasen farklılık gösterir. Bu, insan inme heterojen patofizyolojisi hayvan çalışmalarından elde edilen bulgular tahminde özellikle akılda tutulmalıdır.
Fareler iskemik beyin erken immün hücre işgali analiz etmek MCAO sonra 24 saat kurban edildi. iskemik yarımkürede elde edilen hücre sayımları (MCAO IPSI; ± 0.25 x 10E6 0.95) yoğunluk gradyan santrifüj kontralateral yarımkürede uylumluydu sonra (MCAO ters; 1.09 ± 0.30 x 10E6) ve ipsilateralsahte operasyona farelerin yarımküre (plasebo IPSI; 1.12 ± 0.18 x 10E6, tek yönlü ANOVA, p = 0.524). tripan mavisi dışlama ile ölçülen izole hücrelerin canlılığı yüksek olduğunu ve önemli ölçüde 96,85 ±% 0,60, MCAO kontra 97.12 ±% 1.18, MCAO IPSI 95,68 ± 2,04,% tek yönlü-ANOVA, p = 0.253 sahte gruplar (arasında farklılık yoktu ).
MCAO akış sitometrik analizi ile belirlenmiştir sonra beyinde bileşimi 24 saat infiltre. 1 Ayırıcı stratejisi şematik (A) ve Örnek inme hayvan (B) göstermektedir Şekil. Beyin infiltre lökositler CD45 int mikroglia ayırt edilebilir CD45 yüksek hücreler olarak tanımlandı. T lenfositleri, CD45, yüksek CD3 + hücreleri olarak tarif ederken, CD45, yüksek nüfus içinde, polimorfonükleer nötrofiller (PMN), LY-6G ifade ile tespit edildi. Kalan CD45 yüksek hücreler daha sonra ayırt edildiCD19 (B lenfositleri) ve CD11b ifade tarafından ed. CD11b + fraksiyon LY-6C yüksek 'enflamatuar monocytes` ve monositler, dendritik hücreler (DC) ve makrofajlar kapsayan bir Ly-6C düşük nüfus içinde alt kategorilere edildi.
Inmenin akut aşamasında, miyeloid bağışıklık hücreleri beyin 3,20 sızmak hakim. Nötrofiller damar tıkanması sonra hızla beyne giren ve inflamatuar monositlerin 21 ekstravazasyon teşvik. Şekil 2A kontralateral hemisfer ve sahte cerrahiye oranla MCAO sonra iskemik hemisfer 24 saat içinde Ly6-G + nötrofil yüzdesi artışı gösterir. Bunun aksine, iskemik yarımkürede CD3 + T hücrelerinin oranı, sağlıklı beyinde daha (nispeten) daha düşüktür. CD11b + nüfus içinde, beyin iskemi Ly-6C yüksek inflamatuar monositler güçlü bir ağır basması (Şekil doğru dengeyi kaydırır2B).
Göreli dağılımları ilave olarak, sayma borular CD45 pozitif olaylar bazında numune (Şekil 3) immün hücre alt mutlak değerinin belirlenmesi için kullanılmıştır. Sayma tüpleri floresan boncuk bilinen bir dizi bültenleri liyofilize pelet içerir. örnek pozitif hücrelerinin mutlak sayısı olayları boncuk hücresel olayları bulunan belirlenebilir. Aşağıdaki denklem kullanılmıştır yarımkürede başına CD45 yüksek lökosit sayısını hesaplamak için: yarımkürede başına CD45 yüksek hücreler = (CD45 yüksek olaylar x Toplam sayım boncuk / numune boncuk olayları) x (toplam süspansiyon hacmi (100 ul) / numune hacmi (10 ul )). 24 saat MCAO sonra, enfarktüs yarımkürede toplam lökosit sayısı önemli ölçüde kontralateral hemisfer ve sahte cerrahiye kıyasla arttı (Şekil 3D, tek yönlü ANOVA, p = 0.0004). di Sayımlar stinct immün hücre alt (PMN, T-hücrelerinin, B-hücrelerinin, LY-6C, yüksek ve LY-6C düşük monositler) kolayca ilgili örneğin toplam CD45 lökosit sayısı ile göreli frekans çarpılarak hesaplanabilir.
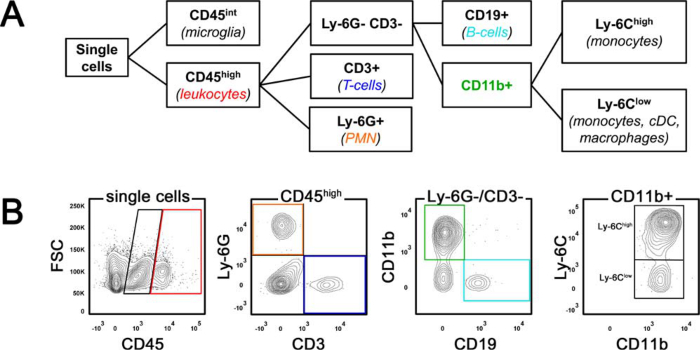
Akım Sitometrisi için Şekil 1. Yolluk Stratejisi. (A) yolluk stratejisinin şematik gösterimi. (B), orta serebral arter oklüzyonu sonrasında Örnek fare beyni, 24 saat izole lökositlerin akış sitometrik analizini göstermektedir. FSC ileri dağılım, PMN polimorfonükleer nötrofiller CDC klasik dendritik hücreler. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
ftp_upload / 53658 / 53658fig2.jpg "/>
İmmün hücre alt Şekil 2. farklılaşması. Ly-6G + -neutrophils (A) bağıl dağılımı, diferansiyel aynı taraf (ipsi) LY-6C (B) 'nin ifadesi ve karşı taraftaki (tarafından tanımlanan CD3 + T hücreleri (A) ve monosit alt-kümeleri kontra) hemisfer orta serebral arter tıkanıklığı (MCAO) ya da ilgili bir sahte ameliyat sonrası 24 saat. Her nüfusun yüzdesi kapısı belirtilmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
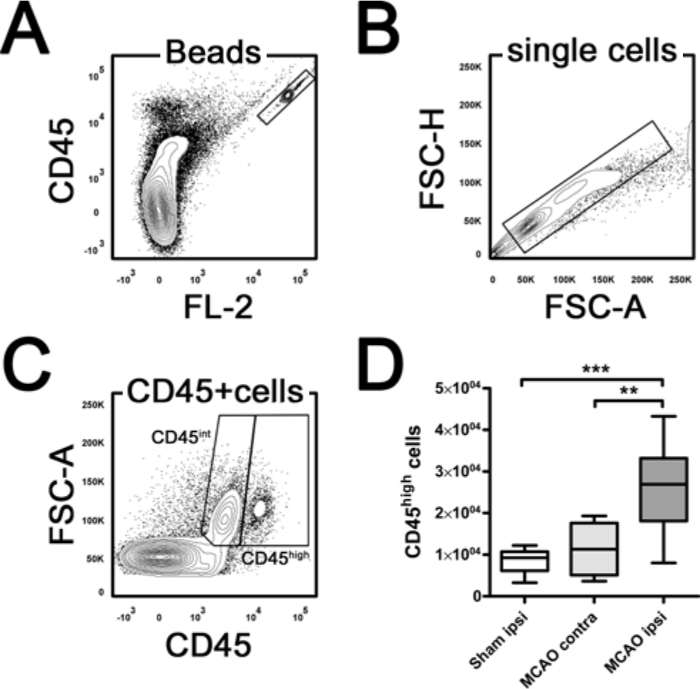
Boncuk Sayma ile Beyin lökosit Şekil 3. belirlenmesi. (A) yüksek çift pozitif boncuk kapısını gösterir. Tek hücre nüfus içinde (B) CD45 int mikroglia CD45 yüksek lökositler (C) ayırt edilebilir. Ölçümü için, kapı CD45 yüksek olayların sayısı sayılır boncuk olaylara normalize oldu. Bu toplam lökosit Not (CD45 yüksek) sayısı önemli ölçüde orta serebral arter tıkanıklığı (MCAO) sonra (kontra) hemisfer ve sham 24 saat ile karşılaştırıldığında ipsilateral (ipsi) yarımkürede artmıştır. ** P <0.01, *** p Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| florokrom | FITC | PE | PerCP | PC7 | APC-Cy7 | V500 |
| (Cy5.5) | ||||||
| Antijen | CD45.2 | CD3 | Ly-6G | CD19 | LY-6C | CD11b |
| Nihai konsantrasyon [ug / ml] | 5 | 1 | 0.2 | 0.2 | 1 | 1 |
| seyreltme faktörü | 1/100 | 1/200 | 1 / 1.000 | 1 / 1.000 | 1/200 | 1/200 |
| Klon | 104 | 145-2C11 | 1A8 | 6D5 | AL-21 | M1 / 70 |
İskemik Beyin Bağışıklık Hücre Tanımlama Tablo 1. Temel Antikor Kokteyl.
Tartışmalar
Burada, deney, inme sonrası kemirgen beyin lökositlerin izolasyonu için, basit ve etkili bir yöntem açıklanmaktadır. yaklaşım güvenilir bir biyolojik tekrarında farklı akış panelleri ölçmek için izin beyin yarımkürede başına yüksek tekrarlanabilir hücre sayıları verir.
Görünüşe göre, kan dahil olmak üzere bağışıklık hücreleri tam olmayan şekilde ayrılması, iskemik beyin giren enflamatuar hücreler asıl miktarına çarpık bir neden olur. Bu protokolü kullanarak Böylece, non-inflamatuar dolaşan lökositler ile sızmış bağışıklık hücrelerinin kirlenmesini önlemek için kapsamlı transcardial perfüzyon özellikle dikkat. deneyim, sol ventrikül ponksiyonu için künt iğne kullanımı sistemik dolaşıma perfüzyon atlamak istiyorum interventriküler septum yaralanma riskini azaltır. burun deliklerinden perfüzyon sıvısına Doğuşu perfüzyon böylece, çok yüksek pressureis bir işareti olduğunuvoid akış oranları> 10 ml / dak. pembemsi renk yoksul perfüzyon bir işareti ise beyin dokusunun beyaz renk soluk iyi perfüzyon gösterir.
Bu protokolün diğer kritik adım mekanik parçalanma yanı sıra enzimatik sindirim içermektedir beyin dokusunun etkin ayrışma olduğunu. hücre süzgecinden doku kıyma proteazların etkililiği arttırmak için çok önemlidir. Doku homojenize zaman mononükleer fagositler autolysis 22 derece duyarlı Ancak, aşırı basınç kaçının. enzimatik sindirim Liberase TL Nötr proteaz termolisinle düşük konsantrasyonlarını içeren yüksek düzeyde saflaştırılmış kolajenaz I ve II bir karışımı olduğu önerilir. Liberase TL tedavisi (KM yayınlanmamış veri) tarafından canlı hücreler önemli ölçüde daha yüksek iyileşme ortaya daha önce açıklanan izolasyon protokolleri 14,22,23 ile doğrudan karşılaştırılması. kollajenaz ile karşılaştırıldığında sık kullandığınız hangibeyin bağışıklık hücrelerinin izolasyonu için d, Liberase TL endotoksin önemsiz düzeyde içerir. Endotoksin düzeyi yüksek bağışıklık hücrelerinin 24 aktivasyon durumunu değiştirme ve ciddi hücre kültürü bozabildikleri için hücreler 25 çıktıları alt analiz için kriteri, bu özel bir önem taşımaktadır. Geleneksel kolajenaz başka bir sakıncası, sonuçların tekrarlanabilirliği tehlikeye ve her bir lot 26 çalışan konsantrasyon belirlenmesi gerekir enzim faaliyetlerinde önemli yeri partiye farklılıklarıdır.
bir yetişkin beyinde, yoğunluk gradyanlı santrifugasyon sureti ile miyelin ayrılması, gen veya protein ifadesi üzerindeki akış sitometrisi ya da daha fazla çalışmalar gibi alt uygulamalar için vazgeçilmez bir adımdır. protokolün bir büyük avantajı gradyanları zaman alıcı hazırlık gerektirmeyen tek katmanlı yoğunluğu işlemdir. Ayrıca, ayırma protokolü güvenilir sonuç üretiroldukça deneyimsiz deneyci tarafından gerçekleştirilen bile s. Bu arada arayüz bozmadan biri pipet zor olduğunu birbirine yakın yoğunlukları ile katmanlı geçişlerini yoksundur.
yüzey işaretleyici CD45 ekspresyonu göre, protokol iskemik beyin üç ana hücre kategorisi verir. hücrelerin büyük bir çoğunluğu nöronal hücrelerin, astroglial, ependim ve endotelyal hücrelerden oluşan bir CD45 negatif popülasyon aittir. Onların bol varlığı öncelikle verimli miyelin ve enkaz kaldırma amaçlayan tek katmanlı yoğunluk gradyanı atfedilir. Buna ek olarak, yerleşik mikroglia 27 temsil eden bir CD45 int nüfus öncelikle hematojen lökosit infiltre içeren bir CD45 yüksek nüfus ayırt edilebilir. Bununla birlikte, aktif mikroglia kanla miyeloid hücrelerin fenotip ve işlevini benimseyebilir unutulmamalıdır. Bu nedenle, sadece uygulama entellektüel28 parabiyoz olarak d teknikleri gibi, kemik iliği 29 kuruntulardan veya kader haritalama analizi 30 inflamasyon sırasında bu iki popülasyonlar arasındaki kesin bir ayrım sağlar.
Akış sitometrisi veri analizi, genellikle belirli bir hücre popülasyonun yüzde oranı dağılımı ile sınırlıdır. olmayan enfarktüslü beyin dokusuna yarımkürede infarkt karşılaştırırken iskemik yaralanma tarafından değiştirildi toplam beyin lökosit sayımı dikkate almaz Ancak, bu bilgiler yanıltıcı olabilir. bağışıklık hücre alt gruplarının inme göreli dağılımı mutlak hücre sayıları ile tamamlanmalıdır sonra Böylece, büyüklük ve enflamatuar infiltratlar fenotipi tam bir resim çizmek için. Bu protokolde tarif edildiği gibi mikro-boncuklar kullanıldığında, kesin bir örnek hacmi pipetleme güvenilir sonuçlar elde etmek için kesinlikle gereklidir. Ayrıca, ters pipetleme güçlü sayıcı tüp köpük oluşumunu önlemek için önerilir. hava kabarcıklarını Kaynaklananmikro-beklenen hacmini azaltmak ve dolayısıyla numunede mutlak CD45 yüksek lökosit sayımı fazla tahmin edilmesine yol açacaktır.
Özet olarak, bu protokol beyinden immün hücreleri izole etmek için kolay ve güvenilir bir yöntem sağlar. Bu iskemik inme inflamatuar yanıt karmaşıklığını incelemek için değerli bir araç olarak hizmet edebilir. Gelecekteki uygulamalar yayılması ve iskemik beyin iltihabı çözümünde monosit alt grupları zamana bağlı bir rol soruşturma bulunmaktadır. Benzer şekilde, inme sonrası adaptif bağışıklık sisteminin rolü tam olarak bilinmemektedir. Uzun vadeli inme sonrası iyileşme ve yeni tedavi yöntemlerinin geliştirilebilmesi için bu nedenle açık umut verici caddeleri üzerindeki etkilerini açıklamak için yardımcı olabilecek in situ alt kümesi özgü transkripsiyon faktörleri veya sitokinler ifade tarafından tespit T hücre alt akım sitometri yöntemiyle.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan ederim.
Teşekkürler
Yazarlar mükemmel teknik destek için Isabell Schulz teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Peri-Star Pro Peristaltic Pump, 4-channel | World precision instruments | PERIPRO-4LS | |
| Heracell 240i CO2 incubator | Thermo Scientific | ||
| MACSmix Tube Rotator | Miltenyi Biotec GmbH | ||
| Heraeus Multifuge 3SR+ | Thermo Scientific | ||
| FACS Canto II | Becton Dickinson | ||
| Isoflurane | Abbott | 4831850 | |
| Hank's buffered salt solution (HBSS) | Gibco/Life Technologies GmbH | 14175-129 | |
| HBSS with Calcium/Magnesium | Gibco/Life Technologies GmbH | 24020-091 | |
| Liberase TL | Roche Diagnostics GmbH | 5401020001 | |
| Percoll Plus | GE Healthcare Europe GmbH | 17-5445-01 | |
| Fetal bovine serum | PAN Biotech | 3302-P101003 | |
| Trypan blue | Gibco/Life Technologies GmbH | 15250-061 | |
| Trucount | BD Biosciences | 340334 | |
| Phosphate buffered saline | Biochrom AG | L 182-10 | |
| DNAse I | Roche Diagnostics GmbH | 11284932001 | |
| CD11b Horizon V500 | BD Biosciences | 562128 | |
| CD16/CD32 | eBioscience | 14-0161 | |
| CD45.2 FITC | eBioscience | 11-0454 | |
| CD3 PE | Biolegend | 100307 | |
| CD19 PE-Cy7 | Biolegend | 115519 | |
| Ly6C APC-Cy7 | BD Biosciences | 560596 | |
| Ly6G PerCP-Cy5.5 | BD Biosciences | 560602 | |
| Silicone Tubing, 1 m | World precision instruments | 503022 | |
| Fine Iris Scissors sharp | Fine Science Tools | 14094-11 | |
| Surgical Scissors | Fine Science Tools | 14130-17 | |
| Fine Iris Scissors sharp/blunt | Fine Science Tools | 14028-10 | |
| Straight 1 x 2 teeth forceps | Fine Science Tools | 11021-14 | |
| Blunt-end Forceps | Fine Science Tools | 11008-13 | |
| 5ml syringe plunger | Carl Roth GmbH (Braun) | EP96.1 | |
| Cell strainer, 100 µm | Dr. I. Schubert, BD | 2360-00 | |
| Omnican Fine dosage syringe 1 ml | Braun | TBD | |
| Cell strainer, 70 µm | Greiner Bio-One GmbH | 542 070 | |
| FACS Tubes | BD Bioscience GmbH | 352052 | |
| serological pipettes, 10 ml | Greiner Bio-One GmbH | 607180 | |
| serological pipettes, 10 ml | Sarstedt AG&Co | 861,254,025 | |
| serological pipettes, 25 ml | Greiner Bio-One GmbH | 760180 | |
| serological pipettes, 5 ml | Greiner Bio-One GmbH | 606180 | |
| serological pipettes, 25 ml | Sarstedt AG&Co | 861,685,020 | |
| serological pipettes,5 ml | Sarstedt AG&Co | 861,253,025 | |
| Tips, 0.1 - 10 µl | Corning B.V.Life Sciences | 4840 | |
| Tips, 100 - 1,000 µl | Greiner Bio-One GmbH | 740290 | |
| Tips, 10 - 200 µl | Greiner Bio-One GmbH | 739296 | |
| Reaction tubes 1.5 ml | Greiner Bio-One GmbH | 616201 | |
| Reaction tubes 2 ml | Greiner Bio-One GmbH | 623201 | |
| Bacteriological petri dish, 94 x 16 mm | Greiner Bio-One GmbH | 633180 | |
| Falcon 15 ml | Greiner Bio-One GmbH | 188271 | |
| Falcon 50 ml | VWR International GmbH (BD) | 734-0448 | |
| Neubauer hemocytometer | Biochrom AG | PDHC-N01 | |
| razor blade | Carl Roth GmbH | CK07.1 |
Referanslar
- Courties, G., et al. Ischemic stroke activates hematopoietic bone marrow stem cells. Circulation research. 116 (3), 407-417 (2015).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nature medicine. 17 (7), 796-808 (2011).
- Möller, K., Boltze, J., Pösel, C., Seeger, J., Stahl, T., Wagner, D. -. C. Sterile inflammation after permanent distal MCA occlusion in hypertensive rats. Journal of cerebral blood flow and metabolism. 34 (2), 307-315 (2014).
- Sughrue, M. E., Mehra, A., Connolly, E. S., D'Ambrosio, A. L., et al. Anti-adhesion molecule strategies as potential neuroprotective agents in cerebral ischemia: a critical review of the literature. Inflammation research. 53 (10), 497-508 (2004).
- Dimitrijevic, O. B., Stamatovic, S. M., Keep, R. F., Andjelkovic, A. V. Absence of the chemokine receptor CCR2 protects against cerebral ischemia/reperfusion injury in mice. Stroke. 38 (4), 1345-1353 (2007).
- Gliem, M., et al. Macrophages prevent hemorrhagic infarct transformation in murine stroke models. Annals of neurology. 71 (6), 743-752 (2012).
- Geissmann, F., et al. Blood monocytes: distinct subsets, how they relate to dendritic cells, and their possible roles in the regulation of T-cell responses. Immunology and cell biology. 86 (5), 398-408 (2008).
- Dunay, I. R., Fuchs, A., Sibley, L. D. Inflammatory monocytes but not neutrophils are necessary to control infection with Toxoplasma gondii in mice. Infection and immunity. 78 (4), 1564-1570 (2010).
- Hammond, M. D., et al. CCR2+ Ly6C(hi) inflammatory monocyte recruitment exacerbates acute disability following intracerebral hemorrhage. The Journal of neuroscience. 34 (11), 3901-3909 (2014).
- Shichita, T., et al. Pivotal role of cerebral interleukin-17-producing gammadeltaT cells in the delayed phase of ischemic brain injury. Nature medicine. 15 (8), 946-950 (2009).
- Liesz, A., et al. Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke. Nature medicine. 15 (2), 192-199 (2009).
- Kleinschnitz, C., Wiendl, H. Con: Regulatory T cells are protective in ischemic stroke. Stroke. 44 (8), 87-88 (2013).
- Hu, X., Li, P., Chen, J. Pro: Regulatory T cells are protective in ischemic stroke. Stroke. 44 (8), e85-e86 (2013).
- Möller, K., Stahl, T., Boltze, J., Wagner, D. -. C. Isolation of inflammatory cells from rat brain tissue after stroke. Experimental & translational stroke medicine. 4 (1), 20 (2012).
- Foster, B., Prussin, C., Liu, F., Whitmire, J. K., Whitton, J. L., Coligan, J. E. Detection of intracellular cytokines by flow cytometry. Current protocols in immunology. , (2007).
- Albu, D. I., Califano, D., Avram, D. Flow cytometry analysis of transcription factors in T lymphocytes. Methods in molecular biology. 647, 377-390 (2010).
- Prinz, M., Priller, J., Sisodia, S. S., Ransohoff, R. M. Heterogeneity of CNS myeloid cells and their roles in neurodegeneration. Nature neuroscience. 14 (10), 1227-1235 (2011).
- Wagner, D. -. C., et al. Allometric dose retranslation unveiled substantial immunological side effects of granulocyte colony-stimulating factor after stroke. Stroke. 45 (2), 623-626 (2014).
- Zhou, W., et al. Postischemic brain infiltration of leukocyte subpopulations differs among murine permanent and transient focal cerebral ischemia models. Brain pathology. 23 (1), 34-44 (2013).
- Gelderblom, M., et al. Temporal and spatial dynamics of cerebral immune cell accumulation in stroke. Stroke. 40 (5), 1849-1857 (2009).
- Soehnlein, O., Lindbom, L. Phagocyte partnership during the onset and resolution of inflammation. Nature reviews. Immunology. 10 (6), 427-439 (2010).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nature protocols. 1 (4), 1947-1951 (2006).
- Arac, A., et al. Systemic augmentation of alphaB-crystallin provides therapeutic benefit twelve hours post-stroke onset via immune modulation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13287-13292 (2011).
- Mattern, T., et al. Endotoxin and lipid A stimulate proliferation of human T cells in the presence of autologous monocytes. Journal of immunology. 153 (7), 2996-3004 (1950).
- Berney, T., et al. Endotoxin-mediated delayed islet graft function is associated with increased intra-islet cytokine production and islet cell apoptosis. Transplantation. 71 (1), 125-132 (2001).
- McShane, P., Sutton, R., Gray, D. W., Morris, P. J. Protease activity in pancreatic islet isolation by enzymatic digestion. Diabetes. 38, s126-s128 (1989).
- Ford, A. L., Goodsall, A. L., Hickey, W. F., Sedgwick, J. D. Normal adult ramified microglia separated from other central nervous system macrophages by flow cytometric sorting. Phenotypic differences defined and direct ex vivo antigen presentation to myelin basic protein-reactive CD4+ T cells compared. Journal of immunology. 154 (9), 4309-4321 (1950).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. a. b. i. o. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nature neuroscience. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Distinct and non-redundant roles of microglia and myeloid subsets in mouse models of Alzheimer's disease. The Journal of neuroscience. 31 (31), 11159-11171 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır