Method Article
Isolation und Analyse über Durchflusszytometrie von Immunzellen aus dem ischämischen Gehirn der Maus
In diesem Artikel
Zusammenfassung
Inflammation plays a central role in the pathogenesis of ischemic stroke. Increasing evidence suggests that it acts as a double-edged sword which exacerbates early brain injury, but also contributes to later repair. This protocol describes the isolation of immune cells from the ischemic brain and their subsequent flow cytometric phenotyping.
Zusammenfassung
Der ischämische Schlaganfall leitet eine robuste Entzündungsreaktion, die in der intravaskulären Raum beginnt und beinhaltet eine schnelle Aktivierung von Gehirn ansässig Zellen. Ein wesentlicher Mechanismus dieser Entzündungsreaktion ist die Migration von durch Chemokin Freisetzung erleichtert Immunzellen auf das ischämische Gehirn zirkuliert und endotheliale Adhäsionsmolekül-Expression erhöht. Brain-Invasion auf Frühphasen-Sekundär ischämische Verletzung beitragen Leukozyten sind bekannt, aber ihre Bedeutung für die Beendigung der Entzündung und später zur Heilung des Gehirns hat bemerkt, erst vor kurzem.
Hier wird ein einfaches Protokoll für die effiziente Isolierung von Immunzellen aus dem ischämischen Gehirn der Maus vorgesehen. Nach transkardialer Durchblutung, Gehirnhälften werden seziert und mechanisch dissoziiert. Die enzymatische Verdauung mit Liberase wird durch Dichtegradientenzentrifugation (wie Percoll) zentrifugiert, um Myelin und Zelltrümmer zu entfernen. Ein wesentlicher Vorteil dieses Protokolls is die einlagige Dichtegradienten Verfahren, das zuverlässig durchgeführt werden keine zeitaufwendige Herstellung von Gradienten erfordern und kann. Der Ansatz liefert eine hohe Reproduzierbarkeit der Zellzahl pro Gehirnhälfte und ermöglicht mehrere Durchflusszytometrie Platten in eine biologische Replikation zu messen. Phänotypische Charakterisierung und Quantifizierung von brain-Invasion von Leukozyten nach experimentellem Schlaganfall kann zu einem besseren Verständnis der vielfältigen Rolle bei ischämischen Schädigung und Reparatur beitragen.
Einleitung
Hirnschlag löst eine anhaltende Entzündungsreaktion, die schnell nach Beendigung des lokalen Blutfluss beginnt und praktisch aller Teile des Immunsystems umfasst. Ein wichtiges Merkmal dieser Entzündungsreaktion ist ein zeitlich Zustrom von Immunzellen des Gehirns, die durch die Aktivierung von Gehirnendothelzellen, erhebliche Chemokin-Sekretion und erhöhte Sympathikus 1-3 angetrieben wird. Entzündliche Zellinfiltration wurde zuvor schädlich betrachtet in ischämischem Schlaganfall, mehrere Behandlungsversuche ausgelegt jedoch zu undifferenziert Leukozyten-Austritt an das Gehirn blockieren konnte eine messbare klinische Nutzen 4 zu induzieren. In jüngerer Zeit wurde deutlich, dass Monozyten abgeleiteten zunächst in Fortschreiten der ischämische Schädigung 5 beteiligten Zellen auch eine entscheidende Rolle für die Auflösung der Entzündung und anschließender Reparatur von Gewebe 6 spielen könnten.
Durch die Identifizierung von phänotypischen und functional Heterogenität zwischen den Monozyten und Makrophagen, hat das Wissen über die Rolle der mononuklearen Phagozyten in der Entwicklung und Auflösung der Entzündung deutlich erweitert. Bei Mäusen kann zirkulierenden Monozyten in wenigstens zwei funktionell unterschiedlichen Untergruppen klassifiziert werden entsprechend ihrer Oberflächenexpression von Lymphozyten-Antigen-Komplex 6 (Ly-6C) 7. Während Ly-6C Hoch'inflammatory monocytes' waren klar 8 zur Bekämpfung von bakteriellen Infektionen als wesentlich gezeigt, in sterile Verletzungen ihre Rolle ist umstritten. In ischämischen Schlaganfall führte selektive Ablation von CCR2 + Ly-6C hohe Monozyten im hämorrhagischen Infarkt Transformation 6. Allerdings verbesserte sich die gleichen experimentellen Ansatz akuten Behinderungen nach Hirnblutung 9. In ähnlicher Weise werden verschiedene Untergruppen von T-Zellen angenommen entweder schädlich 10 oder Schutzmaßnahmen 11 in ischämische Hirnverletzung auszuüben jedoch Daten controversial 12,13 und rechtfertigt weitere Untersuchungen. Angesichts dieser zunehmenden Komplexität, wird deutlich, dass tiefere Kenntnisse über die Rollen der verschiedenen Immunzellen in ischämische Schädigung und Reparatur für die Übersetzung von experimentellen Erkenntnisse in Therapien entscheidend ist nach Schlaganfall Entzündung Targeting.
Heute ist das mächtigste Werkzeug für die zelluläre Immunantworten zu analysieren ist polychromen Durchflusszytometrie. Sie ermöglicht die Identifizierung und Quantifizierung von verschiedenen Immunzelluntergruppen an der Stelle der Entzündung ohne die Notwendigkeit zum Vorspannen des Systems durch in vivo-Markierung oder Genmanipulation 14. Gleichzeitige Färbung von Zelloberflächenmarkern mit Antikörpern gegen intrazellulären Zytokine 15 oder Transkriptionsfaktoren 16 zusätzlich Informationen über den Funktionszustand der einzelnen, phänotypisch identifizierten Zellen bereitstellt. Als einen großen Nachteil, werden Einzelzellsuspensionen für Durchflusszytometrie-Tests erforderlich und somit Informationen über locsierung der zellulären Infiltrate verloren. Während jedoch Histologie ideal räumliche Information zu gewinnen, wird durch die Anzahl von Antikörpern beschränkt, die zu einem einzigen Zeitpunkt verwendet werden können Immunzellen-Untertypen in einem bestimmten Gewebe zu charakterisieren. Heute ist eine Kombination der Anwesenheit und Abwesenheit von verschiedenen Oberflächenmarkern ist notwendig, um eindeutig seltenen Immunzelluntergruppen zu identifizieren, insbesondere die unterschiedlichen Monozyten abgeleiteten Zellpopulationen während der Entzündung 17.
Hier beschreiben wir ein effizientes Protokoll hohe Zahl von Leukozyten aus dem postischämischen Mäusegehirn unter Verwendung einer einfachen einlagigen Dichtegradienten zu isolieren. Die erhaltenen Zellsuspensionen kann entweder durch mehrdimensionale Durchflusszytometrie oder weiter durch Durchflusszytometrie-Sortierung oder immun Auswahl angereichert werden analysiert werden hochspezifische Downstream-Analysen durchzuführen. Die Methode Details transkardialer Durchblutung, die Entfernung von Gehirnhälften, die Dissoziation von Hirngewebe in einzelne Zelle suspensionen, Dichtegradientenzentrifugation für Myelinentfernung sowie Antikörper-Färbung für Zytometrie Analyse fließen.
Protokoll
Alle Tierversuche müssen gemäß Standards für Tierhaltung entsprechen (z. B. der Leitfaden für die Pflege und Verwendung von Labortieren, veröffentlicht von der US-amerikanischen National Institutes of Health, NIH Publication No. 85-23, überarbeitet 1996) und müssen genehmigt werden von der zuständigen staatlichen Behörde.
1. Vorbereitung der Reagenzien
- Verdauungspuffer (1 ml pro Hemisphäre): Man löst ein einheitliches Gemisch von gereinigtem Verdauungsenzyme, beispielsweise Liberase mit geringer Thermolysin Konzentration (TL) auf eine Konzentration von 2 U / ml in Hanks Balanced Salt Solution (HBSS) mit Calcium (Ca) und Magnesium (Mg)
- Waschpuffer mit DNAse: Man löst DNAse I in einer Konzentration von 666U / ml in HBSS (Ca / Mg frei), enthaltend 10% fötales Kälberserum (FCS)
- Waschpuffer ohne DNAse: HBSS (Ca / Mg-frei), das 10% FCS
- Dichtegradienten-Medium (5 ml pro Hemisphäre): Vorbereitung Lager isotonischen Dichtegradienten0; Medium (SIP; 100%) von neun Teile Dichtegradientenmedium Vermischung mit einem Teil 1,5 M Natriumchlorid. Verdünnte SIP bis 25% Dichte durch Zugabe eines geeigneten Volumen HBSS (Ca / Mg frei), enthaltend 3% FCS
- Durchflusszytometrie (FC) Puffer: Bereiten phosphatgepufferter Salzlösung (PBS), enthaltend 3% FCS
2. Vorübergehende Middle Cerebral Artery Occlusion
HINWEIS: Transient mittleren zerebralen Arterienverschluß (MCAO) über den intraluminalen Nahttechnik wurde wie zuvor in 18 12-Wochen alten männlichen C57BL / 6-Mäuse beschrieben durchgeführt.
- Kurz gesagt, betäuben Mäuse mit 2,0% Isofluran in 100% Sauerstoff. Aufrechterhaltung der Körpertemperatur bei 36,5 ° C ± 0,5 ° C durch eine feedback-gesteuerte Heizvorrichtung.
- Nach Ligation der Arteria carotis communis und die äußere Halsschlagader, einzuführen, um den Ursprung der mittleren c eines standardisierten Silizium-Gummi beschichtet Monofilament in der Arteria carotis communis und es voraberebral Arterie.
- Nach 45 Minuten entfernen Sie den Faden Reperfusion zu ermöglichen. Bei scheinoperierten Tiere zurückziehen sofort den Faden nach der mittleren Hirnarterie verschließt Ischämie zu vermeiden.
3. transkardialer Perfusion und Gehirnsezierung
- Bereiten Sie eine Pumpe Schlauchdurchblutung durch ein Ende des Schlauchs in eiskaltem HBSS (Ca / Mg-frei) Eintauchen. Fix eine stumpfe 23 G-Nadel an das andere Ende des Rohres Durchblutung an und schalten Sie die Pumpe vollständig den Schlauch mit HBSS (Ca / Mg-frei) zu füllen.
- Betäuben tief Maus mit 4% Isofluran und einschläfern durch CO 2 Inhalation.
- Bewegen Sie die Maus vom Rücken her auf einer Dissektion Bord in einer Plastikschale eingebettet. Verbreiten Sie Vorder- und Hinterpfoten so breit wie möglich und fixieren sie auf die Zerlegung Platte mit 20 G Nadeln.
- Schnappen Bauchhaut mit einer geraden 1 x 2 Zähne Zange und scharfe Iris Schere verwenden, um einen seitlichen Schnitt durch die Hülle und Bauchdecke zu machen und setzen dieLeber.
- Heben Sie das Brustbein und einschneiden die Membran mit der stumpfen Klinge scharf / stumpf Iris Schere. Weiterhin die seitlichen Brustkorb an beiden Seiten in caudocranial Richtung zu schneiden. Achten Sie darauf, nicht in die Lunge zu verletzen, das Herz und die Brustwandarterien.
- Heben Sie den Hautlappen mit einer stumpfen Pinzette und stecken Sie es auf die Zerlegung Bord. Verwenden stumpfen Ende einer Pinzette und Schere sorgfältig das Herz von Bindegewebe trennen.
- Halten Sie Herz mit einem stumpfen Ende einer Pinzette und legen Sie die Spitze des stumpfen 23 G Nadel mit dem beigefügten Perfusion Rohr in die Spitze des linken Ventrikels. Hinweis: Nicht die Nadel ein zu weit in die linke Herzkammer Verletzung der Scheidewand zu vermeiden. Falls erforderlich, fixieren die Kanüle an Ort und Stelle mit einem geraden scharfen Pinzette.
- Inzision in den rechten Vorhof mit scharfen Iris Schere und gleich wieder an der Pumpe (Fließgeschwindigkeit: 8 - 10 ml / min).
- Weiter Perfusion, bis die Leber ein Licht Kaffee Farbe (~ 30 ml HBSS) zeigt. Währenddie Durchblutung, vermeiden sorgfältig jede Luftblasenbildung in der Rohrleitung.
- Enthaupten die Maus mit gerade chirurgische Scheren direkt hinter dem Schädel. Verwenden Iris Schere ein Mittellinienschnitt der Kopfhaut zu machen, den Schädel freizulegen.
- Legen Sie eine Spitze von scharfen Iris Schere in das Foramen magnum und schneiden seitlich in den Schädel. Wiederholen Sie für die andere Seite.
- Scharfe Iris Schere vorsichtig aus dem gleichen Hohlraum auf der Mittellinie in Richtung der Nase abgeschnitten. Versuchen Sie, die Ende der Schere so oberflächlich wie möglich zu halten Verletzungen des Gehirns zu vermeiden.
- Verwenden feinen Pinzette vorsichtig auf die Schädelknochen von jeder Gehirnhälfte schälen. Hinweis: Infarktgewebe zu den Hirnhäuten oder den Schädel haften; stellen Sie sicher, nicht Hirngewebe aufgrund unvorsichtigen Dissektion zu verlieren
- Heben Sie das Gehirn mit einem Spatel und verwenden scharfe Iris Schere sorgfältig Hirnnervenfasern sezieren, die es auf den Schädel zu beheben. Legen Sie das Gehirn in einen 15-ml-Tube mit 10 ml HBSS gefüllt (+ Ca / Mg) und halten es isthortly auf Eis.
4. Die Dissoziation von Hirngewebe in Einzelzellsuspensionen
- Sorgfältig Hirnstamm und Kleinhirn mit einem sauberen Rasierklinge entfernen. Verwenden Sie einen sauberen Rasierklinge, das Gehirn zu hemisect und jeder Hemisphäre entlang der Frontalebene in drei Stücke von ungefähr gleicher Größe geschnitten.
- Mince seziert Gewebe jeder Hemisphäre durch ein 100 & mgr; m Zelle Sieb des Kolbens Ende einer 5 ml Spritze. Kontinuierlich spülen Sie die Zelle Sieb mit eiskaltem HBSS (+ Ca / Mg). Bewahren homogenisiert Proben auf Eis.
- Zentrifuge bei 286 × g und 4 ° C für 5 Minuten, Verwerfen sorgfältig den Überstand. Das Pellet in 1 ml Verdauungspuffer und übertragen Sie die Suspension in ein 2-ml-Tube. Inkubieren Suspension unter langsamer kontinuierlicher Drehung bei 37 ° C für 1 Stunde.
- Sieve Zellsuspension durch ein 70 um Zelle Sieb und gründlich mit 3 ml Waschpuffer DNAse von 15 ml DNAse-freien Waschpuffer enthält, gefolgt. Zentrifugieren bei 286 · g und 18 ° C für 5 Minuten und den Überstand verwerfen. Hinweis: Hinweis: Die Verwendung von DNAse eliminiert DNA Schleim durch Zelllyse verursacht, die zu Zellaggregation führen könnte das Überleben der Zellen zu beeinträchtigen.
5. Dichtegradientenzentrifugation zur Entfernung von Myelin und Zelltrümmer
- Resuspendieren Zellpellet in 5 ml 25% Dichtegradienten-Medium und Pipetten der Suspension auf eine 15 ml Röhre. Gründlich mischen durch wiederholte und vorsichtiges Pipettieren vermeiden Blasenbildung. Anmerkung: Dichtegradienten-Medium sollte bei RT verwendet werden, um Zell Verklumpung zu verhindern.
- Zentrifuge bei 521 × g und 18 ° C für 20 min. Verwenden niedrigsten Beschleunigungsprofil des Rotors und damit der Rotor ohne Bremse zu stoppen. Entfernen Sie vorsichtig die Röhrchen aus der Zentrifuge ohne Schütteln. aspirieren sorgfältig die Myelinschicht und der Überstand, während das Zellpellet am Boden des Röhrchens beibehalten wird. Hinweis: Stellen Sie sicher, dass die gesamte Myelinschicht zu entfernen, da jede übrig gebliebene wird impair Durchflusszytometrie-Analyse.
- Das Pellet in 10 ml DNAse frei Waschpuffer und pipettieren der Suspension auf eine neue 15-ml-Tube. Anmerkung: Dieser Waschschritt ist entscheidend, da eine ausreichende Entfernung von Medium zu der Menge und Qualität des fertigen Zellprobe deutlich Dichtegradient beiträgt.
- bei 286 · g und 10 ° C für 5 Minuten wieder Zentrifuge und den Überstand verwerfen. Zellzahl und Lebensfähigkeit durch Trypanblau-Ausschluß in einem Hämozytometer resuspendieren Zellen in 100 ul kaltem Waschpuffer und zu bestimmen. Proben bei 4 ° C und weiter zu verarbeiten, sie schnell.
6. Antikörper-Färbung für Analyse über Durchflusszytometrie
- Vor der Antikörpermarkierung, Inkubation der Zellsuspension bei 4 ° C für 10 Minuten mit Anti-Maus-CD16 / CD32-Rezeptor FC Blockierungsreagenz (Endkonzentration von 2,5 ug / ml, Verdünnungsfaktor 1: 200) unspezifische Bindung zu verhindern.
- Hinzufügen Fluorophor-konjugierte primäre Antikörper an der einppropriate Konzentration zu der Zellsuspension (wie in Tabelle 1 angegeben) und für 20 min im Dunkeln bei 4 ° C inkubieren. Anmerkung: Die Kontrollproben sind nicht mit primären Antikörpern gefärbt, aber ansonsten gleich behandelt.
- Wasche die Zellen mit 2 ml FC-Puffer und Zentrifugieren bei 350 xg und 10 ° C für 7 min.Carefully absaugen des Überstandes und Resuspendieren Zellpellet in 200 ul Puffer FC. Speicher vorübergehend Proben bei 4 ° C im Dunkeln bis zur durchflusszytometrischen Analyse.
7. Absolute Quantifizierung durch Zählen Perlen
- Pipette umgekehrt 40 ul FC-Puffer und 10 ul der Zellsuspension in ein Zählrohr mit einer bekannten Zahl von fluoreszierenden Kügelchen enthält. Hinweis: Achten Sie darauf, dass Pipetten kalibriert sind genau 10 ul der Probe zu liefern, wie nachfolgende Berechnung der Leukozytenzahl diesem Band bezieht.
- Inkubieren Zellsuspension mit FITC-markierten CD45-Antikörper (Endkonzentrationvon 5 & mgr; g / ml, Verdünnungsfaktor 1: 100) bei 4 ° C für 20 min im Dunkeln.
- Umgekehrt füllen mit 200 ul Puffer, der den FC Zählrohr ohne Waschschritt und direkt CD45 + Zellen im Durchflußzytometer aufzuzeichnen.
8. Durchflusszytometrischer Acquisition
Hinweis: Um die vorgeschlagenen Antikörpertafel zu analysieren, hat die entsprechende Zytometer mit einem blauen ausgestattet werden (488 nm), Rot (635 nm) und Violett (405 nm) Laser und Filter für FITC, PE, PerCP Cy5.5, PECy7, APC-Cy7 und AmCyan.
- Stellen Sie nach vorne (FSC) und seitwärts (SSC) Streuung von ungefärbten Zellen aus einem ischämischen Hemisphäre verwendet wird. Diskriminieren Dubletten aus einzelnen Zellen in einem Punktdiagramm zeigt die Fläche und Höhe des FSC.
- Anzeige aller Einzelzellen im Einzelparameter-Histogramme für jeden Fluoreszenzkanal verwendet und stellen Sie den Photomultiplier (PMT) Spannungen, so dass einzelne Zellen in der ganz links im Histogramm angezeigt werden.
- Verwenden Sie einen CD45-FITC Einzelgefärbten Probe durch Backgating CD45 hohe Immunzellen in jedem Histogramm und Streudiagramm streuen und PMT-Einstellungen für die Zellen von Interesse zu überprüfen. Hinweis: Passen PMT Spannungen von FITC so dass CD45 negative Zwischen (int) und stark exprimierende Zellen können voneinander unterschieden werden.
- Verwenden Antikörper eingefangen Entschädigung Perlen Multi-Farbkompensation durchzuführen. Stellen Tore für Mikroglia (CD45 int) und Leukozyten (CD45 hoch) und definieren anschließend Leukozyten-Subpopulationen gemäß der Gating-Strategie dargestellt in Abbildung 1.
Ergebnisse
Zerebraler Ischämie wurde in 12-Wochen alten männlichen C57BL / 6-Mäuse über vorübergehende Faden Okklusion der linken Arteria cerebri media (MCAO) initiiert. Für Scheinoperation wurde der Faden eingeführt, um die linke Arteria cerebri media und sofort sofortige Reperfusion zu ermöglichen, zurückgezogen zu verschließen. Wichtig ist, unterscheidet sich zellulären neuroinflammation wesentlich unter häufig angewandt Taktmodelle 19. Dies muss insbesondere berücksichtigt werden, wenn Erkenntnisse aus Tierversuchen auf den heterogenen Pathophysiologie der menschlichen Schlaganfall extrapolieren.
Die Mäuse wurden 24 Stunden nach MCAO getötet zu frühe Immunzellinvasion in die ischämischen Hirn analysieren. Zellzählungen von der ischämischen Hemisphäre erhalten (MCAO ipsi; 0,95 ± 0,25 x 10E6) nach Dichtegradientenzentrifugation mit denen aus der kontralateralen Hemisphäre vergleichbar waren (MCAO contra; 1,09 ± 0,30 x 10E6) und der ipsilateralenHemisphäre von scheinoperierten Mäusen (Schein ipsi; 1,12 ± 0,18 x 10E6, one-way ANOVA, p = 0,524). Die Lebensfähigkeit der isolierten durch Trypanblau-Ausschluss gemessen Zellen war hoch und zwischen den Gruppen (Schein 96,85 ± 0,60%, MCAO contra 97,12 ± 1,18%, MCAO IPSI 95,68 ± 2,04%, one-way-ANOVA, p nicht signifikant unterscheiden = 0,253 ).
Die Zusammensetzung des Gehirn infiltrieren 24 h nach MCAO durch durchflusszytometrische Analyse bestimmt wurde. 1 stellt die Gating-Strategie schema (A) und in einer repräsentativen Schlaganfall Tieres (B). Brain-infiltrierenden Leukozyten wurden als CD45 Hoch Zellen definiert, die aus CD45 int Mikroglia unterschieden werden können. Innerhalb des CD45 hohen Bevölkerungs, neutrophilen Granulozyten (PMN) wurden von Ly-6G Ausdruck identifiziert, während T-Lymphozyten als CD45 hoch CD3 + Zellen abgegrenzt wurden. Die restlichen CD45 hoch Zellen wurden dann unterscheidened von CD19 (B-Lymphozyten) und CD11b-Expression. Die CD11b + Fraktion wurde weiter subkategorisiert in Ly-6C hohe `entzündlichen monocytes` und Ly-6C geringer Bevölkerungs, die Monozyten, dendritische Zellen (DC) und Makrophagen umfasst.
Im akuten Stadium des Schlaganfalls, dominieren myeloischen Immunzellen das Gehirn 3,20 infiltrieren. Neutrophile das Gehirn schnell nach Gefäßverschluss eingeben und den Austritt von entzündlichen Monozyten 21 fördern. 2A zeigt den prozentualen Anstieg von Ly6-G + Neutrophilen im ischämischen Hemisphäre 24 h nach MCAO im Vergleich zum kontralateralen Hemisphäre und Scheinoperation. Im Gegensatz dazu ist der Anteil der CD3 + T-Zellen in den ischämischen Hemisphäre (relativ) niedriger ist als in gesunden Gehirn. Innerhalb des CD11b + Bevölkerung verschiebt Hirnischämie das Gleichgewicht in Richtung einer starken Übergewicht der Ly-6C hoch entzündliche Monozyten (Abbildung2B).
Zusätzlich zur relativen Verteilungen wurden Zählrohre eingesetzt absolute Zahlen von Immunzelluntergruppen in Proben auf der Basis von CD45 positive Ereignisse (3) bestimmen. Zählen Röhrchen enthalten ein lyophilisiertes Pellet, das eine bekannte Anzahl von fluoreszierenden Kügelchen freigibt. Die absolute Zahl der positiven Zellen in der Probe kann durch Bezug zellulären Ereignissen bestimmt werden, um Ereignisse zu Wulst. Zur Berechnung wurde die Anzahl der CD45 hohe Leukozyten pro Hemisphäre die folgende Gleichung verwendet: CD45 hoch Zellen pro Halbkugel = (CD45 hoch Veranstaltungen x Gesamtzählung Perlen / Probe Wulst Ereignisse) x (vollständige Aussetzung Volumen (100 ul) / Probenvolumen (10 ul )). 24 h nach MCAO, insgesamt Leukozytenzahl im Infarkt Hemisphäre wurden im Vergleich zum kontralateralen Hemisphäre und Scheinoperation signifikant erhöht (Abbildung 3D, one-way ANOVA, p = 0,0004). Grafen von der di stinct Immunzelluntergruppen (PMN, T-Zellen, B-Zellen, Ly-6C hoch und Ly-6C niedrigen Monozyten) kann leicht durch Multiplikation ihrer relativen Häufigkeit mit der gesamten CD45 hohe Leukozyten-Zahl der jeweiligen Probe berechnet werden.
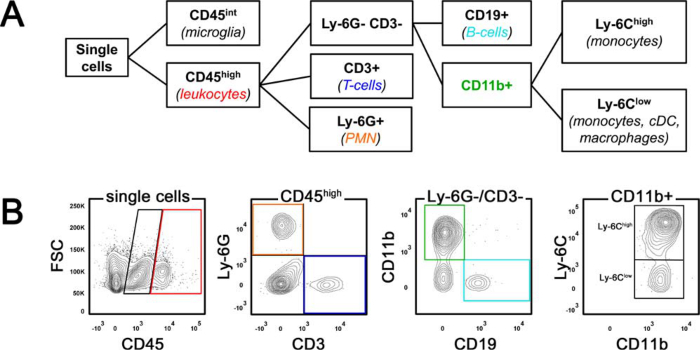
Abbildung 1. Gating-Strategie für die Durchflusszytometrie. (A) Schematische Darstellung des Gating-Strategie. (B) zeigt durchflusszytometrische Analyse von isolierten Leukozyten aus einer repräsentativen Mausgehirn 24 h nach der mittleren zerebralen Arterienverschluss. FSC Vorwärtsstreuung, PMN neutrophilen Granulozyten, CDC klassischen dendritischen Zellen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
ftp_upload / 53658 / 53658fig2.jpg "/>
Abbildung 2. Differenzierung von Immunzellen Subsets. Relative Verteilung der Ly-6G + -neutrophils (A), CD3 + T-Zellen (A) und Monozyten-Teilmengen identifiziert durch differentielle Expression von Ly-6C (B) in der ipsilateralen (ipsi) und kontralateralen ( contra) Hemisphäre 24 Stunden nach der mittleren Hirnarterie (MCAO) oder einer entsprechenden Scheinoperation. Prozentsatz jeder Population im Tor angezeigt wird. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
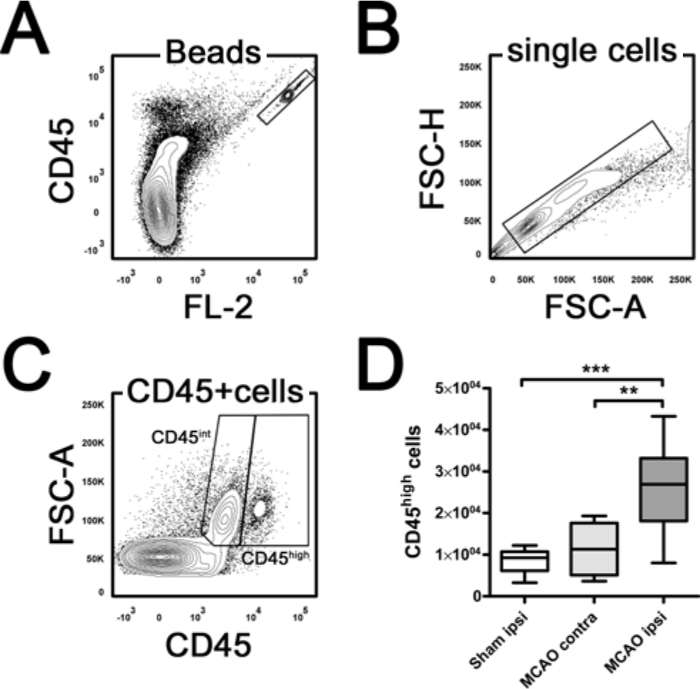
Abbildung 3. Die Quantifizierung von Brain Leukozyten von Perlen Zählen. (A) zeigt die hoch doppelt positiven Wulst Tor. Innerhalb der einzelnen Zellpopulation (B) CD45 int Mikroglia können von CD45 hohe Leukozyten (C) unterschieden werden. Für die Quantifizierung wurde die Zahl der gated CD45 hoch Ereignisse normiert auf den Wulst Ereignisse gezählt. Beachten Sie, dass insgesamt Leukozyten (CD45 hoch) zählt in der ipsilateralen (IPSI) Hemisphäre im Vergleich zur Gegenseite (contra) Hemisphäre und Scheinoperation 24 Stunden nach der mittleren Hirnarterie (MCAO) deutlich erhöht. ** P <0,01, *** p <0,001 durch Einweg-ANOVA und Tukey`s Post-hoc-Test multiple Vergleiche. n = 4-6 pro Gruppe. FSC Vorwärtsstreuung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Fluorochrom | FITC | PE | PerCP | PC7 | APC-Cy7 | V500 |
| (Cy5.5) | ||||||
| Antigen | CD45.2 | CD3 | Ly-6G | CD19 | Ly-6C | CD11b |
| Endgültige Konzentration [g / ml] | 5 | 1 | 0,2 | 0,2 | 1 | 1 |
| Verdünnungsfaktor | 1/100 | 1/200 | 1 / 1.000 | 1 / 1.000 | 1/200 | 1/200 |
| Klon | 104 | 145-2C11 | 1A8 | 6D5 | AL-21 | M1 / 70 |
Tabelle 1. Grund Antikörper-Cocktail für Immunzellidentifikation in der ischämischen Hirn.
Diskussion
Hier beschreiben wir eine einfache und effektive Methode zur Isolierung von Leukozyten aus dem Maus-Gehirn nach experimentellem Schlaganfall. Der Ansatz zuverlässig liefert eine hohe Reproduzierbarkeit der Zellzahl pro Gehirnhälfte so dass unterschiedliche Strömungsplatten in eine biologische Replikation zu messen.
Offensichtlich führt eine unvollständige Entfernung von Blut einschließlich Immunzellen in einem verzerrten Bild über die tatsächliche Höhe der Entzündungszellen, die den ischämischen Hirn eingetragen. Somit wird, wenn dieses Protokoll verwenden besonderes Augenmerk auf gründliche transkardialer Perfusion Kontamination von infiltriert Immunzellen mit nicht-entzündlichen zirkulierenden Leukozyten zu verhindern. Aus Erfahrung, reduziert die Verwendung von stumpfen Nadeln für die linke Herzkammer Punktion das Risiko für Verletzungen der Scheidewand, die Durchblutung des Körperkreislauf umgehen würde. Entstehung der Perfusion Flüssigkeit aus den Nasenlöchern ein Zeichen dafür, dass die Perfusion zu hoch pressureis somit einLeere Flussraten> 10 ml / min. Pale auf weiße Farbe des Hirngewebes zeigt eine gute Durchblutung während rosa Farbe ein Zeichen von schlechter Durchblutung ist.
Ein weiterer kritischer Schritt dieses Protokoll ist effizient Dissoziation des Hirngewebes, die mechanische Fragmentierung sowie enzymatischen Abbau aufweist. das Gewebe durch die Zelle Sieb Zerkleinern ist entscheidend verbesserte Wirksamkeit von Proteasen zur Verfügung zu stellen. Wenn jedoch das Gewebe zu homogenisieren, dass kein übermäßiger Druck als mononukleare Phagozyten zu sehr anfällig sind Autolyse 22. Zur enzymatischen Verdauung Liberase TL wird empfohlen, die eine Mischung von hoch gereinigten Collagenase I und II, die geringe Konzentrationen des neutralen Protease Thermolysin enthält. Der direkte Vergleich mit den zuvor beschriebenen Isolierung Protokolle 14,22,23 wesentlich höhere Ausbeute an lebensfähigen Zellen durch Liberase TL Behandlung (KM unveröffentlichte Daten) ergab. Im Vergleich zu Collagenase, die häufig verwendet werdend für die Isolierung von Immunzellen aus dem Gehirn, enthält Liberase TL vernachlässigbare Niveaus an Endotoxin. Dies ist von besonderer Bedeutung, wenn die Zellen für die nachfolgende Analyse sortiert werden, da hohe Konzentrationen von Endotoxin könnte den Aktivierungszustand von Immunzellen 24 und streng Kultur 25 Ziele beeinträchtigen Zelle verändern. Ein weiterer Nachteil der traditionellen Kollagenase ist signifikant lot-to-lot Unterschiede in den Enzymaktivitäten, die Reproduzierbarkeit der Ergebnisse gefährdet und erfordert die Bestimmung der Arbeitskonzentration für jede Partie 26.
Im erwachsenen Gehirn, Myelin Entfernung durch Dichtegradienten-Zentrifugation ist ein unverzichtbarer Schritt für Downstream-Anwendungen wie Durchflusszytometrie oder weitere Studien über Gens oder der Proteinexpression. Ein Hauptvorteil des Protokolls ist die Einzelschichtdichte Prozedur, die nicht zeitaufwendig Herstellung von Steigungen erfordert. Darüber hinaus erzeugt die Trennung Protokoll zuverlässiges Ergebniss auch wenn sie von eher unerfahrene Experimentatoren durchgeführt. Es ist frei von Schichtverläufe mit Dichten nahe beieinander, die, ohne die Schnittstelle dazwischen Pipette schwierig sind.
Basierend auf der Expression des CD45 Oberflächenmarker, ergibt das Protokoll drei Hauptzellkategorien im ischämischen Gehirn. Die überwiegende Mehrheit von Zellen gehören zu einer CD45 Unterpopulation, die von neuronalen Zellen, Astroglia, Ependymzellen und Endothelzellen besteht. Deren reichlich Präsenz ist mit dem Single-Layer-Dichtegradienten zugeschrieben, die auf effiziente Myelin und Müllbeseitigung in erster Linie zielt. Zusätzlich kann eine CD45 int Wohnbevölkerung Mikroglia aus 27 von einem CD45 hohen Bevölkerungs unterschieden werden, die in erster Linie hämatogene Leukozyten enthält infiltrieren. Es sollte jedoch angemerkt, dass aktiviert werden Mikroglia den Phänotyp und die Funktion von Blut stammenden myeloiden Zellen annehmen. Somit wird nur die Anwendung sophisticated Techniken wie Parabiose 28, Chimären Knochenmark 29 oder Schicksal Mapping-Analyse 30 ermöglichen eine klare Unterscheidung zwischen diesen beiden Populationen während der Entzündung.
Datenanalyse in der Durchflusszytometrie ist oft auf die prozentuale Verteilung von spezifischen Zellpopulationen beschränkt. Wenn jedoch die Infarkt Hemisphäre zu Nicht-Infarkt-Hirngewebe zu vergleichen können diese Informationen irreführend sein, da es nicht die gesamte Gehirn Leukozytenzahl hält, die durch ischämische Verletzung geändert werden. So ein vollständiges Bild von der Größe und Ausprägung Entzündungsinfiltrate zu ziehen nach Schlaganfall relative Verteilung der Immunzelluntergruppen sollten durch absolute Zellzahlen ergänzt werden. Wenn Mikrokügelchen unter Verwendung der in diesem Protokoll beschrieben, Pipettieren eines genauen Probenvolumens ist zwingend erforderlich, um zuverlässige Ergebnisse zu erhalten. Darüber hinaus wird umgekehrt Pipettieren dringend empfohlen, die Schaumbildung in dem Zählrohr zu vermeiden. Anfallende Luftblasenwürde die erwartete Volumen der Mikroperlen reduzieren und damit zu einer Überschätzung der absolute CD45 hohe Leukozytenzahl in der Probe führen.
Zusammenfassend stellt dieses Protokoll eine einfache und zuverlässige Ansatz für Immunzellen aus dem Gehirn isoliert werden. Es kann als ein wertvolles Instrument dazu dienen, die Komplexität der entzündlichen Reaktion auf einen ischämischen Schlaganfall zu sezieren. Zukünftige Anwendungen umfassen Untersuchungen der zeitabhängigen Rolle von Monozyten in Teilmengen Ausbreitung und Auflösung von ischämischen Gehirnentzündung. In ähnlicher Weise ist die Rolle des adaptiven Immunsystems nach Schlaganfall kaum verstanden. Die durchflusszytometrische Analyse der T-Zell-Subpopulationen identifiziert durch die Expression von Teilmenge spezifischen Transkriptionsfaktoren oder Cytokine in situ könnte helfen, ihre Auswirkungen auf die langfristige Erholung nach einem Schlaganfall zu klären und somit offen vielversprechende Möglichkeiten für die Entwicklung neuer Behandlungsansätze.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Die Autoren danken Isabell Schulz für einen ausgezeichneten technischen Support.
Materialien
| Name | Company | Catalog Number | Comments |
| Peri-Star Pro Peristaltic Pump, 4-channel | World precision instruments | PERIPRO-4LS | |
| Heracell 240i CO2 incubator | Thermo Scientific | ||
| MACSmix Tube Rotator | Miltenyi Biotec GmbH | ||
| Heraeus Multifuge 3SR+ | Thermo Scientific | ||
| FACS Canto II | Becton Dickinson | ||
| Isoflurane | Abbott | 4831850 | |
| Hank's buffered salt solution (HBSS) | Gibco/Life Technologies GmbH | 14175-129 | |
| HBSS with Calcium/Magnesium | Gibco/Life Technologies GmbH | 24020-091 | |
| Liberase TL | Roche Diagnostics GmbH | 5401020001 | use at room temperature |
| Percoll Plus | GE Healthcare Europe GmbH | 17-5445-01 | |
| Fetal bovine serum | PAN Biotech | 3302-P101003 | |
| Trypan blue | Gibco/Life Technologies GmbH | 15250-061 | |
| Trucount | BD Biosciences | 340334 | |
| Phosphate buffered saline | Biochrom AG | L 182-10 | |
| DNAse I | Roche Diagnostics GmbH | 11284932001 | |
| CD11b Horizon V500 | BD Biosciences | 562128 | |
| CD16/CD32 | eBioscience | 14-0161 | |
| CD45.2 FITC | eBioscience | 11-0454 | |
| CD3 PE | Biolegend | 100307 | |
| CD19 PE-Cy7 | Biolegend | 115519 | |
| Ly6C APC-Cy7 | BD Biosciences | 560596 | |
| Ly6G PerCP-Cy5.5 | BD Biosciences | 560602 | |
| Silicone Tubing, 1m | World precision instruments | 503022 | |
| Fine Iris Scissors sharp | Fine Science Tools | 14094-11 | |
| Surgical Scissors | Fine Science Tools | 14130-17 | |
| Fine Iris Scissors sharp/blunt | Fine Science Tools | 14028-10 | |
| Straight 1x2 teeth forceps | Fine Science Tools | 11021-14 | |
| Blunt-end Forceps | Fine Science Tools | 11008-13 | |
| 5ml syringe plunger | Carl Roth GmbH (Braun) | EP96.1 | |
| Cell strainer, 100µm | Dr. I. Schubert, BD | 2360-00 | |
| Omnican Fine dosage syringe 1ML | Braun | TBD | |
| Cell strainer, 70µm | Greiner Bio-One GmbH | 542 070 | |
| FACS Tubes | BD Bioscience GmbH | 352052 | |
| serological pipettes, 10ml | Greiner Bio-One GmbH | 607180 | |
| serological pipettes, 10ml | Sarstedt AG&Co | 861,254,025 | |
| serological pipettes, 25ml | Greiner Bio-One GmbH | 760180 | |
| serological pipettes, 5ml | Greiner Bio-One GmbH | 606180 | |
| serological pipettes,25ml | Sarstedt AG&Co | 861,685,020 | |
| serological pipettes,5ml | Sarstedt AG&Co | 861,253,025 | |
| Tips, 0,1-10µl | Corning B.V.Life Sciences | 4840 | |
| Tips, 100-1000µl | Greiner Bio-One GmbH | 740290 | |
| Tips, 10-200µl | Greiner Bio-One GmbH | 739296 | |
| Reaction tubes 1,5ml | Greiner Bio-One GmbH | 616201 | |
| Reaction tubes 2ml | Greiner Bio-One GmbH | 623201 | |
| Bacteriological petri dish, 94x16mm | Greiner Bio-One GmbH | 633180 | |
| Falcon 15ml | Greiner Bio-One GmbH | 188271 | |
| Falcon 50ml | VWR International GmbH (BD) | 734-0448 | |
| Neubauer hemocytometer | Biochrom AG | PDHC-N01 | |
| razor blade | Carl Roth GmbH | CK07.1 |
Referenzen
- Courties, G., et al. Ischemic stroke activates hematopoietic bone marrow stem cells. Circulation research. 116 (3), 407-417 (2015).
- Iadecola, C., Anrather, J. The immunology of stroke: from mechanisms to translation. Nature medicine. 17 (7), 796-808 (2011).
- Möller, K., Boltze, J., Pösel, C., Seeger, J., Stahl, T., Wagner, D. -. C. Sterile inflammation after permanent distal MCA occlusion in hypertensive rats. Journal of cerebral blood flow and metabolism. 34 (2), 307-315 (2014).
- Sughrue, M. E., Mehra, A., Connolly, E. S., D'Ambrosio, A. L., et al. Anti-adhesion molecule strategies as potential neuroprotective agents in cerebral ischemia: a critical review of the literature. Inflammation research. 53 (10), 497-508 (2004).
- Dimitrijevic, O. B., Stamatovic, S. M., Keep, R. F., Andjelkovic, A. V. Absence of the chemokine receptor CCR2 protects against cerebral ischemia/reperfusion injury in mice. Stroke. 38 (4), 1345-1353 (2007).
- Gliem, M., et al. Macrophages prevent hemorrhagic infarct transformation in murine stroke models. Annals of neurology. 71 (6), 743-752 (2012).
- Geissmann, F., et al. Blood monocytes: distinct subsets, how they relate to dendritic cells, and their possible roles in the regulation of T-cell responses. Immunology and cell biology. 86 (5), 398-408 (2008).
- Dunay, I. R., Fuchs, A., Sibley, L. D. Inflammatory monocytes but not neutrophils are necessary to control infection with Toxoplasma gondii in mice. Infection and immunity. 78 (4), 1564-1570 (2010).
- Hammond, M. D., et al. CCR2+ Ly6C(hi) inflammatory monocyte recruitment exacerbates acute disability following intracerebral hemorrhage. The Journal of neuroscience. 34 (11), 3901-3909 (2014).
- Shichita, T., et al. Pivotal role of cerebral interleukin-17-producing gammadeltaT cells in the delayed phase of ischemic brain injury. Nature medicine. 15 (8), 946-950 (2009).
- Liesz, A., et al. Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke. Nature medicine. 15 (2), 192-199 (2009).
- Kleinschnitz, C., Wiendl, H. Con: Regulatory T cells are protective in ischemic stroke. Stroke. 44 (8), 87-88 (2013).
- Hu, X., Li, P., Chen, J. Pro: Regulatory T cells are protective in ischemic stroke. Stroke. 44 (8), e85-e86 (2013).
- Möller, K., Stahl, T., Boltze, J., Wagner, D. -. C. Isolation of inflammatory cells from rat brain tissue after stroke. Experimental & translational stroke medicine. 4 (1), 20 (2012).
- Foster, B., Prussin, C., Liu, F., Whitmire, J. K., Whitton, J. L., Coligan, J. E. Detection of intracellular cytokines by flow cytometry. Current protocols in immunology. , (2007).
- Albu, D. I., Califano, D., Avram, D. Flow cytometry analysis of transcription factors in T lymphocytes. Methods in molecular biology. 647, 377-390 (2010).
- Prinz, M., Priller, J., Sisodia, S. S., Ransohoff, R. M. Heterogeneity of CNS myeloid cells and their roles in neurodegeneration. Nature neuroscience. 14 (10), 1227-1235 (2011).
- Wagner, D. -. C., et al. Allometric dose retranslation unveiled substantial immunological side effects of granulocyte colony-stimulating factor after stroke. Stroke. 45 (2), 623-626 (2014).
- Zhou, W., et al. Postischemic brain infiltration of leukocyte subpopulations differs among murine permanent and transient focal cerebral ischemia models. Brain pathology. 23 (1), 34-44 (2013).
- Gelderblom, M., et al. Temporal and spatial dynamics of cerebral immune cell accumulation in stroke. Stroke. 40 (5), 1849-1857 (2009).
- Soehnlein, O., Lindbom, L. Phagocyte partnership during the onset and resolution of inflammation. Nature reviews. Immunology. 10 (6), 427-439 (2010).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nature protocols. 1 (4), 1947-1951 (2006).
- Arac, A., et al. Systemic augmentation of alphaB-crystallin provides therapeutic benefit twelve hours post-stroke onset via immune modulation. Proceedings of the National Academy of Sciences of the United States of America. 108 (32), 13287-13292 (2011).
- Mattern, T., et al. Endotoxin and lipid A stimulate proliferation of human T cells in the presence of autologous monocytes. Journal of immunology. 153 (7), 2996-3004 (1950).
- Berney, T., et al. Endotoxin-mediated delayed islet graft function is associated with increased intra-islet cytokine production and islet cell apoptosis. Transplantation. 71 (1), 125-132 (2001).
- McShane, P., Sutton, R., Gray, D. W., Morris, P. J. Protease activity in pancreatic islet isolation by enzymatic digestion. Diabetes. 38, s126-s128 (1989).
- Ford, A. L., Goodsall, A. L., Hickey, W. F., Sedgwick, J. D. Normal adult ramified microglia separated from other central nervous system macrophages by flow cytometric sorting. Phenotypic differences defined and direct ex vivo antigen presentation to myelin basic protein-reactive CD4+ T cells compared. Journal of immunology. 154 (9), 4309-4321 (1950).
- Ajami, B., Bennett, J. L., Krieger, C., Tetzlaff, W., Rossi, F. a. b. i. o. M. V. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life. Nature neuroscience. 10 (12), 1538-1543 (2007).
- Mildner, A., et al. Distinct and non-redundant roles of microglia and myeloid subsets in mouse models of Alzheimer's disease. The Journal of neuroscience. 31 (31), 11159-11171 (2011).
- Ginhoux, F., et al. Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science. 330 (6005), 841-845 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten