A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תלת ממדי Assay תרבות לחקור הפולשנות תאים סרטניים היווצרות גידולים בלוויין
In This Article
Summary
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
תרבית תאים יונקת monolayers נעשתה שימוש נרחב ללמוד תהליכים פיסיולוגיים ומולקולריים שונים. עם זאת, גישה זו ללמוד תאי גדלים מניבים לעתים חפצים לא רצויים. לכן, תרבית תאים בסביבה תלת ממדי (3D), לעתים קרובות תוך שימוש ברכיבים תאים מטריקס, הגיחה כחלופה מעניינת בשל דמיון הקרוב אל הילידים ברקמות vivo או איבר. פתחנו מערכת תרבית תאי 3D באמצעות שני תאים, כלומר (אני) תא מרכזי המכיל תאים סרטניים מוטבעים מתנהג ג'ל קולגן כגידול macrospherical פסאודו-יסודי (ii) תא היקפי תא ללא עשוי ג'ל הפיברין, כלומר מרכיב תא מטריקס שונה מאלה ששמשו במרכז, שבו תאים סרטניים יכולים לנדוד (מול פלישה) ו / או יוצרים גידולי microspherical המייצג גידולים משניים או בלווין. ההיווצרות של גידולי לווין בתא הפריפריה היאלהפליא בקורלציה פי מידת האגרסיביות ידוע או מוצא גרורתי של תאים סרטניים הילידים, מה שהופך מערכת התרבות 3D זה ייחודי. גישת תרבית תאים זה עשוי להיחשב להעריך הפולשנות תאים סרטניים תנועתיות, אינטראקציות מטריקס-תאיים תא כשיטה להעריך נכסי תרופה אנטי-סרטניים.
Introduction
חקירת המאפיינים הבסיסיים ואת הביו-רפואיים של פלישת תאים סרטניים / הגירה והקמת גרורות הבאה היא הנושא של 1,2 מחקר אינטנסיבי. גרורה היא לשלב הסופי של הסרטן והניהול הקליני שלה נותר חמקמק. הבנה טובה יותר של גרורות ברמות התאיות ומולקולריות תאפשר הפיתוח של טיפולים יעילים יותר 3.
מספר מאפיינים של תאים גרורתי יכולים להיחקר במבחנה 4 כולל stemness והפוטנציאל שלהם לרכוש מדינה מעברת (למשל, מעבר mesenchymal-epithelioid) להגר ולפלוש בתוך מן הגידול הראשוני 5. עם זאת, ההערכה חוץ גופית של תהליכים הפלישה / גרורות כבר אתגר שכן הוא כמעט אינו כולל את התרומה של זרימת הדם / הלימפה. תרבויות Organotypic מטמיעי שברי גידול ג'ל קולגן יש לשנים קודמותערמומי נעשה שימוש כדי לפקח תוקפנות הסרטן. למרות המורכבות של גידולים נשמרות (למשל, הנוכחות של תאים לא סרטניים), שברי גידול נחשפות דיפוזיה בינוני מוגבל, כדי וריאצית דגימה, וכדי גידול יתר של תאי סטרומה 6. שיטה חלופית מורכבת בגידול תאים סרטניים בתוך מרכיבי תאי מטריקס (ECM), אשר מחק את סביבת התא תלת ממדי (3D). הריבוי של שורות תאי סרטן שד ג'ל קולגן ו / או מרתף קרום נגזר מטריקס הוא בין הדוגמות המאופיינות ביותר של תרבית תאי 3D. באמצעות סביבות תרבות תא ספציפיות 3D, ההרכבה לא המאורגנת שנצפתה עבור תאי סרטן השד גדלו בתנאים סטנדרטיים יכולה להיות הפוכה להיווצרות הספונטנית של acini החלב כגלילים 7-10. יתר על כן, היווצרות spheroids הגידול רב-תאיים שמקורם בתאי סרטן אדנוקרצינומה התקהלו שימוש בטכניקות שונות (למשל, תלוי טיפות, צוף spheroids, אגר embedment) מהווה כיום את assay תרבית תאי 3D הנפוץ ביותר 11-13. עם זאת, assay זה הוא מוגבל על ידי הקבוצה המוגבלת של שורות תאי הסרטן שיכול ליצור spheroids ועל ידי התקופה הקצרה הזמינה ללמוד תאים בתנאים אלה.
בטכניקה דמיינה זו, אנו בזאת להציג assay תרבות מתוחכם תא 3D שבו תאים סרטניים של עניין מוטבעים ג'ל קולגן לאפשר במבחנת היווצרות גידול פסאודו-יסודיים שניתן מצופה לחלופין עם מטריצת קרום הנגזרות במרתף. מרגע היווצרותם, הגידול פסאודו-יסודיים ואז היא דחוקה מטריקס acellular (ג'ל הפיברין במקרה הנוכחי), אשר מאפשר את התאים הסרטניים לחצות את הממשק בין שני תאי מטריקס (ראה איור 1). מעניין, מבני גידול דמוי משני שמקורם מן הגידול פסאודו-יסודי יחד עם תאי סרטן אגרסיביים מופיעיםג'ל הפיברין. מערכת כזו תרבות 3D מציעה את הגמישות הנדרשת כדי לחקור, למשל, תרופות נגד סרטן, ביטוי גנים תאים תאים ו / או תא-ECM אינטראקציות 14-16.
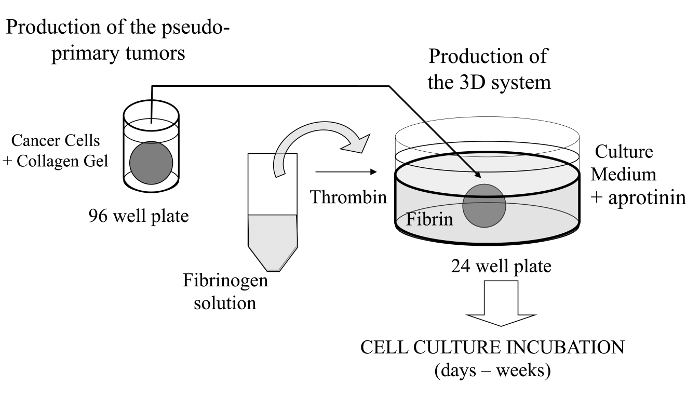
איור 1:.. סקירה כללית של שיטת סיכום סכמטי של השיטה כדי ליצור את מערכת תרבית תאי 3D כמודל ללימודי סרטן אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
הערה: אין שיקול אתיקה מאז תאים מן החי וסרטן האדם נרכשו או בתנאי בחביבות לנו.
1. ביצוע תקעי קולגן (גידול פסאודו-יסודי)
- כן פיזור קולגן. Type I הקולגן בגידים זנב חולדה (RTT) ניתן לחלץ או עיקור כפי שדווח בעבר 17, או לרכוש. לפזר קולגן RTT מיובש בהקפאה (3.25-3.50 מ"ג / מ"ל חומצה אצטית 0.02 N) באמצעות בלנדר (הגדרת מהירות גבוהה; חמש 2 ריצות דקות) עבור ערבוב אחיד.
- הקציר (טריפסין-EDTA, בדרך כלל) ולהשתמש הרחקה כחולה trypan לספירת תאי קיימא באמצעות hemocytometer. התאם את צפיפות התאים הרצוי (5 x 10 4 תאים לכל תקע).
- הכן את כל פתרונות (NaOH, בסרום שור העובר, DMEM 5x, NaHCO 3) בנפרד (טבלה 1) בתנאים סטריליים ולשמור מקורר על הקרח. הערה: הסדר של תוספת של הפתרונות השונים חשוב למנוע זעזועים האוסמוטי או חומצי בתאים.
- בצע פיזור תאים (1.25 x 10 6 תאים) לתוך התמיסה קולגן הסופי (5 מ"ל) כמה שיותר מהר. מערבבים היטב (על ידי pipetting למעלה ולמטה), תוך הימנעות בועות אוויר, ולאחר מכן במהירות להפיץ 200 μl של מוכן לשימוש פתרון היטב בכל צלחת 96-היטב. בעדינות להכות את הצלחת רבה גם על משטח העבודה באזור של מכסה מנוע תרבית תאים כדי להסיר בועות אוויר כדי להפיץ את הפתרון באופן שווה בתוך הבארות.
- לאחר מילוי כל הבארות (שלב זה לוקח בערך 15-20 דקות לכל צלחת 96-היטב), ולאחסן אותו לתוך החממה.
- דגירה את הצלחת ב 37 ° C מ 2 שעות עד לילה. Gelation קולגן (כלומר, fibrillogenesis) מתרחש תוך 30 דקות. הוסף בינוני תרבות (100 μl / טוב) לתרבות לבצע דגירת לילה.
2. שכבה ראשונה של ג'ל פיברין
- הכנת פתרון פיברינוגן.
הערה: באותה אצווה של ג'ל הפיברין רצוי לשמש resul לשחזור יותרts, הפיברין היווצרות קריש עשוי להשתנות בין קבוצות שונות של פיברינוגן הקפאת מיובש מסחרי.- השתמש תמיד פתרון פיברינוגן מוכן טרי. תביאו את פיברינוגן מיובש בהקפאה לטמפרטורת החדר לפני פתיחת הבקבוקון כדי למנוע היווצרות גבישים מימה.
- בהדרגה לפזר את פיברינוגן ב מחומם מראש (37 ° C) מאוזן של האנק מלח פתרון (HBSS) עם Ca 2 + / Mg 2 + בריכוז העבודה של 3 מ"ג / מ"ל (לשקול הכנת עודף 15% של נפח סופי המינימלי הנדרש למשל, 17.25 מ"ג ב 5.75 מ"ל פתרון 5 מ"ל):.
- הוסף dropwise מראש חימם HBSS תחילה solubilize שברי פיברינוגן. לשבור שבר גדול עם מרית בכוס. להתסיס את הכוס מעת לעת כדי להקל ערבוב. אין להשתמש צלחת בוחשת במהלך ההליך. ממס את האבקה הנותרת על ידי pipetting ההשעיה למעלה ולמטה.
- שמור את פתרון פיברינוגן פושר בעוד SteriLizing הפתרון על ידי העברתו דרך מסנן 0.22 מיקרומטר. הערה: אם HBSS אינו חם מספיק או פיברינוגן לא נמס לגמרי, הפתרון שעלול לסתום את המסנן. במידת הצורך, להחליף פילטר פעם או פעמיים, אשר עשוי להקטין את ריכוז פיברינוגן, ובכך נוקשות הפיברין קריש.
- להשעות את התאים של עניין (למשל, תאי אנדותל) לתוך פתרון פיברינוגן מוכן לשימוש תוך התאמת הנפח הסופי שלה, הכוהל חלופי.
- הכנת פתרונות טרומבין.
- כן פתרון מניות DDH 2 O (50 יחידות NIH / מיליליטר), ואז לעקר אותה באמצעות מסנן 0.22 מיקרומטר.
- השתמש יחס פיברינוגן / תרומבין ≥1: 0.0075 (v / v) על מנת ליצור את הג'ל הפיברין.
- יצירת הג'ל הפיברין.
- שמור את פיברינוגן סטרילית תרומבין פתרונות מניות על קרח במהלך כל השלבים הבאים. הג'לים הפיברין מותרים להיוצר 24 גם צלחות.
- ה כיסוי מידמשטח הדואר של כל טוב עם פתרון פיברינוגן (200 μl / טוב), תוך הימנעות היווצרות בועת אוויר. לעבד 6 בארות בכל פעם.
- לאחר פתרון פיברינוגן מכסה לחלוטין את פני השטח של בארות, להטות את הצלחת בזווית של 45 מעלות ולהוסיף 1.5 μl של פתרון תרומבין אל הבאר הראשונה על ידי הטלת תרומבין למרכז הבאר, ואז בעדינות מערבולת את הצלחת אופקית עבור 1-2 שניות.
- השאר את הצלחת במצב יציב מתחת למכסת מנוע הזרימה למינרית (5-10 דקות) עד לתום התהליך gelation / קרישה השלים (NB: התהליך פילמור ואסור להפריע, למשל, על ידי הובלת הצלחת אל האינקובטור).
- לאחר שש הבארות הראשונות יש polymerized, לחזור על הרצף הזהה (כלומר 3 שלבים קודמים) במשך שש הבארות הבאות עד שכל הבארות כבר מעובד.
3. שכבה שנייה של ג'ל הפיברין הדחוק קולגן Plug
- אוֹפְּצִיָהת: (באמצעות תקע קולגן מיד).
- ודא כי השכבה הראשונה של ג'ל הפיברין יש polymerized בכל הבארות על ידי הטיית הצלחת בעדינות. מניחים את צלחת 96-היטב המכיל את הצד אטמי ג'ל קולגן על ידי הצד עם צלחת 24 גם (המכיל את הג'לים הפיברין) כדי להקל העברת המצתים קולגן.
- הוסף טיפה אחת של HBSS לבאר כל צלחת המכילה את המצתים קולגן.
- הסר כל תקע קולגן מהבאר עם מחט דקה רכוב על מזרק (המשמש כידית) או באמצעות מיקרו-כף (ראה וידאו). העבר כל תקע קולגן על שכבת ג'ל הפיברין הראשון באמצעות מיקרו-כפיות אחד או שניים, תוך שהוא מוודא את התקע קולגן הוא מרוכז היטב לתוך הבאר ועקרות שמתוחזק היטב.
- Overlay הג'ל הפיברין יצר בעבר עם השכבה השנייה של פתרון פיברינוגן (300 μl / טוב) ולהציג את תרומבין כמתואר 2.3, שמירה על 1 מינימאלי:. יחס 0.0075 ו רצף של שש בארות בכל פעם
- אפשרות ב '(ציפוי תקע קולגן עם שכבה דקה של ממברנה מרתף Growth Factor-מופחת (GFRBM)).
- כל מגניב הפתרונים והמכשירים המוכנים מראש ולשמור אותם ב 4 ° C או על קרח (למשל, טפטפות, טיפים, מבחנות) במהלך טיפול מאז aliquots הקפוא של GFRBM רגישים מאוד שיעור חימום יתר במהלך המפשיר (בהתאם להוראות היצרן) .
- בעקבות הסרת מבארות צלחת, להשרות כל תקע קולגן עבור 2 דקות בתוך צינור צנטריפוגות 1.5 מ"ל על הקרח המכיל 100 μl של פתרון GRFBM טהור.
- העבר כל תקע מצופה על שכבת הפיברין הראשונה תוך הבטחה זה מרוכז היטב, כפי שתואר קודם לכן. דגירה צלחות המכילות-תקע על 37 מעלות צלזיוס למשך 5 דקות כדי לאפשר GRFBM לגבש ג'ל. מוסיפים את שכבת הפיברין השני כמו בשלב 3.1.4.
4. Cell תנאי בינוני תרבות
- ממלאים כל טוב עם בינוני תרבות (400 μl). התקשורת ותוספי התרבות תיבחרנה על בסיס שורת התאים ותנאים ניסיוניים.
- להוסיף aprotinin, סוכן antifibrinolytic, עד בינוני תרבות בריכוז סופי של יחידות מעכב kallikrein 100 (קיו) / מ"ל.
הערה: אחסן את הצלחות באינקובטור תרבית תאים בתנאים המשמשים הקו הסלולרי נבדק. - לחדש תרבויות עם מדיום חדש בכל יום אחר או על פי לוח הזמנים הניסיונות, ולהוסיף aprotinin. לפני הוספת בינוני טרי, מעט להטות את הצלחת (בזווית 30-35 מעלות) ו להטות את pipet על הצד של הבאר תוך בחינה זהירה שאיבת בינוני מותנה תחת השגחה מתמדת.
תוצאות
כאמור, תכונה מעניינת של assay תרבית תאי 3D זה היא כי תאים סרטניים לא יכולים להעביר רק משקעים קולגן כדי הג'ל הפיברין הסמוך, אלא גם להקים גידולים משניים (למשל, לווין גידול מבנים דמויים). זה ניתן לצפות ישירות עם מיקרוסקופ לעומת שלב הפוך בהגדלות נמוכות...
Discussion
בתור הערת שוליים טכני חשוב, זה חיוני כי אין פער קיים בממשק בין מרכזי הג'לים הפריפריה. אחרת, זה עלול להפחית את היכולת של התאים לנדוד / לפלוש הג'ל הפיברין. רווח בין קולגן ג'לים הפיברין עלול להיווצר במהלך תרבות 24 שעות של הראשון אם תרומבין לא דוללו כראוי. אפשר גם כי שור...
Disclosures
The authors have no disclosure.
Acknowledgements
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materials
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
References
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved