Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Dreidimensionale Kulturtest auf Krebszelle Invasivität und Satelliten Tumorbildung erkunden
In diesem Artikel
Zusammenfassung
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Zusammenfassung
Säugerzellkultur in Monolayern wird weithin verwendet, um verschiedene physiologische und molekulare Prozesse zu untersuchen. dieser Ansatz jedoch zu wachsenden Zellen studieren erzeugt oft unerwünschte Artefakte. Daher Zellkultur in einem dreidimensionalen (3D) Umgebung, die oft extrazelluläre Matrixkomponenten verwenden, erwies sich als eine interessante Alternative wegen seiner Ähnlichkeit mit dem nativen in vivo Gewebe oder Organ. Wir entwickelten ein Kultursystem 3D - Zelle zwei Abteilen unter Verwendung, nämlich (i) eine zentrale Kammer Krebszellen enthält , in einem Kollagengel wirkenden eingebettet als pseudo-primäre macrospherical Tumors und (ii) einem peripheren zellfreien Kammer aus einem Fibrin - Gel, dh eine extrazelluläre Matrixkomponente , die sich von der in der Mitte verwendet werden, in denen Krebszellen (invasion vorne) wandern und / oder mikrosphärischen Tumoren bilden darstellt sekundäre oder Satelliten Tumoren. Die Bildung von Satelliten-Tumoren im peripheres Kompartiment istbemerkenswert korreliert mit der bekannten Aggressivität oder metastasiertem Ursprung der nativen Tumorzellen, die diese 3D-Kultursystem einzigartig macht. Dieser Zellkulturansatz könnte als Krebszelle Invasivität und Motilität, Zell-extrazellulären Matrix-Interaktionen und als ein Verfahren zur Beurteilung anti-Krebs-Medikament Eigenschaften zu bewerten.
Einleitung
Die grundlegenden und biomedizinischen Eigenschaften der Invasion von Krebszellen / Migration und anschließende Metastasierung Einrichtung zu untersuchen , ist Gegenstand einer intensiven Forschung 1,2. Metastasierung ist die letzte Stufe der Krebs und seine klinische Management bleibt schwer zu fassen. Ein besseres Verständnis der Metastasierung auf zellulärer und molekularer Ebene wird die Entwicklung effizienterer Therapien 3 ermöglichen.
Mehrere Eigenschaften von metastatischen Zellen können in vitro 4 einschließlich ihrer stemness und potentielle einen Übergangszustand (beispielsweise epithelioid-mesenchymale Transition) zu migrieren und dringen in und aus dem Primärtumor 5 zu erwerben , untersucht werden. Allerdings hat die in - vitro - Beurteilung der Invasion / Metastasierung Prozesse eine Herausforderung , da sie praktisch den Beitrag des Blut / lymphatischen Kreislauf schließt. Organotypischen Kulturen, die Tumorfragmente in Collagengele einbetten haben früschlauen verwendet worden, um Krebs Aggressivität zu überwachen. Obwohl die Komplexität von Tumoren erhalten wird (beispielsweise das Vorhandensein von Nicht-Krebszellen) werden Tumorfragmente des begrenzten Diffusionsmedium ausgesetzt wird , um Stichprobenvariation und zu einem übermäßigen Wachstum von Stromazellen 6. Ein alternatives Verfahren besteht in Komponenten der extrazellulären Matrix (ECM) in Krebszellen wachsen, die die dreidimensionale (3D) Zellumgebung imitiert. Die Proliferation von Brustkrebszelllinien in einem Kollagen-Gel und / oder einer Basalmembran-Matrix abgeleitet ist unter den besten charakterisierten Beispiele von 3D-Zellkultur. Durch die Verwendung von bestimmten 3D - Zellkulturumgebungen, die desorganisierte Anordnung für Brustkrebszellen beobachtet unter Standardbedingungen gezüchtet kann 7-10 zur spontanen Bildung von Brust Acini und röhrenförmige Strukturen umgekehrt werden. Darüber hinaus sammelten die Bildung von vielzelligen Tumorsphäroide abgeleitet von einem Adenokarzinom Krebszellen mit verschiedenen Techniken (zB hängende Tropfen, schwimmend Sphäroiden, Agar Einbettungs) jetzt die am häufigsten verwendeten 3D - Zellkulturtest 11-13 darstellt. Jedoch ist dieser Test durch den eingeschränkten Satz von Krebszelllinien begrenzt, die Sphäroide und durch den kurzen Zeitraum zur Verfügung zu studieren Zellen unter diesen Bedingungen bilden kann.
In dieser visualisierten Technik stellen wir hier ein anspruchsvolles 3D - Zellkulturassay , wo Krebszellen von Interesse in einem Kollagengel eingebettet sind , die in vitro Bildung eines pseudo-primären Tumors zu ermöglichen , die mit einer Basalmembran stammenden Matrix beschichtet werden alternativ kann. Einmal gebildet, wird die pseudo-primären Tumors dann in einer azellulären Matrix (Fibrin - Gel im vorliegenden Fall) sandwichartig angeordnet, die die Krebszellen ermöglicht die Schnittstelle zwischen den beiden Abteilen Matrix kreuzen (siehe Abbildung 1). Interessanterweise sekundäre tumorartige Strukturen aus dem Pseudo-Primärtumor erscheinen zusammen mit aggressiven Krebszellen mit Ursprung in derFibrin-Gel. Eine solche 3D - Kultursystem bietet die Flexibilität , beispielsweise zu untersuchen, erforderlich, Antikrebsmittel, die Genexpression und die Zell-Zell- und / oder Zell-ECM - Wechselwirkungen 14-16.
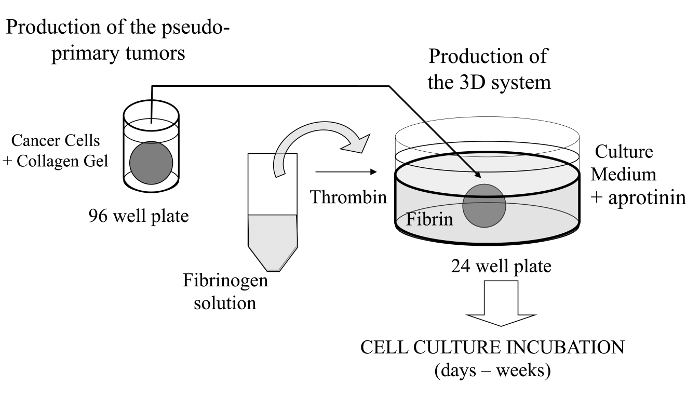
Abbildung 1:.. Überblick über die Methode Schematische Zusammenfassung der Methode der 3D - Zellkultursystem als Modell für Krebsstudien zu generieren Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Protokoll
HINWEIS: Keine Ethik Betracht, da tierische und menschliche Krebszellen erworben wurden oder uns freundlicherweise zur Verfügung gestellt.
1. Erstellen Collagen Stecker (Pseudo-Primärtumor)
- Bereiten Sie eine Kollagen-Dispersion. Typ I aus Rattenschwanzsehnen (RTT) Kollagen kann entweder extrahiert und sterilisiert werden , wie zuvor 17 berichtet, oder gekauft haben . Disperse gefriergetrocknet RTT Kollagen (3,25-3,50 mg / ml in 0,02 N Essigsäure) mit einem Mixer (High-Speed-Einstellung, fünf 2 min läuft) für eine gleichmäßige Durchmischung.
- Harvest (Trypsin-EDTA, in der Regel) und verwenden Trypanblau-Ausschluss für das Zählen lebender Zellen unter Verwendung eines Hämozytometers. Stellen Sie die gewünschte Zelldichte (5 x 10 4 Zellen pro Stecker).
- Bereiten Sie alle Lösungen (NaOH, fötale Rinderserum, DMEM 5x, NaHCO 3) getrennt (Tabelle 1) unter sterilen Bedingungen und gekühlt auf Eis halten. Anmerkung: Die Reihenfolge der Zugabe der verschiedenen Lösungen wichtig ist osmotischen Schocks oder saure in Zellen zu verhindern.
- Führen Zelldispersion (1,25 x 10 & sup6 ; Zellen) in die endgültige Kollagenlösung (5 ml) so schnell wie möglich. Gut mischen (durch Pipettieren oben und unten), während Luftblasen zu vermeiden, und dann verteilen schnell 200 ul der ready-to-use-Lösung in jede Vertiefung einer 96-Well-Platte. schlagen Sie vorsichtig die Multi-Well-Platte auf der Arbeitsfläche Oberfläche der Zellkultur Haube Luftblasen zu entfernen und die Lösung gleichmäßig in den Vertiefungen zu verbreiten.
- Nach dem Befüllen alle Vertiefungen (dieser Schritt dauert etwa 15-20 Minuten pro 96-Well-Platte), bewahren Sie sie in den Inkubator.
- Die Platte bei 37 ° C von 2 h bis über Nacht. Collagen Gelierung (dh Fibrillogenese) tritt innerhalb von 30 min. Hinzufügen Kulturmedium (100 & mgr; l / Vertiefung) zu der Kultur einer Inkubation über Nacht durchzuführen.
2. Erste Schicht von Fibringelstruktur
- Fibrinogenlösung Vorbereitung.
HINWEIS: Die gleiche Charge von Fibrin-Gel sollte idealerweise für reproduzierbarer Resul verwendet werdents, wie Fibrin-Gel-Bildung zwischen verschiedenen Chargen von kommerziellen gefriergetrocknetem Fibrinogen kann variieren.- Verwenden Sie immer eine frisch zubereitete Fibrinogen-Lösung. Bringen Sie die gefriergetrockneten Fibrinogen auf Raumtemperatur vor dem Öffnen der Flasche Hydrat eine Kristallbildung zu vermeiden.
- Progressiv das Fibrinogen in vorgewärmten (37 ° C) Hanks Balanced Salt Solution (HBSS) auflösen mit Ca 2+ / Mg 2+ bei einer Arbeitskonzentration von 3 mg / ml (erwägen , einen 15% Überschuß des Mindest Endvolumen erforderliche Vorbereitung : zB 17.25 mg in 5,75 ml einer 5 ml - Lösung).
- In vorgewärmten HBSS tropfenweise auf den ersten Fibrinogenfragmenten löslich zu machen. Break down größere Fragmente mit einem Spatel in den Becher. Agitieren den Becher von Zeit zu Zeit das Mischen zu erleichtern. Verwenden Sie keine Rührerplatte während des Verfahrens verwendet werden. Man löst das verbleibende Pulver durch Pipettieren der Suspension auf und ab.
- Halten Sie die Fibrinogenlösung lauwarm während steriLIZING die Lösung, indem sie durch ein 0,22 um-Filter geleitet. Hinweis: Wenn die HBSS nicht warm genug ist oder das Fibrinogen nicht vollständig gelöst ist, kann die Lösung den Filter verstopfen. Setzen Sie gegebenenfalls Filter ein- oder zweimal, was die Fibrinogenkonzentration verringern kann und damit Fibringerinnsels Steifigkeit.
- Suspend die Zellen von Interesse (zB Endothelzellen) in ready-to-use Fibrinogen - Lösung , während seine endgültige Einstellen der Lautstärke, als alternatives Verfahren.
- Vorbereiten der Thrombin-Lösungen.
- Bereiten Sie eine Stammlösung in ddH 2 O (50 NIH - Einheiten / ml), dann sterilisieren es einen 0,22 & mgr; m - Filter.
- Verwenden Sie ein Fibrinogen / Thrombin-Verhältnis ≥1: 0,0075 (v / v), um das Fibrin-Gel zu erzeugen.
- Die Erzeugung des Fibringelstruktur.
- Halten Sie das sterile Fibrinogen und Thrombin-Stammlösungen auf Eis während all den nächsten Schritten. Die Fibringele können in Platten mit 24 Vertiefungen zu bilden.
- Unverzüglich Overlay the Oberfläche jeder Vertiefung mit der Fibrinogen-Lösung (200 & mgr; l / Well) während der Luftblasenbildung zu vermeiden. Verfahren 6 Vertiefungen zu einer Zeit.
- Sobald vollständig die Fibrinogenlösung, die Oberfläche der Vertiefungen bedeckt, in einem 45 ° -Winkel der Platte kippen und 1,5 ul Thrombinlösung in die erste Vertiefung mit Hilfe des Thrombins in der Mitte des Bohrlochs fallen und dann auf die Platte leicht geschwenkt horizontal 1-2 sec.
- Lassen Sie die Platte in einer stabilen Position unter der Laminar - Flow - Haube (5-10 min) , bis die Gelierung / Gerinnungsprozess abgeschlossen ist (NB: Polymerisation darf nicht gestört werden, zum Beispiel indem man die Platte in den Inkubator zu transportieren).
- Sobald die ersten sechs Bohrungen polymerisiert haben, wiederholen Sie die gleiche Sequenz (dh die drei vorhergehenden Schritte) für die nächsten sechs Brunnen , bis alle Vertiefungen verarbeitet wurden.
3. Zweite Schicht von Fibringelstruktur und Sandwiched Collagen Stecker
- OptionA: (Mit Hilfe des Collagen-Plug sofort).
- Stellen Sie sicher, dass die erste Schicht aus Fibrin-Gel in allen Vertiefungen zart polymerisiert wurde von der Platte zu kippen. Legen Sie die 96-Well-Platte das Kollagen Gelpfropfen Seite an Seite mit der 24-Well-Platte (mit den Fibringelen), die Übertragung der Kollagen-Stecker zu erleichtern.
- Geben Sie einen Tropfen HBSS in jede Vertiefung der Platte, die die Kollagen-Stecker enthalten.
- Entfernen Sie jede Kollagen Stecker aus dem Bohrloch mit einer dünnen Nadel an einer Spritze befestigt (als Griff verwendet wird) oder mit einem Mikro-Löffel (siehe Video). Bringen Sie jede Kollagen-Stecker auf die erste Fibringelstruktur Schicht mit einem oder zwei Mikrolöffel, gleichzeitig aber dafür sorgen, dass das Kollagen Stecker gut in das Bohrloch zentriert ist und dass die Sterilität ist sehr gepflegt.
- Überlagern, die zuvor gebildete Fibrin-Gel mit der zweiten Schicht von Fibrinogen-Lösung (300 ul / Vertiefung) und die Einführung des Thrombins wie in 2.3 beschrieben, wird ein minimal 1 zu halten. 0,0075 Verhältnis und eine Sequenz von sechs Vertiefungen in einer Zeit
- Option B (Beschichtung der Collagen-Stecker mit einer dünnen Schicht von Wachstumsfaktor-reduziert Basalmembran (GFRBM)).
- Kühle alle hergestellten Lösungen und Instrumente vorher und halten sie bei 4 ° C oder auf Eis (zB Pipetten, Spitzen, Reagenzgläser) während seit gefrorenen Aliquoten GFRBM Handhabung sind sehr empfindlich gegen zu hohe Erwärmungsrate während des Auftauens (folgen Sie den Anweisungen des Herstellers) .
- Nach der Entfernung von den Plattenvertiefungen, tränken jedes Kollagen Stecker für 2 Minuten in einer 1,5-ml-Zentrifugenröhrchen auf Eis, die 100 & mgr; l einer reinen GRFBM Lösung.
- Übertragen jeder beschichteten Stecker auf die erste Fibrinschicht, während es gewährleistet ist gut zentriert ist, wie oben beschrieben. Inkubieren der Steck enthaltenden Platten bei 37 ° C für 5 min die GRFBM zu ermöglichen, ein Gel zu bilden. Fügen Sie die zweite Fibrinschicht, wie in Schritt 3.1.4.
4. Zellkulturmedium Bedingungen
- Füllen Sie jede Vertiefung mit Kulturmedium (400 ul). Die Kulturmedien und Ergänzungen werden auf der Grundlage der Zelllinie und Versuchsbedingungen gewählt werden.
- Hinzufügen Aprotinin, ein Antifibrinolytikum, um Kulturmedium in einer Endkonzentration von 100 Kallikrein-Inhibitor-Einheiten (KIE) / ml.
HINWEIS: Bewahren Sie die Platten in einer Zellkultur-Inkubator unter den Bedingungen für die Zelllinie getestet verwendet. - Füllt Kulturen mit frischem Medium jeden zweiten Tag oder nach dem Versuchsplan, und fügen Sie Aprotinin. Vor Zugabe von frischem Medium, kippen leicht die Platte (bei 30-35 ° Winkel) und neigen die Pipette gegen die Seite des Bohrlochs während sorgfältig das konditionierte Medium unter ständiger Beobachtung Absaugen.
Ergebnisse
Wie bereits erwähnt, ist ein interessantes Merkmal dieser 3D - Zellkulturassay , daß Krebszellen nicht nur aus dem Kollagenstopfen zum benachbarten Fibringel wandern kann, sondern auch sekundäre Tumoren (beispielsweise Satelliten - tumorartige Strukturen) herzustellen. Diese können direkt mit einem invertierten Phasenkontrastmikroskop bei niedrigen und hohen Vergrßerungen durch das Gel Dicke beobachtet, insbesondere mit einem großen Arbeitsabstand Kondensor (Abbild...
Diskussion
Als wichtige technische Fußnote ist es wesentlich, dass kein Spalt an der Grenzfläche zwischen dem zentralen vorhanden ist, und die peripheren Gelen. Andernfalls könnte es die Fähigkeit der Zellen zu reduzieren, um das Fibrin-Gel wandern / eindringen. Ein Raum zwischen dem Kollagen und Fibrin-Gelen kann während der ersten 24 Stunden der Kultur bilden, wenn Thrombin wurde nicht in geeigneter Weise verdünnt worden ist. Es ist auch möglich, dass die Zelllinie in Kultur getestet könnte das Kollagengel führen, zu ko...
Offenlegungen
The authors have no disclosure.
Danksagungen
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materialien
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Referenzen
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten