Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kanser hücre istilası ve Uydu Tümör oluşumu keşfedin Kültür Testi Üç Boyutlu
Bu Makalede
Özet
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Özet
mono tabakaları memeli hücre kültürü çok çeşitli fizyolojik ve moleküler süreçleri incelemek için kullanılır. Ancak, artan hücrelerin incelemek için bu yaklaşım, genellikle istenmeyen eserler üretir. Bu nedenle, genellikle hücre-dışı matris bileşenlerini kullanarak üç boyutlu (3D) bir ortamda, hücre kültürü, in vivo bağlı doku veya organ nativ yakından benzerlik için ilginç bir alternatif olarak ortaya çıkmıştır. Bir fibrin jel yapılmış bir sözde primer macrospherical tümör ve (ii) bir çevresel hücresiz bölme bir kollajen jel hareket gömülü kanser hücrelerini ihtiva eden bir merkez bölme iki bölme, yani: (i) ile 3 boyutlu bir hücre kültür sistemi geliştirmiştir örneğin, merkezi kullanılandan farklı bir hücre dışı matris bileşeni, burada kanser hücrelerinin göç (yayılma ön) ve / veya ikincil veya uydu tümörler temsil mikroküresel tümörler oluşturabilir. periferal bölme uydu tümör oluşumuoldukça bu 3D kültür sistemi benzersiz kılan doğal tümör hücrelerinin bilinen saldırganlık veya metastatik kökenli korelasyon. Bu hücre kültürü Kanserin hücre istilası ve motilite, hücre-hücre üstü matris etkileşimlerini ve anti-kanser ilaç özelliklerini değerlendirmek için bir yöntem olarak değerlendirilmesi için kabul edilebilir.
Giriş
Kanser hücre işgali / göç ve sonraki metastaz kurulması temel ve biyomedikal özelliklerini inceleyen yoğun araştırma 1,2 konusudur. Metastaz kanser nihai aşamasıdır ve klinik yönetim belirsizliğini koruyor. Hücresel ve moleküler düzeyde metastaz daha iyi anlaşılması daha etkin tedavilerin 3 gelişmesini sağlayacaktır.
Metastatik hücrelerin çeşitli özellikleri kendi stemness ve göç içinde ve primer tümörün 5'ten işgal etmeye bir geçiş durumu (örneğin, epiteloid-mezenkimal geçiş) elde etmek için potansiyeli de dahil olmak üzere in vitro 4 keşfedilebilir. Neredeyse kan / lenfatik dolaşımı katkısını hariç çünkü Ancak, işgali / metastaz süreçlerinde in vitro değerlendirilmesi bir meydan okuma olmuştur. kollajen jel tümör fragmanları gömmek organotipik kültürlerinin Previou bilgisisinsi kanser saldırganlık izlemek için kullanılmaktadır. Tümörlerin karmaşıklığı korunmuş olsa da (örneğin, kanserli olmayan hücrelerin varlığı), tümör fragmanları örnekleme varyasyonuna, sınırlı orta difüzyon maruz ve stromal hücrelerinin 6 aşırı büyümesi için vardır. Alternatif bir yöntem, üç boyutlu (3D) hücre ortamı taklit eden hücre dışı matris (ECM) bileşenleri içinde mevcut kanser hücrelerinin büyüyen oluşur. kollajen jel ve / veya bir bazal membran türetilen matriks içinde meme kanseri hücre çizgilerinin proliferasyonu 3D hücre kültürünün en iyi karakterize örnekleri arasındadır. Belirli bir 3D hücre kültür ortamları kullanılarak standart koşullar altında yetiştirilen göğüs kanseri hücreleri için gözlemlenen dağınık düzeneği meme asinüs ve boru şeklindeki yapılar 7-10 kendiliğinden oluşumuna ters çevrilebilir. Ayrıca, adenokarsinom kanser hücrelerinden türetilen çok-hücreli tümör parçacıklarının oluşumunun (başka teknikler kullanılarak toplanmışÖrneğin, şu anda en yaygın olarak kullanılan 3D hücre kültürü tahlil 11-13 oluşturmaktadır) gömme ağar, sferoidler yüzen, damla asılı. Bununla birlikte, bu deney, parçacıklarının oluşturabilen kanseri hücre çizgilerinin sınırlı dizi ve bu koşullarda hücrelerin çalışma süresinin kısalığı ile sınırlıdır.
Bu görsel teknik olarak, bu tarifnamede ilgi kanser hücrelerinin alternatif olarak bir bazal membran türetilmiş matris ile kaplanabilir sözde primer tümörün in vitro oluşumunu sağlamak için, bir kollajen jel gömülü gelişmiş bir 3D hücre kültürü analizinde getirmektedir. Oluştuktan sonra, psödo-primer tümör sonra kanser hücrelerinin, iki matris bölme arasında bir arayüz çapraz sağlayan bir hücresel olmayan matris (mevcut durumda fibrin jel) içinde sandviç (Şekil 1 e bakınız). İlginç bir şekilde, agresif kanser hücreleri ile sözde primer tümörden kaynaklanan sekonder tümör benzeri yapılar görünürfibrin jel. Bu 3 boyutlu bir kültür sistemi, örneğin, anti-kanser ilaçları, gen ifadesi ve hücre-hücre ve / veya hücre-ECM etkileşimleri 14-16 için araştırmak için gerekli esnekliği sunmaktadır.
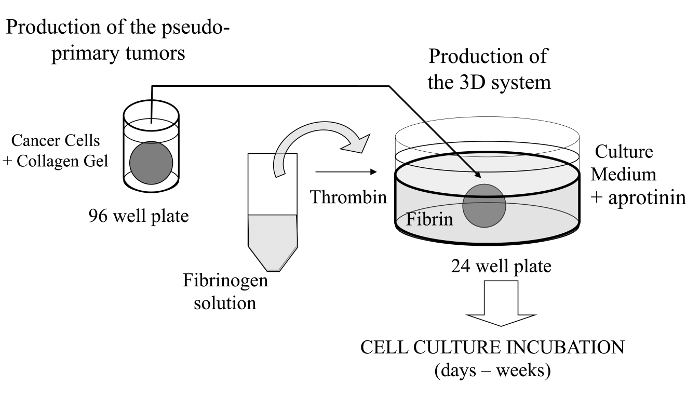
Şekil 1:.. Yöntem bakış kanser çalışmaları için bir model olarak 3D hücre kültür sistemi oluşturmak için yöntemin şematik özeti bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Protokol
NOT: insan ve hayvan kanser hücreleri satın alınabilir veya lütfen bize sağlanan beri yok etik dikkate.
Yapma 1. Kollajen Fiş (Sözde birincil Tümör)
- Bir kollajen dağılımını hazırlayın. Daha önce 17 ya da satın bildirdiği gibi ben de ayıklanır ve sterilize edilebilir sıçan kuyruğu tendonları (RTT) den kollajen yazın. (Beşi 2 dakika çalışır yüksek hız) üniform bir karışımı için dondurularak kurutulmuştur RTT kollajen (0.02 N, asetik asit içinde 3.25-3.50 mg / ml), bir karıştırıcı kullanılarak dağıtılır.
- Hasat (tripsin-EDTA, genellikle) ve hemasitometre kullanarak canlı hücreleri saymak için tripan mavisi dışlama kullanın. İstenilen hücre yoğunluğu (fiş başına 5 x 10 4 hücreler) ayarlayın.
- Steril koşullar altında tüm çözümler (NaOH, fetal sığır serumu, DMEM 5x, NaHCO3) Bileşen (Tablo 1) Hazırlama ve buz üzerinde soğutulmuş tutun. Not: çeşitli çözümler eklenme sırası hücreleri ozmotik veya asidik şokları önlemek için önemlidir.
- Olabildiğince hızlı bir şekilde son kolajen çözeltisi (5 mi) içine hücre dispersiyonu (1.25 x 10 6 hücre) uygulayın. Hava kabarcıklarını önlemek ve daha sonra hızlı bir şekilde 96 oyuklu plakanın her bir hazır kullanımlı çözeltisi 200 ul dağıtma ise (aşağı yukarı pipetleme) tarafından iyice karıştırın. Yavaşça hava kabarcıklarını çıkarmak için hücre kültürü kaput çalışma alanı yüzeyinde çoklu plaka grev ve kuyuların içinde eşit çözüm yaymak için.
- Tüm oyuklara doldurduktan sonra inkübatör içine saklamak, (bu adım 96 oyuklu plaka başına yaklaşık 15-20 dakika sürer).
- gece boyunca 2 saat 37 ° C'de inkübe plakası. Kollajen jelasyon (yani, fibrillogenesis), 30 dakika içinde meydana gelir. Bir gecelik inkübasyondan gerçekleştirmek için kültür kültür ortamı (100 uL / oyuk) ilave edin.
Fibrin Gel 2. İlk Katman
- Fibrinojen solüsyonu hazırlanması.
Not: fibrin jel aynı parti, ideal daha tekrarlanabilir Resul için kullanılmalıdırts, fibrin jel oluşumu, ticari dondurularak kurutulmuş fibrinojen farklı yükleri arasında değişebilir.- Her zaman taze hazırlanmış fibrinojen çözümü kullanın. Hidrat kristal oluşumunu önlemek için, şişeyi açarken, oda sıcaklığına kadar dondurularak kurutuldu fibrinojen getirin.
- Kademeli önceden ısıtılmış (37 ° C), Ca2 + ile Hank'in dengeli tuz çözeltisi (HBSS) / 3 mg / ml çalışma konsantrasyonunda Mg2 + (en az son hacminin% 15 fazlalık hazırlanması düşünülebilir gerekli fibrinojeni çözülür : örneğin, 5 ml çözelti için 5.75 ml 17.25 mg) verdi.
- fibrinojen parçaları çözmek için ilk başta önceden ısıtılmış HBSS damla damla ekleyin. beher bir spatula ile büyük parçaları yıkmak. zaman ve karıştırma işleminin kolaylaştırılması için zaman beher çalkalayın. İşlem sırasında bir karıştırıcı plaka kullanmayın. yukarı ve aşağı süspansiyon pipetleme kalan tozu eritin.
- Steri ise ılık fibrinojen çözüm tutun0.22 um'lik bir filtreden geçirilerek çözelti lizing. Not: HBSS yeterince sıcak değil veya fibrinojen tamamen çözülmüş değilse, çözüm filtreyi tıkayabilir. Varsa, fibrinojen konsantrasyonunu azaltmak ve böylece fibrin pıhtı sertliği olabilir, bir veya iki kez filtreyi değiştirin.
- Bir alternatif prosedür olarak, son hacmi ayarlarken hazır kullanım fibrinojen çözeltisi içine ilgi hücreleri (örneğin, endotel hücreleri) süspanse edin.
- Trombin Çözümleri hazırlanması.
- GKD 2 O (50 NIH birim / mi) içinde bir stok çözelti hazırlayın, daha sonra bir 0.22 mikron filtre kullanılarak sterilize edin.
- bir fibrinojen / trombin oranı ≥1 kullanın: 0.0075 (h / h), fibrin jel oluşturmak için.
- Fibrin Jel oluşturuluyor.
- Steril fibrinojen tutmak ve tüm sonraki adımlar boyunca buz üzerinde stok solüsyonları trombin. fibrin jel 24 oyuklu plakalar içinde oluşturmak üzere izin verilir.
- Derhal bindirme inciHer bir E yüzeyi de hava kabarcığı oluşumunu engelleyerek fibrinojen solüsyonu (200 ul / oyuk). Bir seferde 6 kuyu işleyin.
- fibrinojen çözüm tamamen kuyu yüzeyini kaplayan sonra, bir 45 ° açıyla plaka yatırmak ve iyi merkezi haline trombini bırakarak ilk kuyuya trombin çözeltisi 1.5 ul ekleyin ve sonra yavaşça için yatay plaka girdap 1-2 sn.
- Laminer akış kaputu (5-10 dk) jelleşme / pıhtılaşma işlemi tamamlanıncaya kadar altında stabil pozisyonda plaka bırakın (Not: polimerizasyon işlemi inkübatör plaka taşıyarak, örneğin, rahatsız edilmemelidir).
- İlk altı kuyu polimerize sonra tüm kuyular işlendikten kadar, önümüzdeki altı kuyuları için aynı diziyi (yani 3 Önceki adımlar) tekrarlayın.
Fibrin Gel ve sandviç Kollajen Plug 3. İkinci Kat
- seçenekA: (hemen Kollajen Tak Kullanarak).
- fibrin jel ilk kat ince plaka eğerek bütün kuyularda polimerize emin olun. kolajen fişleri transferini kolaylaştırmak için (fibrin jeller ihtiva eden), 24 oyuklu bir plaka ile yan kollajen jel fişler yan ihtiva eden 96 oyuklu plaka koyun.
- kolajen fişleri ihtiva eden plakanın her oyuğuna HBSS bir damla ekleyin.
- İnce (bir kolu olarak kullanılır) bir şırınga üzerine monte iğne veya (video) bir mikro-kaşık kullanarak iyi her kollajen fişini çıkartın. kollajen fiş de kuyuya merkezli ve kısırlık bakımlı olduğundan emin yaparken, bir veya iki mikro-kaşık kullanarak ilk fibrin jel tabakası üzerine her kollajen fiş aktarın.
- fibrinojen çözeltisi, ikinci tabaka ile daha önce oluşan fibrin jel Yerleşimi (300 ul / oyuk) ve 2.3 de tarif edildiği gibi en az 1 tutarak, trombin tanıtmak. seferinde 0.0075 oranı altı kuyu bir sekans
- (Büyüme Faktörü-azaltılmış Bodrum Membran (GFRBM) ince bir tabaka ile Kollajen Tak Kaplama) Seçenek B.
- Serin, tüm Hazırlanan çözümler ve aletleri önceden ve GFRBM donmuş alikotları beri işlenmesi sırasında (örneğin, pipet, ipuçları, test tüpleri), 4 ° C'de veya buz üzerinde saklayın (üreticinin talimatlarına uyun) çözülme sırasında aşırı ısınma oranına çok duyarlı .
- plaka oyuklarından ayrılmasından sonra, saf GRFBM çözeltisi 100 ul buz ihtiva eden bir 1.5-ml santrifüj tüpü içinde 2 dakika boyunca her kollajen fiş ıslatın.
- Daha önce açıklandığı gibi sağlanması, iyi merkezli iken ilk fibrin tabakası üzerine her kaplanmış fişi aktarın. 5 dakika GRFBM bir jel oluşturmak için izin vermek için 37 ° C'de eklenti ihtiva inkübe edin. Adım 3.1.4 olarak ikinci fibrin katmanı ekleyin.
4. Hücre Kültürü Ortamı koşullar
- (Kültür ortamı ile de 4 her dolum00 ul). Kültür ortamları ve takviyeleri hücre çizgisi ve deneysel koşullara bağlı olarak seçilir.
- 100 kallikrein önleyici birim (KIU) / ml'lik bir son konsantrasyonda kültür ortamına aprotinin bir antifibrinolitik ekleyin.
NOT: test edilen hücre hattı için kullanılan şartlar altında, bir hücre kültürü inkübatöründe plakaları saklayın. - Her gün taze ortam ile kültürler doldurun veya deneysel şemasına göre ve aprotinin ekleyin. Taze orta eklemeden önce biraz (30-35 ° açıyla) plaka yatırın ve dikkatle sürekli gözlem altında klimalı ortam aspirasyon sırasında kuyunun kenarına pipet eğin.
Sonuçlar
Daha önce de belirtildiği gibi, bu 3D hücre kültürü deneyinde ilginç bir özelliği, kanser hücreleri sadece bitişik fibrin jel kolajen fiş göç değil, aynı zamanda, ikincil tümörlerin (örneğin, uydu, tümör benzeri yapılar) tesis olup olmasıdır. Bu, doğrudan doğruya, özellikle uzun bir çalışma mesafesi kondansatör (Şekil 2) ile birlikte, jel kalınlığı boyunca düşük ve yüksek büyütmelerde bir ters faz kontrast mikroskop ile...
Tartışmalar
önemli bir teknik dipnot olarak, bir boşluk, merkezi ve periferik jeller arasındaki ara yüzeyde mevcut olması gereklidir. Aksi takdirde, / göç fibrin jel işgal hücrelerin kapasitesini azaltabilir. Trombin uygun seyreltilmiş edilmemiş ise, kollajen ve fibrin jel arasındaki boşluk kültür ilk 24 saat içinde meydana gelebilir. Kollajen jel neden olabilir test edilen hücre hattı, böylece, her iki jeller arasındaki oluşturmak için göreceli olarak büyük bir alan neden kültür sırasında sözleşme ol...
Açıklamalar
The authors have no disclosure.
Teşekkürler
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Referanslar
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır