A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש רב-פלואור מרת חומצות
In This Article
Summary
כלים לאבחן ספיגה של חומצות מרה למדוד תחבורה חומצות מרה in vivo מוגבלים. גישה חדשנית בבעלי חיים מתוארת אשר מנצלת פרוטון משולב (1 H) בתוספת פלואור (19 F) תהודה מגנטית; יש שיטה חדשנית זו פוטנציאל translational למסך ספיגה של חומצות מרה בפרקטיקה הקלינית.
Abstract
יחד עם התפקיד המסורתי שלהם כמו חומרי ניקוי המאפשרים ספיגות שומן, המתעורר ספרות עולה כי חומצות מרות הן מולקולות איתות חזקות כי להשפיע על איברים מרובים; הם לווסת תנועתיות המעיים וייצור הורמונים, לשנות את הטון של כלי הדם, חילוף החומרים של הגלוקוז, מטבוליזם של שומנים, ניצול אנרגיה. שינויים חומצות מרה בצואה עשוי לשנות את Microbiome הבטן ולקדם פתולוגיה המעי הגס כולל שלשול cholerrheic וסרטן המעי הגס. רגולטורים מרכזיים של רכב חומצות מרות בצואה הם Transporter החומצות המרים נתרן תלוי Apical המעי הדק (ASBT) וצמיחת פיברובלסטים גורמים-19 (FGF19). ביטוי מופחת ותפקוד של ASBT פוחתים חומצות מרות במעי-תופסות. יתר על כן, נתונים חוץ גופית מראים כי כמה תרופות ה- FDA לעכב פונקציה ASBT. שחרור FGF19 חסר מגביר כבד מר סינתזת חומצה ולשחרר לתוך המעיים לרמות מציפי ASBT. כך או תפקוד לקוי ASBT או חסר FGF19 מגביר fחומצות מרות ecal ועלולות לגרום שלשול כרוני ולקדם neoplasia מעי הגס. למרבה הצער, כלים למדוד ספיגה של חומצות מרה הפעולות של תרופות בתחבורה חומצות מרה in vivo מוגבלים. כדי להבין את הפעולות המורכבות של חומצות מרות, טכניקות נדרשות המאפשרות ניטור סימולטני של חומצות מרות במעי ורקמות מטבולית. זה הוביל אותנו להרות שיטה חדשנית למדידת התחבורה של חומצות מרה בבעלי חיים באמצעות שילוב של פרוטון (1 H) פלואור (19 F) דימות תהודה מגנטית (MRI). קליעים נותבים חדשניים פלואור (19 F) מבוססים MRI החי נוצרו ונבדק, הוא במבחנת in vivo. יתרונות של גישה זו כוללים היעדר חשיפה לקרינה מייננת ופוטנציאל translational עבור מחקר ושימוש קליני.
Introduction
יחד עם התפקיד הקלאסי שלהם כמו חומרי ניקוי המאפשרים ספיגת השומן מהבטן, חומצות מרה צמחו כמו מולקולות חזקות איתות המשפיעים באיברים רבים נוספים על אלה הקשורים 1,2 זרימת enterohepatic שלהם. בנוסף לשליטה מטבוליזם שלהם, חומצות מרה לווסת כמה היבטים של הפיזיולוגיה של מערכת העיכול (למשל, תנועתיות המעיים ייצור ההורמונים האינקרטינים, פיזיולוגיה המעי הגס, ואת הנטייה לפתח סרטן) ויש להם תופעות מערכתיות על הטון וסקולרית, גלוקוזה מטבוליזם השומנים, וניצול אנרגיה. בעוד חלק מהתופעות הללו מתווכות במעיים, אחרים נובעים משינויים לאחר ארוחה רמות חומצות מרה מערכתית, כאמור בחולים שמנים או לאחר ניתוח עוקפים קיבה. כדי להבהיר את הפעולות מטבולית המורכבות של חומצות מרת הטכנולוגיה חדשה נדרשת המאפשרות ניטור סימולטני של רמות חומצת מרה בתאים אנטומיים שונים, במערכת העיכול ו metaרקמות bolic (כבד, לבלב, שרירי שלד שומן). קבלת מידע של זמן ומרחב כזה דורש טכנולוגיה חדשנית - in vivo הדמיה באמצעות קליעים נותבים חומצות מרה הרומן כפי שמתואר כאן הוא כזה גישה חדשנית.
חומצות מרה הרכב והפצה בתאים אנטומיים מוסדרים על ידי גורמים לווסת סינתזה בכבד שלהם ספיגת ileal, כולל דיאטה, ניתוח, טיפול אנטיביוטי ושינויים צמחיית המעיים. רגולטור מפתח של ספיגת חומצות מרות במעי עבור הזרימה שלהם enterohepatic 3 (איור 1) הוא נתרן תלוי Apical ileal החומצות המרה Transporter (ASBT; SLC10A2). למרות ספיגה פסיבית מתרחשת ברחבי המעיים, ASBT מתווכת ספיגה של 95% של חומצות מרות במעי כך בדרך כלל יש שפיכה מוגבלת של חומצות מרות לתוך הצואה. Asbt מחסר (Slc10a2 - / -) עכברים גדלו חומצות מרה בצואה וכן ACI מרה פחתהד ברכה 4.
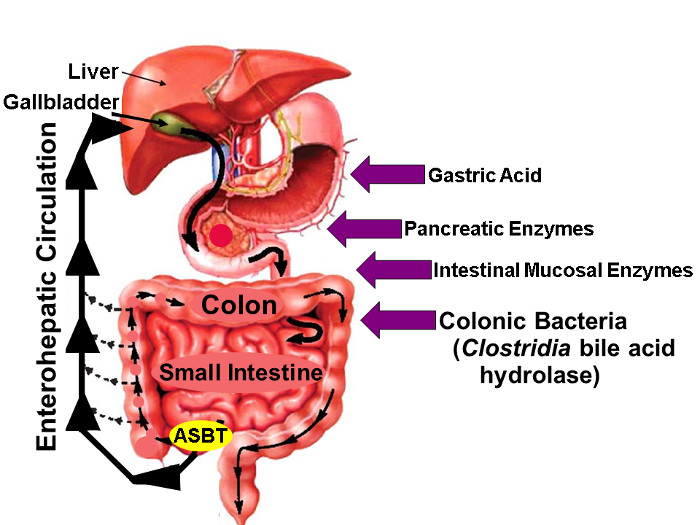
איור 1: מחזור Enterohepatic של מרת חומצות.
איור של מחזור Enterohepatic לפיה מרת חומצות מסונתזות בכבד, מופרש לתוך עץ המרה המאוחסן בתוך הכיס המר, יצא אל מעי הדק הפרוקסימלי עם ארוחות, פעיל נלקח דרך ASBT ב דיסטלי המעי. בעוד כמויות קטנות של חומצות מרות נספגות באופן פסיבי לאורך הבטן, כ 95% של חומצות מרות במעי מועברים באופן פעיל על ידי ASBT וכתוצאה מכך מינימאלי פסד (כ 5%) בצואה אשר הוא מתוגמלת על ידי כמות דומה של סינתזה של חומצת מרה חדשה הכבד, ובכך שמירה על ברכת חומצות מרות יציבה. החיצים מימין לזהות גורמים שעשויים להשפיע יליד פלואור שכותרתו יציבות חומצות מרה, כולל חומצת קיבה, לבלב ואנזימים רירית המעי, והכי importantly, אנזימי hydrolytic שפורסמו על ידי מיני קלוסטרידיאל כי ליישב את מעי דק הדיסטלי ומעי גס. (השתנה עם רשות 16) אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
ספיגה של חומצות מרות יכולה להיות מסווגת לשלושה סוגים, שלכל אחד מהם מגבירים חומצות מרות dihydroxy צואה, ובכך לגרום שלשולים לסירוגין או כרוניים. הקלד 1 תוצאות הפתולוגיה ileal ברוטו (למשל, כריתה, מחלת קרוהן) 5. הקלד 3 תוצאות כריתת כיס מרה, vagotomy, מחלת צליאק, יתר חיידקי, ואת אי ספיקת לבלב. לעומת זאת, אנשים עם "ראשוניים" (סוג 2) ספיגה של חומצות מרה להוות אתגר אבחנתי מעולה משום שאין להם תנאים מקדימים כאלה אין ראיות של פתולוגיה של מעי. לפיכך, הספיגה של חומצת מרה העיקרית היא אבחנה בכינויו שלשול-p תסמונת מעי רגיז redominant (IBS-D), אולי הסיבה הנפוצה ביותר לביקורים הקשורות גסטרואנטרולוגיה מחוץ חולה. ההערכה היא כי כשליש מהחולים עם IBS-D יש ספיגה של חומצת מרה העיקרי; בארצות הברית, זה עשוי לייצג כמה מיליוני אנשים 5. תובנות לאחרונה עולה כי BAM העיקרי נובע עיכוב משוב לקוי של סינתזה של חומצת מרה בכבד על ידי 19-גורם גדילה פיברובלסטים מעיים (FGF19), לא מן הביטוי מופחת או פונקציה של ASBT.
בשנת ספיגת חומצות מרה עיקרית, רמות נמוכות בדם של FGF19 מצליחות לכבות סינתזה של חומצת מרה בכבד - גידול וכתוצאה מכך חומצות מרות במעי מרווית מובילי חומצות מרות, כולל ASBT, ואת שפיכת augmented של חומצות מרות לתוך הצואה גורמת שלשול 6 (איור 2). עכברים חסרי Fgf15 (FGF19 בעכברים) יש מורחב ברכה של חומצות המרות מוגברים חומצות מרות בצואה 7.
= "Jove_content"> 
איור 2: מנגנוני מעיים של חומצות מרה ספיגה.
בדרך כלל, כפי שמוצג פאנל, כ 95% של חומצות מרה במעי נספגים בתחבורה פעיל מעי דיסטלי באמצעות ASBT. כאשר ביטוי או פעילות ASBT הוא פחת (לוח ב '), תוצאות ספיגות חומצות מרות במעי פגומה שפיכה של חומצות מרות לתוך המעי הגס. עם איתות FGF19 לקויה (C פנל), חוסר עיכוב משוב של תוצאות הסינתזה של חומצת מרה בכבד בריכוזים מוגברים של חומצות מרות במעי מציפי יכולת הובלת ASBT עם שפיכה של חומצות מרות לתוך המעי הגס. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
לטווח ארוך, העלאה כרונית ACI המרה בצואהds עשוי לקדם neoplasia המעי הגס. neoplasia קולון נובע דיספלזיה רירית מתקדמת הקשורים מוטציות גנטיות סומטיים, אך גורמים סביבתיים המגבירים חומצות מרות בצואה עשוי להאיץ ולהגדיל את התהליך הזה. במכרסמים, הגדילה חומצות מרה בצואה או כתוצאה הממשל אקסוגניים או חסר Asbt לקדם דיספלזיה המעי הגס היווצרות גידולים 8-10.
יש לציין, ממצאים פרווקטיביים עולים כי תרופות נפוצות בשימוש אושרה על ידי מנהל המזון ותרופות האמריקאי (FDA) potently לעכב תחבורה של חומצות מרות על ידי ASBT במבחנת 11. אם תרופות אלה להפחית תחבורת חומצות מרה קטנה מעי in vivo ולהגביר את רמות חומצת מרה בצואה, את ההשפעה הפוטנציאלית על פתולוגיה מעי גס תהיה בדבר. אפילו עלייה קטנה פתולוגיה המעי הגס לייחס לשימוש של תרופה כזו עשויה להיות השפעה בריאותית משמעותית. ערכת כלים אשר יכול להעריך את הסבירות של אלה ממצאים במבחנת ob אפידמיולוגייםservations ידרבן מחקר נוסף, כולל מחקרי בטיחות שלאחר השיווק.
למרות הצורך, מבחנים מעשיים לזהות אנשים עם ספיגה של חומצות המרות חסרים. מדידה ישירה של חומצות מרות בצואה נדחתה לפני שנים מסורבלות, לא מעשי, ולא אמין 5. גישות חלופיות כוללות מדידת שמירה של נגזרת חומצה כולית רדיואקטיבי שכותרתו סלניום (75 SeHCAT) ורמות פלזמה של 7α-הידרוקסי-4-cholesten-3-אחד (C4), או משפט טיפולי קלסרים חומצות מרות. 75 בדיקות SeHCAT יש זמינות מוגבלת באירופה והוא לא ה- FDA או זמין לשימוש בארה"ב יתר על כן, אפילו חשיפה לקרינה צנועה (0.26 mSv / 75 מבחן SeHCAT) מבדיקות אבחון מעלה חששות, ואת יתר חיידקי מחלה כבדה מתקדמת עלולים לבלבל 75 תוצאות SeHCAT. בדיקות C4 הוא פוטנציאל אטרקטיבי מאז פלזמה רק נדרש, אבל יש לו val חיובי חזוי נמוךue ובדיקה אינו זמין באופן נרחב. מדידת רמות בסרום של FGF19 יש מגבלות דומות. לעתים קרובות רופאים לפנות למשפט טיפולי של sequestrants חומצות מרות, אך גישה זו אינה יכולה לספק אבחנה סופית של ספיגה של חומצות המרות 5.
מסיבות אלה, גישת MRI רומן הייתה יזומה כדי למדוד תחבורה של חומצות מרות והפצת in vivo באמצעות חומצות מרה רבות-פלואור חדשנית (MFBA-MRI). MFBA המכיל שלושה אטומי פלואור (19 ו), איזוטופ יציב של שפע 100% טבעי, מועברים באופן דומה לחומצות מרה יליד 12, והוא יכול לשמש כדי לחזות התחבורה של חומצות מרה עם שילוב של פרוטון (1 H) פלואור ( 19 F) MRI, שיטה רגישה, בטוחה ללא קרינה מייננת חשיפה 13,14.
Protocol
הפרוטוקול הבא עומד בהנחיות אושרה על ידי ועדת טיפול בבעלי חיים מוסדיים השתמש (IACUC) באוניברסיטת מרילנד הספר לרפואה (IACUC פרוטוקול # 0,415,011, אישרה 18 ביוני, 2015).
1. עכברים Gavaging עם 19 F-תווית מרה חומצות
- עכברים Gavage עם 150 מ"ג / ק"ג משקל גוף 19 חומצות מרה F שכותרתו. ממלאים מזרק 1 מ"ל על הנפח עם 19 פתרון מרה F שכותרתו חומצה המניות [ליזין-אצטיל חומצה trifluoro cholic (CA-ליס-TFA; ב 1: 1 פוליאתילן גליקול 400: בופר פוספט של Dulbecco) או cholylsarcosine- trifluoro-N-methyl-acetamide (CA-sar-TFMA; ב -60% פוליאתילן גליקול 400 ו -40% בופר פוספט של Dulbecco] ולצרף מחט gavage קיבה מעוקל 20-מד 1.5 אינץ שקצהו הנורה ודא המחט gavage. זה מספיק זמן כדי להגיע לרמה של סחוס xyphoid של העכבר כאשר מוכנסים בוושט עד הרכזת של המחט
- בתוקף gחרק החיה ידי העור הרפוי בחלק האחורי של הצוואר בין האגודל ואצבע מורה ולהשתמש האצבעות הנותרות כדי לתפוס את העור על גב וזנב נמוכים.
- החזק את העכבר זקוף ולהעביר את המחט gavage לאורך הצד והגג של הפה אל הוושט ומטה לתוך הבטן. אם ההתנגדות הוא נתקל ב הלוע, למקם את המחט עד שהחיה 'בולעת' זה - לא לדחוף כנגד התנגדות.
- אם הרדמה נדרשת gavage, הצב את העכבר בתוך צנצנת פעמון המכיל 5 מ"ל isoflurane וקרוב. כאשר סמן העכבר נופל על צידו, לחכות 7 שניות, להסיר את העכבר ולבצע gavage. כדי להגן על אנשים מפני אדי הרדמה, השתמש צנצנת הפעמון רק במנדף.
- שימו החיה להתאושש isoflurane בעוד כמה דקות.
הערה: מכיוון isoflurane עובר מטבוליזם על ידי הכבד, אות פלואור שמקורם התרופה בשלמותה או מטבוליטים שלו מופרש למערכת המרה וכיס המרה יכול לבלבל fluorine איתותים מ- 19 חומצות מרות F שכותרתו 15. חלופה אחת היא להשתמש קטמין בתוספת xylazine (ראה סעיף 3.1 עבור מינונים).
קציר 2. כיס המרה, הכבד ואת הדם מדידות של חומצות מרה באמצעות כרומטוגרפיה נוזלית / ספקטרומטריית מסה
- כדי להשיג מילוי כיס מרה מקסימלית, עכברים מהירים במשך שעה לפחות 6 לפני קצירת האיברים. הכן קטמין ו xylazine ב פוספט שנאגרו מלוחים (100 קטמין μl, 62.5 xylazine μl, 840 μl PBS).
- באמצעות מזרק סטרילי 1 מ"ל, להזריק hr עכבר תת עורי 1 לפני הקציר איבר עם משקל גוף 15 μl / g של פתרון קטמין / xylazine (קטמין 150 מ"ג ו -18 מ"ג xylazine לכל ק"ג משקל גוף).
- hr אחת שלאחר מתן קטמין / xylazine לאשר הרדמה נאותה על ידי צביטת בוהן ומקום פרקדן העכבר הרדים.
- השתמש במספרי אינץ 5 או 6 לעשות חתך בעור בטן קו אמצע מן החיק אל xyphoid וסיבימספרי ne (4 אינץ ') לחתוך את והצפק ולחשוף אברי בטן - לא לנקב את הסרעפת.
- אחוז תהליך xyphoid עם מהדק 5 אינץ ולהרים בחזרה לרוחב החזה כדי לחשוף את חלל הבטן העליונה. שימוש במלקחיים ו מכשיר קהה לנתח ולהעביר את הכבד הצידה, חושף את כיס המרה.
הערה: אין לקרוע את הכבד או לגעת כיס המרה כמו לשעבר יגרום דימום חמור, וזה רשאי לעורר התכווצות כיס המרה וריקון. - מניחים מהדק 4 אינץ 'על פני צינור המרה המשותף (איור 3, מקווקו חיצים). חותכי רצועת הצמדת המוט המעולה של כיס המרה אל הסרעפת בעדינות להזיז את כיס המרה לצד ימין של הבטן.
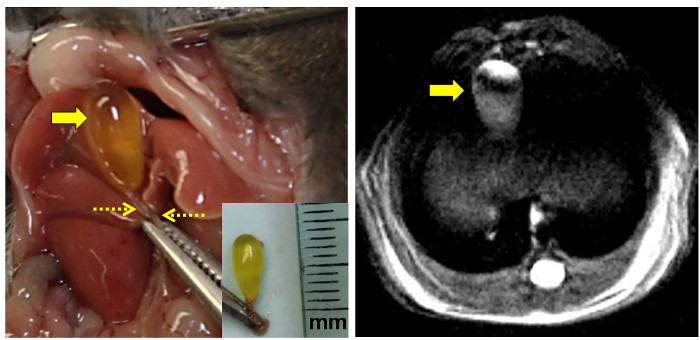
איור 3: אנטומיים Proton MRI צפיות של עכבר כיס מרה.
הלוח השמאלי מציג את mous החשוףכיס המרה דואר משמאל קו האמצע לאחר חתך בבטן. המהדק תופס את תהליך xyphoid. כיס מרת הצום מלא המרה היא מצוין על ידי החץ הגדול ואת צינור מרה משותפת הדק ידי החצים המקווקוים. [הבלעה: נכרת כיס המרה שלם עם צינור המרה המשותף הידק. השליט מסומן במילימטרים (מ"מ).] הפנל הימני מראה פרוטון ברזולוציה גבוהה תמונת MRI צפיפות משוקללת של כיס מרת murine צום (חץ). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- לפני מוציא את כיס המרה לבצע לנקב לב, קציר דם, ולגרום לדימום מחודש החיה לאמת המתת חסד.
הערה: קציר כיס המרה הראשונה עלולים לקרוע את הכבד גורם התמוטטות לב וכלי דם ואי ספיקה להשיג דגימת דם נאותה (≥ 200 μl). - לחשוף את הצד התחתון של הסרעפת שמאללזהות את שטח פעימות הלב. בנקודת הפעימה מקסימלי לב לנקב את הסרעפת והלב עם מחט 23-מד מצורף מזרק 1 מ"ל.
- לאט למשוך את המזרק בזמן aspirating. כאשר הדם מתחיל למלא את המזרק, לעצור נסיגה ולתחזק יניקה לאסוף 0.2 - 0.6 מ"ל דם. בעדינות לסובב את המחט או חוזר בה מעט עשוי להקים מחדש זרימה אם היא תפסיק.
- מעבירים את הדם אל צינור צנטריפוגות heparinized 1.5 מ"ל XG ב 2000 במשך 15 דקות. משקע הפלזמה עם ארבעה חלקים אצטוניטריל ו צנטריפוגות ב XG 12,000 במשך 10 דקות. לנתח את supernatant על ידי / כרומטוגרפיה נוזלית ספקטרוסקופיית מסות (LC / MS / MS) 11-1312-1412-1412-1412-14. במידת הצורך, לאחסן הפלזמה ב -80 מעלות צלסיוס לפני ניתוח.
- באמצעות דיסקציה קהה, לשחרר את כיס המרה מהכבד. Transect צינור המרה המשותף מתחת מהדק, להסיר ולשקול את כיס המרה, ולמקם אותו בתוך microcen 1.5 מ"לצינור trifuge. קציר את הכבד.
- Homogenize כ 100 מ"ג של הכבד ואת כיס המרה כולו על הקרח homogenizer רקמות זכוכית בגודל 21. חלץ עם 75% אצטוניטריל ומים 25% (800 μl עבור הכבד, 300 μl עבור כיס המרה) ו צנטריפוגות ב XG 12,000 במשך 10 דקות. לדלל תמציות לפי הצורך ולכמת התוכן של חומצות מרה באמצעות LC / MS / MS 11-13.
3. פרוטון חיים בעודו חי (1 H) ו פלואור (19 F) דימות תהודה מגנטית
- כדי להשיג מילוי כיס המרה מקסימלית, עכברים לצום לפחות 6 שעות לפני הדמיה. באמצעות קטמין ו xylazine, להרדים עכברים כדי למנוע תנועה בתוך סורק MRI. הכן פתרון המניות של קטמין בתוספת xylazine ב בופר פוספט (130 קטמין μl, 42.5 μl xylazine, 827 μl PBS). hr אחת לפני MRI, להשתמש במזרק סטרילי 1 מ"ל להזריק תת עורי עכבר עם 5 משקל גוף μl / g של פתרון זה (קטמין 65 מ"ג ו 4.25 מ"ג xylazine לכל ק"ג משקל גוף). כדי למנוע יובש בהרדמה להחיל משחת וטרינרים על העיניים של החיה.
- לאחר אינדוקציה עם קטמין / xylazine כנ"ל, קליפ אזור 1.5 ס"מ 2 בצד שמאל החצי התחתון של העכבר הבטן באמצעות 40 # או להבי גוזז חשמלי עדין. לאחר הסרת פרווה, מכין את השטח עם 8 - 12% בדילול פתרון לקרצף כירורגית יוד ולשטוף עם אלכוהול 70% - לחזור שני צעדים. הכנס 24-מד ידי תת עורית מחט / קטטר 0.75 אינץ 'מנהרה לתוך חלל הבטן. ודא את הקטטר אינו נמצא cecum או איבר בטן אחר על ידי המשיכה של הבוכנה - לא אמור להיות שום דם או חומר צואתי ב הקטטר.
- הסר את המחט ולהשאיר את הקטטר intraperitoneal. מניח את העכבר על רפידה תרמית שבשליטת טמפרטורה בתא חי סורק MRI.
- הכן מזרק סטרילי 1-מ"ל המכיל קטמין ו xylazine ב בופר פוספט (1,000 קטמין μl, 300 xylazine μl, 6,700 μl PBS) ולמלא את האורך הרצוי של צינור סטרילי 72 אינץ '. חבר את הקטטר intraperitoneal אל צינורות סטרילית prefilled ולהרחיב אותו הרחק סורק ה- MRI. כדי לשמור על הרדמה להזריק 50 μl של פתרון זה כל 20 דקות אם הסימנים החיוניים של העכבר הם יציבים.
הערה: לפני ההדמיה, לוודא שאין מתכות הן ליד סורק ה- MRI. - השתמש סליל MRI נפח ליניארי כפול מכוון 19 F / 1 H כדי לשדר ולקלוט אותות תדר רדיו ב 300.283 MHz עבור 1 H ו- 282.524 MHz עבור 19 גרעינים F.
- בצע כיול מערכת 11, 13 ולוקליזציה חיה עם שלוש פרוסה (צירי, באמצע sagittal, ואת העטרה) תמונות הסקאוט באמצעות רצף ירה מהר זווית נמוכה (FLASH). כדי להתחיל בניסוי, לחץ על הכפתור 'תנועת האור' בחלון בקרת הסריקה על קונסולת התוכנה.
- רוכשת multislice 1 תמונות H MR באמצעות רכישה מהירה עם הרפיה לשפרment (RARE) רצף בתצוגת הצלב של המדגם או הגוף של החיה עם msec 2,200 זמן החזרה, זמן הד 8.9 msec, גורם RARE 8, שדה הראיה 4 x 4 ס"מ 2, פורסים גודל 1.0 מ"מ, מטריקס עובי 266 x 266, ב-מטוס ברזולוציה 150 x 150 מיקרומטר 2, ומספר הממוצע 6. כדי להתחיל בניסוי, לחץ על כפתור 'תנועת האור' בחלון בקרת הסריקה על קונסולת התוכנה.
- רוכשת 19 תמונות F תוך שימוש ברצף FLASH באותו אזור של MRI H 1 עם זמן החזרה 220 ms, זווית flip = 30 °, זמן הד 3.078 ms, מטריצה בגודל 32 x 32, ב-מטוס ברזולוציה 1.25 x 1.25 מ"מ 2, פורסים 4.0 מ"מ עובי, ומספר ממוצע 768. כדי להתחיל בניסוי, לחץ על "GOP '(G o- O n- P ipeline) שבחלון כלי בקרה ספקטרומטר על קונסולת תוכנה.
- לאחר MRI, להרדים את העכבר עם injecti intraperitonealעל של 15 μl / g קטמין משקל גוף / פתרון xylazine (150 מ"ג קטמין / 18 מ"ג xylazine לכל משקל ק"ג גוף) ואחריו לנקב לב עבור exsanguination.
- כדי לשחזר עכבר מההרדמה, להסיר את הקטטר intraperitoneal אבל לא להשאיר את החיה ללא השגחה עד שהוא חוזר להכרה מספיק כדי לשמור שכיבה sternal.
- כדי למדוד 19 F שכותרתו ריכוזים של חומצות מרות 11-13 מ קציר איבר, לשמור על הרדמה עם קטמין בתוספת xylazine כמתואר לעיל.
תוצאות
השימוש MFBA עבור in vivo MRI כדי "לראות" תחבורה חומצות מרה בזמן אמת יש פוטנציאל גדול עבור שני מחקר ושימוש קליני. יתר על כן, השיטות שתוארו כאן כריתה של כיס המרה וניתוח ביוכימיים של התוכן שלה באמצעות כרומטוגרפיה נוזלית ו ספקטרומטריית מסה לספק אמצעי ...
Discussion
הסינתזה של CA-ליס-TFA ו- CA-sar-TFMA ועל ניתוח במבחנה של התחבורה שלהם באמצעות transfected ביציבות תאי כליה כלבית מדין-דארבי להביע ASBT ותאי כליה עובריים אנושיים המבטא את נתרן / taurocholate שיתוף הובלת פוליפפטיד (NTCP) מפורטים במקום אחר 13,14. כאן, הדגש הוא על מתן פומי של MFBA ידי gavage לח?...
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לבריאות בארה"ב, המכון הלאומי לסוכרת ומחלות עיכול כליות (מספרים מענק R21 DK093406 ו T32 DK067872 כדי JP.R.) וכן בפרס ההצטיינות VA (מספר מענק 1BX002129 כדי JP.R.).
Materials
| Name | Company | Catalog Number | Comments |
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 x 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25 mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg/ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
References
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved