Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En utilisant des acides biliaires multi-fluorés et
Dans cet article
Résumé
Outils pour diagnostiquer la bile malabsorption d'acide et de mesurer le transport des acides biliaires in vivo sont limitées. Une approche innovante d'animaux vivants est décrit qui utilise des protons combiné (1 H) plus de fluor (19 F) d'imagerie par résonance magnétique; cette nouvelle méthodologie a un potentiel de translation à l'écran pour malabsorption des acides biliaires dans la pratique clinique.
Résumé
En plus de leur rôle traditionnel de détergents qui facilitent l'absorption des graisses, de la littérature émergente indique que les acides biliaires sont des molécules de signalisation puissants qui affectent plusieurs organes; ils modulent la motilité intestinale et la production d'hormones, et de modifier le tonus vasculaire, le métabolisme du glucose, le métabolisme des lipides, et l'utilisation de l'énergie. Les changements dans les acides biliaires fécaux peuvent modifier le microbiome intestinal et de promouvoir le côlon pathologie y compris la diarrhée cholerrheic et le cancer du côlon. des régulateurs clés de la composition des acides biliaires fécaux sont le petit intestin apicale acides biliaires Transporteur de sodium-dépendant (ASBT) et fibroblast growth factor-19 (FGF19). expression réduite et la fonction de ASBT diminue intestinale acide biliaire up-prendre. De plus, les données in vitro suggèrent que certains médicaments approuvés par la FDA inhibent la fonction ASBT. FGF19 libération Déficient augmente la synthèse de l'acide biliaire hépatique et de libérer dans les intestins à des niveaux qui dépassent ASBT. Soit un dysfonctionnement ou d'une carence en ASBT FGF19 augmente fles acides biliaires ECAL et peuvent causer la diarrhée chronique et promouvoir la néoplasie du côlon. Malheureusement, les outils pour mesurer la bile malabsorption acide et les actions de la drogue sur le transport des acides biliaires in vivo sont limitées. Afin de comprendre les actions complexes d'acides biliaires, les techniques sont nécessaires qui permettent la surveillance simultanée des acides biliaires dans l'intestin et dans les tissus métaboliques. Ceci nous a amené à concevoir une méthode innovante pour mesurer le transport des acides biliaires chez les animaux vivants en utilisant une combinaison de proton (1 H) et de fluor (19 F) l' imagerie par résonance magnétique (IRM). Traceurs nouveaux pour le fluor (19 F) à base de l' IRM des animaux vivants ont été créés et testés, à la fois in vitro et in vivo. Les points forts de cette approche comprennent le manque d'exposition aux rayonnements et le potentiel translationnelle ionisants pour la recherche et la pratique clinique.
Introduction
En plus de leur rôle en tant que détergents classiques qui facilitent l' absorption des graisses dans l'intestin, les acides biliaires sont apparus comme des molécules de signalisation puissants affectant de multiples organes , en plus de ceux associés à leur circulation entérohépatique 1,2. En plus de contrôler leur propre métabolisme, les acides biliaires moduler plusieurs aspects de la physiologie gastro - intestinale (par exemple, la motilité intestinale et la production de l' hormone incrétine, le côlon physiologie et la susceptibilité au cancer) et ont des effets systémiques sur le tonus vasculaire, le glucose et le métabolisme des lipides, et l' utilisation de l' énergie. Certains de ces effets sont médiés dans l'intestin, d'autres sont dus à des changements dans les niveaux post-prandiaux d'acides biliaires systémiques, comme il est indiqué chez les patients obèses ou après une chirurgie gastrique by-pass. Pour élucider les actions métaboliques complexes des acides biliaires nouvelle technologie est nécessaire que permet la surveillance simultanée des niveaux d'acides biliaires dans les différents compartiments anatomiques, dans le tractus gastro-intestinal et métaboliques tissus (foie, le pancréas, les muscles squelettiques et tissu adipeux). L' obtention d'une telle information temporelle et spatiale nécessite une technologie innovante - imagerie in vivo en utilisant de nouveaux traceurs d'acides biliaires , comme décrit ici est une telle nouvelle approche.
Composition d'acide biliaire et de la distribution dans les compartiments anatomiques sont régulés par des facteurs qui modulent la synthèse hépatique et l'absorption de l'iléon, y compris le régime alimentaire, la chirurgie, l'utilisation d'antibiotiques et de modification de la flore intestinale. Un régulateur clé de l' absorption des acides biliaires intestinaux pour leur circulation entéro 3 (figure 1) est l'iléon apicale Sodium dépendant Bile Acid Transporter (ASBT; SLC10A2). Bien que l'absorption passive se produit tout au long de l'intestin, ASBT médie l'absorption de 95% des acides biliaires intestinaux de sorte que normalement il y a un déversement limité d'acides biliaires dans les selles. ASBT déficient (Slc10a2 - / -) Les souris ont augmenté les acides biliaires fécaux et une diminution de la bile acid piscine 4.
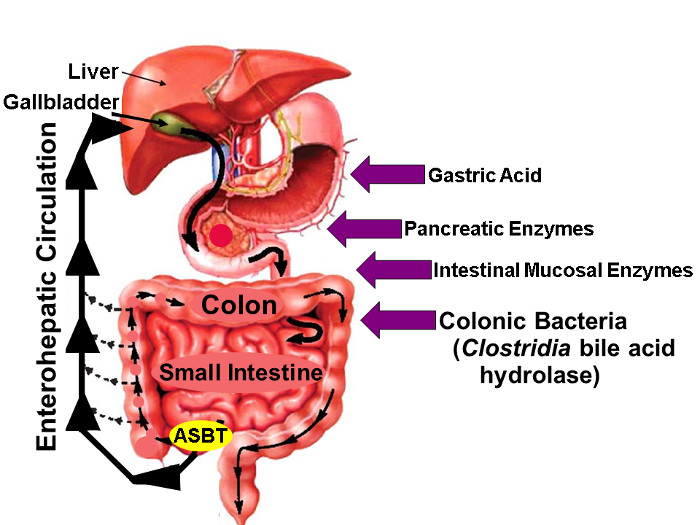
Figure 1: Circulation entérohépatique des acides biliaires.
Illustration de entéro Circulation dans lequel les acides biliaires sont synthétisées dans le foie, Excrétée dans l'arbre biliaire, stockée dans la vésicule biliaire, Sortie dans le proximal Petit Intestin avec les repas, et activement repris via ASBT dans le Distal iléon. Tandis que de faibles quantités d'acides biliaires sont absorbés passivement à travers le tube digestif, environ 95% des acides biliaires intestinaux sont transportés activement par ASBT entraînant un minimum (environ 5%) de la perte dans les selles, qui est compensée par une quantité similaire de nouvelle synthèse des acides biliaires dans le foie, ce qui maintient un pool d'acides biliaires à l'état stable. Les flèches à droite identifient les facteurs qui peuvent influer sur la stabilité de l'acide biliaire natif et le fluor marqué, y compris l'acide gastrique, du pancréas et des enzymes de la muqueuse intestinale, et, le plus importantly, enzymes hydrolytiques libérés par des espèces clostridiennes qui colonisent l'intestin grêle et le côlon distal. (Modifié avec la permission 16) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
malabsorption des acides biliaires peuvent être classés en trois types, dont chacune augmente les acides biliaires dihydroxylés fécales, ce qui provoque une diarrhée intermittente ou chronique. Type 1 résultats de pathologie iléale brut (par exemple, la résection, la maladie de Crohn) 5. Tapez 3 résultats de cholécystectomie, vagotomie, la maladie coeliaque, la prolifération bactérienne, et l'insuffisance pancréatique. En revanche, les personnes (type 2) malabsorption des acides biliaires «primaire» posent un défi diagnostique formidable parce qu'ils manquent de telles conditions antécédentes et ne disposent pas des preuves de la pathologie dans l'iléon. Par conséquent, la malabsorption des acides biliaires primaires est souvent diagnostiquée à tort comme la diarrhée-psyndrome redominant du côlon irritable (IBS-D), peut-être la raison la plus courante pour liés gastro-entérologie-out-patients visites. Il a été estimé qu'un tiers des patients atteints d'IBS-D ont malabsorption des acides biliaires primaires; aux États - Unis, ce qui peut représenter plusieurs millions de personnes 5. connaissances récentes indiquent que BAM primaire dérive de troubles de la rétro-inhibition de la synthèse des acides biliaires du foie par l'intestin fibroblast growth factor-19 (FGF19), et non à partir de l'expression ou la fonction de ASBT réduite.
Malabsorption de l' acide biliaire primaire, de faibles taux plasmatiques de FGF19 ne parviennent pas à arrêter la synthèse de l' acide biliaire hépatique - l'augmentation résultante des acides biliaires intestinaux sature des transporteurs d'acides biliaires, y compris ASBT et le déversement augmentée des acides biliaires dans les selles provoque une diarrhée 6 (Figure 2). Les souris déficientes en FGF15 (FGF19 murin) ont une piscine d'acide biliaire élargi et une augmentation des acides biliaires fécaux 7.

Figure 2: Mécanismes de Intestinal Bile Acid malabsorption.
Normalement, comme indiqué dans le panneau A, environ 95% des acides biliaires intestinaux sont absorbés par transport actif dans l'iléon distal par l' intermédiaire ASBT. Lorsque l' expression ou l' activité ASBT est diminuée (panneau B), douteux des résultats d'absorption des acides biliaires intestinaux dans le déversement des acides biliaires dans le côlon. Avec la signalisation FGF19 altérée (panneau C), l'absence de rétro - inhibition de la bile hépatique résultats de la synthèse de l' acide dans l' augmentation des concentrations d'acides biliaires intestinaux qui accablent la capacité de transport de ASBT du déversement des acides biliaires dans le côlon. S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
À long terme, l'élévation chronique fécale bile acids peut favoriser la néoplasie du côlon. Colon néoplasie provient de la dysplasie de la muqueuse progressive associée à des mutations de gènes somatiques, mais les facteurs environnementaux qui augmentent les acides biliaires fécaux peuvent accélérer et augmenter ce processus. Chez les rongeurs, une augmentation des acides biliaires fécaux , soit en conséquence de l' administration exogène ou d'une déficience ASBT du côlon promouvoir la dysplasie et la formation de tumeurs 8-10.
Notamment, les résultats de provocation indiquent que les médicaments couramment utilisés approuvés par la Food and Drug Administration (FDA) inhibent puissamment le transport des acides biliaires par ASBT in vitro 11. Si ces médicaments réduisent petit le transport des acides biliaires intestinale in vivo et d' augmenter les niveaux d'acides biliaires fécaux, l'impact potentiel sur la pathologie du côlon serait concernant. Même une petite augmentation dans le côlon pathologie attribuable à l'utilisation d'un tel médicament pourrait avoir un impact majeur sur la santé. Une boîte à outils qui peut évaluer la plausibilité de ces derniers dans les résultats in vitro et ob épidémiologiquevations stimulerait des recherches supplémentaires, y compris des études de sécurité post-commercialisation.
Malgré la nécessité, des essais pratiques pour identifier les personnes atteintes de malabsorption des acides biliaires font défaut. La mesure directe des acides biliaires fécaux a été rejetée il y a des années comme encombrants, peu pratiques et peu fiables 5. D' autres approches comprennent la rétention d'un dérivé radioactif de sélénium marqué par l' acide cholique (75 SeHCAT) et les taux plasmatiques de 7α-hydroxy-4-cholestén-3-one (C4), ou un essai thérapeutique de liant d'acides biliaires de mesure. Des tests de 75 SeHCAT a disponibilité limitée en Europe et ne sont pas approuvés par la FDA ou disponibles pour une utilisation aux États - Unis en outre, même l' exposition aux rayonnements modeste (0,26 mSv / 75 test SeHCAT) à partir de tests de diagnostic soulève des préoccupations, et la prolifération bactérienne et les maladies du foie avancé peuvent confondre 75 résultats de SeHCAT. test C4 est potentiellement intéressante puisque seul le plasma est nécessaire, mais il a une faible val positive prédictiveue et les tests ne sont pas largement disponibles. La mesure des taux sériques de FGF19 a des limites similaires. Cliniciens fréquemment recours à un essai thérapeutique de chélateurs des acides biliaires, mais cette approche ne peut pas fournir un diagnostic définitif de malabsorption des acides biliaires 5.
Pour ces raisons, une nouvelle approche IRM a été conçu pour mesurer le transport des acides biliaires et la distribution in vivo en utilisant des acides biliaires multi-fluorés innovants (MFBA-IRM). MFBA contenant trois atomes de fluor (19 F), un isotope stable de 100% d' abondance naturelle, sont transportés de manière similaire aux acides biliaires natifs 12 et peut être utilisé pour visualiser le transport des acides biliaires avec une combinaison de protons (1 H) et du fluor ( 19 F) IRM, une méthode sûre sensible sans exposition aux rayonnements ionisants 13,14.
Protocole
Le protocole suivant est conforme aux lignes directrices approuvées par le Comité institutionnel des animaux soin et l'utilisation (IACUC) à l'Université du Maryland School of Medicine (IACUC Protocole # 0415011, a approuvé 18 Juin, 2015).
1. Souris avec gavage Acides Bile 19 F-Étiqueté
- Souris Gavage avec 150 mg / kg de poids corporel 19 acides biliaires F-étiquetés. Remplir une seringue de 1 ml au volume nécessaire avec 19 F marqué solution d' acide biliaire stock [acide trifluoro-acétyl cholique lysine (CA-lys-TFA, en 1: 1 polyéthylène glycol 400: le phosphate de Dulbecco saline tamponnée) ou cholylsarcosine- trifluoro-N-méthyl-acétamide (CA-sar-TFMA; dans 60% de polyéthylène glycol 400 et 40% du tampon phosphate salin de Dulbecco] et joindre un 1,5 pouces incurvé aiguille de gavage gastrique de l'ampoule à pointe de calibre 20 Assurez-vous que l'aiguille de gavage. est suffisamment longue pour atteindre le niveau du cartilage xiphoïde de la souris lorsqu'il est inséré dans l'œsophage jusqu'à l'embase de l'aiguille
- fermement grâper l'animal par la peau lâche à l'arrière du cou entre le pouce et l'index et utiliser les autres doigts pour saisir la peau sur le bas du dos et de la queue.
- Maintenez la souris droite et passer l'aiguille de gavage le long du côté et le toit de la bouche dans l'oesophage et dans l'estomac. En cas de résistance au pharynx, repositionner l'aiguille jusqu'à ce que l'animal 'avale' il - ne pas pousser contre la résistance.
- Si l'anesthésie est nécessaire pour gavage, placez la souris dans une cloche contenant 5 ml isoflurane et à proximité. Lorsque la souris tombe sur son côté, attendez 7 secondes, retirez la souris et effectuer gavage. Pour protéger le personnel des vapeurs anesthésiques, utilisez la cloche seulement dans une hotte.
- Observer l'animal récupérer de l'isoflurane dans quelques minutes.
NOTE: Depuis isoflurane est métabolisé par le foie, un signal de fluor provenant de la drogue intact ou de ses métabolites excrété dans le système biliaire et la vésicule biliaire peut confondre Fluorine signaux à partir de 19 acides biliaires F marqués 15. Une alternative consiste à utiliser la kétamine, plus xylazine (voir section 3.1 pour des doses).
2. La récolte de la vésicule biliaire, du foie et du sang pour les mesures d'acide Bile utilisant la chromatographie liquide / spectrométrie de masse
- Pour obtenir un remplissage de la vésicule biliaire maximale, des souris à jeun depuis au moins 6 heures avant la récolte des organes. Préparer kétamine et de xylazine dans une solution saline tamponnée au phosphate (100 pi kétamine, la xylazine 62,5 ul, 840 ul de PBS).
- En utilisant une seringue stérile de 1 ml, injecter une sous-cutanée de souris 1 heure avant la récolte d'organes avec 15 ul / g de poids corporel d'une solution de kétamine / xylazine (150 mg de kétamine et de xylazine 18 mg par kg de poids corporel).
- Une heure après l'administration de la kétamine / xylazine confirmer une anesthésie adéquate par pincement de l'orteil et placez le décubitus souris anesthésiée.
- Utilisez 5 ou 6 ciseaux de pouce pour faire une incision abdominale peau médiane du pubis à la xiphoïde et ficiseaux ne (4 pouces) pour couper la doublure péritonéale et exposer les organes abdominaux - ne pas percer le diaphragme.
- Attrapez le processus xiphoïde avec une pince de 5 pouces et soulevez en arrière à travers la poitrine pour exposer la cavité abdominale supérieure. Utilisez une pince et un instrument contondant pour disséquer et déplacer le foie de côté, l'exposition de la vésicule biliaire.
REMARQUE: Ne pas déchirer le foie ou de toucher la vésicule biliaire comme l'ancien entraîne des saignements sévères et ce dernier peut stimuler la vésicule biliaire contraction et la vidange. - Placez un collier de 4 pouces à travers le canal cholédoque (Figure 3, des flèches en pointillés). Couper le ligament fixer le pôle supérieur de la vésicule biliaire à la membrane et déplacez doucement la vésicule sur le côté droit de l'abdomen.
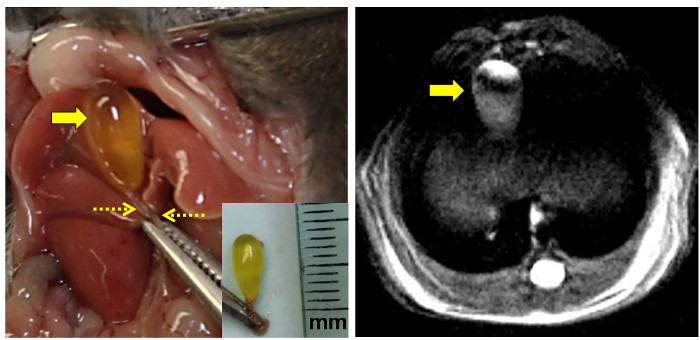
Figure 3: Anatomical et Proton IRM Vues de la vésicule biliaire Mouse.
Le panneau de gauche montre la nyme exposéee vésicule biliaire à la gauche de la ligne médiane après incision abdominale. La pince saisit le processus xiphoïde. Le jeûne vésicule biliaire remplie est indiquée par la grande flèche et le canal cholédoque serré par les flèches en pointillés. [Encart: excisés vésicule intacte avec le canal cholédoque serré. La règle est marquée en millimètres (mm).] Le panneau de droite montre une image IRM protons à haute résolution densité pondérée de la vésicule biliaire murin à jeun (flèche). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Avant exciser la vésicule biliaire effectuer une ponction cardiaque, le sang de la récolte, et Exsanguination l'animal pour vérifier l'euthanasie.
NOTE: La récolte de la vésicule biliaire première peut lacérer le foie provoquant un collapsus cardiovasculaire et l'échec pour obtenir un échantillon de sang adéquat (≥ 200 pi). - Exposer le dessous du diaphragme gauche etidentifier la surface de battement du cœur. Au point de pulsation cardiaque maximale percer le diaphragme et le cœur avec une aiguille de calibre 23 fixée à une seringue de 1 ml.
- Lentement retirer la seringue tout en aspirant. Lorsque le sang commence à remplir la seringue, arrêter de retirer et de maintenir l'aspiration pour recueillir 0,2 à 0,6 ml de sang. tourner doucement l'aiguille ou de retirer légèrement peut rétablir le flux si elle cesse.
- Transférer le sang dans un tube héparinisé 1,5 ml et on centrifuge à 2000 g pendant 15 min. Précipiter le plasma avec quatre parties d'acétonitrile et centrifuger à 12 000 xg pendant 10 min. Analyser le surnageant par chromatographie liquide / spectrométrie de masse (LC / MS / MS) 11-1312-1412-1412-1412-14. Si nécessaire, stocker le plasma à -80 ° C avant analyse.
- Utilisation de dissection, libérer la vésicule biliaire du foie. Transect le canal cholédoque en dessous de la pince, retirer et peser la vésicule biliaire, et le placer dans un microcen de 1,5 mlTube trifuge. Récolter le foie.
- Homogénéiser environ 100 mg de foie, la vésicule biliaire et de l'ensemble de la glace dans un homogénéisateur de tissu de verre de taille 21. Extraire avec 75% d'acétonitrile et 25% d'eau (800 ul pour le foie, la vésicule biliaire pour 300 ul) et centrifuger à 12 000 xg pendant 10 min. Diluer des extraits selon les besoins et quantifier la teneur en acides biliaires par LC / MS / MS 13/11.
3. animaux vivants du proton (1 H) et du fluor (19 F) , imagerie par résonance magnétique
- Pour obtenir un remplissage de la vésicule biliaire maximale, des souris à jeun depuis au moins 6 heures avant l'imagerie. Utilisation de la kétamine et xylazine, anesthésier les souris pour empêcher le mouvement dans le scanner IRM. Préparer une solution mère de kétamine, plus xylazine dans un tampon phosphate salin (130 kétamine ul, 42,5 ul xylazine, 827 ul de PBS). Une heure avant l'IRM, l'utilisation d'une seringue stérile de 1 ml pour injecter une sous-cutanée de souris avec 5 ul / g de poids corporel de cette solution (65 mg de kétamine et 4,25 mg xylazine par kg de poids corporel). Pour prévenir la sécheresse sous anesthésie appliquer une pommade vétérinaire aux yeux de l'animal.
- Après l' induction avec de la kétamine / xylazine comme ci - dessus, un clip d' une zone de 1,5 cm 2 sur la gauche de la moitié inférieure de l' abdomen de la souris en utilisant # 40 ou plus fines lames de la tondeuse électrique. Après le retrait de la fourrure, préparer la zone avec 8-12% diluée solution de lavage chirurgical iode et rincer à 70% d'alcool - répéter les deux étapes. Insérer un calibre 24 de 0,75 pouces aiguille / cathéter sous-cutané et d'un tunnel dans la cavité abdominale. Assurez-vous que le cathéter est pas dans le caecum ou autre organe abdominal en tirant sur le piston - il devrait y avoir pas de sang ou de matières fécales dans le cathéter.
- Retirez l'aiguille et laisser le cathéter intrapéritonéale. Placez la souris sur un pad thermique à température contrôlée dans la chambre scanner des animaux IRM.
- Préparer une seringue stérile de 1 ml contenant de la kétamine et de la xylazine dans un tampon phosphate salin (1000 kétamine ul, 300 ul xylazine, 6,700 ul de PBS) et remplir la longueur désirée d'un tube stérile de 72 pouces. Connecter le cathéter intrapéritonéale à la tubulure stérile préremplie et l'étendre loin du scanner IRM. Pour maintenir l'anesthésie injecter 50 ul de cette solution toutes les 20 minutes si les signes vitaux de la souris sont stables.
REMARQUE: Avant l'imagerie, assurez-vous pas de métaux sont à proximité du scanner IRM. - Utiliser une bobine d'IRM de volume linéaire à double accordé 19 F / 1 H à émettre et recevoir des signaux de fréquence radio à 300,283 MHz pour 1 H et 282,524 MHz pour les noyaux de 19 F.
- Effectuer le système d' étalonnage 11, 13 et localisation des animaux avec trois tranches (axial, sagittal médian, et coronales) images scouts en utilisant un plan séquence à faible angle rapide (FLASH). Pour commencer le test, cliquez sur le bouton «feu de circulation» dans la fenêtre de contrôle de numérisation sur la console du logiciel.
- Acquérir multicoupes 1 images H MR en utilisant une acquisition rapide avec la relaxation améliorerment séquence (RARE) dans la vue en coupe de l'échantillon ou le corps de l'animal avec le temps de répétition de 2200 ms, temps d' écho 8.9 msec, facteur RARE 8, champ de vision 4 x 4 cm 2, tranche d' épaisseur 1,0 mm, taille de la matrice 266 x 266, résolution dans le plan 150 x 150 um 2, et le nombre de moyennes 6. Pour démarrer l'expérience, cliquez sur le bouton «feu de circulation» dans la fenêtre de contrôle de numérisation sur la console du logiciel.
- Acquérir 19 F images en utilisant une séquence FLASH dans la même région du 1 H IRM avec le temps de répétition 220 ms, angle de bascule = 30 °, le temps d' écho 3.078 ms, la taille de la matrice 32 x 32, dans le plan de résolution de 1,25 x 1,25 mm 2, tranche d' épaisseur 4,0 mm, et le nombre de moyennes 768. Pour démarrer l'expérience, cliquez sur le (G o- O n P ipeline) bouton dans la fenêtre de l' outil de contrôle Spectrometer sur la console du logiciel «GOP».
- Après l'IRM, euthanasier la souris avec INJECTI intrapéritonéalesur de 15 ul / g de poids corporel de kétamine / xylazine solution (150 mg de kétamine / xylazine 18 mg par kg de poids corporel) suivie d'une ponction cardiaque pour exsanguination.
- Pour récupérer une souris de l'anesthésie, retirer le cathéter intrapéritonéale, mais ne pas laisser l'animal sans surveillance jusqu'à ce qu'elle reprenne conscience suffisante pour maintenir décubitus sternale.
- Pour mesurer 19 F-marquées concentrations d'acides biliaires 11-13 de la récolte d'organes, maintenir l' anesthésie avec de la kétamine , plus xylazine comme décrit ci - dessus.
Résultats
L'utilisation de MFBA pour in vivo IRM pour «voir» le transport des acides biliaires en temps réel a un grand potentiel pour la recherche et l' utilisation clinique. En outre, les procédés décrits ici pour la résection de la vésicule biliaire et de l'analyse biochimique de son contenu en utilisant la chromatographie liquide et la spectrométrie de masse constituent un moyen de confirmer les résultats de l'imagerie. Toutefois, la validité de ces méthode...
Discussion
La synthèse de l' AC-Lys- TFA et CA-Sar-TFMA et l'analyse in vitro de leur transport à l' aide transfectées de façon stable Madin-Darby cellules de rein canin exprimant ASBT et les cellules rénales embryonnaires humaines exprimant le polypeptide de sodium / taurocholate co-transport (PNT) sont détaillées ailleurs 13,14. Ici, l'accent est mis sur l'administration orale de MFBA par gavage à des animaux, suivie par la récolte de la vésicule biliaire, le foie et le sang pour...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par les Instituts nationaux de la santé, l'Institut national du diabète et des maladies digestives et rénales (numéros de subvention R21 DK093406 et T32 DK067872 à JP.R.) et le prix du mérite VA (numéro de subvention 1BX002129 à JP.R.).
matériels
| Name | Company | Catalog Number | Comments |
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 x 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25 mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg/ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Références
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon