È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Utilizzando Multi-fluorurati biliari acidi e
In questo articolo
Riepilogo
Strumenti per diagnosticare la bile malassorbimento degli acidi e misurano il trasporto degli acidi biliari in vivo sono limitati. Un approccio innovativo di animali vivi è descritto che utilizza protoni combinato (1 H) più di fluoro (19 F) risonanza magnetica; questa nuova metodologia ha traslazionale potenziale per lo screening del malassorbimento degli acidi biliari nella pratica clinica.
Abstract
Insieme con il loro tradizionale ruolo di detergenti che facilitano l'assorbimento del grasso, la letteratura emergente indica che gli acidi biliari sono potenti molecole di segnalazione che interessano più organi; modulano la motilità intestinale e la produzione di ormoni e alterano il tono vascolare, il metabolismo del glucosio, il metabolismo lipidico, e l'utilizzo di energia. Le variazioni di acidi biliari fecali possono alterare la microbioma intestinale e promuovere la patologia del colon tra cui la diarrea cholerrheic e il cancro del colon. regolatori chiave della composizione in acidi biliari fecale sono il piccolo intestino apicale sodio-dipendente Bile Acid Transporter (ASBT) e di crescita dei fibroblasti fattore-19 (FGF19). ridotta espressione e la funzione di ASBT diminuisce acidi biliari intestinali up-take. Inoltre, i dati in vitro suggeriscono che alcuni farmaci approvati dalla FDA inibiscono la funzione ASBT. rilascio FGF19 carente aumenta la sintesi degli acidi biliari epatici e rilasciare nell'intestino a livelli che superano ASBT. Sia ASBT disfunzione o deficit di FGF19 aumentano facidi biliari ECAL e possono causare diarrea cronica e promuovere la neoplasia del colon. Purtroppo, strumenti per misurare la bile malassorbimento degli acidi e le azioni delle droghe sul trasporto degli acidi biliari in vivo sono limitati. Per comprendere le azioni complesse di acidi biliari, le tecniche sono necessarie che permettono il monitoraggio simultaneo di acidi biliari nell'intestino e nei tessuti metabolici. Questo ci ha portato a concepire un metodo innovativo per misurare trasporto degli acidi biliari in animali vivi utilizzando una combinazione di protone (1 H) e fluoro (19 F) risonanza magnetica (MRI). Traccianti innovativi per fluoro (19 F) -based vivo MRI animali sono stati creati e testati, sia in vitro che in vivo. Punti di forza di questo approccio comprendono la mancanza di esposizione alle radiazioni e il potenziale traslazionale ionizzanti per la ricerca e la pratica clinica.
Introduzione
Insieme con il loro ruolo classico come detergenti che facilitano l'assorbimento dei grassi a livello intestinale, acidi biliari sono emersi come potenti molecole di segnalazione che interessano più organi, oltre a quelli associati con il loro 1,2 circolazione enteroepatica. Oltre a controllare il proprio metabolismo, acidi biliari di modulare diversi aspetti della fisiologia gastrointestinale (ad esempio, la motilità intestinale e la produzione di ormoni incretine, la fisiologia del colon, e suscettibilità al cancro) e hanno effetti sistemici sul tono vascolare, metabolismo glucidico e lipidico, e l'utilizzo di energia. Mentre alcuni di questi effetti sono mediati nell'intestino, gli altri sono a causa di cambiamenti nei livelli postprandiali acidi biliari sistemici, come osservato nei pazienti obesi o dopo l'intervento chirurgico di by-pass gastrico. Per chiarire le complesse azioni metaboliche degli acidi biliari è necessaria una nuova tecnologia che consente di monitorare simultaneo di livelli di acidi biliari in diversi compartimenti anatomici, nel tratto gastrointestinale e metatessuti bolici (fegato, pancreas, muscolo scheletrico e tessuto adiposo). Ottenere queste informazioni temporali e spaziali richiede una tecnologia innovativa - imaging in vivo utilizzando nuovi traccianti acidi biliari, come descritto qui è un approccio del genere romanzo.
la composizione degli acidi biliari e la distribuzione nei compartimenti anatomici sono regolate da fattori che modulano la loro sintesi epatica e l'assorbimento ileale, tra cui la dieta, la chirurgia, l'uso di antibiotici e cambiamenti nella flora intestinale. Un regolatore chiave della intestinale assorbimento degli acidi biliari per la loro circolazione enteroepatica 3 (figura 1) è il ileale apicale sodio-dipendente Bile Acid Transporter (ASBT; SLC10A2). Sebbene assorbimento passivo si verifica durante l'intestino, ASBT media assorbimento del 95% degli acidi biliari intestinali modo che normalmente vi è fuoriuscita limitata di acidi biliari nelle feci. Asbt-deficienti (Slc10a2 - / -) topi sono aumentati gli acidi biliari fecale e un aci bile diminuitad piscina 4.
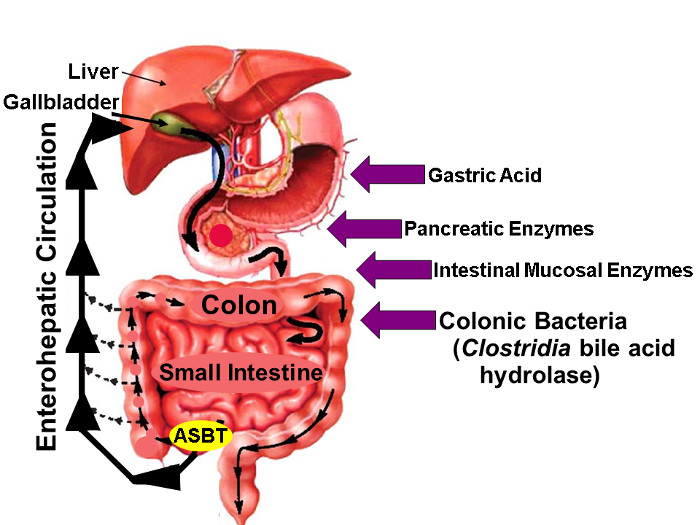
Figura 1: circolazione enteroepatica di acidi biliari.
Illustrazione di enteroepatica Circolazione cui biliari acidi sono sintetizzato nel fegato, escreta nel biliare albero, conservato nella cistifellea, rilasciata nel piccolo intestino prossimale con i pasti, e attivamente ripreso tramite ASBT nel distale ileo. Considerando che piccole quantità di acidi biliari sono assorbiti passivamente tutto l'intestino, circa il 95% di acidi biliari intestinali sono trasportati attivamente ASBT conseguente perdita minima (circa il 5%) nelle feci che viene compensata da una quantità simile di nuova sintesi degli acidi biliari in fegato, mantenendo così un pool di acidi biliari stato stazionario. Le frecce a destra identificano alcuni fattori che possono influenzare la stabilità nativo e fluoro marcato degli acidi biliari, tra cui l'acido gastrico, del pancreas e gli enzimi della mucosa intestinale, e, più importantly, enzimi idrolitici rilasciati da specie clostridi che colonizzano l'intestino tenue e del colon distale. (Modificata con il permesso 16) Clicca qui per vedere una versione più grande di questa figura.
malassorbimento degli acidi biliari possono essere classificati in tre tipi, ciascuno dei quali aumenta acidi biliari diidrossi fecali, causando diarrea intermittente o cronica. Tipo 1 risultati dalla patologia ileale lordo (ad esempio, la resezione, morbo di Crohn) 5. Tipo 3 risultati di colecistectomia, vagotomia, celiachia, proliferazione batterica, e insufficienza pancreatica. Al contrario, le persone con (tipo 2) malassorbimento degli acidi biliari 'primaria' rappresentano una sfida diagnostica formidabile perché mancano queste condizioni antecedenti e non hanno prove di patologia nell'ileo. Quindi, malassorbimento degli acidi biliari primari è comunemente confusa con la diarrea-pLa sindrome redominant intestino irritabile (IBS-D), forse la ragione più comune per le visite ambulatoriali gastroenterologia-correlati. È stato stimato che un terzo dei pazienti con IBS-D ha primaria malassorbimento acido biliare; negli Stati Uniti, questo può rappresentare diversi milioni di persone 5. intuizioni recenti indicano che BAM primario deriva dalla inibizione di feedback compromissione della sintesi degli acidi biliari dal fegato mediante intestinale di crescita dei fibroblasti fattore-19 (FGF19), non per l'espressione o la funzione di ASBT ridotta.
Nel primaria malassorbimento degli acidi biliari, bassi livelli plasmatici di FGF19 non riescono a spegnere la sintesi degli acidi biliari epatica - il conseguente aumento degli acidi biliari intestinali satura trasportatori degli acidi biliari, compresi ASBT, e la fuoriuscita aumentata di acidi biliari nelle feci provoca diarrea 6 (Figura 2). Mice carente in Fgf15 (FGF19 murino) hanno una piscina acidi biliari ampliato e aumentato acidi biliari fecali 7.

Figura 2: Meccanismi di intestinale Bile Acid malassorbimento.
Normalmente, come mostrato nel pannello A, circa il 95% di acidi biliari intestinali sono assorbiti dal trasporto attivo nell'ileo distale tramite ASBT. Quando l'espressione o l'attività ASBT è diminuita (pannello B), deteriorati intestinali risultati di assorbimento degli acidi biliari in fuoriuscita di acidi biliari nel colon. Con segnalazione FGF19 compromessa (pannello C), la mancanza di inibizione valutazioni di bile epatica risultati di sintesi di acido in un aumento delle concentrazioni di acidi biliari intestinali che superano la capacità di trasporto ASBT con fuoriuscita di acidi biliari nel colon. Clicca qui per vedere una versione più grande questa figura.
A lungo termine, aumento cronico in fecale Aci bileds può promuovere neoplasia del colon. Colon neoplasia deriva da displasia mucosa progressiva associata a mutazioni del gene somatiche, ma i fattori ambientali che aumentano gli acidi biliari fecali possono accelerare e aumentare questo processo. Nei roditori, aumento degli acidi biliari fecali oa seguito di somministrazione esogena o deficienza asbt promuovere displasia colon e formazione del tumore 8-10.
In particolare, i risultati provocatori indicano che i farmaci di uso comune approvati dalla Food and Drug Administration (FDA) inibiscono il trasporto degli acidi biliari da ASBT in vitro 11. Se questi farmaci riducono piccolo trasporto degli acidi biliari intestinale in vivo e aumentare i livelli di acidi biliari fecali, il potenziale impatto sulla patologia del colon sarebbe preoccupante. Anche un piccolo aumento nella patologia colon attribuire all'utilizzo di tale farmaco potrebbe avere un notevole impatto sulla salute. Un kit di strumenti in grado di valutare la plausibilità di questi in risultati in vitro e ob epidemiologicaservations sarebbero stimolare ulteriori ricerche, compresi gli studi di sicurezza post-marketing.
Nonostante la necessità, test pratici per identificare le persone con malassorbimento degli acidi biliari sono carenti. La misura diretta di acidi biliari fecali è stata respinta anni fa come ingombrante, poco pratico, e inaffidabile 5. Approcci alternativi includono la misura mantenimento di un derivato radioattivo selenio marcato acido colico (75 SeHCAT) e livelli plasmatici di 7α-idrossi-4-cholesten-3-one (C4), o un processo terapeutico di legante di acidi biliari. 75 test SeHCAT trovi disponibilità limitata in Europa e non è approvato dalla FDA o disponibili per l'uso negli Stati Uniti, inoltre, anche l'esposizione alle radiazioni modesta (0,26 mSv / 75 di prova SeHCAT) dal test diagnostici solleva preoccupazioni, e la proliferazione batterica e la malattia epatica avanzata possono confondere 75 risultati SeHCAT. test C4 è potenzialmente interessante in quanto è richiesta solo al plasma, ma ha una bassa Val positivo predittivoue e la sperimentazione non è ampiamente disponibile. Misurare i livelli sierici di FGF19 ha limitazioni simili. Spesso i medici ricorrono ad un processo terapeutico di sequestranti degli acidi biliari, ma questo approccio non può fornire una diagnosi definitiva di acidi biliari malassorbimento 5.
Per queste ragioni, un nuovo approccio risonanza magnetica è stato concepito per misurare il trasporto degli acidi biliari e la distribuzione in vivo usando acidi biliari multi-fluorurati innovativi (MFBA-MRI). MFBA contenente tre atomi di fluoro (19 F), un isotopo stabile del 100% abbondanza naturale, vengono trasportati in modo simile agli acidi biliari autoctone 12, e può essere utilizzato per visualizzare trasporto degli acidi biliari con una combinazione di protone (1 H) e fluoro ( 19 F) risonanza magnetica, un metodo sicuro sensibile senza esposizione a radiazioni ionizzanti 13,14.
Protocollo
Il seguente protocollo aderisce alle linee guida approvate dal Comitato Istituzionale Animal Care e Usa (IACUC) presso l'Università del Maryland School of Medicine (IACUC protocollo # 0.415.011, approvata 18 giugno 2015).
1. I topi Gavaging con 19 F-Labeled acidi biliari
- Topi sonda gastrica con / kg di peso corporeo di 19 acidi biliari F-etichettati 150 mg. Riempire una siringa da 1 ml per il volume necessario con 19 F-marcato soluzione di acido biliare magazzino [colico acido-trifluoro-acetil lisina (CA-Lys-TFA; in 1: 1 polietilene glicole 400: fosfato di Dulbecco soluzione salina tamponata) o cholylsarcosine- trifluoro-N-metil-acetammide (CA-sar-TFMA; nel 60% glicole polietilenico 400 e il 40% di Dulbecco tampone fosfato] e allegare un calibro 20 da 1,5 pollici curvo ago sonda gastrica gastrica lampadina a punta assicurarsi che l'ago sonda gastrica. è sufficiente per raggiungere il livello della cartilagine xifoidea del mouse quando inserito nell'esofago fino al mozzo dell'ago
- saldamente graspa l'animale dalla pelle allentata sul retro del collo tra il pollice e l'indice e utilizzare le altre dita per afferrare la pelle sulla parte inferiore della schiena e la coda.
- Tenere il mouse verticale e passare l'ago sonda gastrica lungo il lato e il tetto della bocca nell'esofago e giù nello stomaco. Se si incontra resistenza alla faringe, riposizionare l'ago fino a quando l'animale 'inghiotte' che - non spingere contro la resistenza.
- Se è necessaria l'anestesia per gavage, posizionare il mouse in una campana di vetro contenente 5 ml di isoflurano e vicino. Quando il mouse cade su un fianco, attendere 7 secondi, togliere il mouse ed eseguire sonda gastrica. Per proteggere il personale da vapori anestetici, utilizzare la campana di vetro solo in una cappa aspirante.
- Osservare l'animale recuperare da isoflurano in pochi minuti.
NOTA: Dal momento che isoflurano viene metabolizzato dal fegato, un segnale di fluoro proveniente da droga intatte o dei suoi metaboliti escreti nel sistema biliare e della colecisti può confondere fluorine segnali da 19 acidi biliari F-etichettati 15. Un'alternativa è quella di utilizzare la ketamina più xylazina (vedi sezione 3.1 per le dosi).
2. La raccolta della cistifellea, il fegato e il Sangue di acido biliare misurazioni utilizzando cromatografia liquida / spettrometria di massa
- Per ottenere il riempimento della colecisti massima, topi veloce per almeno 6 ore prima della raccolta degli organi. Preparare ketamina e xilazina in PBS (100 ml di ketamina, 62,5 xilazina ml, 840 ml di PBS).
- Usando una siringa sterile da 1 ml, iniettare un topo per via sottocutanea 1 ora prima della raccolta organo con 15 microlitri / g di peso corporeo di soluzione di ketamina / xilazina (150 mg ketamina e 18 mg xilazina per kg di peso corporeo).
- Un ora dopo la somministrazione di ketamina / xylazina confermare un'adeguata anestesia pizzico punta e posizionare il supina anestetizzato mouse.
- Utilizzare 5 o 6 pollici forbici per fare una linea mediana incisione cutanea addominale dal pube al xifoidea e fiforbici ne (4 pollici) per tagliare il rivestimento peritoneale ed espongono organi addominali - non di non perforare il diaframma.
- Afferrare il processo xifoideo con un morsetto da 5 pollici e sollevare di nuovo sul petto per esporre la cavità addominale superiore. Utilizzare pinze e un corpo contundente di sezionare e spostare il fegato da parte, esponendo la cistifellea.
NOTA: non lacerare il fegato o toccare la cistifellea come l'ex provoca gravi emorragie e quest'ultimo può stimolare la contrazione della colecisti e lo svuotamento. - Posizionare un morsetto da 4 pollici attraverso il dotto biliare comune (Figura 3, frecce tratteggiate). Tagliare il legamento fissaggio del polo superiore della cistifellea al diaframma e spostare delicatamente la cistifellea al lato destro dell'addome.
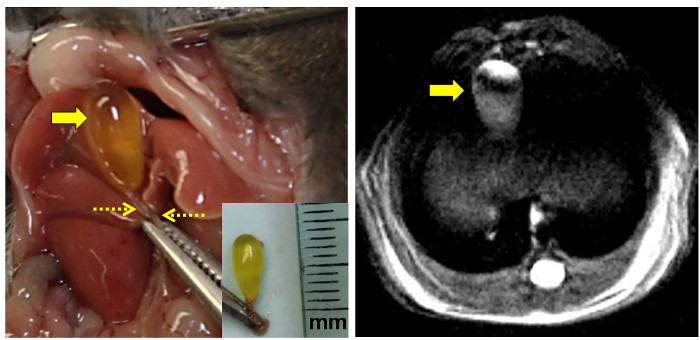
Figura 3: anatomica e Proton risonanza magnetica Vista della colecisti Mouse.
Il pannello di sinistra mostra il MoU espostoe cistifellea a fianco di linea mediana dopo incisione addominale. La pinza afferra il processo xifoideo. La cistifellea digiuno bile-riempita è indicata dalla freccia grande e il condotto biliare comune serrato dalle frecce tratteggiate. [Nel riquadro: asportata la cistifellea intatto con il dotto biliare comune bloccato. Il righello è segnato in millimetri (mm).] Il pannello di destra mostra un'immagine MRI ad alta risoluzione protonica densità ponderata della cistifellea murino digiuno (freccia). Clicca qui per vedere una versione più grande di questa figura.
- Prima di asportare la colecisti eseguire puntura cardiaca, il sangue raccolto, e Exsanguinate l'animale per verificare l'eutanasia.
NOTA: La raccolta della cistifellea prima può lacerare il fegato causando il collasso cardiovascolare e il fallimento per ottenere un campione di sangue sufficiente (≥ 200 ml). - Esporre la parte inferiore del diaframma e sinistroindividuare la superficie battito del cuore. Al punto di pulsazione cardiaca massima forare la membrana e il cuore con un ago da 23 attaccato ad una siringa da 1 ml.
- Lentamente ritirare la siringa mentre aspirazione. Quando il sangue comincia a riempire la siringa, fermare il ritiro e la manutenzione di aspirazione per raccogliere 0,2-0,6 ml di sangue. ruotando leggermente l'ago o la revoca leggermente possono ristabilire il flusso se cessa.
- Trasferire il sangue in una provetta eparinizzata 1,5 ml e centrifugare a 2000 xg per 15 min. Precipitare il plasma con quattro parti acetonitrile e centrifugare a 12.000 xg per 10 min. Analizzare il surnatante mediante spettroscopia cromatografia liquida / massa (LC / MS / MS) 11-1312-1412-1412-1412-14. Se necessario, memorizzare il plasma a -80 ° C prima dell'analisi.
- Utilizzando smussa, liberare la cistifellea dal fegato. Transetto il dotto biliare comune sotto la pinza, rimuovere e pesare la cistifellea, e metterlo in un microcen 1,5 mltubo trifuge. Raccolto il fegato.
- Omogeneizzare circa 100 mg del fegato e della colecisti intera su ghiaccio in una size-21 omogeneizzatore tessuto di vetro. Estrarre con 75% acetonitrile e 25% di acqua (800 ml per il fegato, 300 microlitri per colecisti) e centrifugare a 12.000 xg per 10 min. Diluire estratti come necessario e quantificare il contenuto degli acidi biliari con LC / MS / MS 11-13.
3. animale vivo protone (1H) e fluoro (19 F) Risonanza Magnetica
- Per ottenere il riempimento della colecisti massima, topi veloce per almeno 6 ore prima di imaging. Utilizzando ketamina e xilazina, anestetizzare topi per impedire il movimento nello scanner MRI. Preparare una soluzione stock di ketamina più xylazina nel tampone fosfato (130 ml di ketamina, 42,5 ml xilazina, 827 ml di PBS). Uno hr prima MRI, utilizzare una siringa sterile da 1 ml per iniettare un sottocutanea mouse con 5 ml / g di peso corporeo di questa soluzione (65 mg ketamina e 4,25 mg xylazine per kg di peso corporeo). Per prevenire la secchezza in anestesia applicano unguento veterinario per gli occhi dell'animale.
- Dopo l'induzione con ketamina / xylazina come sopra, ritagliare un'area di circa 1,5 cm 2 a sinistra metà inferiore del mouse dell'addome utilizzando # 40 o più sottili lame del tagliacapelli elettrico. Dopo la rimozione di pelliccia, preparare l'area con 8-12% soluzione di lavaggio chirurgico di iodio diluita e risciacquare con il 70% di alcol - ripetere entrambe le fasi. Inserire una 24-gauge da 0,75 pollici ago / catetere per via sottocutanea e tunnel nella cavità addominale. Assicurarsi che il catetere non è nel cieco o altro organo addominali tirando indietro lo stantuffo - non dovrebbero esserci sangue o materiale fecale nel catetere.
- Rimuovere l'ago e lasciare il catetere intraperitoneale. Posizionare il mouse su un pad termico a temperatura controllata nella camera di scanner MRI animale.
- Preparare una siringa da 1 ml sterile contenente ketamina e xilazina in tampone fosfato (1.000 ml di ketamina, 300 ml xilazina, 6.700 ml PBS) e riempire la lunghezza desiderata di 72 pollici tubo sterile. Collegare il catetere intraperitoneale al tubo sterile preriempita e si estendono lontano dallo scanner MRI. Per mantenere l'anestesia iniettare 50 ml di questa soluzione ogni 20 minuti se i segni vitali del mouse sono stabili.
NOTA: prima di imaging, accertarsi non metalli sono in prossimità dello scanner MRI. - Utilizzare una bobina MRI volume lineare dual-tuned 19 F / 1 H per trasmettere e ricevere segnali a radiofrequenza a 300,283 MHz per 1 H e 282,524 MHz per 19 nuclei F.
- Eseguire la calibrazione del sistema 11, 13 e localizzazione degli animali con tre fetta (assiale, sagittale, coronale e) le immagini scout utilizzando una sequenza girata veloce a basso angolo (FLASH). Per iniziare l'esperimento, fare clic sul pulsante 'semaforo' nella finestra Scan Control sulla console software.
- Acquisire multistrato 1 immagini H MR utilizzando acquisizione rapida con il relax miglioraremento (RARE) Sequenza nella vista trasversale del campione o il corpo dell'animale con tempo di ripetizione 2200 msec, tempo di eco 8.9 msec, fattore RARE 8, campo di vista 4 x 4 cm 2, fetta di spessore 1.0 millimetri, dimensione della matrice 266 x 266, in-plane risoluzione 150 x 150 micron 2, e il numero di medie 6. Per avviare l'esperimento, fare clic sul pulsante 'semaforo' nella finestra Scan Control sulla console software.
- Acquisire 19 immagini F utilizzando una sequenza FLASH nella stessa regione del 1 H RMN con tempo di ripetizione 220 ms, angolo di capovolgere = 30 °, tempo di eco 3.078 ms, dimensione della matrice 32 x 32, in-plane risoluzione 1,25 x 1,25 mm 2, fetta di spessore 4,0 millimetri, e il numero di medie 768. Per avviare l'esperimento, fare clic sul (O n- P ipeline G o-) pulsante nella finestra Spectrometer Control Tool sulla console software 'GOP'.
- Dopo la risonanza magnetica, eutanasia il mouse con iniez intraperitonealesu 15 microlitri / g di peso corporeo di ketamina / xilazina soluzione (150 mg ketamina / xilazina 18 mg per kg di peso corporeo) seguita da puntura cardiaca per dissanguamento.
- Per recuperare un mouse dall'anestesia, rimuovere il catetere intraperitoneale ma non lasciare l'animale incustodito fino a quando non riprende conoscenza sufficiente per mantenere decubito sternale.
- Per misurare le concentrazioni di acidi biliari 19 F-etichettati 11-13 dalla vendemmia organo, mantenere l'anestesia con ketamina più xylazina come descritto sopra.
Risultati
L'uso di MFBA per la risonanza magnetica in vivo a 'vedere' il trasporto degli acidi biliari in tempo reale ha un grande potenziale sia per la ricerca e l'uso clinico. Inoltre, i metodi qui descritti per la resezione della colecisti e analisi biochimica del suo contenuto mediante cromatografia liquida e spettrometria di massa forniscono un mezzo per confermare risultati di imaging. Tuttavia, la validità di questi metodi richiede un dosaggio preciso, i tempi di a...
Discussione
La sintesi di CA-Lys-TFA e CA-sar-TFMA e l'analisi in vitro delle loro trasporto che utilizza cellule di rene canino Madin-Darby stabilmente transfettate che esprimono ASBT e cellule renali di embrioni umani che esprime il polipeptide sodio / taurocolato co-trasporto (NTCP) sono dettagliati altrove 13,14. Qui, l'attenzione è rivolta la somministrazione orale di MFBA mediante sonda gastrica agli animali vivi, seguita dalla raccolta della cistifellea, fegato e sangue per l'analisi del cont...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health, National Institute of Diabetes e Digestiva e malattie renali (numeri di sovvenzione R21 DK093406 e T32 DK067872 a JP.R.) e un premio di merito VA (concessione numero 1BX002129 a JP.R.).
Materiali
| Name | Company | Catalog Number | Comments |
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 x 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25 mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg/ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Riferimenti
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon