Method Article
בידול העצבי המהיר של גזע תאים המושרה pluripotent למדידת פעילות רשת על מערכי מייקרו-אלקטרודה
* These authors contributed equally
In This Article
Summary
אנו לשנות וליישם פרוטוקול שפורסם בעבר המתאר את הבידול מהירה, לשחזור, ויעיל של תאי גזע מושרים אנושיים (hiPSCs) לתוך נוירונים בקליפת המוח מעוררים 12. באופן ספציפי, השינוי שלנו מאפשר שליטה של צפיפות תאים עצבית ושימוש על מערכים מיקרו-אלקטרודות למדוד תכונות אלקטרו ברמת הרשת.
Abstract
נוירונים שמקורם בתאי גזע מושרים אנושיים (hiPSCs) לספק כלי חדש ומבטיח ללימוד הפרעות נוירולוגיות. בעשור האחרון, פרוטוקולים רבים להבחנה hiPSCs לתוך הנוירונים פותחו. עם זאת, הפרוטוקולים הללו הם לעתים קרובות איטיים עם שונות גבוהות, שחזור נמוך, יעילות נמוכה. בנוסף, הנוירונים שהושגו עם פרוטוקולים אלה הם בדרך כלל לא בשלה וחסרי פעילות תפקודית נאותה היא ברמות התא בודד ורשת אלא אם הנוירונים הם מתורבתים במשך כמה חודשים. חלקי בשל המגבלות הללו, תכונות הפעילות של רשתות נוירונים נגזרות hiPSC עדיין לא היטב מאופיינות. כאן, אנו להתאים פרוטוקול שפורסם לאחרונה המתאר ייצור של נוירונים אדם מן hiPSCs ידי ביטוי הכפוי של גורם שעתוק neurogenin-2 12. פרוטוקול זה הוא מהיר (מניב נוירונים בוגרים תוך 3 שבועות) ויעיל, עם יעילות ההמרה כמעט 100% של אנקודריםתאי ed (> 95% של תאי DAPI חיובי הם MAP2 חיובי). יתר על כן, פרוטוקול מניב אוכלוסייה הומוגנית של נוירונים מעוררים שתאפשר חקירת תרומות ספציפיות תא מסוג להפרעות נוירולוגיות. שינה הפרוטוקול המקורי על ידי יצירת תאי hiPSC transduced ביציבות, נותנת לנו שליטה מפורשת על המספר הכולל של נוירונים. תאים אלה משמשים לאחר מכן ליצור רשתות נוירונים נגזרות hiPSC על מערכי אלקטרודה מיקרו. בדרך זו, פעילות אלקטרו הספונטנית של רשתות נוירונים נגזרות hiPSC ניתן למדוד ומאופיין, תוך שמירה על עקביות interexperimental מבחינת צפיפות תאים. הפרוטוקול המובא הוא החלים רחב, במיוחד עבור מחקרים מכניסטית תרופתיים על רשתות נוירונים אדם.
Introduction
התפתחות תאי גזע מושרים אנושיים (hiPSCs) פרוטוקולי בידול לייצר נוירונים אדם במבחנה ספק כלי חדש רב עצמה לחקר הפרעות נוירולוגיות. עד לאחרונה, המחקר של הפרעות אלה הכביד קשות על ידי היעדר מערכות מודל באמצעות נוירונים אדם. למרות שניתן להשתמש בהם מכרסמים ללמוד הפרעות נוירולוגיות, התוצאות של מחקרים כאלה לא יכול להיות מתורגם בקלות לבני אדם 1. ההגבלות שניתנו, נוירונים הנגזרות hiPSC הם מודל חלופה מבטיחה שניתן להשתמש בהם כדי להבהיר את המנגנונים המולקולריים שבבסיס הפרעות נוירולוגיות ו להקרנה סמים חוץ גופית.
בעשור האחרון, מספר פרוטוקולים להמיר hiPSCs לתוך הנוירונים פותח 2-8. עם זאת, הפרוטוקולים הללו עדיין מוגבלים במובנים רבים. ראשית, הפרוטוקולים הם בדרך כלל זמן רב: נוירונים שהניבו עם התבגרות נאותה (כלומר synapse היווצרות) ופעילות פונקציונלית דורשות חודשים של נהלי culturing, אשר הופכים מחקרים בקנה מידה גדולה 9 קשים. בנוסף, hiPSC אל נוירון יעיל המרה הוא נמוך. פרוטוקולים לעתים קרובות להניב אוכלוסייה הטרוגנית של נוירונים, ובכך לא לאפשר מחקרים של תת-מערכות ספציפיות של תאים עצביים. יתר על כן, הפרוטוקולים אינם לשחזור, מניב תוצאות שונות עבור קווי iPSC שונים 10,11. לבסוף, בשלב התבגרות תכונות פעילות של נוירונים וכתוצאה מכך הם גם משתנים 10.
כדי לטפל בבעיות אלה, ואח ג'אנג. (2013) 12 פיתח פרוטוקול במהירות reproducibly מייצר נוירונים האדם מן hiPSCs ידי overexpressing גורם שעתוק neurogenin-2. כפי שדווח על ידי המחברים, בידול מתרחש במהירות יחסית (רק 2 - 3 שבועות לאחר גרימת ביטוי של neurogenin-2), הפרוטוקול ניתן לשחזור (נכסים נוירונים הם עצמאיים של היםtarting קו hiPSC), ואת המרת hiPSC אל נוירון היא יעילה ביותר (כמעט 100%). אוכלוסיית נוירונים שנוצרו עם הפרוטוקול שלהם הומוגנית (דומת נוירונים עליונה שכבת קליפת המוח), המאפשרת החקירה של תרומות ספציפיות תא מסוג להפרעות עצביות. יתר על כן, הנוירונים hiPSC הנגזרות שלהם הציגו תכונות בוגרות (למשל, את היכולת ליצור סינפסות ופעילות פונקציונלית חזקה) רק לאחר 20 ד.
אפיון תכונות אלקטרו של נוירונים הנגזרות hiPSC ברמת הרשת היא תנאי חשוב לפני הטכנולוגיה hiPSC ניתן לנצל לחקר מחלות אנושיות. מסיבה זו, קבוצות מחקר רבות החלו לאחרונה לחקור נוירונים הנגזרים בתאי גזע ברמת הרשת באמצעות מערך מיקרו-אלקטרודות (MEA) מכשירים (מערכות רבות ערוציות, Reutlingen, גרמניה) 13-16. האלקטרודות של MEA מוטבעי מצע שעליו תאים עצביים יכולים להיות מתורבתים.MEAs יכול לשמש כדי לחקור את תכונות אלקטרו של רשתות נוירונים והתפתחות חוץ גופית של פעילותם. נכון לעכשיו, MEAs משמש רק בשילוב עם פרוטוקולי בידול כי לקחת כמה חודשים כדי להניב רשתות בוגרות. לפיכך, שילוב MEAs עם פרוטוקול התמיינות מהיר אמורה להקל על השימוש בטכנולוגיה זו במחקרים רחב היקף של הפרעות נוירולוגיות.
כאן, אנו מציגים שינוי ואח 'ג'אנג. (2013) פרוטוקול 12 ולהתאימה לשימוש על MEAs. בפרט, ולא להסתמך על התמרה lentiviral חריפה, במקום יצרנו קווי hiPSC להביע ביציבות rtTA / Ngn2 לפני גרימת בידול. עשינו את זה בעיקר כדי לקבל שליטה לשחזור על צפיפות תאים העצבית, מאז צפיפות התאים העצבית היא קריטית ליצירת רשת עצבית, ועל קשר טוב בין הנוירונים ואת אלקטרודות של MEA 17,18. Althougח ואח 'ג'אנג. פרוטוקול יעיל מאוד ביחס המרה של hiPSCs transduced, זה משתנה באופן אינהרנטי ביחס לתשואה הסופי של נוירונים ממספר hiPSCs מצופה בתחילה (ראה איור 2E ב ג'אנג et al.) 12. עם קו יציב, אנו למנוע בעיות רבות גורם השתנות, כגון רעילות lentiviral ויעילות זיהום. לאחר מכן, אנו אופטימיזציה הפרמטרים באופן מהימן לייצר רשתות נוירונים הנגזרות hiPSC על MEAs, קבלת התבגרות רשת (למשל, אירועים סינכרוני מעורבים ברוב הערוצים) על ידי בשבוע השלישי. פרוטוקול מהיר ואמין זה אמור לאפשר השוואה ישירה בין הנוירונים נגזרו קווי hiPSC (מטופל ספציפי כלומר) שונים, כמו גם לספק עקביות חזקות ללימודים תרופתיים.
Protocol
כל הניסויים בבעלי חיים בוצעו בהתאם להנחיות חיה לטיפול ולשימוש אישרה ועדת טיפול בבעלי חיים, מרכז רפואי אוניברסיטת Radboud, הולנד, (RU-DEC-2011-021, מספר פרוטוקול: 77,073).
בידוד תא גליה 1. והתרבות
הערה: הפרוטוקול המובא כאן מבוסס על העבודה של מקארתי דה Vellis 19, ו פרוטוקול מפורט מאוד דומה האסטרוציטים עכבר זמין 20. כדי ליצור תרבויות עיקריות של האסטרוציטים קליפת מוח מן עובריים במוחות עכברים (E18), חולדה בהריון צריכה להיות מוקרבת, העוברים צריכים להיות שנקטפו מן הרחם, ואת המוח צריך להיות מבודד מן העוברים. כדי למלא בבקבוק T75, הקורטקס מ 2 מוח עוברי צריך להיות משולב. כחלופה, זמינים מסחרית האסטרוציטים מטוהרים וקפואים ניתן לרכוש.
- הכן את בקבוק תרבות T75
- לדלל Poly-D- ליזין (PDL) בultrapure סטרילית, מים לריכוז סופי של 10 מיקרוגרם / מ"ל. הוסף 5 מ"ל של PDL בדילול אל הבקבוק תרבות T75. סוויש סביב בעדינות כדי להרטיב את משטח כל הגידול. מניחים את הבקבוק C חממה humidified 37 מעלות למשך 3 שעות.
- לשאוב PDL מהבקבוק. יש לשטוף את הבקבוק עם 3x 5 מ"ל מים סטריליים כדי להסיר PDL מאוגד. לשאוב את המים לחלוטין. השאירו את הבקבוק להתייבש במנדף זרימה למינרית או להשתמש מיד.
- דיסקציה של הקורטקס
- הכן 50 בינוני לנתיחה מ"ל: בינוני L-15 של ליבוביץ עם 2% (v / v) תוספת B-27. שמור על הקרח.
- להרדים חולדה עמוק עם isoflurane בתא אינדוקציה (קופסת הפרספקס קטן) עד הנשימה נפסקת (~ 5 - 8 דקות). סור עכברוש מאולם האינדוקציה מורדם מייד נקע בצוואר רחם.
- תרסיס הבטן של חולדה עם 70% EtOH וימחה עודף. לחשוף ולהסיר את הרחם מן הסכר באמצעות secti קיסריעל בעזרת זוג מספריים 21.
- חותכים עוברים בודד הצ'קים שלהם השפירים במספריים, מעבירים לצלחת פטרי סטרילית מלאה בינוני לנתיחה קרה, ולשמור על קרח.
- העבר עוברים שוב מנה חדשה, סטרילי 6 ס"מ פטרי מלאות בינוני לנתיחה קר. חלץ את המוח מן העוברים תחת מיקרוסקופ סטריאו. כדי לחשוף את המוח, בעדינות לקלף את עור הגולגולת באמצעות מלקחיים. בעדינות לגרוף את כל המוח ולהעביר לצלחת פטרי 35 מ"מ עם מדיום לנתיחה טרי וקר.
הערה: מוח פריטים הגזורים מעוברים ניתן לאחסן במדיום לנתיחה על קרח למשך שעות רבות מבלי לאבד כדאיות הסלולר. - הפרד את שתי ההמיספרות של המוח כל על ידי חיתוך דרך קו האמצע עם מספריים באביב שקצהו קנס או אזמל. בזהירות להפשיט את קרומי המוח עם מלקחיים ישר שקצהו בסדר.
הערה: חשוב מאוד להסיר את קרומי המוח לגמרי. thהוא זיהום פיברובלסטים מונע התרבות astrocyte. פיברובלסטים הם חלוקת תאים במהירות ובסופו של דבר יתפוס את מקומו של התאים האחרים. - הסר את המוח התיכון / בסטריאטום ואת פקעת ההרחה במספריים באביב או אזמל. כמו כן יש לוודא להסיר את ההיפוקמפוס (C בצורת מבנה זה perimedian ואת הזנב ביחס הקורטקס) עם מספריים באביב או אזמל. אסוף ההמיספרות בקליפת המוח צינור צנטריפוגות 15 מ"ל מלאים 5 בינוני לנתיחה מ"ל. שמור על הקרח.
- דיסוציאציה של קליפת המוח
- הכן 2 מ"ל Ca 2 + / Mg 2 + ללא תמיסת מלח מאוזן של האנק (HBSS) עם 0.25% טריפסין (בינוני דיסוציאציה). כן 50 מיליליטר גבוה גלוקוז בינוני של הנשר השונה של Dulbecco (DMEM) עם 15% (V / V) בסרום שור עוברי (FBS) ו -1% (v / v) פניצילין / סטרפטומיצין (מדיום תרבות) ולסנן לעקר.
- תנו רקמות ליישב לתחתית של התחתית צנטריפוגות. בזהירות כפיפירט כמה שיותר המדיום לנתיחה ככל האפשר מלמעלה הרקמה. שטפו את רקמת עם 5 מ"ל Ca 2 + / Mg 2 + ללא HBSS (ללא טריפסין) ולאפשר רקמות להתיישב בחלק התחתון של הצינור.
- בזהירות לשאוב את HBSS. הוסף בינוני דיסוציאציה מ"ל 2 קפיצי הצינור בעדינות לתערובת האנזים סביב הרקמה. דגירה באמבט מים 37 מעלות צלזיוס למשך 5-10 דקות. פליק הצינור כמה פעמים במהלך הדגירה כדי להתסיס את הרקמה.
- מיד triturate רקמת באמצעות קצה פיפטה 1,000 μL. הגדרת עוצמת pipetter לכ -800 μL. לשאוב את השברים להוציא בכוח על הצד של הצינור, ישירות מעל הקו הנוזל. עם זאת, מנסה למזער בועות או קצף. חזור על הפעולה עד הרקמה ניתק מספיק, כ -15 - 20x. הוסף 8 בינוני תרבות מ"ל כדי להשבית טריפסין. לערבב בעדינות על ידי היפוך הצינור מספר פעמים.
- לעבור את ההשעיה התא דרך מסננת תא 70 מיקרומטר להציב על גבי 50 מטרצינור צנטריפוגות L. יש לשטוף את הצינור 15 מ"ל עם המדיום תרבות ולסנן המדיום דרך מסננת תא לאסוף המדיום בצינור 50 מ"ל עם ההשעיה התא. יש לשטוף את מסננת התא כמה פעמים עם המדיום לתרבות. לאחר השטיפה, נפח הסופי צריך להיות בערך 20 - 25 מ"ל.
- גלולת התאים ב XG 200 במשך 10 דקות. בזהירות לשאוב כמה שיותר בינוני ככל האפשר, בלי לגעת תא גלולה. Resuspend התאים בינוני תרבות 1 מ"ל בעזרת פיפטה μL 1000. הוסף בינוני תרבות מ"ל prewarmed 11 ומערבבים בעדינות (כדי למנוע בועות) בעזרת פיפטה 10 מ"ל.
- יש לשטוף את הבקבוק T75 מצופה PDL פעם עם המדיום תרבות 5 מ"ל. לשאוב את המדיום ולהעביר את ההשעיה תא אל הבקבוק. כל התאים נמצאים ההשעיה הם מצופים, ואנו מוצאים את זה בדרך כלל מיותר לספור אותם, מאז האסטרוציטים לא ניתן להבדיל בין תאי אחרים ההשעיה. מניחים את הבקבוק לתוך C חממה humidified 37 מעלות עם אווירה של f 5% CO 2או יומיים.
- הרחבה ותחזוקה של האסטרוציטים
- החלף את המדיום כולו עבור ד בפעם הראשונה 2 לאחר ציפוי ראשוני. החלף את המדיום כולו לאחר מכן כל 3 ד. תמיד prewarm המדיום טרי עד 37 ° C לפני הוספת לתאים.
הערה: האסטרוציטים דורשים 7 - 10 ד צפויים להגיע ל 90% confluency (האסטרוציטים מופיעים בשכבת פסיפס צפופה, עם המיקרוגליה oligodendrocytes שוכבים על גבי ומעורבבים). - כאשר האסטרוציטים להגיע לכ 90% confluency, לנער את הבקבוק כדי להסיר את תאי גליה המזהמים:
- הסר את הבקבוק מן החממה להדק את המכסה (פנוליות) או לכסות את הנמל (מסונן). כדי להסיר microglia, לנער את הבקבוק על פלטפורמת מסלולית ב 180 סל"ד במשך 1 שעה. לשאוב את המדיום. יש לשטוף מיד עם 5 מ"ל מחומם מראש בינוני תרבות, לשאוב ולהחליף עם 12 בינוני תרבות מ"ל.
- כדי להסירoligodendrocytes, להחזיר את הבקבוק אל הרציף מסלולית ולנער ב 250 סל"ד, 37 ° C למשך תקופה מינימלית של 7 שעות, אך רצוי O / N.
- לשאוב את המדיום. יש לשטוף מיד עם 5 מ"ל מחומם מראש בינוני תרבות, לשאוב ולהחליף עם 12 בינוני תרבות מ"ל. מחזירים את הבקבוק אל האינקובטור.
- כאשר 100% ומחוברות, לפצל את האסטרוציטים באמצעות נהלים סטנדרטיים לפי יחס של 1: 3 ל -1: 2 עם 0.05% טריפסין-ethylenediaminetetraacetic חומצה (EDTA). בבקבוק T75 ב -100% confluency בדרך כלל יניב כ 4.0 x 10 6 תאים בסך הכל. תחת לוח זמנים זה, התרבויות ניתן לבצע בדרך כלל לפצל פעם בשבוע.
הערה: כאשר האסטרוציטים להגיע confluency, הם יכולים להיות שנקטפו ומשומשים לבידול hiPSC כמתואר להלן בשלב פרוטוקול 3.4. האסטרוציטים ניתן לפצל לפחות פעם אחת ללא הפסד ניכר של כדאיות. הם יכולים להישמר עד 2 חודשים בתרבות. מניסיון, האסטרוציטים עוברי חולדה יום העיקרי 18 progressively להיות מובחנים סופני ו / או לאבד את יכולת הקיום לאחר פיצול חזר. למרות שזה אפשרי להקפיא את האסטרוציטים לשימוש עתידי, אנחנו מעדיפים לבודד את האסטרוציטים מן המוח העוברי טריים בעת הצורך.
- החלף את המדיום כולו עבור ד בפעם הראשונה 2 לאחר ציפוי ראשוני. החלף את המדיום כולו לאחר מכן כל 3 ד. תמיד prewarm המדיום טרי עד 37 ° C לפני הוספת לתאים.
דור 2. rtTA / Ngn2 -positive hiPSCs
הערה: hiPSCs המשמשים בניסויים שלנו נוצרו בתוך הבית על ידי התמרה lentiviral של פיברובלסטים האדם עם תכנות מחדש גורמי cMYC, Sox2, Oct4 ו KLF4.
הערה: עבור הדור של rtTA / Ngn2 -positive hiPSCs, וקטורים lentiviral משמשים לשלב את transgenes ביציבות לתוך הגנום של hiPSCs. הפרוטוקול לייצור של lentivirus שפורסם בעבר 22. הפרטים של וקטורי אריזת lentiviral המשמשים לייצור חלקיקי lentivirus rtTA ו Ngn2 ניתנים לוח של חומרים / ציוד. וקטור ההעברה המשמש lentivirus rtTA הוא pLVX-EF1α- (ט-און-מתקדם) -IRES-G418 (R); כלומר וקטור זה מקודד ט-האון מתקדם transactivator תחת שליטה של מקדם EF1α מכונן מקנה עמידות בפני G418 האנטיביוטי. וקטור ההעברה המשמש lentivirus Ngn2 הוא pLVX- (TRE-thight) - (עכבר) Ngn2-PGK-puromycin (R); כלומר וקטור זה מקודד גן neurogenin-2 murine תחת שליטה של מקדם ט שבשליטת ואת גן התנגדות puromycin תחת השליטה של מקדם PGK מכונן. לפיכך, באמצעות וקטורי העברת שני אלה, קו hiPSC ניתן ליצור עבורו את הביטוי של neurogenin-2 בעכברים יכול להיגרם על ידי השלמה הבינונית עם דוקסיציקלין. עבור התמרה של hiPSCs, supernatant עם חלקיקים lentivirus משמש (המכונה "ההשעיה lentivirus 'ב שאר הטקסט), כלומר שנינותHout ריכוז חלקיקים באמצעות ultracentrifugation.
- פלייט hiPSCs (יום 1)
הערה: כרכים המוזכרים בפרוטוקול זה להניח כי hiPSCs בתרבית צלחת 6 היטב כי התאים של באר אחת נקצרים. בנוסף, ההנחה היא כי התאים מצופה מכן ב -12 בארות צלחת 12 היטב.- הכן 10 מ"ל קר DMEM / F12 עם 1% (v / v) מרתף מטריקס ממברנה (BMM) להשיג מדולל BMM. להוסיף 800 μL בדילול BMM לכל גם צלחת 12 באר. דגירה עבור h 1 לפחות C חממה humidified 37 מעלות עם אווירה של 5% CO 2. לפני השימוש, דגירת הצלחת של 1 ש 'ב RT.
- בינוני חם 15 מ"ל Essential 8 (E8) עם 1% (v / v) פניצילין / סטרפטומיצין, 9 מ"ל DMEM / F12 ו- 1 פתרון ניתוק התא מ"ל (CDS) לטמפרטורת החדר. מוסף המדיום E8 עם קינאז חלבון הקשורים Rho (ROCK) מעכב.
- לשאוב את המדיום בילה של hiPSCsד להוסיף 1 מ"ל CDS אל hiPSCs. דגירה 3 - 5 דקות C חממה humidified 37 מעלות עם אווירה של 5% CO 2. בדוק תחת מיקרוסקופ אם התאים ניתוק זה מזה.
- הוסף 2 מ"ל DMEM / F12 בבאר, להשעות את התאים בעדינות עם טפטפת 1,000 μL ולהעביר את התאים צינור 15 מ"ל. להוסיף 7 מ"ל DMEM / F12 על השעיית התא. ספין התאים ב XG 200 במשך 5 דקות.
- לשאוב supernatant ולהוסיף 2 מ"ל של המדיום E8 מוכן. לקבל השעיה תא שבו hiPSCs הם ניתק (לא יוצרים גושים התא) על ידי הצבת קצה פיפטה 1,000 μL נגד הצד של הצינור 15 מ"ל ו resuspending התאים בעדינות. בדוק תחת מיקרוסקופ אם התאים הם ניתקו.
- לקבוע את מספר תאים (תאים / מ"ל) באמצעות תא hemocytometer.
הערה: צלחת 6 היטב היטב ב 80 - 90% confluency יהיה בדרך כלל תשואה 3.0 - 4.0 x 10 6 תאים בסך הכל. - לשאובבדילול BMM מבאר 12 את הצלחת היטב. לדלל את התאים כדי לקבל השעיה תא של 3.0 x 10 4 תאים / מ"ל. פלייט 1 מ"ל של ההשעיה תא לכל טוב של 12 את הצלחת היטב. מניחים 12 O הצלחת היטב / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- Transduce התאים iPS עם lentivirus rtTA ו Ngn2 (יום 2)
- מ"ל E8 חם 12 בינוני עם 1% (v / v) פניצילין / סטרפטומיצין לטמפרטורת החדר. מוסף המדיום E8 עם ROCK מעכב polybrene לריכוז סופי של 8 מיקרוגרם / מ"ל למדיום E8.
- הפשרת aliquots עם השעית lentivirus. להוסיף polybrene לריכוז סופי של 8 מיקרוגרם / מ"ל ההשעיה lentivirus. לשאוב את המדיום בילה ולהוסיף 1 מ"ל של המדיום E8 מוכן היטב כל אחד.
- בצע התמרה עם כמויות שונות של rtTA - השעיות -lentivirus Ngn2. לדוגמה, transduלספירת hiPSCs על ידי הוספת 100 μL של שני -lentivirus rtTA ו Ngn2 השעית -lentivirus כדי גם אחד מ -12 ההצלחה היטב. עבור בארות אחרים, להשתמש 200 μL, 300 μL, 400 μL ו 500 μL ההשעיה lentivirus במקום 100 μL. HiPSCs של שתי בארות הצלחת 12 גם לא צריך להיות transduced; הם ישמשו כקבוצת ביקורת במהלך הבחירה.
הערה: transductions הם רצוי ביצע בשני עותקים, כך יעילות התמרה ניתן לאמוד באופן מדויק יותר לאחר תחילת הבחירה (ראה שלב פרוטוקול 2.2.4). כמות ההשעיה lentivirus הנדרש ביעילות transduce רוב hiPSCs תלוי כייל של ההשעיה lentivirus וקו hiPSC המשמש. במחקר זה, אנו בדרך כלל משתמשים 100 - 500 μL של ההשעיה lentivirus כדי transduce hiPSCs. - מניחים את צלחת 12 גם C חממה humidified 37 מעלות עם אווירה של 5% CO2 במשך 6 שעות. לפני תום תקופת הדגירה 6 שעות, חם 12 בינוני מ"ל E8 עם 1% (v / v) פניצילין / סטרפטומיצין ו -12 פוספט שנאגרו מלוחים של מ"ל Dulbecco (DPBS) RT. מוסף המדיום E8 עם מעכב ROCK.
- לשאוב את המדיום E8 בילו. לשטוף היטב עם כל 1 מ"ל DPBS. הוסף 1 מ"ל של המדיום מוכן E8 היטב כל אחד. מניחים 12 O הצלחת היטב / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- רענן מדיום E8 (יום 3)
- מ"ל E8 חם 12 בינוני עם 1% (v / v) פניצילין / סטרפטומיצין RT. לשאוב את המדיום בילה מבארות 12 את הצלחת היטב ולהוסיף 1 מ"ל של המדיום E8 מוכן היטב כל אחד. מניחים 12 O הצלחת היטב / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- לבצע בחירה עם puromycin ו G418 (יום 4 - 8)
הערה: בהתאם לשיעור חלוקת התא של הירךקו SC ואת היעילות של תמרת lentiviral, התאים עשויים להגיע ל -70 - 80% confluency בתקופת הבחירה, ובנקודת התרבויות צריכות להיות מפוצלות. בגלל העיתוי של פיצול לא ניתן לחזות מראש, זה לא יהיה המוזכרים בפרוטוקול. עם זאת, במקום לרענן את מדיום E8 השלים עם הריכוזים ציינו של puromycin ו G418, אפשר לפצל את תרבות hiPSC כתרבות hiPSC נורמלית (כולל ציפוי התאים על צלחות מצופות vitronectin). היוצא מן הכלל היחיד הוא כי המדיום E8 יש להשלימם עם ריכוזים ציינו של אנטיביוטיקה כדי להמשיך את הבחירה.- מ"ל E8 חם 12 בינוני עם 1% (v / v) פניצילין / סטרפטומיצין לטמפרטורת החדר. הוספת puromycin ו G418 לבחירה; כמויות שונות של אנטיביוטיקה מתווספים בתקופת הבחירה (טבלה 1).
- להעריך את היעילות של התמרה על ידי אומדן אחוז G418- ו puromycinתאי -resistant. כדי להעריך את אחוז תאים עמידים, להעריך את אחוז התאים המתים (תאים nonresistant) עבור תנאים שונים (התרבויות transduced עם כמויות שונות של ההשעיה lentivirus) ועבור תאים nontransduced (התאים לשמש כביקורת מבחר). חישוב אחוזי התאים עמידים כמו [100% - (אחוז התאים המתים)].
הערה: אם transductions עם הכמויות השונות של השעית lentivirus בוצע בשני עותקים, את יעילות התמרה ניתן לאמוד באופן מדויק יותר. התנאי עם התאים שאינם transduced משמש כביקורת בחירה; האחוזים של תאים מתים על תרבויות transduced עם כמויות שונות של ההשעיה lentivirus צריך להיות נמוך יותר. האחוז המשוער של תאים עמידים משמש לבחור את hiPSCs כי הם חיוביים סביר לשני transgenes. באופן כללי, אנו בוחרים את hiPSCs ממצב התמרה היה> 90% של התאהים לשרוד את תקופת בחירת 5 ד. - לשאוב את המדיום בילה של hiPSCs ולהוסיף 1 מ"ל של המדיום E8 מוכן הבארות. מניחים 12 O הצלחת היטב / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
| ריכוז סופי של G418 | ריכוז סופי של puromycin | |
| יום 4 | 250 מיקרוגרם / מ"ל | 2 מיקרוגרם / מ"ל |
| יום 5 | 250 מיקרוגרם / מ"ל | 2 מיקרוגרם / מ"ל |
| יום 6 | 250 מיקרוגרם / מ"ל | 1 מיקרוגרם / מ"ל |
| יום 7 | 250 מיקרוגרם / מ"ל | 1 מיקרוגרם / מ"ל |
| יום 8 | 250 מיקרוגרם / מ"ל | 1 מיקרוגרם / מ"ל |
טבלה 1: ריכוז של אנטיביוטיקה בתקופת הבחירה. ריכוזים של puromycin ו G418 במהלך 5 ד תקופת הבחירה.
- עצור את הבחירה ולהתחיל culturing רגיל (יום 9 ואילך)
- לאחר תקופת הבחירה 5 ד, בתרבות hiPSCs -positive rtTA / Ngn2 כמו hiPSCs רגיל, למעט העובדה המדיום E8 של התאים הוא השלים עם G418 לריכוז סופי של 50 מיקרוגרם / מ"ל ועם puromycin לריכוז סופי של 0.5 מיקרוגרם / מ"ל.
הערה: התאים אפשר להקפיא עכשיו (על פי פרוטוקולים סטנדרטיים עבור cryopreservation של תאים) כדי לשמש כגיבוי. זהו צעד חשוב עבור השחזור של פרוטוקול הבידול, משום שהיא מאפשרת את השימוש של אצווה הזהה של hiPSCs rtTA / Ngn2 -positive לניסויי בידול עתידיים רבים.
- לאחר תקופת הבחירה 5 ד, בתרבות hiPSCs -positive rtTA / Ngn2 כמו hiPSCs רגיל, למעט העובדה המדיום E8 של התאים הוא השלים עם G418 לריכוז סופי של 50 מיקרוגרם / מ"ל ועם puromycin לריכוז סופי של 0.5 מיקרוגרם / מ"ל.
בידול 3. rtTA / Ngn2 hiPSCs -positive כדי נוירונים ב -6 היטבMEAs וזכוכית Coverslips
הערה: בפרוטוקול זה, את הפרטים ניתנים להבחנה rtTA / Ngn2 hiPSCs -positive על שני מצעים שונים, כלומר 6 באר MEAs (מכשירים מורכב 6 בארות עצמאית עם 9 הקלטה 1 התייחסות microelectrodes מוטבע לכל טוב) וזכוכית coverslips ב הבארות של צלחת 24 גם. הפרוטוקולים, עם זאת, ניתן להתאים בקלות על מצעים גדולים (למשל, עבור הבארות של 12 או 6 צלחות גם), על ידי דרוג את הערכים שהוזכרו על פי שטח הפנים.
- הכן את MEAs או coverslips זכוכית (יום 0 ויום 1)
- היום לפני תחילת הבידול, לעקר את MEAs פי המלצת היצרן.
- לדלל את החלבון הדבק פולי-L-ornithine (אש"ף) במי ultrapure סטרילית לריכוז סופי 50 מיקרוגרם / מיליליטר. מעיל באזור האלקטרודה פעילה של MEAs 6-היטב על ידי הצבת 100 μLטיפה של אש"ף המדולל היטב כל אחד. מניחים את coverslips בבארות של צלחת 24 גם באמצעות פינצטה סטרילית. להוסיף 800 μL של אש"ף המדולל היטב כל אחד. למנוע את coverslips לצוף על ידי דחיפה אותם עם קצה פיפטה 1000 μL.
- דגירה MEAs 6-היטב O צלחת 24 גם / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2. למחרת, לשאוב את אש"ף המדולל. שטוף את משטחי הזכוכית של MEAs 6-היטב את coverslips פעמים עם מי ultrapure סטרילית.
- לדלל laminin ב DMEM / F12 קר לריכוז סופי של 20 מיקרוגרם / מ"ל (עבור MEAs 6 גם) ו -10 מיקרוגרם / מ"ל (עבור coverslips זכוכית). מיד המעיל באזור האלקטרודה הפעיל של MEAs 6-היטב על ידי הצבת ירידה 100 μL בכל טוב. באופן דומה, להוסיף 400 μL של laminin מדולל היטב בכל צלחת 24 היטב כדי לצפות את coverslips. למנוע את coverslips לצוף על ידי דחיפה אותם עם קצה פיפטה 1,000 μL.
- דגירה את הצלחת MEAs 6 באר ו -24 גם C חממה humidified 37 מעלות עם אווירה של 5% CO 2 עבור h 2 לפחות.
- פלייט hiPSCs (יום 1)
הערה: כרכים המוזכרות צעדים 3.2.1 - 3.2.4 להניח כי rtTA / Ngn2 hiPSCs -positive בתרבית צלחת 6-היטב כי התאים של באר אחת נקצרים. הכרכים הנדרשים ציפוי התאים על MEAs 6 באר ו / או coverslips תלוי במספר של 6 באר MEAs ו / או מספר coverslips המשמשים בניסוי; המספרים המפורטים צעדים 3.2.6 - 3.2.8 לאפשר דרוג לגדלים שונים של ניסויים.- DMEM / F12 חם, CDS ובינוניים E8 עם 1% (v / v) פניצילין / סטרפטומיצין R / T. להוסיף דוקסיציקלין לריכוז סופי של 4 מיקרוגרם / מ"ל ו ROCK מעכב למדיום E8.
- לשאוב את המדיום בילה של hiPSCs -positive rtTA / Ngn2 ולהוסיף 1 מ 'CDS L אל hiPSCs. דגירה 3 - 5 דקות C חממה humidified 37 מעלות עם אווירה של 5% CO 2. בדוק תחת מיקרוסקופ אם התאים ניתוק זה מזה.
- הוסף 2 מ"ל DMEM / F12 בבאר, להשעות את התאים בעדינות עם טפטפת 1,000 μL ולהעביר את התאים צינור 15 מ"ל. להוסיף 7 מ"ל DMEM / F12 על השעיית התא. ספין התאים ב XG 200 במשך 5 דקות.
- לשאוב supernatant ולהוסיף 2 מ"ל של המדיום E8 מוכן. לנתק את hiPSCs ידי הצבת קצה פיפטה 1,000 μL על הצד של 15 הצינור מ"ל ו resuspending התאים בעדינות. בדוק תחת מיקרוסקופ אם התאים הם ניתקו.
- לקבוע את מספר תאים (תאים / מ"ל) באמצעות תא hemocytometer.
הערה: צלחת 6 באר היטב ב 80 - 90% confluency יהיה בדרך כלל תשואה 3.0 - 4.0 x 10 6 תאים בסך הכל. - לשאוב את laminin המדולל. עבור MEAs 6-היטב, לדלל את התאים כדי לקבל לסה"נll ההשעיה של 7.5 x 10 5 תאים / מ"ל. פלייט התאים על ידי הוספת ירידה של 100 μL של השעית התא על אזור אלקטרודה הפעיל בכל טוב של MEAs 6 באר. עבור coverslips, לדלל את התאים כדי לקבל השעיה תא של 4.0 x 10 4 תאים / מ"ל. פלייט התאים על ידי הוספת 500 μL של ההשעיה תא אל בארות הצלחת 24 גם.
הערה: צפיפות התא הסופית על MEAs היא גבוהה יותר מאשר על coverslips (איור 1 א 'וב'). מצאנו כי צפיפות תא גבוהה זו נדרשה להקלטה תקינה של פעילות הרשת. בפרוטוקול, המספרים ניתנים שהתבררו להיות אופטימלי עבור המבחנים. - מניחים את MEAs 6-היטב 24 צלחת יפה C חממה humidified 37 מעלות עם אווירה של 5% CO 2 על 2 h (MEAs) או O / N (צלחת יפה 24).
- לאחר 2 שעות, להוסיף בזהירות 500 μL של המדיום מוכן E8 היטב כל של MEAs 6 באר. מניחים את 6-אנחנוll MEAs O / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- שינוי המדיום (יום 2)
- למחרת, להכין DMEM / F12 עם 1% (v / v) תוספת N-2, 1% (v / v) שאינם חיוניים חומצות אמינו 1% (v / v) פניצילין / סטרפטומיצין. הוסף רקומביננטי אנושי neurotrophin-3 (NT-3) לריכוז סופי של 10 ng / mL, גורם נוירוטרופי שמופק מהמוח רקומביננטי אנושי (BDNF) לריכוז סופי של 10 ng / mL, ו דוקסיציקלין לריכוז סופי של 4 מיקרוגרם / מ"ל. מומלץ לחמם את הבינוני עד 37 ° C.
- להוסיף laminin לריכוז סופי של 0.2 מיקרוגרם / מ"ל למדיום. מסנן המדיום שהתקבל. לשאוב את המדיום בילה מבארות של MEAs 6-היטב את הצלחת 24 גם ולהחליפה המדיום מוכן. דגירה MEAs 6-היטב O צלחת 24 גם / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- להוסיף האסטרוציטים חולדה (יום 3)
הערה: כרכים המוזכרים בפרוטוקול זה להניח כי האסטרוציטים עכברוש מתורבתים צלוחיות תרבות T75. זה קריטי, כי האסטרוציטים העכברוש שנוספים התרבויות הם באיכות טובה. אנו משתמשים בשני קריטריונים כדי לבדוק אם האסטרוציטים העכברוש הם באיכות טובה. ראשית, תרבות astrocyte העכברוש אמורה להיות מסוגל לגדול ומחוברות בתוך עשרה ימים לאחר במנותק מן המוח העוברי החולדה. שנית, לאחר פיצול תרבות astrocyte חולדה, האסטרוציטים העכברוש אמורים להיות מסוגלים ליצור monolayer ומחוברת, פסיפס (איור 1 ג). אם תרבות העכברוש astrocyte אינה ממלאת שני קריטריונים אלה, אנו ממליצים לא להשתמש תרבות זו לניסויי בידול.- 0.05% טריפסין-EDTA חם RT. מומלץ לחמם את F12 DPBS ו DMEM / עם 1% (v / v) פניצילין / סטרפטומיצין ל -37 מעלות צלזיוס.
- לשאוב את המדיום בילה של התרבות astrocyte חולדה. שטפו את התרבות על ידי הוספת 5 מ"ל DPBS ו סוויש אותו סביב בעדינות.
- Aspirאכל את DPBS ולהוסיף טריפסין-EDTA מ"ל 0.05% 5. סוויש את EDTA טריפסין סביב בעדינות. דגירת C חממת humidified 37 מעלות עם אווירה של 5% CO 2 למשך 5 - 10 דקות.
- בדוק תחת מיקרוסקופ אם התאים מנותקים. לנתק את התא האחרון על ידי להכות את הבקבוק כמה פעמים.
- הוסף 5 מ"ל של DMEM / F12 אל הבקבוק. Triturate התאים בעדינות בתוך הבקבוק עם טפטפת 10 מ"ל. אסוף את ההשעיה תא צינור 15 מ"ל. לסובב את הצינור ב XG 200 עבור 8 דקות.
- לשאוב supernatant ו resuspend התאים 1 מ"ל של DMEM / F12. לקבוע את מספר תאים (תאים / מ"ל) באמצעות תא hemocytometer.
- להוסיף 7.5 x 10 4 האסטרוציטים לכל טוב של MEAs 6 באר. להוסיף 2.0 x 10 4 האסטרוציטים לכל טוב של צלחת 24 גם. דגירה MEAs ואת O צלחת 24 גם / N C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- שינוי המדיום (יום 4)
- הכן בינוני neurobasal עם 2% (v / v) B-27 תוספת, 1% (v / v) L-alanyl-L- גלוטמין ו -1% (v / v) פניצילין / סטרפטומיצין. להוסיף NT-3 לריכוז סופי של 10 ng / mL, BDNF לריכוז סופי של 10 ng / mL, ו דוקסיציקלין לריכוז סופי של 4 מיקרוגרם / מ"ל. בנוסף, להוסיף ציטוזין β-D-arabinofuranoside לריכוז של 2 מיקרומטר.
הערה: ציטוזין β-D-arabinofuranoside מתווסף בינוני לעכב התפשטות astrocyte וכדי להרוג את hiPSCs הנותרים שאינם הבחנה לתוך הנוירונים. - מסנן המדיום וחם עד 37 מעלות צלזיוס. לשאוב את המדיום בילה מבארות של MEAs 6-היטב את הצלחת 24 גם ולהחליפה המדיום מוכן. שמירה על MEAs 6-היטב את הצלחת 24 גם C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
- הכן בינוני neurobasal עם 2% (v / v) B-27 תוספת, 1% (v / v) L-alanyl-L- גלוטמין ו -1% (v / v) פניצילין / סטרפטומיצין. להוסיף NT-3 לריכוז סופי של 10 ng / mL, BDNF לריכוז סופי של 10 ng / mL, ו דוקסיציקלין לריכוז סופי של 4 מיקרוגרם / מ"ל. בנוסף, להוסיף ציטוזין β-D-arabinofuranoside לריכוז של 2 מיקרומטר.
- רענן המדיום (יום 6 - 28)
הערה: החל מ יום 6, לרענן וחצישל המדיום כל יומיים. מהיום 10 ואילך, המדיום הוא השלים עם FBS לתמוך את הכדאיות astrocyte.- הכן בינוני neurobasal עם 2% (v / v) תוספת B-27, 1% (v / v) L-alanyl-L- גלוטמין ו -1% (v / v) פניצילין / סטרפטומיצין. להוסיף NT-3 לריכוז סופי של 10 ng / mL, BDNF לריכוז סופי של 10 ng / mL, ו דוקסיציקלין לריכוז סופי של 4 מיקרוגרם / מ"ל. מהיום 10 ואילך, גם להשלים את המדיום עם 2.5% (v / v) FBS. סנן בינונית חמה וכתוצאה מכך ל -37 מעלות צלזיוס.
- הסר מחצית המדיום בילה מבארות של MEAs 6-היטב את הצלחת 24 גם בעזרת פיפטה μL 1000 ו להחליף אותו עם המדיום מוכן. שמירה על MEAs 6-היטב את הצלחת 24 גם C חממה humidified 37 מעלות עם אווירה של 5% CO 2.
4. להקים את הפרופיל הנוירופיזיולוגיים של נוירונים hiPSC הנגזרות
הערה: שבועיים עד שלושה שבועות לאחר בduction של בידול, הנוירונים הנגזרים hiPSC יכול לשמש עבור ניתוחים במורד שונים. בסעיף זה, דוגמאות של ניתוחים במורד כמה מקבלות כי ניתן לבצע כדי לקבוע את הפרופיל הנוירופיזיולוגי של נוירונים נגזרים hiPSC.
- לאפיין את פעילות הרשת העצבית באמצעות MEAs
- שיא 20 דקות פעילות אלקטרו של נוירונים הנגזרות hiPSC בתרבית על MEAs. במהלך ההקלטה, לשמור על הטמפרטורה ב 37 מעלות צלזיוס, ולמנוע שינויי אידוי ו- pH של המדיום על ידי ניפוח זרם בלתי פוסק, איטי של גז humidified (5% CO 2, 20% O 2, 75% N 2) על MEA .
- לאחר הגברת 1200X (MEA 1060, MCS), לדגום את האות ב -10 קילוהרץ באמצעות כרטיס רכישת נתוני MCS. לנתח את הנתונים (ספייק וזיהוי פרץ) באמצעות חבילת תוכנה מותאמת אישית 23.
- המאפיין את פעילות התא הבודד אלקטרו
- מעביר את תלושי לכסות המכילים את התרבויות עצביות שמקורם hiPSC אל חדר הקלטה קבוע בשלב שקוע מיקרוסקופ זקוף. שיא 20 דקות של זרמי postsynaptic עורר פוטנציאל פעולה ספונטנית (sEPSC) 24. זיהוי האירוע הסינפטי באמצעות תוכנית neuroscientific.
- לאפיין את המורפולוגיה העצבית וביטוי synapsin
- תיקון ו להכתים את הנוירונים הנגזרות hiPSC עבור MAP2, synapsin-1/2, ו PSD-95 22, 24, 25. לכמת את מספר synapsin-1/2 ו PSD-95 puncta באמצעות תוכנת ניתוח התמונה.
תוצאות
כאן יש לנו שונה בהצלחה פרוטוקול שבו hiPSCs הם מובחנים ישירות לתוך נוירונים בקליפת המוח על ידי יתר המבטא את גורם שעתוק neurogenin-2 12 ואנחנו צריכים להתאים אותו לשימוש MEAs. גישה זו היא מהירה ויעילה המאפשר לנו להשיג נוירונים פונקציונלי פעילות רשת כבר בשבוע השלישי לאחר האינדוקציה של בידול.
במהלך פרוטוקול הבידול, התאים נכתבו מורפולוגית להידמות נוירונים: תהליכים קטנים נוצרו נוירונים נכתבו חיבור לכל (איור 1 א) אחר. הקמנו פרופיל הנוירופיזיולוגי של נוירונים נגזרו קו hiPSC בריא שליטה, על ידי מדידת המורפולוגיה העצבית שלהם ומאפיינים הסינפטי במהלך פיתוח. נוירונים hiPSC הנגזרות היו מוכתמים עבור MAP2 ו synapsin-1/2 בימים שונים לאחר תחילתשל (איור 2 א) בידול. הנוירונים נגזרים להראות מורפולוגיה עצבית בוגרת כבר 3 שבועות לאחר האינדוקציה של בידול. מספר synapsin-1/2 puncta (מדד למספר סינפסות) היה לכמת מבוסס על synapsin-1/2 stainings immunocytochemistry. מספר synapsin-1/2 puncta גדל לאורך זמן, דבר המצביע על כך את רמת הקישוריות עצבית גדלה גם (2B איור). מספר synapsin-1/2 puncta 23 ימים לאחר אינדוקציה של בידול היה דומה בשתי שורות שב"ס עצמאית (איור 2 ג). בגיל 23 DIV ביותר synapsin1 / 2 puncta היו בצמוד PSD-95 puncta, אשר מעיד על סינפסות תפקודית (איור 2 ד).
עולה בקנה אחד עם התוצאות שתוארו על ידי ג'אנג et al., שעוררנו אוכלוסיית נוירונים בקליפת מוח שכבה מעוררת העליונה, אושר על ידי הפאן עצבי ו-ספציפי תת סוג קליפת מוח מ arkers כגון BRN2 ו SATB2 (שכבה II / III). אנחנו לא שמרו נוירונים שהיו חיוביות עבור הנוירונים בשכבה עמוקה CTIP2 (שכבה V) או FOXP2 (VI שכבה) (איור 2E ו- F)
כדי לאפיין את הפעילות אלקטרו של נוירונים hiPSC הנגזרות, השתמשנו נוכחי כל תא והקלטות מהדק מתח, כלומר תכונות פנימיות קלט מעורר על נוירונים אלה נמדדו במהלך פיתוח. הנוירונים הצליחו ליצור פוטנציאל פעולה כבר שבוע לאחר הבידול ואחוז spiking תאים גברה לאורך זמן (איור 2G ו- H). יתר על כן, הנוירונים קבלו גירוי סינפטיים מעורר כבר שבוע לאחר האינדוקציה של בידול: הוא תדיר אמפליטודה של קלט סינפטיים המעורר גדלו במהלך פיתוח (האיור 2I - K).
NT "FO: keep-together.within-page =" 1 "> כדי להבין טוב יותר כיצד פעילות-תא בודד משלב כדי ליצור פונקציות ברמת רשת, זה הכרחי כדי ללמוד כיצד נוירונים הפועלים בתיאום במבחנת רשתות נוירונים בתרבית על MEAs. מהווים מודל ניסיוני ערך ללימוד הדינמיקה העצבית. הקלטנו 20 דקות של פעילות הרשת אלקטרו של נוירונים נגזר קו hiPSC בריא שליטה בתרבית על MEAs 6-היטב (איור 2M). שבועות מעטים לאחר אינדוקציה של בידול, הנוירונים נגזר hiPSCs שליטה בריאה נוצר רשתות נוירונים פעילות מבחינה תפקודית, מוקרן אירועים ספונטניים (0.62 ± 0.05 ספייק / s; 2N האיור). בשלב זה של התפתחות (כלומר 16 ד לאחר תחילת ההתמיינות) נקבע אירועים סינכרוני מעורבים כל הערוצים . של MEAs מזוהה (איור 2 טו) רמת פעילות ברשת עלתה במהלך הפיתוח: במהלך השבוע הרביעי אחרי t אינדוקציה של בידול הוא, רשתות נוירונים הראה רמה גבוהה של פעילות ספונטנית (2.5 ± 0.1 ספייק / s; איור 2N) בכל הבארות של המכשיר. פרצי רשת סינכרוני גם רשתות הציג (4.1 ± 0.1 פרץ / min, איור 2 טו) עם משך ארוך (2,100 ± 500 ms).
איור 1: hiPSC בידול לתוך נוירונים. נקודות א שלושה זמן של בידול hiPSCs לתוך הנוירונים על coverslips. ציפוי ב של hiPSCs על MEAs. ג האסטרוציטים ב 100% confluency ב בבקבוק T75 (לציין כי תאי יוצרי monolayer פסיפס). ברי סולם: 150 מיקרומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
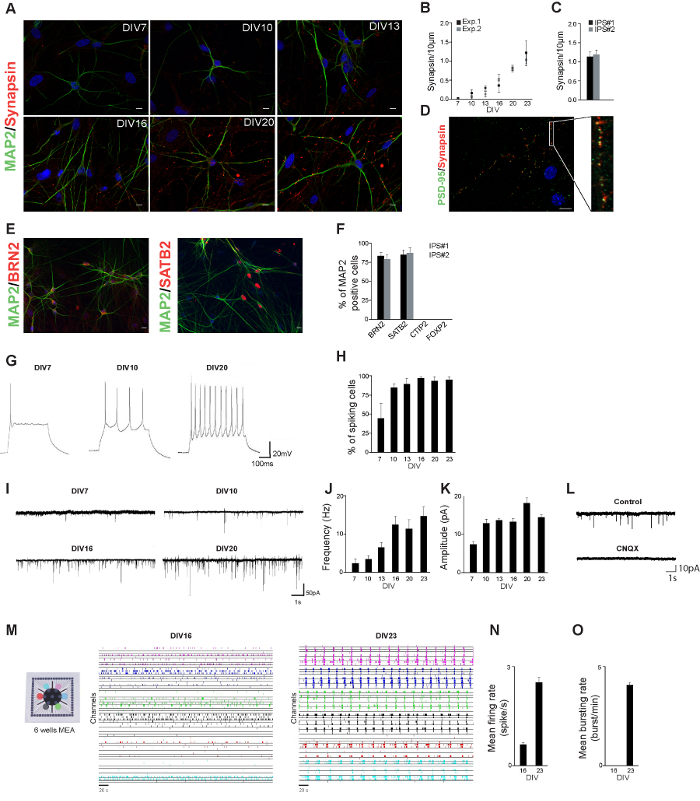
איור 2. hiPSC הנגזרים אפיון נוירונים. א hiPSC הנגזרות נוירונים היו מוכתמים עבור MAP2 (ירוק) synapsin-1/2 (אדום) בימים שונים לאחר תחילת בידול. סרגל קנה מידה: 10 מיקרומטר. ב כימות puncta synapsin בשני ניסויים בלתי תלויים. בכל ניסויים לפחות 10 תאים נותחו. ג כימות puncta synapsin ב DIV23 בנוירונים נגזר משני קווי שב"ס עצמאיים. ד hiPSC הנגזרות נוירונים היו מוכתמים עבור PSD-95 (ירוק) synapsin-1/2 (אדום) 23 ימים לאחר תחילת בידול. puncta synapsin מונחים זה לצד זה כדי PSD-95 puncta. א hiPSC הנגזרות נוירונים היו מוכתמים עבור MAP2 (ירוק) BRN2 (אדום) או SATB2 (אדום) 23 ד לאחר תחילת בידול. אחוז פ התאים החיוביים MAP2 כיהיו חיוביים עבור סמנים מצוינים. נציג G. הקלטות מהדק הנוכחי מראה פוטנציאל פעולה שיכולה להיווצר מוקדם ככל 7 ד לאחר תחילת בידול. ח אחוז התאים בימים שונים לאחר האינדוקציה של בידול המראים אחד או יותר פוטנציאל פעולה. I. עקבות נציג של זרמים סינפתטי (EPSCs) שקבלו נוירונים נגזרים hiPSC בימים שונים לאחר בידול. תדירות J. של זרמים סינפתטי במהלך הפיתוח. ק משרעת של זרמים סינפתטי במהלך הפיתוח. ל נציג עקבות של הקלטות EPSC ללא (שליטה) ועם CNQX (CNQX). מ נוירונים נגזרו שורה אחת hiPSC היו בתרבית על MEA 6-היטב פעילות רשת מוצגת עבור רשתות נוירונים נגזרות hiPSC 16 ו -23 ד לאחר האינדוקציה של בידול. הפעילות רשמהכל (קצב דגימה של 10 קילוהרץ) גם מסומן בצבע שונה (5 דק 'של 20 דקות של הקלטה מוצגת). נ ירי שיעור 16 ו -23 ד לאחר האינדוקציה של בידול. O. מתפרץ שיעור 16 ו -23 ד לאחר האינדוקציה של בידול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
לאור התוצאות, איכות hiPSC נגזרות הנוירונים וכתוצאה מכך ניתן להעריך על ידי יצירת פרופיל הנוירופיזיולוגי של התאים. כלומר, שלושה עד ארבעה שבועות לאחר תחילת בידול, מורפולוגיה, synapsin-1/2 הביטוי אלקטרופיזיולוגיה של נוירונים ניתן להעריך. באותו נקודת זמן, הנוירונים הנגזרות hiPSC צפויים להראות מורפולוגיה העצבית דמוי, להיות MAP2, synapsin / PSD-95 חיובי כאשר immunocytochemistry ביצוע, וכדי תערוכהt פעילות אלקטרו ספונטנית (הן ברמה-התא הבודד ורשת).
Discussion
הנה יישמנו פרוטוקול בידול-hiPSC יעיל בהוצאת ג'אנג et al. (2013) 12 למדידת פעילות הרשת של רשתות נוירונים הנגזרות hiPSC על MEAs. התאמנו הפרוטוקול המקורי על ידי יצירת קו hiPSC -positive rtTA / Ngn2 לפני גרימת והבחנה עצבית. צעד נוסף זה מאפשר לנו לשלוט על צפיפות תאים העצבית על MEA. שליטה על הצפיפות העצבית הייתה תנאי מוקדם חשוב להתאמת פרוטוקול MEAs ולהבטחת עקביות. כדי למדוד את הפעילות של רשתות נוירונים באמצעות MEAs, הנוירונים צריכים ליצור רשתות צפופות ישירות על גבי האלקטרודות MEA 17,18. זה בהכרח מחייב פיקוח הדוק על צפיפות הציפוי של נוירונים. שורת hiPSC rtTA / Ngn2 -positive מאפשרת שליטה של צפיפות נוירון כי טקטיקה זו אינה מסתמכת על transductions lentiviral החריף של hiPSCs לפני הבידול;הקו -positive hiPSC rtTA / Ngn2 ולכן כמעט מבטלת כל וריאציה התשואה הסופית עקב, למשל, רעילות lentiviral ויעילות זיהום משתנה.
עוד שלב קריטי של הליך הניסוי הוא מספר האסטרוציטים עכברוש כי הם cocultured עם hiPSCs הבחנה. האסטרוציטים פעילים לתרום העידון לפתח מעגלים עצביים על ידי שליטת סינפסה היווצרות, תחזוקה, וביטול, כל אלה הם תהליכים חשובים לתפקוד עצבי. הפרוטוקול המובא במאמר זה הוא מאוד astrocyte תלוי: מלא בוגרת ויוצרי סינפסות תפקודית, הנוירונים מחייבים תמיכה מן האסטרוציטים. חווינו שמספר האסטרוציטים צריך להיות פחות או יותר שווה למספר הנוירונים הנגזרות hiPSC לתמוך ההבשלה של נוירונים לבין היווצרות של רשתות נוירונים מפגין פעילות ספונטנית. בשל כך שהתשואות פרוטוקול astrocyte שלנו מבוי סתום תא ראשוניטורס עם תוחלת חיים מוגבלת, בידודה של האסטרוציטים עכברוש צריך להתבצע על בסיס קבוע.
ההסתגלות שלנו של הפרוטוקול בהוצאת ג'אנג et al. (2013) 12 לשימוש עם טכנולוגיית MEA צפויה לשפר משמעותית את יכולתנו לחקור את פעילות הרשת של רשתות נגזרות hiPSC. בעבר, פרוטוקולים המשמשים ללימוד רשתות נוירונים נגזרות hiPSC עם MEAs הסתמכו על נהלי בידול גוזל זמן 13-16. פרוטוקול מאל et ג'אנג. (2013) מספק אלטרנטיבה מהירה, והשינוי שלנו מסיר מקור ההשתנות, מה שהופך את זה עכשיו יותר ריאלי להשתמש נוירונים נגזרים hiPSC בשילוב עם טכנולוגית MEA, במיוחד תפוקה גבוהה או מחקרים פרמקולוגיים. בנוסף, כיוון שאמצעי בהוצאת ג'אנג et al. (2013) 12 מניב אוכלוסייה הומוגנית של נוירונים בקליפת המוח העליון שכבתי, הפרוטוקול המותאם שלנו עושה מחקרים ממוקדים ההאפשר לתוך הרשתctivity של משנה העצבית המסוים הזה.
עם זאת, גישה זו יש גם כמה מגבלות. ראשית, את ההומוגניות של התרבויות יכולה להיחשב גם חסרון, כי התרבויות נוטות פחות להידמות ברשתות vivo, שבו סוגים שונים של נוירונים (כלומר נוירונים מעכבים ו מעוררים) מהווים רשת הטרוגנית. כדי לשפר עוד יותר את השימוש של נוירונים נגזרים hiPSC עם טכנולוגית MEA, זה יהיה חשוב לפתח פרוטוקולי בידול מהירים (transgene המבוסס) עבור אוכלוסיות תאים עצביות אחרות. אם הפרוטוקולים מתפרסמים, הרשתות במבחנה היו לחקות ברשתות vivo הדוקות יותר. שנית, האסטרוציטים עכברוש נוכחיים יש להוסיף לתאי עצב hiPSC הנגזר לתמיכה בצמיחה, ולכן הרשת העצבית וכתוצאה מכך אינה במובן סנסו רשת עצבי אנושי. פרוטוקולים אמין להבחנה hiPSCs לתוך האסטרוציטים מאי סול בעתידve זו בעיה 26. שלישית, דו מימדי רשתות נוירונים, כפי שמתואר כאן, הם מודל מוגבל ללימוד מורכבות תלת ממדי in vivo רשתות נוירונים. למרבה המזל, פרוטוקולים המתאר תלת מימדי תרבויות של נוירונים העיקרי עכברוש בשילוב עם הטכנולוגיה MEA כבר זמינים 27,28. מכאן ולהבא, השילוב של פרוטוקולי בידול מהירים לקבלת נוירונים hiPSC נגזרות האסטרוציטים עם טכניקות תרבות תלת ממדים וטכנולוגיית MEA אמור לספק תובנה רומן לתוך הפרעות נוירולוגיות בסיסיות מנגנונים ביולוגיים.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Jessica Classen for performing the whole-cell patch-clamp experiments. The hiPSCs used in our experiments were kindly provided by Huiqing Zhou and Willem van den Akker from the Radboud University Nijmegen. The transfer vectors used in this protocol were kindly provided by Oliver Brüstle, Philipp Koch and Julia Ladewig from the University of Bonn Medical Centre.
Materials
| Name | Company | Catalog Number | Comments |
| Lebovitz's L-15 medium | Gibco | 11415-064 | |
| B-27 supplement | Gibco | 0080085SA | |
| Poly-D-Lysine (PDL) | Sigma-Aldrich | P6407 | |
| Ca2+/Mg2+-free HBSS | Gibco | 14175-095 | |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | |
| 2.5% Trypsin | Gibco | 15090-046 | |
| High-glucose DMEM | Gibco | 11965-092 | |
| FBS (Fetal Bovine Serum) | Sigma-Aldrich | F2442-500ML | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| 70 µm cell strainer | BD Falcon | 352350 | |
| DPBS | Gibco | 14190-094 | |
| psPAX2 lentiviral packaging vector | Addgene | Plasmid #12260 | |
| pMD2.G lentiviral packaging vector | Addgene | Plasmid #12259 | |
| Basement membrane matrix | Gibco | A1413201 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Cell detachment solution | Sigma-Aldrich | A6964 | |
| E8 medium | Gibco | A1517001 | |
| ROCK inhibitor | Gibco | A2644501 | Alternatively, ROCK inhibitors like thiazovivin can be used. |
| Polybrene | Sigma-Aldrich | H9268-5G | |
| G418 | Sigma-Aldrich | G8168-10ML | |
| Puromycin | Sigma-Aldrich | P9620-10ML | |
| Vitronectin | Gibco | A14700 | |
| 6-well MEAs | Multi Channel Systems | 60-6wellMEA200/30iR-Ti-tcr | |
| Glass coverslips | VWR | 631-0899 | |
| Poly-L-Ornithine (PLO) | Sigma-Aldrich | P3655-10MG | |
| Laminin | Sigma-Aldrich | L2020-1MG | |
| Doxycyclin | Sigma-Aldrich | D9891-5G | |
| N-2 supplement | Gibco | 17502-048 | |
| Non-essential amino acids | Sigma-Aldrich | M7145 | |
| NT-3, human recombinant | Promokine | C66425 | |
| BDNF, human recombinant | Promokine | C66212 | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| L-alanyl-L-glutamine | Gibco | 35050-038 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Cytosine β-D-arabinofuranoside | Sigma-Aldrich | C1768-100MG | |
| Straight fine-tipped forceps | Fine Science Tools | 11251 | |
| Fine-tipped spring scissors | Fine Science Tools | 91500-09 |
References
- Ahfeldt, T., Litterman, N. K., Rubin, L. Studying human disease using human neurons. Brain Res. , (2016).
- Zhang, S. C., Wernig, M., Duncan, I. D., Brustle, O., Thomson, J. A. In vitro differentiation of transplantable neural precursors from human embryonic stem cells. Nat Biotechnol. 19 (12), 1129-1133 (2001).
- Perrier, A. L., et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proc Natl Acad Sci USA. 101 (34), 12543-12548 (2004).
- Wu, H., et al. Integrative genomic and functional analyses reveal neuronal subtype differentiation bias in human embryonic stem cell lines. Proc Natl Acad Sci USA. 104 (34), 13821-13826 (2007).
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P., Tomishima, M., Sadelain, M., Studer, L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7, 1836-1846 (2012).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Johnson, M. A., Weick, J. P., Pearce, R. A., Zhang, S. C. Functional neural development from human embryonic stem cells: accelerated synaptic activity via astrocyte coculture. J Neurosci. 27 (12), 3069-3077 (2007).
- Hu, B. Y., et al. Neural differentiation of human induced pluripotent stem cells follows developmental principles but with variable potency. Proc Natl Acad Sci USA. 107 (9), 4335-4340 (2010).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8 (6), 695-706 (2011).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Saitoh, Y., Alhebshi, A. H., Gotoh, M., Suzuki, I. Long-term electrophysiological activity and pharmacological response of a human induced pluripotent stem cell-derived neuron and astrocyte co-culture. Biochem Biophys Res Commun. 443 (4), 1176-1181 (2014).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Sci Rep. 6, 26181 (2016).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Front Neurosci. 10, (2016).
- Heikkila, T. J., et al. Human embryonic stem cell-derived neuronal cells form spontaneously active neuronal networks in vitro. Exp Neurol. 218 (1), 109-116 (2009).
- Massobrio, P., Massobrio, G., Martinoia, S. Multi-program approach for simulating recorded extracellular signals generated by neurons coupled to microelectrode arrays. Neurocomputing. 70, 2467-2476 (2007).
- Wang, L., Riss, M., Buitrago, J. O., Claverol-Tinturé, E. Biophysics of microchannel-enabled neuron-electrode interfaces. J Neural Eng. 9 (2), (2012).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J. Vis. Exp. (71), e50079 (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J Vis Exp. (63), e3965 (2012).
- Ba, W., et al. ARHGAP12 functions as a developmental brake on excitatory synapse function. Cell Rep. 14 (6), 1355-1368 (2016).
- Bologna, L. L., et al. Investigating neuronal activity by SPYCODE multi-channel data analyzer. Neural Netw. 23 (6), 685-697 (2010).
- Ba, W., et al. TRIO loss of function is associated with mild intellectual disability and affects dendritic branching and synapse function. Hum Mol Genet. 25 (5), 892-902 (2016).
- Benevento, M., et al. Histone methylation by the Kleefstra syndrome protein EHMT1 mediates homeostatic synaptic scaling. Neuron. 91 (2), 341-355 (2016).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature biotechnology. 29 (6), 528-534 (2011).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Sci Rep. 4, 5489 (2014).
- Tedesco, M., Frega, M., Martinoia, S., Pesce, M., Massobrio, P. Interfacing 3D engineered neuronal cultures to micro-electrode arrays: an innovative in vitro experimental model. J Vis Exp. (104), e53080 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved