Method Article
Mikro-elektrot dizileri Ağ Aktivite Ölçüm uyarılmış pluripotent kök hücrelerin Rapid Nöronal Farklılaşma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Biz değiştirmek ve uyarıcı kortikal nöronların 12 içine insan kaynaklı pluripotent Kök Hücre (hiPSCs) arasında hızlı, tekrarlanabilir ve verimli farklılaşma anlatan bir önceden yayınlanmış protokolü uygulamak. Özellikle, modifikasyon ağ düzeyinde elektrofizyolojik özelliklerini ölçmek için, mikro-elektrot dizileri üzerinde nöronal hücre yoğunluğu ve kullanım kontrol edilmesini sağlar.
Özet
insan kaynaklı Pluripotent Kök Hücre türetilen Nöronlar (hiPSCs) nörolojik bozukluklar çalışmak için umut verici yeni bir araç sağlar. Son on yıl içinde, nöronlar içine hiPSCs ayırt etmek için birçok protokol geliştirilmiştir. Bununla birlikte, bu protokoller genellikle yüksek değişkenliği düşük tekrarlanabilirlik ve düşük verimlilik ile yavaştır. Buna ek olarak, bu protokoller elde nöronlar genellikle olgun ve nöronlar birkaç ay boyunca kültürlenir sürece, hem tek hücreli ve ağ seviyelerde yeterli fonksiyonel aktivitesi eksikliği. Kısmen Bu sınırlamalar nedeniyle, hiPSC türetilmiş nöronal ağların fonksiyonel özellikleri henüz tam olarak karakterize edilmiştir. Burada, transkripsiyon faktörü neurogenin-2, 12 zorlanmış ekspresyonu ile hiPSCs insan nöron üretimini tarif yakın zamanda yayınlanan bir protokolün uyum sağlar. Bu protokol hızlı det yaklaşık% 100 dönüşüm verimliliği ile ve verimli (olgun 3 hafta içinde nöronlar veren) birEd hücreleri (> DAPI-pozitif hücre% 95 olan MAP2 pozitif). Ayrıca, iletişim kuralı, nörolojik bozukluklar, hücre türüne özgü katkılar araştırılmasını sağlayacak uyarıcı nöronlardan homojen bir popülasyonu verir. Biz bize nöronların sayısı üzerinde tam kontrol vererek, stabil transduced hiPSC hücreleri üreterek özgün protokol güncellenmiştir. Bu hücreler daha sonra, mikro-elektrot dizileri üzerinde hiPSC türetilen nöron ağları oluşturmak için kullanılır. Bu şekilde, hiPSC türetilmiş nöronal ağların kendiliğinden elektrofizyolojik aktivite ölçülebilir ve hücre yoğunluğu açısından interexperimental tutarlılık korurken, karakterize edilir. sunulan protokol özellikle insan nöronal ağlarda mekanik ve farmakolojik çalışmalar için, geniş çapta uygulanabilir.
Giriş
İnsan uyarılmış pluripotent kök hücrelerin (hiPSCs) farklılaşma protokolleri geliştirilmesi nörolojik bozukluklar çalışmak için yeni ve güçlü bir araç sağladı in vitro insan nöronları üretmek için. Yakın zamana kadar, bu hastalıkların araştırılması ciddi insan nöronları kullanarak model sistemler eksikliği güçleştirmiştir. Kemirgenler nörolojik bozukluklar incelemek için kullanılabilir, ancak bu tür çalışmaların sonuçları, insanlarda 1 kolayca çevrilemez. Bu sınırlamaları dikkate alındığında, hiPSC türetilmiş nöronlar moleküler mekanizmaları altta yatan nörolojik bozukluklar aydınlatmak için kullanılan ve in vitro ilaç taraması için olabilir umut vaat eden bir alternatif bir model vardır.
Son on yılda, çeşitli protokoller nöronlara hiPSCs 2-8 geliştirilmiştir dönüştürmek. Bununla birlikte, bu protokoller de birçok yönden sınırlıdır. İlk olarak, protokoller çoğu zaman alıcıdır: Yeterli olgunlaşma ile üreten nöronlar (yani synapse formasyonu) ve fonksiyonel aktivite 9 zorlu büyük ölçekli çalışmalar vermektedir kültür işlemlerinin, aylar gerektirir. Buna ek olarak, hiPSC-to-nöron dönüşüm verimliliği düşüktür. Protokoller genellikle nöronlar heterojen popülasyonu elde ve böylece nöronal hücrelerin spesifik alt setinin çalışmaları izin vermez. Ayrıca, protokoller farklı iPSC hatları 10,11 için farklı sonuçlar veren, tekrarlanabilir değildir. Son olarak, olgunlaşma aşaması ve elde edilen nöronların fonksiyonel özellikleri 10 de değişkendir.
Bu sorunların, Zhang ve arkadaşları gidermek için. (2013) 12, hızlı ve yeniden üretilebilir neurogenin-2 transkripsiyon faktörü aşırı ifade ile hiPSCs insan nöronları üreten bir protokol geliştirilmiştir. nöronal özellikleri s bağımsız (- (3 hafta Neurogenin-2 ekspresyonuna yol sonra sadece 2), protokol tekrarlanabilir yazarları tarafından bildirildiği gibi, farklılaşma nispeten hızlı bir şekilde gerçekleşirhiPSC çizgi) tarting ve hiPSC-to-nöron dönüşüm (yaklaşık% 100) yüksek verimli olduğunu. kendi protokol oluşturulacak nöron popülasyonu nöronal bozukluklar hücre türüne özgü katkılar inceleme sağlayan homojen (üst katman kortikal nöronlar benzeri) almaktadır. Dahası, onların hiPSC türetilmiş nöronlar sadece 20 d sonra olgun özelliklere (örneğin, yetenek sinapsları ve sağlam fonksiyonel aktiviteyi oluşturmak için) sergiledi.
ağ düzeyinde hiPSC türetilmiş nöronların elektrofizyolojik özelliklerin belirlenmesi hiPSC teknolojisi önce önemli bir ön koşul insan hastalıklarının incelenmesi için istismar edilebilir. Bu nedenle, pek çok araştırma grupları son zamanlarda mikro-elektrot dizisi (MEA) cihazları (Çok Kanallı Sistemleri, Reutlingen, Almanya) 13-16 kullanarak ağ düzeyinde kök hücre kökenli nöronlar araştırmaya başlamışlardır. Bir MEA elektrotlar nöronal hücre kültürlenebilir hangi bir alt-tabaka içine gömülür.Taraflı çevre nöronal ağlar ve aktivitesinin in vitro gelişimi elektrofizyolojik özellikleri keşfetmek için kullanılabilir. Şu anda, ÇÇA sadece olgun ağlar elde etmek için birkaç ay sürebilir farklılaşma protokolleri ile birlikte kullanılır. Bu nedenle, hızlı bir farklılaşma protokolü ile ÇÇA birleştiren nörolojik bozuklukların büyük ölçekli çalışmalarda bu teknolojisinden kolaylaştırmalıdır.
Burada, Zhang ve arkadaşları bir modifikasyonunu sunulmaktadır. (2013) 12 protokol ve ÇÇA kullanılmak üzere adapte. Özellikle, daha doğrusu bir akut lentiviral transdüksiyon güvenmek yerine, biz yerine stabil farklılaşma oluşturulmadan önce rtTA / Ngn2 ifade hiPSC hatları oluşturdu. Biz nöronal hücre yoğunluğu nöronal ağ oluşumu için kritik öneme sahiptir ve nöronlar ve MEA 17,18 elektrotları arasında iyi temas beri, nöronal hücre yoğunluğu üzerinde tekrarlanabilir kontrole sahip öncelikle yaptı. althougH Zhang ve ark. Protokol kalıt hiPSCs dönüştürülmesi ile ilgili olarak çok daha etkili olduğunu, başlangıçta 12 (Zhang ve ark. Şekil 2e) kaplamalı hiPSCs sayısından nöronların nihai verimi bakımından doğal bir değişkendir. istikrarlı bir çizgi ile, biz böyle lentiviral toksisite ve enfeksiyon verimliliği gibi değişkenliği neden birçok konuda, ortadan kaldırır. Daha sonra ağ olgunlaşmasını elde güvenilir ÇÇA üzerinde hiPSC türetilmiş nöron ağları üreten parametrelerini optimize (örneğin, kanallar çoğunluğunu kapsayan eşzamanlı olaylar) üçüncü haftasında. Bu hızlı ve güvenilir bir protokol farklı (yani hastaya özgü) hiPSC hatları yanı sıra farmakolojik çalışmalar için sağlam tutarlılık sağlamak türetilen nöronlar arasında doğrudan karşılaştırmalar etkinleştirmeniz gerekir.
Protokol
hayvanlar üzerinde tüm deneyler Hayvan Bakım Komitesi, Radboud Üniversitesi Tıp Merkezi, Hollanda, (: 77.073 RU-Aralık-2011-021, protokol numarası) onaylanmış hayvan bakım ve kullanım talimatlarına uygun olarak gerçekleştirilmiştir.
1. Glia Hücre İzolasyonu ve Kültür
NOT: Burada sunulan protokol Velli 19 McCarthy çalışmalarına ve de dayanır ve fare astrositler için bir çok benzer ayrıntılı bir protokol mevcut 20 mesafesindedir. Embriyonik (E18) fare beyinlerinden korteks astrositler birincil kültürleri oluşturmak için, hamile bir sıçan feda edilmesi gerekmektedir, embriyolar rahim hasat edilmesi gerekir ve beyinleri embriyolardan izole edilmesi gerekir. T75 şişeyi doldurmak için, 2 embriyonik beyinlerinden korteks kombine edilmesi gerekir. Bir alternatif olarak, ticari olarak temin edilebilir, saflaştırılmış ve dondurulmuş astrositler satın alınabilir.
- T75 kültür şişesi hazırlayın
- Seyreltik poli-D-Lisin (PDL) 'de10 ug / ml bir son konsantrasyona kadar, steril saf su. T75 kültür şişesine seyreltilmiş PDL 5 ml ekleyin. tüm büyüme yüzeyini ıslak etrafında yavaşça swish. 3 saat boyunca nemlendirilmiş 37 ° C inkübatör içine yerleştirilir.
- şişeden PDL aspire. bağlanmamış PDL kaldırmak için 5 ml steril su ile şişesi 3x durulayın. Tamamen su aspire. bir laminar akış başlığı ya hemen kullanılmıştır kurumaya balon bırakın.
- Korteks diseksiyonu
- % 2 (v / v) B-27 ilavesi ile Lebovitz L-15 orta: 50 ml diseksiyon orta hazırlayın. buz üzerinde tutun.
- (- 8 dak ~ 5) solunum sona erene kadar bir indüksiyon odasında derin izofluran ile sıçan (küçük pleksiglas kutu) anestezisi. indüksiyon odasından sıçan çıkarın ve hemen servikal dislokasyon ötenazi.
- % 70 EtOH ile sıçan karın sprey ve aşırı silin. Açığa ve Sezaryen secti aracılığıyla baraj rahim kaldırmakmakas 21 bir çift kullanarak.
- Makasla kendi amnion kesesi bireysel embriyolar kesilmiş soğuk diseksiyon orta ile dolu bir steril Petri kabı transfer ve buz üzerinde tutmak.
- soğuk diseksiyon ortam ile donatılmış bir steril 6 cm Petri için tekrar embriyolar aktarın. stereo bir mikroskop altında embriyolardan beyinleri ekstrakte edin. beyin ortaya çıkarmak için hafifçe forseps kullanarak deri ve kafatası uzak soyun. Yavaşça tüm beyin kepçe ve taze, soğuk diseksiyon orta ile 35 mm Petri kabı transfer.
Not: embriyolarından kesilir Bütün beyinler hücre yaşama yeteneklerini kaybettirmeden, birçok saat buz üzerinde diseksiyon ortamında saklanabilir. - ince uçlu yaylı makas veya neşter ile orta hat boyunca keserek her beynin iki yarısının ayırın. Dikkatle düz ince uçlu forseps ile meninks kapalı şerit.
NOT: Bu tamamen meninksler kaldırmak için çok önemlidir. thastrosit kültürü engeller fibroblast kirliliğidir. Fibroblastlar hızla bölünen hücreler ve sonunda diğer hücreleri yerinden edecek. - orta beyin / striatum ve yaylı makas veya neşter ile koku ampulü çıkarın. Ayrıca yaylı makas veya bir bisturi ile (korteks ile ilgili perimedian ve kaudal C-şekilli bir yapı) hipokampus kaldırmak için emin olun. 5 ml diseksiyon ortam maddesi ile doldurulmuş bir 15 ml santrifüj tüpüne kortikal hemisferlerin toplayın. buz üzerinde tutun.
- Korteks ayrışma
- Hazırlama 2 mL Ca2 + / Mg2 + içermeyen% 0.25 tripsin ile Hank'in dengeli tuz çözeltisi (HBSS) (ayrışma ortamı). 50 mL yüksek glukoz,% 15 (h / h) fetal sığır serumu (FBS) ve% 1 ile Dulbecco Modifiye Eagle Ortamı (DMEM) (h / h), penisilin / streptomisin (kültür ortamı) ve filtre sterilize hazırlayın.
- Doku santrifüj tüpünün dibine dinlendiriniz. dikkatledokudan yukarıdan mümkün olduğunca diseksiyon orta kadar korsan. 2+ / Mg 2 + içermeyen HBSS (tripsin olmadan) 5 ml Ca doku yıkayın ve doku tüpün dibinde yerleşmek için izin verir.
- Dikkatle HBSS aspire. 2 mL ayrıştırma ortamı ekleyin ve doku etrafında enzimi karıştırmak için hafifçe tüp fiske. 5-10 dakika için 37 ° C su banyosu içinde inkübe edin. doku çalkalamak için inkübasyon sırasında tüpü birkaç kez Flick.
- Hemen 1.000 uL pipet kullanarak doku çiğnemek. yaklaşık 800 mcL pipetter sesini ayarlama. parçaları aspire ve doğrudan sıvı hattı üzerinde, tüp yüzüne zorla çıkarmak. Ancak, kabarcıklar veya köpüklenme en aza indirmeye çalışın. 20x - Doku yeterince yaklaşık 15 ayrışmış kadar tekrarlayın. Tripsin inaktive 8 ml kültür ortamı ekleyin. Tüp hafifçe birkaç kez baş aşağı çevirerek kanştınn.
- 50 m üstüne yerleştirilmiş bir 70 mikron hücre süzgecinden hücre süspansiyonu geçirinL'lik bir santrifüj tüpü. kültür ortamında 15 ml tüp yıkayın ve hücre süspansiyonu ile 50 ml bir tüp içinde orta toplamak için hücre süzgecinden orta filtre. hücre süzgeç kültür ortamı ile bir kaç kez yıkayın. 25 ml - durulanmasından sonra, son hacmi, yaklaşık 20 olması gerekir.
- 10 dakika boyunca 200 x g'de Pelet hücreleri. Dikkatle hücre pelletini dokunmadan, mümkün olduğu kadar çok bir ortam aspire edin. 1000 uL pipet kullanılarak 1 mL kültür ortamı içinde tekrar süspansiyon hücreleri. 11 mL önceden ısıtılmış kültür ortamı ekleyin ve 10 ml pipet kullanarak (kabarcıklarını engellemek için) hafifçe karıştırın.
- 5 ml kültür ortamı ile bir kez PDL kaplı T75 şişesi durulayın. orta aspire ve şişeye hücre süspansiyonu aktarın. Tüm hücreler kaplanır süspansiyonda, ve biz astrositler süspansiyon diğer hücrelerden ayırt edilemez çünkü genellikle gereksiz, onları saymak bulabilirsiniz. % 5 CO2 f atmosferi olan nemlendirilmiş bir 37 ° C inkübatör içine içine yerleştirilirya da iki gün.
- Genişleme ve astrositler bakımı
- ilk kaplama sonra ilk kez 2 gün boyunca tüm orta yerine. Tüm orta sonradan her 3 d değiştirin. Her hücrelere ilave edilmeden önce 37 ° C'ye kadar taze ortam prewarm.
NOT: astrositler 7 gerektiren - yaklaşık% 90 confluency (astrositler mikroglia ve oligodendrosit üstüne yalan ve karışmış olan bir yoğun paketlenmiş mozaik desenli tek tabaka olarak görünür) ulaşmak için 10 d. - astrositler yaklaşık% 90 confluency ulaştığında, kirlenmesine glial hücreleri çıkarmak için şişeyi sallayın:
- inkübatör şişeyi çıkarın ve kapağı (fenolik) sıkın ya da bağlantı noktasını kapsayacak (süzülmüş). mikroglia kaldırmak için 1 saat 180 rpm'de bir orbital platform üzerinde çalkalanır. orta aspire. 5 ml önceden ısıtılmış bir kültür ortamı, aspirasyon ile bir kez yıkayın ve 12 ml kültür ortamı ile değiştirin.
- Ayırmakoligodendrosit O / N, tercihen yörünge platforma şişeyi geri 250 rpm'de sallamak 37 ° C, 7 saat en az fakat.
- orta aspire. 5 ml önceden ısıtılmış bir kültür ortamı, aspirasyon ile bir kez yıkayın ve 12 ml kültür ortamı ile değiştirin. inkübatör şişeyi geri dönün.
- % 0.05 tripsin etilendiamintetraasetik asit (EDTA) ile 2: 1 ila 3:% 100 konfluent, 1 oranında, standart prosedürler kullanılarak astrositler split. % 100 confluency A T75 şişesi tipik toplamda yaklaşık 4.0 x 10 6 hücre verecektir. Bu programa göre, kültürler genellikle haftada bir kez bölünebilir.
Not: astrositler konfluent ulaştığında, hasat edilebilir ve protokol adım 3.4 aşağıda tarif edildiği gibi hiPSC farklılaşması için de kullanılır. astrositler canlılığı bir fark kaybı olmadan en az bir kez bölünebilir. Bu kültürde, 2 ay boyunca muhafaza edilebilir. deneyim, birincil embriyonik 18 günlük sıçan astrositler progressively terminal farklılaşmış olabilir ve / veya tekrarlanan ayrıldıktan sonra canlılığını kaybeder. ileride kullanılmak üzere astrositler dondurmak mümkün olsa da, biz gerektiğinde taze embriyonik beyinleri gelen astrositler izole tercih.
- ilk kaplama sonra ilk kez 2 gün boyunca tüm orta yerine. Tüm orta sonradan her 3 d değiştirin. Her hücrelere ilave edilmeden önce 37 ° C'ye kadar taze ortam prewarm.
RtTA 2. Üretim / Ngn2 pozitif hiPSCs
NOT: yeniden programlama c-myc, Sox2, Oct4 ve Klf4 faktörleri ile deneyler için kullanılan hiPSCs insan fibroblast lentiviral transdüksiyon tarafından in-house üretilmiştir.
Not: rtTA / Ngn2 -pozitif hiPSCs oluşturulması için, lentiviral vektörler stabil olarak hiPSCs genomu transgenlerin entegre etmek için kullanılır. Lentivirüs üretimi için protokol daha önce 22 yayınlanmıştır. RtTA ve Ngn2 lentivirüs parçacıkları üretmek için kullanılan lentiviral ambalaj vektörlerinin bilgilerini temin edilmiştir Malzeme / Ekipman Masa. RtTA lentivirüs için kullanılan transfer vektörü pLVX-EF1α- olduğu (Tet-On-İleri) -IRES-G418 (R); örneğin, bu vektör, antibiyotik G418 için bir kurucu EF1α promotörün kontrolü altında Gelişmiş transaktivatör Tet-On ve kazandıran direnç kodlar. Ngn2 lentivirüs için kullanılan transfer vektör pLVX- (TRE-thight) - (FARE) Ngn2-PGK-Puromycin (R); örneğin, bu vektör, murin Neurogenin-2 Tet kontrollü promoterinin kontrolü ve bir kurucu PGK promoterinin kontrolü altında puromisin direnç geni altında geni kodlar. Bu nedenle, bu iki transfer vektörleri kullanılarak bir hiPSC hattı oluşturulabilir olan murin Neurogenin-2 ifadesi doksisiklin ile orta ilave tarafından indüklenebilir. HiPSCs transdüksiyonu için, lentivirüs partikülleri içeren süpernatan kullanılır, örneğin, zeka (metnin geri kalan kısmında "lentivirüs süspansiyon" olarak adlandırılır)hout ultrasantrifüj kullanılarak parçacıklar konsantre edildi.
- HiPSCs Plate (gün 1)
NOT: Bu protokol açıklanan miktarlar hiPSCs 6 gözenekli bir plakada kültürlenmiştir olduğu ve bir kuyunun hücreler hasat varsayalım. Buna ek olarak, hücreler, bir 12 yuvalı plaka 12 kuyu sonradan kaplanır varsayılmıştır.- Seyreltilmiş BMM elde edilmesi için,% 1 (h / h) Bazal Membran Matrisi (BMM) 10 ml soğuk DMEM / F12 hazırlayın. 12 çukurlu bir levhanın her çukuruna BMM seyreltilmiş 800 uL ekleyin. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde en az 1 saat süreyle inkübe edin. Kullanmadan önce, oda sıcaklığında 1 saat için plaka inkübe edin.
- % 1 (h / h), penisilin / streptomisin, 9 ml DMEM / F12 ve oda sıcaklığına kadar 1 ml hücre kopması çözeltisi (CDS) Sıcak 15 mL uçucu 8 (E8) ortamı. Rho-ilişkili protein kinaz (ROCK) inhibitörü ile E8 orta tamamlar.
- hiPSCs harcanan orta aspire birD hiPSCs 1 ml CDS ekleyin. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 5 dakika - 3 inkübe edin. Hücreler birbirlerinden ayrılmakta olup olmadığını mikroskop altında kontrol edin.
- nazikçe 1.000 uL pipet ile hücreleri askıya ve 15 ml tüp hücreleri aktarmak, kuyuda 2 ml DMEM / F12 ekleyin. Hücre süspansiyonuna 7 ml DMEM / F12 ekleyin. 5 dakika boyunca 200 xg'de hücreleri dönerler.
- Süpernatantı aspire ve hazırlanan E8 orta 2 mL ekleyin. hiPSCs 15 ml tüpün kenarına 1000 uL pipet ucu koyarak ve yavaşça yeniden süspansiyona alınmasıyla (hücre kümeleri oluşturmaz) ayrışmış olduğu bir hücre süspansiyonu elde edilir. Hücreler ayrışmış olup olmadığını mikroskop altında kontrol edin.
- Bir hemositometre odasını kullanan hücreler (hücre / ml) sayısını belirler.
NOT: 80 de A 6 kuyu plaka - toplam 4,0 x 10 6 hücre -% 90 confluency tipik 3.0 verecektir. - soluklu12 gözlü bir levhanın gözleri arasında BMM seyreltilmiştir. 3.0 x 10 4 hücre / mL'lik bir hücre süspansiyonu elde etmek için hücreleri seyreltilir. 12 gözlü plakanın her bir kuyucuğu hücre süspansiyonu Levha 1 ml. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 12 oyuklu plaka O / N yerleştirin.
- RtTA ve Ngn2 lentivirüs ile iPS hücreleri nakletmek (2 gün)
- Oda sıcaklığında% 1 (h / h), penisilin / streptomisin ile sıcak 12 ml E8 ortamı. E8 ortama 8 ug / mL'lik bir nihai konsantrasyona kadar ROCK inhibitör ve polibren ile E8 orta ek.
- lentivirüs süspansiyon alikotları çözülme. lentivirüs süspansiyona 8 ug / mL'lik nihai bir konsantrasyona kadar polibren ekleyin. harcanan ortam aspire ve her bir hazırlanabilir E8 ortamın 1 ml.
- Ve Ngn2 -lentivirus süspansiyonlar - Farklı rtTA miktarlarda ile iletimini gerçekleştirmek. Örneğin, transdu12 yuvalı plakanın bir oyuğuna rtTA -lentivirus ve Ngn2 -lentivirus süspansiyonu her iki tarafından 100 uL eklenmesiyle hiPSCs ce. Diğer kuyular için, lentivirüs süspansiyon yerine 100 mcL 200 mcL, 300 uL, 400 uL ve 500 uL kullanın. 12 plaka iki kuyu hiPSCs transduse olmamalıdır; Onlar seçim sırasında kontrol olarak görev yapacak.
NOT: transdüksiyon verimliliği (protokol adım 2.2.4) seçimi başladıktan sonra daha doğru tahmin edilebilir, böylece transdüksiyon tercihen iki kopya halinde gerçekleştirilir. etkin bir şekilde hiPSCs çoğunluğu transdüksiyonu için gerekli olan lentivirüs süspansiyon miktarı lentivirüs süspansiyonu ve kullanılan hiPSC hattının titresi bağlıdır. hiPSCs transdüksiyona lentivirüs süspansiyon 500 ul - Bu çalışmada, genelde 100 kullanımı. - % 5 CO atmosferi ile nemlendirilmiş 37 ° C inkübatör içinde 12 gözlü plaka koyun6 saat boyunca 2. 6 saatlik inkübasyon süresi sona ermeden önce,% 1 (h / h), penisilin / streptomisin ve 12 sıcak 12 ml E8 ortamı oda sıcaklığına ml Dulbecco fosfat tamponlu tuz (DPBS). ROCK inhibitörü ile E8 orta tamamlar.
- harcanan E8 orta aspire. 1 mL DPBS ile de her bir yıkama. Her bir oyuğa hazırlanan E8 ortamının 1 ml. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 12 oyuklu plaka O / N yerleştirin.
- E8 orta Yenile (3 gün)
- Oda sıcaklığına% 1 (h / h), penisilin / streptomisin ile sıcak 12 ml E8 ortamı. 12 gözlü bir levhanın gözleri harcanan ortam aspire ve her bir hazırlanmış E8 ortamın 1 ml. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 12 oyuklu plaka O / N yerleştirin.
- Puromisin ve G418 (- 8 gün 4) ile seçim yapınız
NOT: Hip hücre bölünmesi oranına bağlı olarakkültürler bölmek gerekir bu noktada seçim dönemi boyunca% 80 confluency - SC hattı ve lentiviral transdüksiyon verimliliği, hücreler 70 ulaşabilir. bölme zamanlaması önceden tahmin edilemez, çünkü bu protokolde değinilmeyecektir. Bununla birlikte, bunun yerine puromisin ve G418 belirtilen konsantrasyonları ile takviye edilmiş E8 orta yenilemek, bir (vitronektin kaplı plakalar üzerinde kaplama hücreleri de dahil olmak üzere), normal hiPSC kültür olarak hiPSC kültürü ayırabilir. Bunun tek istisnası, E8 ve orta noktası devam antibiyotik belirtilen konsantrasyonları ile takviye edilmesi gerektiğidir.- Oda sıcaklığında% 1 (h / h), penisilin / streptomisin ile sıcak 12 ml E8 ortamı. seçim puromisin ve G418 ekleyin; antibiyotiklerin farklı miktarlarda ayıklanma periyodu (tabela 1) esnasında ilave edilir.
- G418- ve puromycin yüzdesini tahmin edilerek transdüksiyon etkinliğini tahmindayanıklı hücreleri. Dirençli bir hücre yüzdesi tahmin etmek için, farklı koşullar (lentivirüs süspansiyon farklı miktarları ile transduse kültürler) ölü hücrelerin yüzdesi (nonresistant hücreleri) tahmin etmek ve nontransduced hücreleri (bir seçme kontrol olarak hizmet hücreler) dir. [- (Ölü hücrelerin yüzdesi)% 100] olarak dirençli hücrelerin yüzdesini hesaplayın.
Not: lentivirüs süspansiyon farklı miktarları ile transdüksiyon iki kez gerçekleştirildi ise, transdüksiyon verimliliği daha doğru bir şekilde tahmin edilebilir. transdüksiyona hücreleri ile durumu seçim kontrolü olarak hizmet eder; lentivirüs süspansiyon farklı miktarları ile kalıt kültürleri için ölü hücrelerin yüzdesi, daha düşük olmalıdır. Dirençli bir hücre tahmini yüzdesi büyük olasılıkla Her iki transgen açısından pozitif olan hiPSCs seçmek için kullanılır. Genel olarak, hücrenin>% 90 iletim durumundan hiPSCs vardı seçims 5 d seçme dönemi hayatta. - hiPSCs harcanan aracı maddesi aspire ve çukurlara hazırlanan E8 ortamın 1 ml. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 12 oyuklu plaka O / N yerleştirin.
| G418 nihai konsantrasyonu | Puromycin nihai konsantrasyonu | |
| 4. gün | 250 ug / ml | 2 ug / ml |
| 5. gün | 250 ug / ml | 2 ug / ml |
| 6. gün | 250 ug / ml | 1 ug / ml |
| 7. gün | 250 ug / ml | 1 ug / ml |
| 8. gün | 250 ug / ml | 1 ug / ml |
Tablo 1: Seçim Döneminde Antibiyotiklerin konsantrasyonları. Seçim dönemi 5 gün boyunca puromycin ve G418 konsantrasyonları.
- Seçim durdurun ve düzenli kültürlenmesini (daha sonra gün 9 ve) başlatın
- Hücre E8 orta / ml ve puromisin ile bir nihai konsantrasyona kadar 50 ug bir son konsantrasyona kadar G418 ile desteklenmiş haricinde 5 d seçme süresi, normal hiPSCs olarak rtTA / Ngn2 pozitif hiPSCs, kültür, sonra 0.5 ug / mL.
NOT: Hücreler artık yedek olarak hizmet etmek (hücrelerin dondurulması için standart protokollere göre) dondurulabilir. Birçok gelecek farklılaşma deneyler için rtTA / Ngn2 pozitif hiPSCs aynı parti kullanımını sağlar, çünkü bu, farklılaşma protokolünün tekrarlanabilirlik için önemli bir adımdır.
- Hücre E8 orta / ml ve puromisin ile bir nihai konsantrasyona kadar 50 ug bir son konsantrasyona kadar G418 ile desteklenmiş haricinde 5 d seçme süresi, normal hiPSCs olarak rtTA / Ngn2 pozitif hiPSCs, kültür, sonra 0.5 ug / mL.
6-kuyu üzerinde nöronlar için rtTA / Ngn2 pozitif hiPSCs 3. FarklılaşmaÇÇA ve Cam Lameller
NOT: Bu protokol, ayrıntıları iki farklı yüzeylerde, yani 6-iyi ÇÇA ve cam lamelleri içinde (kuyu başına 9 kayıt ve 1 referans gömülü mikroelektrotla 6 bağımsız kuyuların oluşan cihazlar) üzerinde rtTA / Ngn2 pozitif hiPSCs ayrımında verilmektedir 24 gözlü bir levhanın gözleri. Protokoller, ancak kolayca yüzey alanına göre bahsedilen değerleri ölçekleme, (12 ya da 6-delikli plakalara için, örneğin) büyük yüzeyler için uyarlanabilir.
- ÇÇA ya da cam lamelleri (gün 0 ve 1) Hazırlama
- farklılaşma başlamasından bir gün önce, üreticinin tavsiyesine göre ÇÇA sterilize.
- yapışma proteini Poli-L-ornitin (PLO) aşırı saf, steril su içinde son konsantrasyon 50 ug / mL'ye seyreltilir. Coat 100 uL koyarak 6-iyi ÇÇA aktif elektrot alanıHer iyi seyreltilmiş FKÖ'nün bırakın. Steril cımbız kullanılarak 24 oyuklu plakanın kuyucuklarında lamelleri yerleştirin. her bir ile seyreltilmiş PLO 800 uL ekleyin. 1000 uL pipet ile onları iterek yüzen lamelleri önleyin.
- % 5 CO2 atmosferi ile 6 oyuklu ölçümü ve 24 plaka göre O / N nemlendirilmiş 37 ° C inkübatör inkübe edin. Ertesi gün, seyreltilmiş FKÖ'yü aspire. aşırı saf, steril su ile iki kez 6 oyuklu ÇÇA cam yüzeyleri ve lamelleri yıkayın.
- nihai (6-çukurlu ölçümü için), 20 ug / ml konsantrasyonda ve (cam lamelleri) 10 ug / ml soğuk DMEM / F12 laminin seyreltilir. Hemen kaplama her bir bir 100 uL damla yerleştirerek 6 oyuklu ÇÇA aktif elektrot alanı. Benzer şekilde, kat 24 oyuklu plakanın her bir ile seyreltilmiş laminin lamelleri 400 uL ekleyin. 1000 uL pipet ile onları iterek yüzen lamelleri önleyin.
- En az 2 saat boyunca% 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 6 oyuklu ölçümü ve 24 yuvalı plaka inkübe edin.
- HiPSCs Plate (gün 1)
Not: adımda 3.2.1 açıklanan miktarlar - 3.2.4 rtTA / Ngn2 pozitif hiPSCs 6 oyuklu plaka içerisinde kültürlenmiş olduğu ve bir kuyunun hücreler hasat varsayalım. 6-çukurlu ölçümü ve / veya lamelleri hücreleri kaplama için gerekli olan miktarlar 6 oyuklu ölçümü ve / veya deneyde kullanılan lamelleri sayısına sayısına bağlıdır; adımlarda 3.2.6 belirtilen numaraları - 3.2.8 farklı deney boyutları ölçekleme izin verir.- Sıcak DMEM / F12, CDS ve R / T% 1 (v / v) penisilin / streptomisin ile E8 orta. E8 ortamına son 4 ng / ml konsantrasyonda ve kaya inhibitörüne doksisiklin ekleyin.
- RtTA / Ngn2 pozitif hiPSCs harcanan orta aspire ve 1 m eklemekhiPSCs L CDS. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 5 dakika - 3 inkübe edin. Hücreler birbirlerinden ayrılmakta olup olmadığını mikroskop altında kontrol edin.
- nazikçe 1.000 uL pipet ile hücreleri askıya ve 15 ml tüp hücreleri aktarmak, kuyuda 2 ml DMEM / F12 ekleyin. Hücre süspansiyonuna 7 ml DMEM / F12 ekleyin. 5 dakika boyunca 200 xg'de hücreleri dönerler.
- Süpernatantı aspire ve hazırlanan E8 orta 2 mL ekleyin. 15 ml tüpün kenarına 1000 uL pipet ucu koyarak ve yavaşça yeniden süspansiyona alınmasıyla hiPSCs ayrıştırmaları. Hücreler ayrışmış olup olmadığını mikroskop altında kontrol edin.
- Bir hemositometre odasını kullanan hücreler (hücre / ml) sayısını belirler.
NOT: 80 de A 6-plaka - toplam 4,0 x 10 6 hücre -% 90 confluency tipik 3.0 verecektir. - seyreltilmiş laminin aspire. 6-çukurlu ölçümü için, CE elde etmek için hücreleri sulandırmak7.5 x 10 5 hücre / mL ll süspansiyonu. 6-çukurlu ÇÇA her çukuruna aktif elektrot alanı hücre süspansiyonunun 100 uL bir damla eklenerek hücreler plaka. Lamelleri için, 4.0 x 10 4 hücre / mL'lik bir hücre süspansiyonu elde etmek için hücreleri seyreltin. 24 oyuklu bir plakanın oyuklarına hücre süspansiyonu 500 ul ilave edilerek hücreler plaka.
Not: ÇÇA ilgili nihai hücre yoğunluğu lamelleri (Şekil 1 A ve B) daha yüksektir. Bu yüksek hücre yoğunluklu ağ aktivite uygun kayıt için gerekli olduğu bulunmuştur. Protokolde, sayılar deneyleri için optimum olduğu daha önce ortaya çıktı sağlanmaktadır. - 2 saat (Ölçüm) ya da O / N (24 boşluklu plaka) için% 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 6 oyuklu ölçümü ve 24 yuvalı plaka koyun.
- 2 saat sonra, dikkatli bir şekilde 6-çukurlu ÇÇA her oyuğuna hazırlanan E8 ortamının 500 uL ekleyin. 6-biz koyunO taraflı çevre LL /% 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde n.
- Orta değiştirmek (2 gün)
- Sonraki gün,% 1 (h / h), N-2 ek,% 1 (h / h) temel olmayan amino asitler ve% 1 (h / h), penisilin / streptomisin içeren DMEM / F12 hazırlar. Ekleme insan rekombinant nörotrofin-3 (NT-3) 4 ug bir son konsantrasyona kadar bir son 10 ng / ml'lik bir nihai konsantrasyona kadar 10 ng / ml insan rekombinant beyin türevli nörotrofik faktör (BDNF) konsantrasyonu ve doksisikline / ml. 37 ° C'ye kadar ortam ısıtın.
- ortama 0.2 ug / ml'lik bir nihai konsantrasyona kadar laminin ekleyin. Elde edilen orta filtre. 6-çukurlu ÇÇA kuyulardan harcanan orta ve 24 oyuklu plaka aspire ve hazırlanan ortam maddesi ile değiştirin. % 5 CO2 atmosferi ile 6 oyuklu ölçümü ve 24 plaka göre O / N nemlendirilmiş 37 ° C inkübatör inkübe edin.
- Sıçan astrositler ekleyin (3 gün)
NOT: Bu protokolde belirtilen hacimleri sıçan astrositler T75 kültür şişelerinde kültüre olduğunu varsayıyorum. Kültürlere ilave edilir sıçan astrositler iyi kalitede olmasını önemlidir. Biz sıçan astrositler kaliteli olup olmadığını kontrol etmek için iki kriter kullanın. İlk olarak, sıçan astrosit kültürü sıçan embriyonik beyinleri izolasyon sonra on gün içinde konfluent büyümek gerekir. İkinci olarak, sıçan astrosit kültürü ayrıldıktan sonra, sıçan astrositler konfluent, baklava tek tabaka (Şekil 1C) oluşturmak için mümkün olmalıdır. Sıçan astrosit kültürü bu iki kriterleri yerine getirmez ise, biz farklılaşma deneyleri için bu kültürü kullanmamanızı öneririz.- Oda sıcaklığına kadar ısınmaya% 0.05 tripsin-EDTA. 37 ° C'de% 1 (h / h), penisilin / streptomisin DPBS ve DMEM / F12 ısıtın.
- Sıçan astrosit kültürü harcanan orta aspire. 5 ml DPBS ekleyerek kültür yıkayın ve çevresinde yavaşça homoseksüel.
- AspirDPBS yedi ve 5 mL% 0.05 tripsin-EDTA ekleyin. etrafında yavaşça tripsin-EDTA homoseksüel. 10 dakika - 5 5% CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde inkübe edin.
- Hücreler müstakil olup olmadığını mikroskop altında kontrol edin. Şişe bir kaç kez vurarak son hücreleri ayırmak.
- şişeye DMEM / F12 5 mL ekleyin. 10 ml pipet ile balon içerisinde hafifçe hücreleri çiğnemek. 15 ml bir tüp içinde bir hücre süspansiyonu toplanır. 8 dakika boyunca 200 xg'de tüp Spin.
- Süpernatant aspire ve DMEM / F12 1 mL tekrar süspansiyon hücreleri. Bir hemositometre odasını kullanan hücreler (hücre / ml) sayısını belirler.
- 6-çukurlu ÇÇA oyuk başına 7.5 x 10 4 astrositler ekleyin. 24 çukurlu levha başına 2.0 x 10 4 astrositler ekleyin. / N,% 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde ölçümü ve 24 oyuklu plaka O inkübe edin.
- Orta değiştirmek (gün 4)
- % 2 (hac / hac) B-27 takviyesi,% 1 (h / h) L-alanil-L-glutamin ve% 1 (h / h), penisilin / streptomisin ile, Neuro temelli vasat hazırlayın. 4 mg / ml bir son konsantrasyona kadar 10 ng / mL ve doksisiklin nihai bir konsantrasyona kadar 10 ng / mL, BDNF nihai konsantrasyona NT-3 ekle. Buna ek olarak, 2 uM bir konsantrasyona sitozin β-D-arabinofuranosid ekleyin.
Not: Sitosin β-D-arabinofuranosid astrosit proliferasyonunu inhibe ettiği ve nöronlara ayırt ancak geriye kalan hiPSCs öldürmek için ortama ilave edilir. - 37 ° C'ye kadar ortam ve sıcak filtre. 6-çukurlu ÇÇA kuyulardan harcanan orta ve 24 oyuklu plaka aspire ve hazırlanan ortam maddesi ile değiştirin. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 6 oyuklu ölçümü ve 24 oyuklu plaka koruyun.
- % 2 (hac / hac) B-27 takviyesi,% 1 (h / h) L-alanil-L-glutamin ve% 1 (h / h), penisilin / streptomisin ile, Neuro temelli vasat hazırlayın. 4 mg / ml bir son konsantrasyona kadar 10 ng / mL ve doksisiklin nihai bir konsantrasyona kadar 10 ng / mL, BDNF nihai konsantrasyona NT-3 ekle. Buna ek olarak, 2 uM bir konsantrasyona sitozin β-D-arabinofuranosid ekleyin.
- Orta Yenile (gün 6-28)
NOT: 6 gün başlayarak, yarım yenilemeorta her iki gün. günden sonra 10, orta astrosit canlılığını desteklemek için FBS ile takviye edilmektedir.- % 2 (v / v) B-27 takviyesi,% 1 (h / h) L-alanil-L-glutamin ve% 1 (h / h), penisilin / streptomisin ile, Neuro temelli vasat hazırlayın. 4 mg / ml bir son konsantrasyona kadar 10 ng / mL ve doksisiklin nihai bir konsantrasyona kadar 10 ng / mL, BDNF nihai konsantrasyona NT-3 ekle. 10. günde başlayarak kaynaktan da% 2.5 (h / h) FBS ile orta tamamlar. 37 ° C elde edilen orta ve sıcak filtre.
- 6-çukurlu ÇÇA oyuklarına ve 1000 uL pipet kullanılarak 24 oyuklu plaka harcanan ortamın yarısı çıkarın ve hazırlanmış ortam ile değiştirin. % 5 CO2 atmosferi olan nemlendirilmiş bir 37 ° C kuluçka makinesi içinde 6 oyuklu ölçümü ve 24 oyuklu plaka koruyun.
4. hiPSC türetilmiş Nöronlar nörofizyolojik Profili oluşturulması
NOT: in sonra iki üç haftafarklılaşma duction, hiPSC türetilmiş nöronlar, farklı alt analizler için de kullanılabilir. Bu bölümde bazı alt analizlerin örnekleri hiPSC türetilen nöron nörofizyolojik profilini belirlemek için yapılabilir olduğu verilmiştir.
- ÇÇA kullanarak nöronal ağ etkinliğini karakterize
- ÇÇA kültüre hiPSC türetilen nöron elektrofizyolojik aktivite Telaffuz 20 dakika. Kayıt esnasında, 37 ° C'de sıcaklığı korumak ve MEA üzerinde nemli gaz (% 5 CO2,% 20 O2,% 75 N2) sabit bir yavaş akış şişirilerek ortamın buharlaştırılması ve pH değişiklikleri önlemek .
- 1200X büyütme (MEA 1060, MCS) sonra, MCS veri toplama kartı kullanarak 10 kHz sinyal örnek. Özel bir yazılım paketi 23 kullanarak verileri (başak ve patlama algılama) analiz.
- Tek hücreli elektrofizyolojik aktiviteyi karakterize
- dik bir mikroskop bir dalgıç sabit aşamalı kayıt odasına hiPSC-türetilen nöron hücreleri ihtiva eden kapak slipi aktarın. Spontan aksiyon potansiyeli-uyarılmış postsinaptik akımlar (sEPSC) 24 rekor 20 dk. sinirbilimsel programını kullanarak sinaptik etkinliği algıla.
- Nöronal morfoloji ve synapsin ifade karakterize
- Fix ve map2 için hiPSC türetilmiş nöronlar leke, synapsin-1/2, ve 22, 24, 25 PSD-95. Görüntü analiz yazılımı kullanılarak synapsin-1/2 ve PSD-95 puncta sayısını ölçmek.
Sonuçlar
Burada başarılı hiPSCs transkripsiyon faktörü neurogenin-2 üzerinde 12 salgılayan kortikal nöronlar doğrudan farklılaşmış olan bir protokol yapılması ve biz ÇÇA kullanımı için adapte edilmiştir. Bu yaklaşım, hızlı ve bize farklılaşma indüksiyon sonrası üçüncü haftasında zaten fonksiyonel nöronlar ve ağ etkinliğini elde etmek için izin etkilidir.
Farklılaşma protokolü sırasında, hücreler morfolojik nöronlar benzemeye başladı: küçük süreçler oluşturulmuş ve nöronlar birbirlerine (Şekil 1A) bağlanırken başladı. Bu gelişme sırasında nöronal morfoloji ve sinaptik özelliklerini ölçerek, sağlıklı kontrol hiPSC hattından türetilen nöron nörofizyolojik profilini oluşturmuştur. hiPSC türetilen nöron başlangıç takip eden farklı günlerde MAP2 ve synapsin-1/2 için boyandıfarklılaşma (Şekil 2A). türetilmiş nöronlar 3 hafta farklılaşma indüksiyon sonrası zaten olgun nöronal morfoloji göstermektedir. sinapsin-1/2 puncta (sinaps sayısı için bir ölçü) sayısı synapsin-1/2 immünositokimya boyamalar göre ölçülmüştür. Sinapsin-1/2 puncta sayısı nöronal bağlantı düzeyi de (Şekil 2B) artmakta olduğunu göstermektedir, zamanla artmıştır. 23 gün farklılaşmasının indüksiyonu sonrasında sinapsin-1/2 puncta sayısı iki bağımsız IPS hatları (Şekil 2C) benzerdi. 23. En DIV synapsin1 / 2 puncta fonksiyonel sinaps (Şekil 2D) göstermektedir PSD-95 puncta, bitişik edildi.
Zhang ve arkadaşları tarafından tarif edilen sonuçlarla tutarlıdır. Biz pan nöronal ve alt tip spesifik kortikal m teyit uyarıcı üst katman kortikal nöronlar popülasyonu oluşturulur Bu BRN2 ve SATB2 olarak arkers (katman II / III). Biz derin katman nöronların CTIP2 (katman V) ya da Foxp2 (katman VI) (Şekil 2E ve F) için pozitif nöronlar dikkat etmedi
HiPSC türetilen nöron elektrofizyolojik aktivite karakterize etmek için, geliştirme sırasında ölçüldü bu nöronlar üzerinde bütün hücre akımı ve gerilim kelepçe kayıtları, örneğin, iç özellikleri ve heyecanlandırıcı girişleri kullanılmıştır. Nöronlar farklılaşma ve hücre spike yüzdesinin zaman (Şekil 2G ve H) üzerinden artan sonra zaten bir hafta aksiyon potansiyelleri oluşturmak başardık. Ayrıca, nöronlar farklılaşmanın başlaması bir hafta sonra zaten uyarıcı sinaptik girdi aldı: uyarıcı sinaptik girdi hem frekans ve genlik gelişimi sırasında (Şekil 2I - K) arttı.
nt "fo: = keep-together.within-sayfa" 1 "> daha tek hücre etkinliği ağ düzeyinde fonksiyonlarını oluşturacak şekilde birleştirir nasıl anlamak için, nöronlar uyum içinde nasıl çalıştığını incelemek için esastır ÇÇA üzerinde in vitro nöronal ağlar kültür. nöronal dinamiklerini incelemek için değerli bir deneysel model oluşturmaktadır. Biz 6-kuyu ÇÇA (Şekil 2M) kültüre sağlıklı kontrol hiPSC hattından elde edilen nöronların elektrofizyolojik ağ etkinliğinin 20 dakika kaydedildi. Birkaç hafta farklılaşmasının indüksiyon sonrası, nöronlar . sağlıklı kontrol hiPSCs türetilen spontan olaylar (0.62 ± 0.05 başak / s Şekil 2N) gösteren fonksiyonel olarak aktif nöron ağları oluşturulmuştur (yani 16 d farklılaşma başladıktan sonra) gelişme bu aşamada tüm kanallar ilgilendiren bir senkron olaylar . ÇÇA (Şekil 2O) tespit edilir ağ aktivite düzeyi gelişimi sırasında artmış: t sonra dördüncü haftasında (Şekil 2N 2.5 ± 0.1 başak / s) cihazının tüm kuyularda farklılaşmanın o indüksiyon, nöronal ağlar spontan aktivite yüksek düzeyde gösterdi. Uzun süreli ağları da sergilenen senkron ağ patlamaları (4.1 ± 0.1 patlama / dk Şekil 2O) (2100 ± 500 ms).
Şekil 1: Nöronlar içine hiPSC Farklılaşma. Lamelleri nöronların içine hiPSCs farklılaşma A. Üç kez puan. ÇÇA üzerinde hiPSCs B. Kaplama. C. Astrositler T75 şişesi içinde% 100 birbirine karıştığında (hücreler baklava tek tabaka oluşturur dikkat edin). Ölçek çubukları: 150 um. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
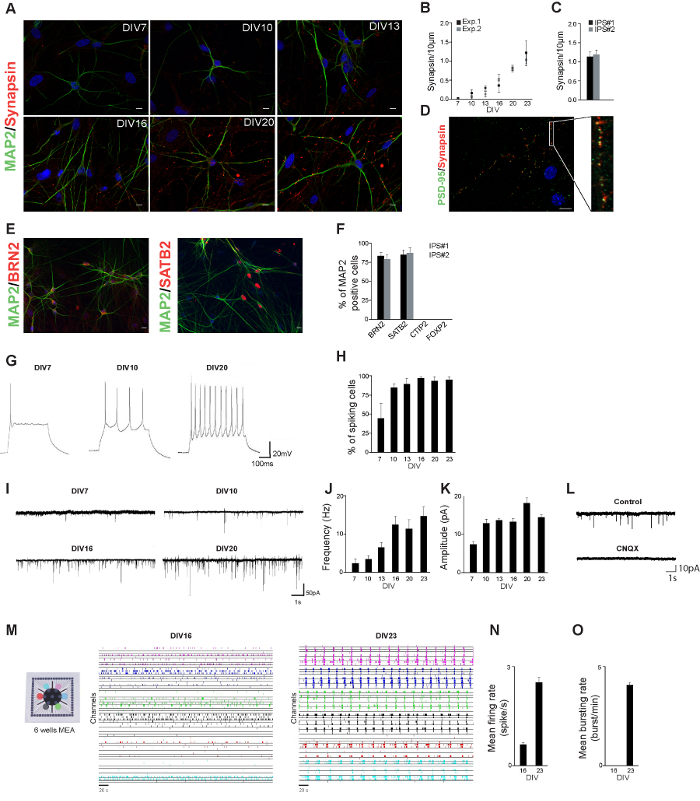
Şekil 2. Nöronlar Karakterizasyonu hiPSC türevi. C. hiPSC türetilen nöron farklılaşma başladıktan sonra MAP2 (yeşil) ve synapsin-1/2 (kırmızı), farklı günlerde için boyandı. Ölçek çubuğu: 10 mikron. İki bağımsız deneyde sinapsin puncta B. miktarının belirlenmesi. Her bir deney en az 10 hücre analiz edilmiştir. Iki bağımsız IPS çizgilerinden türetilen nöronlarda DIV23 de sinapsin puncta C. miktarının belirlenmesi. D. hiPSC türetilen nöron PSD-95 (yeşil) için boyandı ve synapsin-1/2 (kırmızı) 23 gün farklılaşma başladıktan sonra bulundu. Synapsin puncta PSD-95 puncta bitişik olduğundan. E. hiPSC türetilmiş nöronlar MAP2 (yeşil) ve BRN2 (kırmızı) veya SATB2 (kırmızı) farklılaşma başlamasından sonra 23 gün süreyle boyandı. Map2 pozitif hücrelerin F. yüzdesi obelirtilen belirteçler için pozitifti. Bu aksiyon potansiyeli gösteren G. Örnek mevcut kelepçe kayıtları gibi erken farklılaşma başladıktan sonra 7 gün olarak oluşturulabilir. Bir veya daha fazla aksiyon potansiyelleri göstermektedir farklılaşmanın başlaması takip eden farklı günlerde hücreler H. yüzdesi. I. farklılaşma takip eden farklı günlerde hiPSC türetilen nöron tarafından alınan eksitatuvar postsinaptik akımlar (EPSCs) temsil eden iz. Gelişimi sırasında eksitatuvar postsinaptik akımlar J. sıklığı. Gelişimi sırasında eksitatuvar postsinaptik akımlar K. genliği. L. Temsilcisi (kontrol) olmadan ve CNQX (CNKX) ile EPSC kayıtları izler. Bir hiPSC çizgisinden türetilen M. Nöronlar 6 oyuklu MEA kültürlendi ve ağ etkinliği hiPSC türetilmiş nöronal ağlar 16 ve farklılaşmasının indüksiyonu sonrasında 23 gün boyunca gösterilmektedir. kaydedilen aktivitesiher bir (10 kHz'lik örnekleme oranı), farklı bir renk ile belirtilir (kayıt 20 dakika 5 dakika gösterilmiştir). N. Atış hızı 16 ve farklılaşma indüksiyon sonrası 23, d. O. Patlama hızı 16 ve farklılaşma indüksiyon sonrası 23, d. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
sonuçlar göz önüne alındığında, elde edilen hiPSC türetilen nöron kalitesi hücre nörofizyolojik profil verme ile değerlendirilebilir. Bu üç ila dört hafta değerlendirilebilir farklılaşma, morfoloji, sinapsin-1/2 ekspresyonu ve nöronların elektrofizyoloji başlamasından sonra vardır. Bu zaman noktasında, hiPSC türetilmiş nöronlar MAP2, sinapsin / PSD-95 pozitif performans immünsitokimya için, nöronal benzeri morfoloji gösteren ve sergisi beklenmektedirt spontan elektrofizyolojik aktivite (her ikisi de tek hücre ve ağ düzeyinde).
Tartışmalar
Burada Zhang ve arkadaşları tarafından yayınlanan verimli bir hiPSC-farklılaşma protokolü hayata geçirdik. ÇÇA üzerinde hiPSC türetilmiş nöral ağların ağ etkinliğini ölçmek için (2013) 12. Biz nöronal farklılaşma indükleyici önce rtTA / Ngn2 pozitif hiPSC hattı oluşturarak orijinal protokol uyarladı. Bu ek adım bize MEA nöronal hücre yoğunluğunu kontrol etmenizi sağlar. nöronal yoğunluğu üzerinde kontrol ÇÇA protokolü uyarlanması için ve tutarlılık sağlanması için önemli bir ön koşul oldu. ÇÇA kullanarak nöron ağları aktivitesini ölçmek için, nöronlar doğrudan MEA elektrotlar 17,18 üstünde yoğun ağları oluşturmak gerekir. Bu mutlaka nöronların kaplama yoğunluğu üzerinde sıkı kontrol gerektirir. RtTA / Ngn2 pozitif hiPSC hattı bu taktik önce farklılaşmasına hiPSCs akut lentiviral transdüksiyon dayanmaz çünkü nöron yoğunluğu kontrolü sağlar;rtTA / Ngn2 pozitif hiPSC hattı, bu nedenle neredeyse örneğin, lentiviral toksisite ve değişken enfeksiyon verimliliği için, nedeniyle son verimle herhangi bir değişiklik ortadan kaldırır.
Deneysel işlemin bir diğer kritik adım ayırt hiPSCs ile kültive edilir sıçan astrositlerin sayısıdır. Astrositler aktif nöronal işleyişi için önemli süreçlerdir hepsi sinaps oluşumunu, bakım ve ortadan kaldırılması, kontrol ederek nöral devreleri geliştirme arıtma katkıda bulunur. Bu çalışmada sunulan protokol yüksek astrosit bağlıdır: tamamen olgun ve işlevsel sinaps oluşturmak için, nöronlar astrositler gelen desteği gerektirir. Bu astrositler sayısı nöronların olgunlaşmasını ve spontan aktivite sergileyen nöronal ağların formasyonunu destekleyecek hiPSC türetilmiş nöronların sayısı kabaca eşit olmalıdır yaşadı. Bizim astrosit protokol verimleri primer hücre cul yanasınırlı bir ömrü olan lar, sıçan astrositler izolasyonu düzenli yapılmalıdır.
Zhang ve arkadaşları tarafından yayınlanan bir protokolün Bizim adaptasyonu. (2013) 12 MEA teknolojisi ile kullanım için muhtemelen önemli ölçüde hiPSC türetilmiş ağların ağ etkinliğini incelemek için yeteneğimizi artıracak. Daha önce, ÇÇA ile hiPSC türetilmiş nöron ağları çalışmak için kullanılan protokoller zaman alıcı farklılaşma prosedürleri 13-16 dayanmıştır. Zhang ve ark protokol. (2013) hızlı bir alternatif sağlar, ve modifikasyonu şimdi daha uygun özellikle yüksek verim ya da farmakolojik çalışmalarda, MEA teknolojisi ile kombinasyon halinde hiPSC türetilmiş nöronlar kullanımı kolaylaştırır değişkenlik kaynağı kaldırılır. Buna ek olarak, çünkü Zhang ve arkadaşları tarafından yayınlanan metot. (2013) 12 üst katman kortikal nöronların homojen bir nüfus, bizim uyarlanmış protokolü ağ a içine mümkün odaklı çalışmalar yapan verimleriBu özel nöron alt kümesinin ctivity.
Bununla birlikte, bu yaklaşım aynı zamanda çeşitli sınırlamalara sahiptir. Kültürler nöron farklı sınıfları (örneğin, baskılayıcı ve uyarıcı nöronlar) heterojen bir ağ oluşturan in vivo şebekesinde benzer daha az olduğu için İlk olarak, kültürlerin homojenliği da bir dezavantaj olarak kabul edilebilir. ayrıca MEA teknolojisi ile hiPSC türevli nöronların kullanımını artırmak için, diğer nöronal hücre popülasyonları için hızlı (transgen tabanlı) farklılaşma protokolleri geliştirmek için önemli olacaktır. Protokoller kullanılabilir hale varsa, in vitro ağları daha yakından in vivo ağları taklit ediyorum. İkinci olarak, bu fare astrositler büyüme destek hiPSC türetilen nöron eklenmelidir ve bu nedenle elde edilen nöronal ağ, bir insan nöronal ağ dar anlamda değildir. Gelecekteki sol astrositlerin olabilir içine hiPSCs ayırt etmek için güvenilir protokollerBu sorunu 26 ettik. Burada tarif edildiği gibi Üçüncü olarak, iki boyutlu bir nöronal ağlar, karmaşık üç boyutlu, in vivo nöronal ağlar çalışmak için sınırlı bir model vardır. Neyse ki, MEA teknolojisi ile birlikte de farelerin primer nöron üç boyutlu kültürleri açıklayan protokolleri 27,28 zaten mevcuttur. Prospektif, üç boyutlu kültür teknikleri ve MEA teknolojisi ile hiPSC türevli nöronlar ve astrositler elde etmek için hızlı farklılaşma protokolleri kombinasyonu biyolojik mekanizmaları altta yatan nörolojik bozukluklar içine yeni fikir vermelidir.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors thank Jessica Classen for performing the whole-cell patch-clamp experiments. The hiPSCs used in our experiments were kindly provided by Huiqing Zhou and Willem van den Akker from the Radboud University Nijmegen. The transfer vectors used in this protocol were kindly provided by Oliver Brüstle, Philipp Koch and Julia Ladewig from the University of Bonn Medical Centre.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Lebovitz's L-15 medium | Gibco | 11415-064 | |
| B-27 supplement | Gibco | 0080085SA | |
| Poly-D-Lysine (PDL) | Sigma-Aldrich | P6407 | |
| Ca2+/Mg2+-free HBSS | Gibco | 14175-095 | |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | |
| 2.5% Trypsin | Gibco | 15090-046 | |
| High-glucose DMEM | Gibco | 11965-092 | |
| FBS (Fetal Bovine Serum) | Sigma-Aldrich | F2442-500ML | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| 70 µm cell strainer | BD Falcon | 352350 | |
| DPBS | Gibco | 14190-094 | |
| psPAX2 lentiviral packaging vector | Addgene | Plasmid #12260 | |
| pMD2.G lentiviral packaging vector | Addgene | Plasmid #12259 | |
| Basement membrane matrix | Gibco | A1413201 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Cell detachment solution | Sigma-Aldrich | A6964 | |
| E8 medium | Gibco | A1517001 | |
| ROCK inhibitor | Gibco | A2644501 | Alternatively, ROCK inhibitors like thiazovivin can be used. |
| Polybrene | Sigma-Aldrich | H9268-5G | |
| G418 | Sigma-Aldrich | G8168-10ML | |
| Puromycin | Sigma-Aldrich | P9620-10ML | |
| Vitronectin | Gibco | A14700 | |
| 6-well MEAs | Multi Channel Systems | 60-6wellMEA200/30iR-Ti-tcr | |
| Glass coverslips | VWR | 631-0899 | |
| Poly-L-Ornithine (PLO) | Sigma-Aldrich | P3655-10MG | |
| Laminin | Sigma-Aldrich | L2020-1MG | |
| Doxycyclin | Sigma-Aldrich | D9891-5G | |
| N-2 supplement | Gibco | 17502-048 | |
| Non-essential amino acids | Sigma-Aldrich | M7145 | |
| NT-3, human recombinant | Promokine | C66425 | |
| BDNF, human recombinant | Promokine | C66212 | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| L-alanyl-L-glutamine | Gibco | 35050-038 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Cytosine β-D-arabinofuranoside | Sigma-Aldrich | C1768-100MG | |
| Straight fine-tipped forceps | Fine Science Tools | 11251 | |
| Fine-tipped spring scissors | Fine Science Tools | 91500-09 |
Referanslar
- Ahfeldt, T., Litterman, N. K., Rubin, L. Studying human disease using human neurons. Brain Res. , (2016).
- Zhang, S. C., Wernig, M., Duncan, I. D., Brustle, O., Thomson, J. A. In vitro differentiation of transplantable neural precursors from human embryonic stem cells. Nat Biotechnol. 19 (12), 1129-1133 (2001).
- Perrier, A. L., et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proc Natl Acad Sci USA. 101 (34), 12543-12548 (2004).
- Wu, H., et al. Integrative genomic and functional analyses reveal neuronal subtype differentiation bias in human embryonic stem cell lines. Proc Natl Acad Sci USA. 104 (34), 13821-13826 (2007).
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P., Tomishima, M., Sadelain, M., Studer, L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7, 1836-1846 (2012).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Johnson, M. A., Weick, J. P., Pearce, R. A., Zhang, S. C. Functional neural development from human embryonic stem cells: accelerated synaptic activity via astrocyte coculture. J Neurosci. 27 (12), 3069-3077 (2007).
- Hu, B. Y., et al. Neural differentiation of human induced pluripotent stem cells follows developmental principles but with variable potency. Proc Natl Acad Sci USA. 107 (9), 4335-4340 (2010).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8 (6), 695-706 (2011).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Saitoh, Y., Alhebshi, A. H., Gotoh, M., Suzuki, I. Long-term electrophysiological activity and pharmacological response of a human induced pluripotent stem cell-derived neuron and astrocyte co-culture. Biochem Biophys Res Commun. 443 (4), 1176-1181 (2014).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Sci Rep. 6, 26181 (2016).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Front Neurosci. 10, (2016).
- Heikkila, T. J., et al. Human embryonic stem cell-derived neuronal cells form spontaneously active neuronal networks in vitro. Exp Neurol. 218 (1), 109-116 (2009).
- Massobrio, P., Massobrio, G., Martinoia, S. Multi-program approach for simulating recorded extracellular signals generated by neurons coupled to microelectrode arrays. Neurocomputing. 70, 2467-2476 (2007).
- Wang, L., Riss, M., Buitrago, J. O., Claverol-Tinturé, E. Biophysics of microchannel-enabled neuron-electrode interfaces. J Neural Eng. 9 (2), (2012).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J. Vis. Exp. (71), e50079 (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J Vis Exp. (63), e3965 (2012).
- Ba, W., et al. ARHGAP12 functions as a developmental brake on excitatory synapse function. Cell Rep. 14 (6), 1355-1368 (2016).
- Bologna, L. L., et al. Investigating neuronal activity by SPYCODE multi-channel data analyzer. Neural Netw. 23 (6), 685-697 (2010).
- Ba, W., et al. TRIO loss of function is associated with mild intellectual disability and affects dendritic branching and synapse function. Hum Mol Genet. 25 (5), 892-902 (2016).
- Benevento, M., et al. Histone methylation by the Kleefstra syndrome protein EHMT1 mediates homeostatic synaptic scaling. Neuron. 91 (2), 341-355 (2016).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature biotechnology. 29 (6), 528-534 (2011).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Sci Rep. 4, 5489 (2014).
- Tedesco, M., Frega, M., Martinoia, S., Pesce, M., Massobrio, P. Interfacing 3D engineered neuronal cultures to micro-electrode arrays: an innovative in vitro experimental model. J Vis Exp. (104), e53080 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır