Method Article
マイクロ電極アレイ上のネットワーク・アクティビティを測定するための人工多能性幹細胞の急速な神経分化
* これらの著者は同等に貢献しました
要約
私たちは、興奮性皮質ニューロン12に人間の人工多能性幹細胞(hiPSCs)の、迅速な再現性、および効率的な分化を説明以前に公開されたプロトコルを変更して実施します。具体的には、私たちの修飾は、神経細胞の密度の制御を可能にし、ネットワークレベルでの電気生理学的特性を測定するために微小電極アレイ上で使用します。
要約
人間の人工多能性幹細胞(hiPSCs)由来のニューロンは、神経疾患を研究するための有望な新しいツールを提供しています。過去十年間では、ニューロンへhiPSCsを区別するための多くのプロトコルが開発されています。しかし、これらのプロトコルは、多くの場合、高い変動、低再現性、および低効率と遅いです。また、これらのプロトコルを用いて得られたニューロンは、多くの場合、未成熟であり、ニューロンは、数ヶ月のために培養される場合を除き、単一細胞とネットワークの両レベルで十分な機能活性を欠いています。部分的に起因するこれらの制限のために、hiPSC由来の神経回路網の機能特性は、まだ十分に特徴付けられていません。ここでは、転写因子ニューロゲニン-2 12の強制発現によってhiPSCsからのヒトの神経細胞の産生を記載し、最近公開されたプロトコルに適合させます。このプロトコルは、transducのほぼ100%の変換効率で、迅速な(3週間以内に成熟ニューロンを生じる)と効率的ですED細胞(> DAPI陽性細胞の95%であるMAP2陽性)。さらに、プロトコルは、神経疾患への細胞型特異的な貢献の調査を可能にする興奮性ニューロンの均一な集団を生成します。私たちは私たちに、ニューロンの総数を明示的に制御を与え、安定的に形質導入されたhiPSC細胞を生成することにより、元のプロトコルを変更しました。次いで、これらの細胞を微小電極アレイ上hiPSC由来神経回路網を生成するために使用されます。細胞密度の観点から実験間の一貫性を保持しつつ、このようにして、hiPSC由来の神経回路網の自発電気活動を測定し、特徴付けることができます。提示されたプロトコルは、特にヒト神経ネットワーク上の機序および薬理学的研究のために、広く適用可能です。
概要
in vitroでのヒト神経細胞を生成するために、人間の人工多能性幹細胞(hiPSCs)の開発分化プロトコルは、神経疾患を研究するための強力な新しいツールを提供しています。最近まで、これらの疾患の研究は厳しく、人間の神経細胞を用いたモデルシステムの欠如によって妨げられました。げっ歯類の神経疾患を研究するために使用することができるが、そのような試験の結果は、ヒト1に容易に変換することができません。これらの制限を考えると、hiPSC由来のニューロンは、神経学的障害の根底にある分子メカニズムを解明し、インビトロ薬剤スクリーニングのためにするために使用することができる有望な代替モデルです。
過去十年間では、ニューロンへhiPSCsを変換するには、いくつかのプロトコルが2-8を開発されてきました。しかし、これらのプロトコルは、依然として多くの方法で制限されています。まず、プロトコルは、多くの場合、時間がかかる:( すなわち synap十分な成熟と神経細胞を生成しますSE形成)および機能的活性は、9困難な大規模な研究をレンダリングする培養手順、数ヶ月を必要とします。また、hiPSC対のニューロンの変換効率が低いです。プロトコルは、多くの場合、神経細胞の異種集団を得、従って、神経細胞の特定のサブセットの研究を許可していません。また、プロトコルが異なるIPSCライン10,11のために異なる結果をもたらす、再現性がありません。最後に、成熟段階と、得られた神経細胞の機能的特性はまた、10の変数です。
これらの問題に対処するために、Zhang ら。 (2013)12を迅速かつ再現ニューロゲニン-2転写因子を過剰発現させることによってhiPSCsからのヒトの神経細胞を生成するプロトコルを開発しました。ニューロンの特性は、複数の独立している( - (3週間ニューロゲニン-2の発現を誘導した後にのみ2)、プロトコルが再現可能である著者によって報告され、分化が比較的迅速に発生しますhiPSCライン)をtarting、およびhiPSCツーニューロンの変換は(ほぼ100%)は非常に効率的です。そのプロトコルで生成された神経細胞の集団は、神経疾患への細胞型特異的な貢献の調査を可能にすること、(上位層皮質ニューロンに似ている)均質です。さらに、彼らのhiPSC由来のニューロンは、わずか20日後に成熟した性質(シナプスと堅牢な機能活性を形成するために、 例えば 、能力)を示しました。
hiPSC技術は、ヒト疾患の研究のために利用することができる前に、ネットワークレベルでhiPSC由来の神経細胞の電気生理学的特性を特徴づけることは、重要な前提条件です。この理由のため、多くの研究グループは、最近、マイクロ電極アレイ(MEA)装置(マルチチャンネルシステムズ、ロイトリンゲン、ドイツ)13-16を用いて、ネットワークレベルで幹細胞由来のニューロンを研究し始めました。 MEAの電極は、神経細胞を培養することが可能な基板内に埋め込まれています。MEAは、神経回路網の電気生理学的特性およびその活性のインビトロでの発達を調査するために使用することができます。現在、のMEAは、成熟したネットワークを生成するために数ヶ月を要する分化プロトコルと組み合わせて使用されます。したがって、迅速な分化プロトコルでのMEAを組み合わせて、神経障害の大規模な研究で、この技術の使用を容易にすべきです。
ここでは、Zhang らの変更を提示します。 (2013年)12プロトコルとのMEA上で使用するためにそれを適応させます。具体的には、むしろ急性レンチウイルス形質導入に頼るよりも、我々は代わりに安定的に分化を誘導する前のrtTA / Ngn2を表現hiPSCラインを作成しました。我々は、神経細胞の密度は、神経ネットワーク形成のための、および神経細胞およびMEA 17,18の電極間の良好な接触のために重要であるため、主に、神経細胞密度にわたって再現可能な制御を持つようにこれをしました。 Althoug時間Zhang ら。プロトコルは、形質導入hiPSCsの変換に関して非常に効率的である、それは最初は12(Zhang らに図2Eを参照してください)メッキhiPSCsの数からニューロンの最終収率に関して本質的に可変です。安定したラインで、我々はこのようなレンチウイルスの毒性と感染効率などの変動を引き起こす多くの問題を、排除します。私たちは、その後、第3週することで、ネットワークの成熟( 例えば 、チャネルの大部分を含む同期イベント)を得、確実にMEAの上hiPSC由来の神経回路網を生成するパラメータを最適化しました。この迅速かつ信頼性の高いプロトコルが異なる( すなわち、患者特異的)hiPSCラインだけでなく、薬理学的研究のための強固な一貫性を提供由来ニューロン間の直接比較を有効にする必要があります。
プロトコル
動物実験はすべてラートボウト大学医療センター、オランダ、(:77073 RU-DEC-2011から021、プロトコル番号)、動物管理委員会の承認を受け、動物の管理と使用ガイドラインに従って実施しました。
1.グリア細胞の単離および培養
注:ここで紹介するプロトコルは、マッカーシーとデVellis 19の作業に基づいて、マウスのアストロサイトのために非常に類似した詳細なプロトコールは20利用可能です。胚(E18)ラットの脳から皮質星状細胞の初代培養物を生成するために、妊娠中のラットを屠殺する必要があり、胚を子宮から採取する必要があり、脳の胚から単離する必要があります。 T75フラスコを埋めるために、2胚の脳からの皮質を結合する必要があります。代替として、市販の精製及び凍結アストロサイトは、購入することができます。
- T75培養フラスコを準備
- 希釈ポリ-D-リジン(PDL)で10μg/ mLの最終濃度に滅菌超純水。 T75培養フラスコに希釈したPDLの5ミリリットルを追加します。全体の成長表面を濡らすことの周りに優しく振ります。 3時間加湿37℃インキュベーターにフラスコを置きます。
- フラスコからPDLを吸引。結合していないPDLを削除するには、5 mLの滅菌水でフラスコ3回すすいでください。完全に水を吸引。層流フードまたは直ちに使用中で乾燥さフラスコを残します。
- 皮質の解剖
- 2%(v / v)のB-27サプリメントとLebovitzのL-15培地:50mLの解剖媒体を準備します。氷の上に保管してください。
- ( - 8分〜5)呼吸が止まるまで誘導室(小プレキシグラスボックス)にイソフルランで深くラットを麻酔。誘導チャンバーからラットを外し、すぐに頸椎脱臼により安楽死させました。
- 70%EtOHでラットの腹部をスプレーし、過剰分を拭き取ります。帝王切開secti経由ダムから子宮を露出し、削除はさみ21のペアを使用して上。
- 、はさみで自分の羊膜嚢から個々の胚をカット冷たい解剖媒体で満たされた無菌のペトリ皿に移し、氷上に保ちます。
- 冷たい解剖媒体で満たされた新しい、滅菌6センチメートルシャーレに再び胚を移します。実体顕微鏡下で胚からの脳を抽出します。脳を公開するには、静かに鉗子を使用して皮膚や頭蓋骨を引き剥がします。静かに脳全体をかき出す、新鮮な、冷たい解剖培地で35ミリメートルのペトリ皿に移します。
注:胚から切開全脳は、細胞の生存能力を失うことなく、多くの時間、氷上で解剖媒体に格納することができます。 - 先の細い春のハサミやメスで正中線を切断することにより、各脳の2つの半球を分離します。慎重にまっすぐ先の細いピンセットで髄膜を取り除きます。
注:それは完全に髄膜を除去することが非常に重要です。目アストロサイトの文化の防止線維芽細胞の汚染があります。線維芽細胞は急速に分裂する細胞であり、最終的には他のセルを置換します。 - 中脳/線条体と春のハサミやメスで嗅球を削除します。また、春のハサミやメスで海馬(perimedianと皮質に対して尾側であるC字型構造)を取り外してください。 5 mLの解剖媒体で満たされた15 mL遠心管中の皮質半球を収集します。氷の上に保管してください。
- 皮質の解離
- 準備を2mLのCa 2+ / Mgの2+を含まない0.25%トリプシンでハンクス液(HBSS)(解離培地)。 15%(v / v)のウシ胎児血清(FBS)および1%(v / v)のペニシリン/ストレプトマイシン(培地)およびフィルター滅菌して50 mLの高グルコースのダルベッコ改変イーグル培地(DMEM)を準備します。
- 組織を遠心分離管の底に沈殿してみましょう。慎重として組織上からできるだけ解剖媒体の限り海賊。 2+ / Mgの2+を含まないHBSS(トリプシンなし)を5mLのCaで組織を洗浄し、組織がチューブの底に沈降することを可能にします。
- 慎重にHBSSを吸引。 2 mLの分離培地を追加し、組織の周りに酵素を混合するために穏やかにチューブをフリック。 5〜10分間37℃の水浴中でインキュベートします。組織を攪拌するインキュベーションの間、チューブを数回フリック。
- すぐに千μLピペットチップを用いて組織を粉砕します。約800μLのピペッターの音量を設定します。片を吸引し、直接流体ラインの上に、チューブの側に強制的に排出します。しかし、気泡や発泡を最小限に抑えるようにしてください。 20倍 - 組織が約15、十分に解離されるまで繰り返します。トリプシンを不活性化するために8 mLの培地を追加します。静かにチューブを数回転倒混和します。
- 50 mの位置上に配置された70μmの細胞ストレーナーを通して細胞懸濁液を渡しますLの遠心分離管。培地で15 mLのチューブを洗浄し、細胞懸濁液を50 mLチューブに培地を収集するために、セルストレーナーを通して媒体を濾過します。培地で細胞ストレーナーを数回すすいでください。 25 mLの - 洗浄した後、最終体積は約20であるべきです。
- 10分間、200×gで細胞をペレット化。慎重に細胞ペレットを触れることなく、できるだけ多くの媒体を吸引します。 1000μLのピペットを用いて1mLの培地中で細胞を再懸濁。 11 mLの予め温めた培地を追加し、10 mLのピペットを用いて(気泡を防止するために)穏やかに混合します。
- 5 mLの培養培地で1回PDLでコーティングされたT75フラスコをすすぎます。培地を吸引し、フラスコに細胞懸濁液を転送します。すべての細胞をプレーティングされる懸濁液中であり、我々は、アストロサイトは、懸濁液中の他の細胞から分化することができないので、それは一般的に不必要な、それらをカウントする見つけます。 5%CO 2のfの雰囲気で加湿した37℃のインキュベーターにフラスコを置きますまたは2日間。
- アストロサイトの拡張とメンテナンス
- 最初のプレーティング後、初めて2日間、媒体全体を交換してください。 3日毎に、その後、媒体全体を交換してください。常に細胞に添加する前に37°Cに新鮮な培地をprewarm。
注: - (アストロサイトは、ミクログリアとオリゴデンドロサイトは、トップと混在上に横たわると、高密度に充填されたテッセレーションされた単層として表示されます)約90%の密集度に到達するために10日間のアストロサイトは、7が必要です。 - アストロサイトは、約90%の密集度に到達すると、夾雑グリア細胞を除去するために、フラスコを振ります。
- インキュベーターからフラスコを外し、キャップを締めてください(フェノール)または(フィルタリング)ポートをカバーしています。ミクログリアを削除するには、1時間、180 rpmでオービタルプラットフォーム上でフラスコを振ります。培地を吸引除去します。 5 mLの予め温めた培地で一回すすぎ、吸引および12 mLの培地と交換してください。
- 削除するオリゴデンドロサイトは、軌道プラットフォームにフラスコを返し、7時間の最低250rpmで、37℃で振るが、好ましくはO / N。
- 培地を吸引除去します。 5 mLの予め温めた培地で一回すすぎ、吸引および12 mLの培地と交換してください。インキュベーターにフラスコを返します。
- 0.05%トリプシン - エチレンジアミン四酢酸(EDTA)で2:1〜3:100%コンフルエントで、1の割合で標準的な手順を使用して星状細胞を分割します。 100%の集密度でT75フラスコは、典型的には、合計で約4.0×10 6個の細胞が得られます。このスケジュールの下では、培養は通常、週1回分割することができます。
注:星状細胞は、コンフルエントに達したとき、プロトコルステップ3.4において以下に記載されるように、それらを採取し、hiPSCの分化のために使用することができます。星状細胞は生存能力の顕著な損失なしに少なくとも一度分割することができます。彼らは、培養中の最大2ヶ月間維持することができます。経験から、一次胎生18日のラットアストロサイトのPROGRessively最終分化になり、および/または反復分割後の生存率を失います。それは将来の使用のためにアストロサイトを凍結することは可能ですが、我々は必要なときに新鮮胚脳からアストロサイトを単離することを好みます。
- 最初のプレーティング後、初めて2日間、媒体全体を交換してください。 3日毎に、その後、媒体全体を交換してください。常に細胞に添加する前に37°Cに新鮮な培地をprewarm。
rtTAの2世代/ Ngn2陽性hiPSCs
注:再プログラミングがcMYCは、SOX2、OCT4およびKLF4因子で私たちの実験のために使用hiPSCsは、ヒト線維芽細胞のレンチウイルス形質導入により、社内で作成しました。
注:rtTA の / Ngn2陽性hiPSCsの世代のために、レンチウイルスベクターを安定hiPSCsのゲノム中に導入遺伝子を組み込むために使用されています。レンチウイルスの産生のためのプロトコルは、22以前に公開されています。 rtTAとNgn2レンチウイルス粒子を生成するために使用されるレンチウイルスパッケージングベクターの詳細が設けられています材料/機器の表。 rtTAのレンチウイルスのために使用されるトランスファーベクターはpLVX-EF1α-です(テト・オン・アドバンス)-IRES-G418(R); すなわち、このベクターは、構成EF1αプロモーターの制御下でのTet-Onの高度トランスをコードし、抗生物質G418に対する耐性を付与します。 Ngn2レンチウイルスのために使用される転移ベクターは、あるpLVX-(TRE-thight) - (MOUSE)Ngn2-PGK-ピューロマイシン(R); すなわち 、このベクターは、構成的PGKプロモーターの制御下でのTet制御プロモーターおよびピューロマイシン耐性遺伝子の制御下にマウスニューロゲニン-2の遺伝子をコードしています。したがって、これらの2つの転送ベクトルを用いて、hiPSCラインを作成することができるが、そのために、マウスニューロゲニン-2の発現は、ドキシサイクリンを含む培地を補充することによって誘導することができます。 hiPSCsの形質導入のために、レンチウイルス粒子と上澄み液が使用されている、すなわち 、ウィット(テキストの残りの部分に「レンチウイルスサスペンション」と呼ばれます)超遠心分離を使用して粒子を集中ハウト。
- hiPSCsをプレート(1日目)
注:このプロトコルに記載されているボリュームがhiPSCsは、6ウェルプレート中で培養すること、および1つのウェルの細胞を回収していることを前提としています。また、細胞は、12ウェルプレートの12ウェルに続いてメッキされているものとします。- 希釈されたBMMを得るために、1%(v / v)の基底膜マトリックス(BMM)と10 mLの冷たいDMEM / F12を準備します。 12ウェルプレートのウェルあたりBMM希釈し、800μLを追加します。 5%CO 2の雰囲気で加湿した37℃のインキュベーター中で少なくとも1時間インキュベートします。使用する前に、室温で1時間静置します。
- 1%(v / v)のペニシリン/ストレプトマイシン、9 mLのDMEM / F12と室温に1 mLの細胞剥離液(CDS)とウォーム15 mLのエッセンシャル8(E8)培地。 Rho関連タンパク質キナーゼ(ROCK)阻害剤とE8媒体を補います。
- hiPSCsの使用済み培地を吸引D hiPSCsに1 mLのCDSを追加します。 5%のCO 2の雰囲気で加湿37℃インキュベーター中で5分間- 3インキュベートします。細胞が互いに着脱されているかどうかを顕微鏡下で確認してください。
- 優しく千μLピペットで細胞を懸濁し、15 mLのチューブに細胞を移す、十分に2mLのDMEM / F12を追加します。細胞懸濁液に7 mLのDMEM / F12を追加します。 5分間、200×gで細胞をスピン。
- 上清を吸引し、準備E8培地2mlを追加します。 15 mLチューブの側面に千μLピペットの先端を入れ、軽く細胞を再懸濁することにより、(細胞塊を形成しない)hiPSCsが解離された細胞懸濁液を得ます。細胞が解離されているかどうかを顕微鏡下で確認してください。
- 血球計数器チャンバーを用いて細胞(細胞/ mL)の数を決定します。
注:80で6ウェルプレート-合計で4.0×10 6細胞- 90%の密集度は、典型的には3.0が得られます。 - 吸引物12ウェルプレートのウェルからのBMMに希釈しました。 3.0×10 4細胞/ mLの細胞懸濁液を得るために細胞を希釈します。プレート12ウェルプレートのウェル当たり細胞懸濁液1ml。 5%CO 2の雰囲気で加湿した37℃のインキュベーター中で12ウェルプレートO / Nを配置します。
- rtTAのとNgn2レンチウイルスを持つiPS細胞を形質導入(2日目)
- 室温に1%(v / v)のペニシリン/ストレプトマイシンとウォーム12 mLのE8媒体。 E8媒体8 / mlの最終濃度にROCK阻害剤とポリブレンとE8培地を補います。
- レンチウイルス懸濁液でアリコートを解凍します。レンチウイルス懸濁液に8μgの/ mLの最終濃度にポリブレンを追加します。使用済み培地を吸引除去し、各ウェルに用意E8培地1mlを追加します。
- Ngn2 -lentivirus懸濁液-異なるrtTAの量と伝達を行います。例えば、transdu12ウェルプレートの1ウェルにrtTAの -lentivirusとNgn2 -lentivirusサスペンションの両方の100μLを添加することにより、CE hiPSCsを。他のウェルは、レンチウイルス懸濁液の代わりに100μLを200μL、300μL、400μLおよび500μLを使用します。 12ウェルプレートの2つのウェルのhiPSCsは、形質導入すべきではありません。彼らは選択の間のコントロールとして機能します。
注:形質導入効率は、選択の開始後に、より正確に推定することができるように、形質導入は、好ましくは、(プロトコルステップ2.2.4を参照)、重複して行われます。効率的hiPSCsの大半を形質導入するために必要とされるレンチウイルス懸濁液の量は、レンチウイルス懸濁液の力価および使用されているhiPSCラインに依存します。 hiPSCsを形質導入するためにレンチウイルス懸濁液を500μL - 本研究では、通常は100を使用しています。 - 5%COの雰囲気で加湿37℃インキュベーター中で12ウェルプレートを置き6時間2。 6時間のインキュベーション期間の終了前に、1%(v / v)のペニシリン/ストレプトマイシン及び12とウォーム12 mLのE8媒体RTへmLのダルベッコのリン酸緩衝生理食塩水(DPBS)。 ROCK阻害剤とE8媒体を補います。
- 費やしE8媒体を吸引。 1 mLのDPBSで各ウェルを洗浄します。各ウェルに用意E8媒体の1 mLを加え。 5%CO 2の雰囲気で加湿した37℃のインキュベーター中で12ウェルプレートO / Nを配置します。
- E8媒体をリフレッシュ(3日目)
- RTに1%(v / v)のペニシリン/ストレプトマイシンとウォーム12 mLのE8媒体。 12ウェルプレートのウェルから使用済み培地を吸引除去し、各ウェルに準備E8培地1mlを追加します。 5%CO 2の雰囲気で加湿した37℃のインキュベーター中で12ウェルプレートO / Nを配置します。
- ピューロマイシンおよびG418で選択を行う(日4から8)
注:ヒップの細胞分裂速度に依存培養物を分割する必要がある点で、選択期間中に80%のコンフルエンシー - SCラインおよびレンチウイルス形質導入の効率は、細胞が70に到達することができます。分割のタイミングを事前に予測することはできないので、プロトコルに記載されません。しかし、代わりにピューロマイシンおよびG418の言及濃度を補っE8媒体をリフレッシュするの、1は(ビトロネクチンでコーティングされたプレート上に細胞をプレーティングを含む)は、通常のhiPSC文化としてhiPSC文化を分割することができます。唯一の例外は、E8媒体が選択を継続する抗生物質の言及濃度を補充する必要があることです。- 室温に1%(v / v)のペニシリン/ストレプトマイシンとウォーム12 mLのE8媒体。選択のためのピューロマイシンおよびG418を追加します。抗生物質の異なる量は、選択期間( 表1)中に添加されます。
- G418-およびピューロマイシンの割合を推定することにより、形質導入の効率を推定耐性細胞。耐性細胞の割合を推定するために、異なる条件(レンチウイルス懸濁液の異なる量で形質導入培養)のために死んだ細胞の割合(非耐性細胞)を推定し、nontransduced細胞(選択制御としての役割を果たす細胞)のために。 [ - (死細胞の割合)100%]として耐性細胞の割合を計算します。
注:レンチウイルス懸濁液の異なる量の形質導入は、二重に行われた場合、形質導入効率をより正確に推定することができます。非形質導入細胞を用いた条件は、選択コントロールとして機能します。レンチウイルス懸濁液の異なる量で形質導入培養のための死細胞の割合は低くあるべきです。耐性細胞の推定割合は、おそらく両方の導入遺伝子について陽性であるhiPSCsを選択するために使用されます。一般的に、我々は、伝達状態からhiPSCsは、細胞の> 90%であった選択しますsが5日間の選択期間を生き残ります。 - hiPSCsの使用済み培地を吸引し、ウェルに準備E8培地1mlを追加します。 5%CO 2の雰囲気で加湿した37℃のインキュベーター中で12ウェルプレートO / Nを配置します。
| G418の最終濃度 | ピューロマイシンの最終濃度 | |
| 4日目 | 250 / mlの | 2 / mlの |
| 5日目 | 250 / mlの | 2 / mlの |
| 6日目 | 250 / mlの | 1μg/ mLの |
| 7日目 | 250 / mlの | 1μg/ mLの |
| 8日目 | 250 / mlの | 1μg/ mLの |
表1:選択期間に抗生物質の濃度。 選択期間の5日間、ピューロマイシンおよびG418の濃度。
- 選択を停止し、定期的に培養を開始(9日目以降)
- 5日間の選択期間後に、培養物のrtTA / Ngn2陽性hiPSCs通常hiPSCsとして、細胞のE8培地を50μg/ mlの最終濃度にし、最終濃度をピューロマイシンでG418を補充していることを除いて0.5μgの/ mLです。
注:細胞は今バックアップとして機能する(細胞の凍結保存のための標準的なプロトコルに従って)凍結することができます。それは多くの将来の分化実験のためのrtTA / Ngn2陽性hiPSCsの同じバッチを使用することができるので、これは、分化プロトコルの再現のための重要なステップです。
- 5日間の選択期間後に、培養物のrtTA / Ngn2陽性hiPSCs通常hiPSCsとして、細胞のE8培地を50μg/ mlの最終濃度にし、最終濃度をピューロマイシンでG418を補充していることを除いて0.5μgの/ mLです。
6ウェル上のニューロンへのrtTA / Ngn2陽性hiPSCsの3分化多国間環境協定とガラスカバースリップ
注:このプロトコルでは、詳細が2つの基板、 すなわち 6ウェルのMEAとガラスカバースリップで(ウェル当たり9記録1参照組み込みマイクロ電極で6つの独立したウェルで構成されるデバイス)上のrtTA / Ngn2陽性hiPSCsを区別するために設けられています24ウェルプレートのウェル。プロトコルは、しかしながら、容易に表面積に応じて述べた値をスケーリングすることにより、(12-または6-ウェルプレートのウェルについて、 例えば )より大きな基板に適合させることができます。
- MEAまたはカバーガラス(0日と1日目)を準備
- 分化の開始の前日には、製造業者の推奨に従ってのMEAを殺菌します。
- 接着タンパク質ポリ-L-オルニチン(PLO)滅菌超純水で最終濃度を50μg/ mLに希釈します。コート100μLを配置することにより、6ウェルのMEAの活性電極面積各ウェルの希釈されたPLOのドロップ。滅菌ピンセットを用いて、24ウェルプレートのウェルにカバースリップを置きます。各ウェルに希釈されたPLOの800μLを追加します。 1000年μLピペットチップでそれらを押し下げて、フローティングからカバースリップを防ぎます。
- 5%CO 2の雰囲気下で6ウェルのMEA、24ウェルプレートのO / Nで加湿した37℃のインキュベーターに培養します。次の日は、希釈されたPLOを吸引します。滅菌超純水で2回、6ウェルのMEAのガラス面とカバースリップを洗ってください。
- (6ウェルMEAについて)を20μg/ mLおよび(カバーガラス用)を10μg/ mLの最終濃度になるように冷たいDMEM / F12中でラミニンを希釈します。各ウェル中の100μLの滴を配置することによって、すぐにコート6ウェルのMEAの活性電極面積を。同様に、コートに24ウェルプレートの各ウェルに希釈したラミニンのカバースリップを400μLを追加します。千μLピペットチップでそれらを押し下げて、フローティングからカバースリップを防ぎます。
- 少なくとも2時間、5%の大気CO 2で加湿した37℃のインキュベーター中で6ウェルのMEA、24ウェルプレートをインキュベート。
- hiPSCsをプレート(1日目)
注:ステップ3.2.1に記載されているボリューム- 3.2.4 のrtTA / Ngn2陽性hiPSCsは、6ウェルプレート中で培養すること、および1つのウェルの細胞を回収していることを前提としています。 6ウェルのMEAおよび/またはカバーガラス上の細胞をプレーティングするために必要とされるボリュームは、6ウェルのMEAの数及び/又は実験に使用されているカバースリップの数に依存します。ステップ3.2.6で指定された番号 - 3.2.8は、異なる実験のサイズにスケーリングすることができます。- 暖かいDMEM / F12、CDSおよびR / T、1%(v / v)のペニシリン/ストレプトマイシンでE8媒体。 E8媒体への最終的な4μgの/ mLの濃度とROCK阻害剤にドキシサイクリンを追加します。
- rtTA / Ngn2陽性hiPSCsの使用済み培地を吸引し、1メートルを追加hiPSCsにLのCDS。 5%のCO 2の雰囲気で加湿37℃インキュベーター中で5分間- 3インキュベートします。細胞が互いに着脱されているかどうかを顕微鏡下で確認してください。
- 優しく千μLピペットで細胞を懸濁し、15 mLのチューブに細胞を移す、十分に2mLのDMEM / F12を追加します。細胞懸濁液に7 mLのDMEM / F12を追加します。 5分間、200×gで細胞をスピン。
- 上清を吸引し、準備E8培地2mlを追加します。 15 mLチューブの側面に千μLピペットの先端を入れ、軽く細胞を再懸濁することによりhiPSCsを解離。細胞が解離されているかどうかを顕微鏡下で確認してください。
- 血球計数器チャンバーを用いて細胞(細胞/ mL)の数を決定します。
注:80で6ウェルプレート-合計で4.0×10 6細胞- 90%の密集度は、典型的には3.0が得られます。 - 希釈されたラミニンを吸引。 6ウェルのMEAについては、CEを得るために細胞を希釈7.5×10 5細胞/ mLのLLサスペンション。 6ウェルのMEAの各ウェル内の活性電極領域に細胞懸濁液100μLの液滴を加えることにより細胞をプレート。カバーガラスは、4.0×10 4細胞/ mLの細胞懸濁液を得るために細胞を希釈します。 24ウェルプレートのウェルに細胞懸濁液500μLを添加して細胞をプレート。
注:MEAの上の最終細胞密度は、カバーガラス( 図1AおよびB)よりも高いです。我々は、この高い細胞密度は、ネットワーク活動の適切な記録のために必要であったことを見出しました。プロトコルでは、数字は、アッセイに最適であることが判明したが提供されます。 - 2時間(MEAの)またはO / N(24ウェルプレート)、5%CO 2の雰囲気で加湿した37℃のインキュベーター中で6ウェルのMEAおよび24ウェルプレートを置きます。
- 2時間後、慎重に6ウェルのMEAの各ウェルに用意E8媒体の500μLを追加します。 6 - 私たちを置きますLLのMEA O / N 5%CO 2の雰囲気で加湿37℃インキュベーターインチ
- 培地を変更します(2日目)
- 翌日、1%(v / v)のN-2サプリメント、1%(v / v)の非必須アミノ酸、1%(v / v)のペニシリン/ストレプトマイシンを含むDMEM / F12を準備します。最終10ng / mLの濃度、および4μgの最終濃度をドキシサイクリンに10ng / mLの最終濃度のヒト組換えニューロトロフィン-3(NT-3)、ヒト組換え脳由来神経栄養因子(BDNF)を追加/ mLです。 37℃に培地を温めます。
- 培地に0.2μgの/ mLの最終濃度にラミニンを追加します。得られた培地をフィルタリングします。 6ウェルのMEAのウェルから使用済み培地および24ウェルプレートを吸引し、準備された培地に交換してください。 5%CO 2の雰囲気下で6ウェルのMEA、24ウェルプレートのO / Nで加湿した37℃のインキュベーターに培養します。
- ラットアストロサイトを追加します(3日目)
注:このプロトコルに記載されているボリュームがラットアストロサイトは、T75培養フラスコ中で培養することを前提としています。培養物に添加されたラットアストロサイトは、良い品質のものであることが重要です。我々は、ラットアストロサイトは、良い品質のものであるかどうかをチェックするために2つの基準を使用します。まず、ラットアストロサイトの文化は、ラット胚の脳からの単離後10日以内にコンフルエントに成長させることができるはずです。第二に、ラットアストロサイトの文化を分割した後、ラットの星状細胞はコンフルエント、テッセレーションの単層( 図1C)を形成することができるはずです。ラットアストロサイト培養物は、これらの2つの基準を満たさない場合、我々は、分化実験のために、この培養物を使用しないように助言します。- RTへの暖かい0.05%トリプシン-EDTA。 1%DPBSおよびDMEM / F12を温め、37℃まで(v / v)のペニシリン/ストレプトマイシン。
- ラットアストロサイト培養液の使用済み培地を吸引除去します。 5 mLのDPBSを追加することにより、文化を洗浄し、周りに軽く振ります。
- AspirDPBSを食べ、5 mLの0.05%トリプシン-EDTAを追加します。周りに優しくトリプシンEDTAを振ります。 10分- 5、5%の大気CO 2で加湿した37℃のインキュベーター中でインキュベートします。
- 細胞が分離されているかどうかを顕微鏡下で確認してください。フラスコを数回押すことで、最後のセルを切り離します。
- フラスコにDMEM / F12の5ミリリットルを追加します。 10 mLのピペットで静かにフラスコ内の細胞を粉砕します。 15 mLチューブ中の細胞懸濁液を収集します。 8分間、200×gでチューブをスピン。
- 上清を吸引し、DMEM / F12 1 mLに細胞を再懸濁。血球計数器チャンバーを用いて細胞(細胞/ mL)の数を決定します。
- 6ウェルのMEAのウェルあたり7.5×10 4アストロサイトを追加します。 24ウェルプレートのウェルあたり2.0×10 4アストロサイトを追加します。 5%CO 2の雰囲気で加湿した37℃のインキュベーター中のMEAおよび24ウェルプレートO / Nインキュベートします。
- 培地を変更します(4日目)
- 2%(v / v)のB-27サプリメント、1%(v / v)のL-アラニル-L-グルタミンおよび1%(v / v)のペニシリン/ストレプトマイシンを神経基礎培地を準備します。 4μg/ mLの最終濃度に10ng / mLの、及びドキシサイクリンの最終濃度を10ng / mLの、BDNFの最終濃度にNT-3を加えます。また、2μMの濃度にシトシンβ-D-アラビノフラノシドを追加します。
注:シトシンβ-D-アラビノフラノシドは、星状細胞の増殖を阻害し、神経細胞に分化されていない残りのhiPSCsを殺すために培地に添加されます。 - 37°Cまでの媒体と暖かいをフィルタリングします。 6ウェルのMEAのウェルから使用済み培地および24ウェルプレートを吸引し、準備された培地に交換してください。 5%CO 2の雰囲気で加湿37℃インキュベーターで6ウェルのMEA、24ウェルプレートを維持します。
- 2%(v / v)のB-27サプリメント、1%(v / v)のL-アラニル-L-グルタミンおよび1%(v / v)のペニシリン/ストレプトマイシンを神経基礎培地を準備します。 4μg/ mLの最終濃度に10ng / mLの、及びドキシサイクリンの最終濃度を10ng / mLの、BDNFの最終濃度にNT-3を加えます。また、2μMの濃度にシトシンβ-D-アラビノフラノシドを追加します。
- 培地をリフレッシュ(日6から28まで)
注:6日目から開始して、リフレッシュ半分培地の2日ごと。以降10日目からは、培地は、星状細胞の生存性をサポートするために、FBSが補充されます。- 2%(v / v)のB-27サプリメント、1%(v / v)のL-アラニル-L-グルタミンおよび1%(v / v)のペニシリン/ストレプトマイシンを神経基礎培地を調製。 4μg/ mLの最終濃度に10ng / mLの、及びドキシサイクリンの最終濃度を10ng / mLの、BDNFの最終濃度にNT-3を加えます。 10日目以降からは、また、2.5%(v / v)のFBSを含む培地を補います。 37°Cに生じた培地と暖かいをフィルタリングします。
- 1000年μLピペットを用いて、6ウェルのMEA、24ウェルプレートのウェルから使用済み培地の半分を削除し、準備された培地に交換してください。 5%CO 2の雰囲気で加湿37℃インキュベーターで6ウェルのMEA、24ウェルプレートを維持します。
4. hiPSC由来のニューロンの神経生理学的プロフィールを確立
注:で後2〜3週間分化のductionは、hiPSC由来のニューロンは、異なる下流の分析のために使用することができます。このセクションでは、いくつかの下流の分析の例は、hiPSC由来のニューロンの神経生理学的プロフィールを確立するために行うことができる与えられています。
- MEAを用いた神経回路網の活動を特徴づけます
- MEAの上で培養hiPSC由来の神経細胞の電気生理学的活動の記録20分。録音中、37℃の温度を維持し、MEAに加湿ガス(5%CO 2、20%O 2、75%N 2)の定数、遅い流れを膨張させることにより、媒体の蒸発およびpH変化を防ぎます。
- 1200X増幅(MEA 1060 MCS)後、MCSデータ収集カードを使用して10kHzで信号をサンプリングします。カスタム・ソフトウェア・パッケージ23を使用してデータ(スパイクおよびバースト検出)分析。
- 単一細胞電気生理学的活性を特徴付けます
- 正立顕微鏡に沈め固定段の記録室にhiPSC由来の神経細胞の培養を含むカバースリップを転送します。自発的な活動電位誘発性シナプス後電流(sEPSC)24の記録20分。神経科学プログラムを使用して、シナプス事象を検出します。
- ニューロンの形態およびシナプシン表情を特徴付けます
- 修正して、MAP2のためhiPSC由来の神経細胞を染色、シナプシン1月2日、および22、24、25、PSD-95。画像解析ソフトウェアを用いてシナプシン-1/2、PSD-95涙点の数を定量化します。
結果
ここでは、正常にhiPSCsは、転写因子ニューロゲニン-2 12を過剰発現させることにより、皮質神経細胞に直接区別されているプロトコルを変更していると我々はのMEAの使用のためにそれを適応しています。このアプローチは、高速、私たちは分化誘導後第3週の間に、既に機能的ニューロンおよびネットワーク活動を得ることができるように効率的です。
分化プロトコルの過程で、細胞は形態学的に神経細胞に似始め:小プロセスが形成されたニューロンは、互いに( 図1A)への接続を開始しました。我々は、開発中に、そのニューロンの形態とシナプスの特性を測定することにより、健全な制御hiPSCライン由来のニューロンの神経生理学的プロファイルを確立しました。 hiPSC由来のニューロンは開始後異なる日にMAP2とシナプシン1月2日のために染色しました分化( 図2A)の。派生ニューロンは3週間分化誘導後、すでに成熟した神経細胞の形態を示します。シナプシン1月2日の涙点(シナプスの数の尺度)の数は、シナプシン1月2日免疫細胞化学染色に基づいて定量しました。シナプシン-1/2涙点の数は、神経接続のレベルも( 図2B)が増加していることを示唆し、経時的に増加しました。 23日間分化誘導後のシナプシン1月2日の涙点の数は、2つの独立したIPSライン( 図2C)で同様でした。 23最もDIVシナプシン/ 2涙点で機能的シナプス( 図2D)の指標であるPSD-95涙点に並置されました。
Zhang らによって記載された結果と一致し、我々はパン神経細胞およびサブタイプ特異的皮質メートルによって確認され、興奮上層皮質ニューロンの集団を生成このようなBRN2とSATB2(層II / III)としてarkers。私たちは、深い層ニューロンCTIP2(V層)またはFOXP2(層VI)( 図2EおよびF)について陽性であった神経細胞を観察しませんでした
hiPSC由来のニューロンの電気生理学的活性を特徴付けるために、我々は、開発中に測定されたこれらのニューロンへの全細胞電流及び電圧クランプ記録、 すなわち固有の特性および興奮性入力を使用します。神経細胞は、分化の後に1週間すでに活動電位を生成することができたとスパイク細胞の割合は、時間( 図2GおよびH)の上に増加しました。さらに、ニューロンは週分化誘導後にすでに興奮性シナプス入力を受けた:興奮性シナプス入力の周波数と振幅の両方を開発( 図2I - K)の間に増加しました。
ntの"FO:=キープtogether.within-ページ" 1 ">優れた単一細胞の活性は、ネットワークレベルの機能を形成するために組み合わせる方法を理解するには、ニューロンがコンサートでどのように機能するかを検討することが不可欠であるin vitroでの神経回路網は、MEAの上で培養。ニューロンのダイナミクスを研究するための貴重な実験モデルを構成している。我々は、6ウェルのMEA( 図2M)で培養し、健康な制御hiPSCライン由来神経細胞の電気生理学的ネットワーク活動の20分を記録した。数週間を分化誘導した後、ニューロン開発のこの段階(分化の開始後すなわち 16 d)のすべてのチャンネルが関与なし同期イベントで。;自発的なイベント( 図2N 0.62±0.05スパイク/秒)を示す、機能的に活性な神経回路網を形成し、健康なコントロールhiPSCs由来多国間環境協定の( 図2O)が検出されたネットワーク活動のレベルは開発中に増加:4週目の間にトン後彼は、分化の誘導、神経回路網は、自発的な高レベルの活性を示した(2.5±0.1スパイク/秒; 図2N)デバイスの全てのウェルインチネットワークはまた、長い期間(2100±500ミリ秒)と同期網バースト(4.1±0.1バースト/分、 図2O)を示しました 。
図1: 神経細胞への分化hiPSC。カバースリップ上のニューロンへのhiPSCsの分化A. 3つの時点。多国間環境協定上のhiPSCsのB.めっき。 T75フラスコ中の100%の集密度でC.星状細胞(細胞がモザイク状の単層を形成することに注意してください)。スケールバー:150μmで。 この図の拡大版をご覧になるにはこちらをクリックしてください。
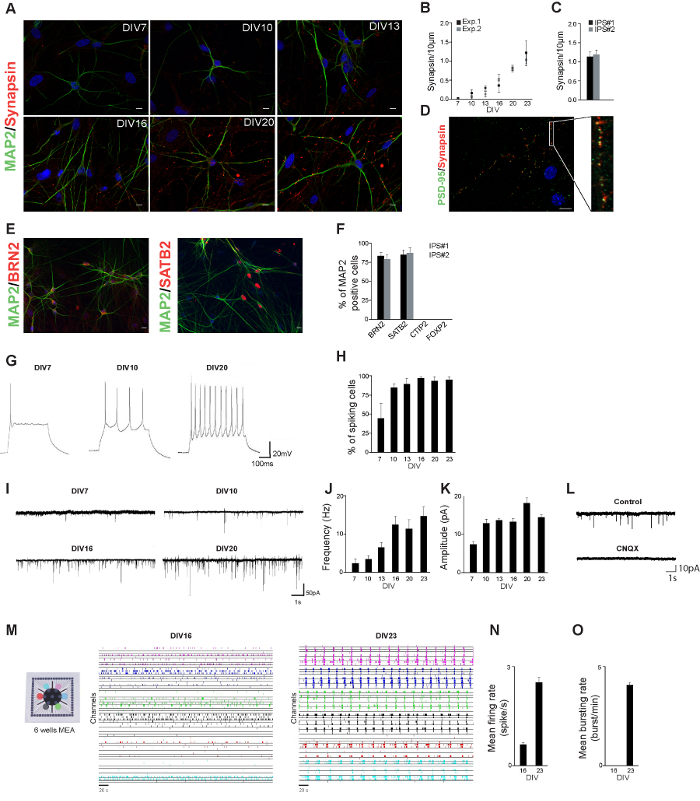
図2.ニューロン特性評価をhiPSCが由来します。 A. hiPSC由来の神経細胞は、分化の開始後異なる日にMAP2(緑)、シナプシン1月2日(赤)について染色しました。スケールバー:10μmです。 2つの独立した実験におけるシナプシンの涙点のB.定量。各実験では、少なくとも10個の細胞を分析しました。二つの独立したIPS株由来の神経細胞におけるDIV23でシナプシン涙点のC.定量。 D. hiPSC由来のニューロンは、23日間分化の開始後PSD-95(緑)、シナプシン1月2日(赤)について染色しました。涙点シナプシンPSD-95の斑点に並置されています。 E. hiPSC由来のニューロンはMAP2(緑)、BRN2(赤)またはSATB2(赤)、分化の開始後23日間染色しました。そのMAP2陽性細胞のF.割合示されたマーカーについて陽性でした。その活動電位を示すG.代表電流クランプ記録は、分化の開始後、早ければ7 dとを生成することができます。一つ以上の活動電位を示す分化誘導後の異なる日での細胞のH.割合 。 I.分化後の異なる日でhiPSC由来のニューロンが受信した興奮性シナプス後電流(EPSCs)の代表的な痕跡。開発中に興奮性シナプス後電流のJ.頻度 。開発中に興奮性シナプス後電流のK.振幅。 L.代表的には、(制御)することなく、およびCNQX(CNQX)とEPSCの録音をトレースします。 1 hiPSCライン由来M.ニューロンは、6ウェルMEA上で培養したとネットワーク活動をhiPSC由来の神経回路網16と分化誘導後の23日間に示されています。から記録された活動各ウェル(10 kHzでのサンプリングレート)は、異なる色(記録の20分の5分が示されている)で示されています。 N.発射速度16と分化誘導後23 D。 O.破裂率16および分化誘導後23 D。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果を考えると、得られたhiPSC由来のニューロンの質は、細胞の神経生理学的プロフィールを作成することによって評価することができます。すなわち、3〜4週間の分化の開始後、ニューロンの形態、シナプシン-1/2の発現および電気生理学を評価することが可能です。その時点で、hiPSC由来のニューロンは、免疫細胞化学を行う際に、MAP2であることが、シナプシン/ PSD-95陽性の神経細胞様の形態を示すことが期待され、およびexhibiにトン自発的な電気生理学的活性(両方の単一セルおよびネットワークレベルで)。
ディスカッション
ここでは、Zhang らによって発表され、効率的なhiPSC-分化プロトコルを実装しています。 MEAの上hiPSC由来の神経回路網のネットワーク活動を測定する(2013)12。我々は、神経分化を誘導する前のrtTA / Ngn2陽性hiPSCラインを作成することによって、元のプロトコルを適応しました。この追加のステップは、私たちは、MEA上の神経細胞密度を制御することができます。神経細胞の密度の制御は、MEAのにプロトコルを適応させるための性と一貫性を確保するための重要な前提条件でした。 MEAを用いた神経回路網の活性を測定するために、神経細胞は、MEAの電極17,18の上に直接密なネットワークを形成する必要があります。これは必ずしも神経細胞のプレーティング密度を厳密に制御する必要があります。この戦術は、分化前にhiPSCsの急性レンチウイルス形質導入に依存しないためのrtTA / Ngn2陽性hiPSCラインは、ニューロン密度を制御することができます。rtTA / Ngn2陽性hiPSCラインは、したがって、ほぼ例えば、レンチウイルスの毒性および可変感染効率に起因最終収率の変動を排除します。
実験手順のもう一つの重要なステップは、差別hiPSCsと共培養されたラットアストロサイトの数です。アストロサイトは、積極的に神経機能するために重要なプロセスであるその全てが、シナプス形成、保守、および除去を制御することにより、神経回路の開発の洗練に貢献しています。本論文で提示プロトコルは非常にアストロサイトに依存している:完全に成熟と機能のシナプスを形成するために、ニューロンはアストロサイトからのサポートを必要とします。我々は、アストロサイトの数は、ニューロンの成熟と自発的な活性を示す神経回路網の形成をサポートするために、hiPSC由来のニューロンの数にほぼ等しくなければならないことを経験しました。私たちのアストロサイトのプロトコル利回り初代細胞CULので、限られた寿命を持つトゥーレスは、ラットアストロサイトの単離は、定期的に実行する必要があります。
Zhang らによって発表されたプロトコルの私達の適応。 (2013)12は、MEA技術で使用するための可能性が大幅にhiPSC派生ネットワークのネットワーク活動を研究する当社の能力を向上させます。以前は、時間のかかる分化手順13-16に頼ったMEAとhiPSC由来の神経回路網の研究のために使用されるプロトコル。 Zhang らからプロトコル。 (2013)は、迅速な代替手段を提供し、私たちの修正は、それが今より実現可能な特に高スループットまたは薬理学的研究では、MEAの技術と組み合わせてhiPSC由来の神経細胞を使用することが可能になる変動性の源を除去します。また、この方法は、Zhang らにより発表されているため。 (2013)12は、私たちの適応プロトコルはネットワークAへの可能なフォーカスされた研究を行い、上位層皮質ニューロンの均一な集団を生成しますこの特定の神経細胞のサブセットのctivity。
それにもかかわらず、このアプローチはまた、いくつかの制限を有します。培養物は、ニューロンの異なるクラス( すなわち、抑制性および興奮性ニューロン)の異種ネットワークを構成する生体内ネットワークに似ている可能性が低いため、最初に、培養物の均質性はまた、不利と考えることができます。さらにMEA技術とhiPSC由来の神経細胞の使用を強化するために、他の神経細胞集団のための迅速な(導入遺伝子ベース)の分化プロトコルを開発することが重要であろう。プロトコルが利用可能になった場合は、in vitroでのネットワークは、より密接にin vivoでのネットワークを模倣します。第二に、現在ではラットアストロサイトは、成長をサポートするためのhiPSC由来の神経細胞に添加しなければならないので、結果として神経回路網は、人間の神経回路網狭義ではありません。アストロサイトにhiPSCsを区別するための信頼性の高いプロトコルは、将来のゾル5月この問題は26 VEの 。ここで説明するように、第3の、二次元の神経回路網は、複雑な三次元インビボで神経回路網を研究するための限られたモデルです。幸いなことに、MEAの技術と組み合わせて、ラット初代神経細胞の三次元培養を記述するプロトコルは、27,28はすでに利用可能です。将来を見越して、3次元培養技術とMEA技術でhiPSC由来の神経細胞とアストロサイトを得るための迅速な分化プロトコルの組み合わせは、神経疾患の根底にある生物学的メカニズムに新たな洞察を提供する必要があります。
開示事項
The authors have nothing to disclose.
謝辞
The authors thank Jessica Classen for performing the whole-cell patch-clamp experiments. The hiPSCs used in our experiments were kindly provided by Huiqing Zhou and Willem van den Akker from the Radboud University Nijmegen. The transfer vectors used in this protocol were kindly provided by Oliver Brüstle, Philipp Koch and Julia Ladewig from the University of Bonn Medical Centre.
資料
| Name | Company | Catalog Number | Comments |
| Lebovitz's L-15 medium | Gibco | 11415-064 | |
| B-27 supplement | Gibco | 0080085SA | |
| Poly-D-Lysine (PDL) | Sigma-Aldrich | P6407 | |
| Ca2+/Mg2+-free HBSS | Gibco | 14175-095 | |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | |
| 2.5% Trypsin | Gibco | 15090-046 | |
| High-glucose DMEM | Gibco | 11965-092 | |
| FBS (Fetal Bovine Serum) | Sigma-Aldrich | F2442-500ML | |
| Penicillin/Streptomycin | Sigma-Aldrich | P4333 | |
| 70 µm cell strainer | BD Falcon | 352350 | |
| DPBS | Gibco | 14190-094 | |
| psPAX2 lentiviral packaging vector | Addgene | Plasmid #12260 | |
| pMD2.G lentiviral packaging vector | Addgene | Plasmid #12259 | |
| Basement membrane matrix | Gibco | A1413201 | |
| DMEM/F12 | Gibco | 11320-074 | |
| Cell detachment solution | Sigma-Aldrich | A6964 | |
| E8 medium | Gibco | A1517001 | |
| ROCK inhibitor | Gibco | A2644501 | Alternatively, ROCK inhibitors like thiazovivin can be used. |
| Polybrene | Sigma-Aldrich | H9268-5G | |
| G418 | Sigma-Aldrich | G8168-10ML | |
| Puromycin | Sigma-Aldrich | P9620-10ML | |
| Vitronectin | Gibco | A14700 | |
| 6-well MEAs | Multi Channel Systems | 60-6wellMEA200/30iR-Ti-tcr | |
| Glass coverslips | VWR | 631-0899 | |
| Poly-L-Ornithine (PLO) | Sigma-Aldrich | P3655-10MG | |
| Laminin | Sigma-Aldrich | L2020-1MG | |
| Doxycyclin | Sigma-Aldrich | D9891-5G | |
| N-2 supplement | Gibco | 17502-048 | |
| Non-essential amino acids | Sigma-Aldrich | M7145 | |
| NT-3, human recombinant | Promokine | C66425 | |
| BDNF, human recombinant | Promokine | C66212 | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| L-alanyl-L-glutamine | Gibco | 35050-038 | |
| Neurobasal medium | Gibco | 21103-049 | |
| Cytosine β-D-arabinofuranoside | Sigma-Aldrich | C1768-100MG | |
| Straight fine-tipped forceps | Fine Science Tools | 11251 | |
| Fine-tipped spring scissors | Fine Science Tools | 91500-09 |
参考文献
- Ahfeldt, T., Litterman, N. K., Rubin, L. Studying human disease using human neurons. Brain Res. , (2016).
- Zhang, S. C., Wernig, M., Duncan, I. D., Brustle, O., Thomson, J. A. In vitro differentiation of transplantable neural precursors from human embryonic stem cells. Nat Biotechnol. 19 (12), 1129-1133 (2001).
- Perrier, A. L., et al. Derivation of midbrain dopamine neurons from human embryonic stem cells. Proc Natl Acad Sci USA. 101 (34), 12543-12548 (2004).
- Wu, H., et al. Integrative genomic and functional analyses reveal neuronal subtype differentiation bias in human embryonic stem cell lines. Proc Natl Acad Sci USA. 104 (34), 13821-13826 (2007).
- Chambers, S. M., Fasano, C. A., Papapetrou, E. P., Tomishima, M., Sadelain, M., Studer, L. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Shi, Y., Kirwan, P., Livesey, F. J. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks. Nat Protoc. 7, 1836-1846 (2012).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Johnson, M. A., Weick, J. P., Pearce, R. A., Zhang, S. C. Functional neural development from human embryonic stem cells: accelerated synaptic activity via astrocyte coculture. J Neurosci. 27 (12), 3069-3077 (2007).
- Hu, B. Y., et al. Neural differentiation of human induced pluripotent stem cells follows developmental principles but with variable potency. Proc Natl Acad Sci USA. 107 (9), 4335-4340 (2010).
- Kim, H., et al. miR-371-3 expression predicts neural differentiation propensity in human pluripotent stem cells. Cell Stem Cell. 8 (6), 695-706 (2011).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Odawara, A., Saitoh, Y., Alhebshi, A. H., Gotoh, M., Suzuki, I. Long-term electrophysiological activity and pharmacological response of a human induced pluripotent stem cell-derived neuron and astrocyte co-culture. Biochem Biophys Res Commun. 443 (4), 1176-1181 (2014).
- Odawara, A., Katoh, H., Matsuda, N., Suzuki, I. Physiological maturation and drug responses of human induced pluripotent stem cell-derived cortical neuronal networks in long-term culture. Sci Rep. 6, 26181 (2016).
- Amin, H., Maccione, A., Marinaro, F., Zordan, S., Nieus, T., Berdondini, L. Electrical Responses and Spontaneous Activity of Human iPS-Derived Neuronal Networks Characterized for 3-month Culture with 4096-Electrode Arrays. Front Neurosci. 10, (2016).
- Heikkila, T. J., et al. Human embryonic stem cell-derived neuronal cells form spontaneously active neuronal networks in vitro. Exp Neurol. 218 (1), 109-116 (2009).
- Massobrio, P., Massobrio, G., Martinoia, S. Multi-program approach for simulating recorded extracellular signals generated by neurons coupled to microelectrode arrays. Neurocomputing. 70, 2467-2476 (2007).
- Wang, L., Riss, M., Buitrago, J. O., Claverol-Tinturé, E. Biophysics of microchannel-enabled neuron-electrode interfaces. J Neural Eng. 9 (2), (2012).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85, 890-902 (1980).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J. Vis. Exp. (71), e50079 (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J Vis Exp. (63), e3965 (2012).
- Ba, W., et al. ARHGAP12 functions as a developmental brake on excitatory synapse function. Cell Rep. 14 (6), 1355-1368 (2016).
- Bologna, L. L., et al. Investigating neuronal activity by SPYCODE multi-channel data analyzer. Neural Netw. 23 (6), 685-697 (2010).
- Ba, W., et al. TRIO loss of function is associated with mild intellectual disability and affects dendritic branching and synapse function. Hum Mol Genet. 25 (5), 892-902 (2016).
- Benevento, M., et al. Histone methylation by the Kleefstra syndrome protein EHMT1 mediates homeostatic synaptic scaling. Neuron. 91 (2), 341-355 (2016).
- Krencik, R., Weick, J. P., Liu, Y., Zhang, Z. -. J., Zhang, S. -. C. Specification of transplantable astroglial subtypes from human pluripotent stem cells. Nature biotechnology. 29 (6), 528-534 (2011).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Sci Rep. 4, 5489 (2014).
- Tedesco, M., Frega, M., Martinoia, S., Pesce, M., Massobrio, P. Interfacing 3D engineered neuronal cultures to micro-electrode arrays: an innovative in vitro experimental model. J Vis Exp. (104), e53080 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved