A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד של ובתאים אנדותל מן הבריאה מתנדבת ופוטנציאל הנדידה שלהם בהשפעת דגימות סרום לאחר ניתוח הלב
In This Article
Summary
ובתאי אנדותל (EPCs) מעורבים באופן מכריע על נאווסקולריזציה של רקמות איסכמי. שיטה זו מתארת את הבידוד של EPCs אדם מדם היקפי, כמו גם זיהוי של פוטנציאל הנדידה שלהם נגד דגימות סרום חולי הכירורגיים לב.
Abstract
ובתאי אנדותל (EPCs) מגויס ממח העצם בתנאים פתולוגיים כמו היפוקסיה ומעורב באופן מכריע על נאווסקולריזציה של רקמות איסכמי. מקורו, סיווג ואפיון של EPCs הם מורכבים; יחד עם זאת, שני סוגי המשנה הבולטים של EPCs הוקמו: מה שנקרא "מוקדם" EPCs (המכונה לאחר מכן כבר-EPCs) ומאוחר-תולדה EPCs (מאוחרת EPCs). הם יכולים להיות מסווגים לפי מאפיינים ביולוגיים כמו גם לפי המראה שלהם במהלך בתרבות חוץ גופית. בעוד "מוקדם" EPCs מופיעים פחות משבוע אחרי התרבות של תאים mononuclear היקפי הנגזרות דם במדיה EC-ספציפי, בסוף-תוצאה ניתן למצוא EPCs לאחר 2-3 שבועות. EPCs מאוחרת-תולדה הוכרו להיות מעורבים ישירות נאווסקולריזציה, בעיקר באמצעות יכולתם להתמיין לתאי אנדותל בוגרים, ואילו "מוקדם" EPCs להביע גורמים angiogenic שונים כמו endogenמטען מפוקפק לקדם אנגיוגנזה באופן paracrine. במהלך איסכמיה לבבית / reperfusion (I / R), גורמים שונים לשלוט ביות של EPCs לאזורים של היווצרות כלי דם.
מקרופאג גורם הגירה מעכבת (MIF) הוא ציטוקין פרו-דלקתי דמוי chemokine ו ubiquitously הביע תואר לאחרונה לתפקד רגולטור מפתח כמו הגירת EPCs בריכוזים פיסיולוגיים 1. מעניין, MIF מאוחסן ברכות תאיות ניתן לשחרר במהירות לתוך זרם הדם לאחר כמה גירויים (למשל אוטם שריר לב).
פרוטוקול זה מתאר שיטה לבידוד האמין והתרבות של מוקדם EPCs מדם היקפי אדם בוגר המבוסס על מבחר CD34 חיובי עם תרבות עוקבת במדיום המכיל גורמי גדילה האנדותל על צלחות מצופות פיברונקטין לשימוש מבחני הגירה במבחנה נגד דגימות סרום חולי הכירורגיים לב. יתר על כן,שפעת נדידה של MIF על chemotaxis של EPCs לעומת ציטוקינים ממגר אנגיוגנזה ידועה אחרים באה לידי ביטוי.
Introduction
ובתאי אנדותל (EPCs) הם במחזור הדם האנושי ויש להם את היכולת להתמיין לתאי אנדותל 2. הם משתתפים vasculogenesis ומסוגלים מזעור הנזק נגרם על ידי דלקת איסכמיה / reperfusion (I / R) פציעות בדרכים שונות 3, 4. לדוגמה, EPCs מראים רמות גבוהות של אנזימים נוגדי חמצון תוך תאיים כמו catalase, peroxidase גלוטתיון או סופראוקסיד דיסמוטאז מנגן (MnSOD) 5. ההתנגדות המוגבהת מפני סטרס חמצונים מאפשרת EPCs לתפקד microenvironments עם מיני חמצן תגובתי גבוהים (ROS) לאחר פגיעה איסכמית 6. גם מחקרים קודמים הצביעו על כך שמספר EPCs עלול להיות מתואמים תיקון כלי הדם וכי מספר מופחת של מחזורי EPCs מנבא את התרחשותם של אירועים קרדיווסקולריים 7,class = "Xref"> 8. עם זאת, הגדרה ברורה של EPC לא נמצאה עדיין. עד עכשיו, אין סמן משטח תאים ספציפי או פנוטיפ עקבית EPCs ותאים אלה הם נדירים מאוד בדם ההיקפי 9. EPC אדם צריך להיחשב כתא במחזור עם יכולת שיקומה של האנדותל נפצע ומבנים וסקולרית חדשים.
אחת הדרכים לבודד ולאפיין EPCs היא באמצעות הדבקה על פיברונקטין. ובכך, את היכולת של תאים אלה משמשת להראות הידבקות מעולה כדי פיברונקטין מנות צופה לעומת להקליד 1 קולגן, למשל 3, 10, 11. עם זאת, אחרים מצאו כי תאי ציפוי mononuclear על מנות מצופות פיברונקטין וללא שום צעד טיהור קודם או יותר מובילים מושבות כוללות ובתאים מיאלואידית, מונוציטים, ו- T לימפוציטים 12, 13, 14. יתר על כן, במקרה זה, טסיות עלול לזהם את תא mononuclear (MNC) החלק ובכך להעביר חלבונים בממברנה פלזמה לכל תאים חסידים 15.
מלבד אפיון באמצעות מבחני הידבקות במבחנה, שילוב של סמנים פני תא שונים משמש לתיאור סוג תא נחשב כסוג של EPC. במקרה זה, לאחר הידבקות בתיווך פיברונקטין, התאים מנותחים בדבר תכונות אנדותל דמוי שלהם. בתהליך זה, סמנים האנדותל שני הקשורים התא, ליפופרוטאין בצפיפות acetylated-נמוך (acLDL) ו הקולטן לגורם הצמיחה של אנדותל כלי הדם 2 (VEGFR-2, KDR), לשחק תפקיד. תאי מקרופאגים האנדותל הוכחו תופסי acLDL במיוחד בתהליך הנקרא "מסלול תא נבלות" 16. חלבון סמן נוסף הוא KDR בשם רצפטור VEGF העיקרי על האנדותלתאים 17. עם זאת, כפי EPCs בכלל בתרבית התקשורת השלימה עם גורמי גדילת האנדותל נסיוב עגל עוברי, יתכן כי מקרופאגים, אשר ייתכן גם שהוא מבודד בטעות, תערוכת פרופיל סמן אנדותל הדמוי. כפי שהוצג קודם, אם תורבתו בינוני אנדותל ממוזג, מקרופאגים להביע חלבונים "ספציפי האנדותל" 18.
באופן כללי, ישנן שתי קטגוריות של EPCs בתוך תת יותר, אשר ניתן למצוא בדם או להיות מתורבת במבחנה. EPCs מאוחרת-תולדה (סוף-EPCs) מופיעים לאחר 2-3 שבועות של תרבות. תאים אלה משולבים מהר לתוך monolayer של בתאי האנדותל וריד אדם הטבור והוא יכול ליצור צינורות נימי 19. חוץ מזה, מה שנקרא "מוקדם EPCs" לזרום בדם במשך כשבוע ולפעול בצורה פסיבית יותר באמצעות מולקולות angiogenic ומספק, כגון צמיחה אנדותל כלי הדםגורם (VEGF), או CXCL8 19. חולים עם מחלת עורקים כליליים (CAD) הראו כמויות נמוכות משמעותית של מוקדם EPCs בהשוואה לקבוצת ביקורת ללא CAD 20. מעניין לציין, כי אותה הקבוצה הראתה כמויות גדולות יותר של EPCs מאוחר בהשוואה לקבוצת ביקורת. מחקר אחר הראה כי מוקדם EPCs להגן EPCs הבדיל מן אפופטוזיס בתנאים חמצוני באופן paracrine 6. לכן, EPCs מוקדם עשוי לספק השפעות מגנות רלוונטיות באמצעות ההגירה של תאים אחרים בצורה וקישוט רכב או paracrine בתוך הדם ההיקפי.
פרוטוקול זה מתאר שיטה לטהר מוקדם EPCs על ידי הבידוד הראשון-שבריר PBMC מדם היקפי אדם ובהמשך לבודד CD34 + תאים מן-שבריר PBMC כדי לנקות השעית תא זה תאים לא רצויים. CD34 הוא סמן, המשמש לבידוד של תאי גזע hematopoietic אדם 9 . לאחר מכן, CD34 + תאים בתרבית על משטחים בתרבית רקמה מצופה פיברונקטין. אחרי שלושה ימים, את המדיום משתנה, ובכך לאבד את כל התאים שאינם חסידים. לבסוף, EPCs מבודד מגואלות לאמת את הספיגה של acLDL ואת הנוכחות של KDR כמו אנדותל תא סמן באמצעות תא קרינת מיון מופעל (FACS). כסמן נוסף, ניתחנו מולקולה הידבקות התא טסיות האנדותל (PECAM-1, CD31), אשר מתרחשת גם על תאי האנדותל.
שיקום של רקמת שריר הלב פגום או אוטם ידי גיוס משופרת של EPCs שייך אסטרטגיות טיפול נחקר באינטנסיביות במחלות לב וכלי דם. עם זאת, התרגום של תוצאות ניסוי לתוך פרקטיקה קלינית עדיין מאתגר, בהתחשב הגומלין הסלולר מורכב בגוף האדם במהלך תנאי pathophysiological שונים. יתר על כן, אני הלבבי / פציעות R לעורר הפרשת יתר של ציטוקינים שונים, הורמוני fac הצמיחה tors, השולט על הביות של EPCs לאזורים של היווצרות כלי דם 13. כפי שמוצגות, CXCL8, סטרומה תא הנגזרות 1α גורם (SDF-1α, CXCL12), VEGF גורם מעכבות הגירה מקרופאג (MIF) עולה במידה ניכרת בדגימות הבא אני לבבי / R פציעה 1. בין גורמים אלה, MIF הוא ציטוקין pleiotropic chemokine דמוי עם מאפיינים פרו-דלקתיים בעיקרה. בניגוד השם ההיסטורי שלה, MIF יש פונקציות פרו-נודדות, מתנהג כמו chemokine נכון על סוגי תאים שונים 1, 21, 22. MIF בתיווך תהליכי גיוס תא קושרו אל CXCR2 קולטנים chemokine ו CXCR4, אשר MIF נקשר, ומפעיל באופן שאינו מאותו מקור 21. מן הראוי לציין כי EPCs מבטאות הן של קולטנים אלה על פני השטח שלהם, אשר בנוסף להיות למעלה מוסדר בתנאים היפוקסיהתחת = "Xref"> 23, 24. יתר על כן, הראיות המצטברות עולה כי יש MIF השפעה קרדיו-מגן הכוללת במהלך I / R פציעה של הלב 22, 25, 26. בהקשר זה, מוכיח עוד כי MIF עשוי לתמוך נאווסקולריזציה במהלך מתח היפוקסי חשוב ורלוונטי במיוחד, כאשר בוחנים את מנגנוני התאוששות המוגבלים של שריר הלב הפגוע 27. מחקרים קודמים במבחנה וניסויים בעכברי מודל הפרה-קליני ספקו ראיות ראשונות על תפקידו של MIF ב EPCs גיוס 4. ראוי לציין, MIF גם הוא חלבון מטען בולט של EPCs העשויים להתפרסם במהלך גיוס EPCs בתוך אתרים איסכמי 28. עם זאת, מחקרים במסגרות קליניות בפרט בהשוואה אחר (אנגיוגנזה) ציטוקינים בסרום להישאר חמקמקים.
Protocol
דם עבור בידוד של EPCs התקבל מתנדבים בריאים לאחר הסכמה מדעת בהתאם ועדת האתיקה המקומית. דגימות סרום המשמש מבחני הגירה התקבלו מחולים שעברו ניתוחי לב קונבנציונלי עם השימוש מכונת לב-ריאה (CPB). קריטריוני הכללה היו פעולות חירום, הריון ידוע או חשוד, המטופלת בגיל פחות מ -18 שנים, ואי קבלת הסכמה מדעת. דגימות סרום נמשכו בנוסף מדידות שגרתיות קליני (מיד לפני הניתוח ומיד לאחר רה-פרפוזיה בשריר הלב / פתיחת מהדק צלב אבי העורקים) ומאוחסן לאחר מכן ב -80 ° C עד לניתוח הסופי. הדירקטוריון סקירה מוסדיים (ועדת האתיקה, אוניברסיטת אאכן RWTH) אישר את המחקר הזה. המטופלים הראו בגיל ממוצע של 68.6 שנים משקל ממוצע של 81.7 ק"ג. מחל טרום קיימים-כלולות: יתר לחץ דם (65%), מחלת ריאות כרונית (19%), arteriopathy לב נוסף (16%), חוסר תפקוד מוחי (6%), תעוקת חזה בלתי יציב (3%), אוטם שריר לב האחרון (28% תוך 90 ד), מחלת כליות כרונית (14%), מחלה כבדה (2%) וסוכרת (34%).
1. ציפוי של T75 Flask:
- הכן 5 פתרון פיברונקטין מ"ל (1 מ"ג פיברונקטין האדם מדולל 15 מים ultrapure מ"ל) לכל בקבוק T75.
- מוסיפים את הפתרון בבקבוק T75 ולהמתין עד שהמים מתאדים. כדי למנוע הפרעות מיותרות במהלך תהליך הבידוד בשל אידוי, לבצע תהליך זה מראש (לילה למשל) בטמפרטורת החדר. פתרון זה נותן 4.44 מיקרוגרם פיברונקטין / 2 ס"מ.
- הכן את MV2 מדיום הגידול תא האנדותל ידי להשלים את המדיום MV2 הבזליים עם תוספי גורם הגדילה שסיפק היצרן.
בידוד 2. של ובתאי אנדותל (EPCs) מ- 60 מיליליטר דם:
הערה: ככל קוקטייל מבחר CD34 חיוביnd החרוזים המגנטיים זמינים מסחרי ערכת מבחר משולבת, אין ריכוזים שספקו יצרן. עם זאת, כ -100 μL של הנוגדן מספיק לעיבוד עד 5 x 10 8 תאים. החרוזים המגנטיים מדוללים במים, dextran צופה וכ 5,000x קטן יותר בהשוואת חרוזים זמינים מסחרי אחרים. לפרטים נוספים, ראה הוראות manufacturer's.
- מערבבים דם (עם או בלי תרופות נגד קרישת דם) 1: 1 עם Ca 2 + 2 + ללא -Mg PBS.
- הוסף 15 מ"ל של תמיסת שיפוע צפיפות לכל צינור 50 מ"ל. לפרטים נוספים, ראה הוראות manufacturer's.
- לאט שכבת הדם מדולל על גבי שיפוע פתרון צפיפות.
- צנטריפוגה דגימות ב 2500 XG במשך 30 דקות עם אצה איטית וללא בלימה.
- בזהירות לאסוף את שכבת מעיל באפי כל צינור (איור 1) בעזרת פיפטה פלסטיק סטרילית והכניס אותו לתוך צינור נוסף.הימנע אוסף של פתרון שיפוע צפיפות. תשואת PBMC הצפויה היא כ 3-4 x 10 6 תאים / מיליליטר דם.

איור 1: צפיפות Gradient צנטריפוגה של מעיל Bbuffy על פתרון Ficoll. מוצג הוא התוצאה של צנטריפוגה שיפוע הצפיפות ב 2500 XG במשך 30 דקות על פתרון שיפוע צפיפות. מתואר הם אריתרוציטים, גרנולוציטים (אדום), את החלק היחסי התא mononuclear (שכבה לבנה), פלזמה (צהוב), והפתרון שיפוע צפיפות (לבנבן). אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- לדלל את שבריר התא mononuclear הדם ההיקפיים עם לפחות 3 כרכים של PBS ומערבבים. צנטריפוגה בטמפרטורת החדר למשך 15 דקות ב 200 x ז.
- חזור על שלב 2.6 פעמים.
- לשאוב התא גלולה supernatant ו resuspend ב 5 בינוני מ"ל MV2.
- הוספת 100 μL של נוגדן CD34 האדם (מספיק לעיבוד עד 5 x 10 8 תאים) לכל מעיל באפי בשימוש ולסובב במשך 15 דקות ב 37 מעלות צלזיוס עם 5% CO 2.
- הוסף 50 μL של חרוזים מגנטיים מצופה dextran לכל מעיל באפי בשימוש ולסובב במשך 10 דקות ב 37 מעלות צלזיוס עם 5% CO 2.
- לאחר דגירה, להעביר את ההשעיה לצינורות FACS עם מקסימום של 3 מ"ל בצינור אחד. כמויות גדולות יותר לא תהיינה מותרות עם המגנט.
- הכנס FACS צינור (ים) לתוך המגנט (ים) ולחכות 5 דקות.
- בטל supernatant ללא משיכת צינורות FACS מתוך המגנט.
- Resuspend התאים בצינור אחד FACS עם 3 בינוני מ"ל MV2 מחוץ המגנט.
- חזור על שלבים 2.12-2.14 פעמיים.
- משוך את צינורות FACS מתוך למגנטים resuspend התאים 3 בינוני מ"ל MV2.
- מעבירים את ההשעיה התא לתוך f T75 מראש מצופהlasks ולהוסיף 17 בינוני מ"ל MV2 לכל בקבוק.
הערה: הבינוני צריך להיות שונה לאחר 3 ימים. לאחר שבוע, תאים מראים מבני ציר דמוי (איור 2) והם מוכנים לשימוש. לקבלה לתצפית על הבידוד ראה איור 3.
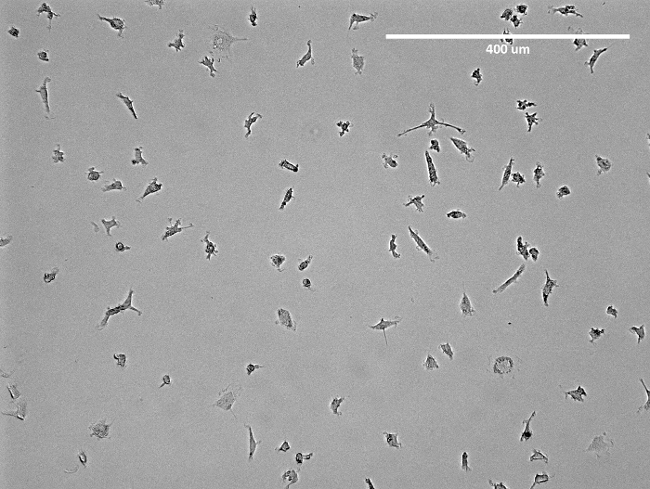
איור 2: תמונה מיקרוסקופית של EPCs המבודד. המוצג הוא תמונה מייצגת של מוקדם EPCs מבודד בבקבוק T75 לפני ניתוק. לכאורה הוא מבנה דמוי כישור של EPCs. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
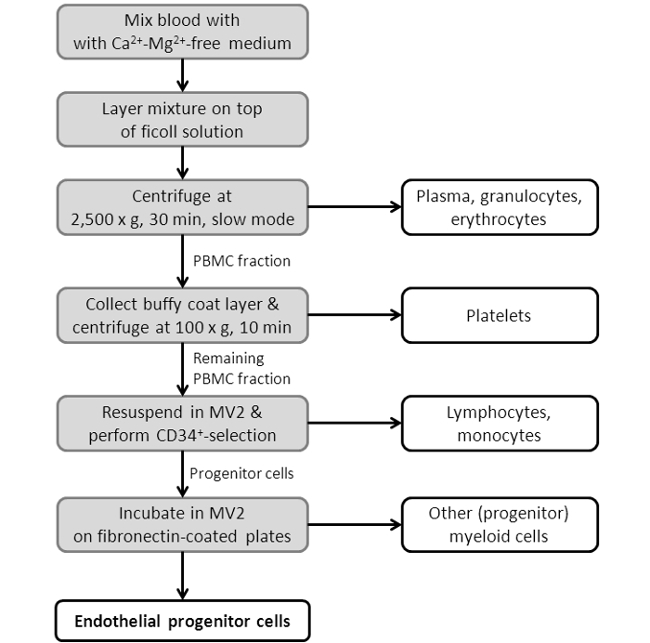
איור 3: תרשים הזרימה מציגה הליך בידוד EPC. המתואר הוא ערכה, להראותing הצעדים היחידים של פרוטוקול בידוד EPC. עבור פרוטוקול מפורט יותר ראה סעיף 2 בפרק הפרוטוקול.
3. Assay הגירה
- הוצא את המדיה EPCs בבקבוק T75.
- לשטוף עם 5 מ"ל PBS על ידי רועדת אותו בזהירות.
- הסר PBS ולהוסיף 5 פתרון ניתוק התא מסחרי מ"ל. מתן עד התאים מנותקים (לבדוק תחת מיקרוסקופ). להאיץ את הניתוק ידי הקשה בתחתית בזהירות של הבקבוק.
- כאשר התאים מנותקים, להוסיף במהירות 5 מיליליטר של מדיום מלא MV2 ולהעביר את השעית התא לתוך צינור נוסף.
- צנטריפוגה XG ב 2000 למשך 5 דקות.
- Resuspend התאים 5-10 מ"ל PBS ו צנטריפוגות שוב XG ב 2000 למשך 5 דקות.
- חזור על שלב 3.6.
- Resuspend תא גלול במדיום מורעב MV2 (50,000 תאים 75 μL לכל טוב גלגול נדרש).
הערה: איזו מערכת הגירה נדרשת תלוי בסוג התא assay. יש הבדל בקטרים נקבוביים erent וגדל צלחת (מספר הבארות). לקבלת EPCs גודל נקבובי של 5 מיקרומטר 96 המערכת גם הוא אופטימלי. - מכין את צלחת ההגירה על ידי הוספת 235 μL של מדגם הסרום (נסיוב מדולל 1: 5 ב MV2 בינוני מורעב) לתוך התא התחתון (איור 4).
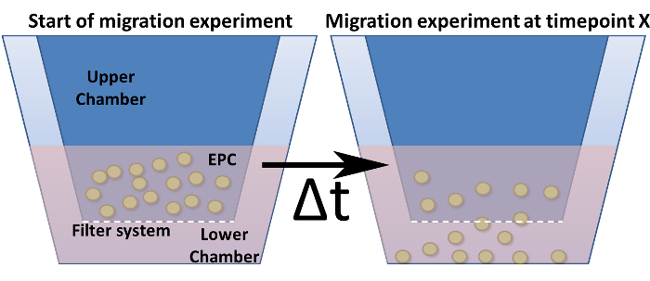
איור 4: Assay הגירה בתוך לשכת בוידן השתנה. המוצג הוא העיצוב הכללי של חדר בוידן שונה. מוסיף תרבית תאים (= חדר העליון) מסומן בכחול כהה מוכנסים לתוך בתא התחתון. התחתי (אבל לא הקירות) מוסיפים אלה מייצגים את מערכת הסינון כולל את הנקבוביות. (א) מציג את ההתקנה בשלב נקודת האפס. (ב) אחרי נקודת זמן שנבחר, תאים נדדו דרך המסנן כלפי גירוי.fig4large.jpg "target =" _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- מוסיפים את הכנס זמן קצר לפני הוספת פתרון התא.
- הוסף 75 μL של פתרון התא (= 50,000 תאים) לתוך החדר העליון.
- תנו EPCs להעביר במשך 3 שעות ב 37 מעלות צלזיוס, 5% CO 2 (זמן ההעברה תלוי בסוג מערכת התא).
- כדי למנוע חפצים פלואורסצנציה אוטומטי בסרום, לכמת תאים היגרו באמצעות צילומים של הבאר תחת מיקרוסקופ לספור את התאים באמצעות תוכנת חצי אוטומטי "ImageJ".
- הסר את החדר העליון (המכיל את כל התאים שאינם שהועברו).
- להוסיף 70 μL 3.6% פתרון paraformaldehyde, כולל צבע Hoechst (בדילול 1: 1,000). הצלחת יכולה להיות מאוחסן על 37 מעלות צלזיוס, 5% CO 2 לילה.
- צנטריפוגה צלחת זמן קצר כדי לקבל את כל התאים לאותו מישור המוקד XG ב 2000 במשך 1-2 דקות.
- קחו 5 תמונות לכל well (איורים 5 ו -6) עם הגדלה 100x.
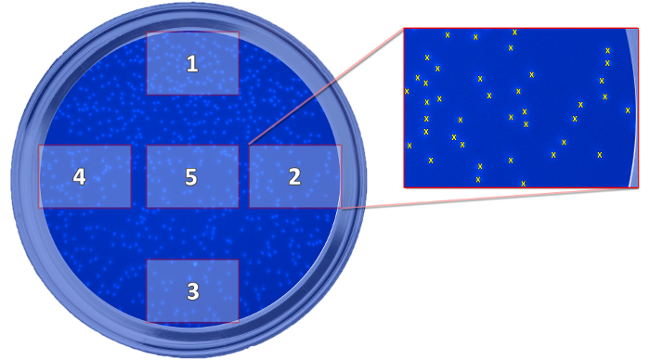
איור 5: תכנית המראה את המיקום של התמונות שצולמו. התכנית מתארת את עמדת החמש התמונות שצולמו, אשר יש צורך בקביעת תאים הגרו, ביחס הבאר. התמונות נלקחות לספור את התאים לחשב ערך ממוצע לכל היטב. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 6: תמונה מיקרוסקופית עבור כימות Cell. המוצג הוא תמונה מייצגת, אשר נלקח כימות התא. התאים היו מוכתמים קבועים using Hoechst לצבוע ב paraformaldehyde 3.6%. נקודות מייצגות קבועות מוכתמות ובתאים אנדותל. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- ספירת התאים נדדו באמצעות תוכנת חצי אוטומטי "ImageJ" על ידי המכון הלאומי לבריאות.
תוצאות
אפיון של ובתאי אנדותל מבודדים
ראשית, את הספיגה של acLDL אומתה, כמו גם את הביטוי של KDR, ו CD31 על פני השטח של אוכלוסיית התא המבודדת. כפי שמראה איור 7 א, 85.1% של EPCs המבודד הראו ספיגה של acLDL והביעו CD31. ...
Discussion
החלק הראשון של מחקר כלל את הבידוד של EPCs אדם מהדם ההיקפי של מתנדבים בריאים כדי לאפשר הערכה מקיפה של הדם של חולים לאחר ניתוח לב. לכן, צנטריפוגה שיפוע צפיפות בוצעה על מנת להפריד את החלק היחסי PBMC מפלסמה, גרנולוציטים ו אריתרוציטים. כדי להסיר ביותר של טסיות זיהום, שבריר התא ה...
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
יש המחברים לא בתודות.
Materials
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
References
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved