È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'isolamento di cellule progenitrici endoteliali da volontari sani e il loro potenziale migratori influenzato dal siero campioni dopo cardiochirurgia
In questo articolo
Riepilogo
cellule progenitrici endoteliali (EPC) sono cruciale coinvolti nella neovascolarizzazione di tessuti ischemici. Questo metodo descrive l'isolamento di EPC umani da sangue periferico, così come l'identificazione della loro potenziale migratorio contro campioni di siero di pazienti chirurgici cardiaci.
Abstract
cellule progenitrici endoteliali (EPC) sono reclutati dal midollo osseo in condizioni patologiche come l'ipossia e sono fondamentalmente coinvolti nella neovascolarizzazione di tessuti ischemici. L'origine, la classificazione e la caratterizzazione di EPC sono complesse; Nonostante, due importanti sottotipi di EPC sono stati stabiliti: i cosiddetti "primi" EPC (successivamente indicati come primi-EPC) e tardo-escrescenza EPC (fine-EPC). Essi possono essere classificati per proprietà biologiche nonché dal loro aspetto durante la coltura in vitro. Mentre EPC "precoce" appaiono in meno di una settimana dopo la coltura di cellule mononucleate del sangue periferico di derivazione nei media CE-specifica, EPC tardo-escrescenza si possono trovare dopo 2-3 settimane. EPC tardo-escrescenza sono stati riconosciuti di essere direttamente coinvolti nella neovascolarizzazione, soprattutto attraverso la loro capacità di differenziarsi in cellule endoteliali mature, mentre "presto" EPC esprimono diversi fattori angiogenetici come endogenocargo unità organizzative per promuovere l'angiogenesi in modo paracrino. Nel corso del miocardio da ischemia / riperfusione (I / R), vari fattori controllano la homing di EPC alle regioni di formazione dei vasi sanguigni.
Macrofagi fattore inibitorio della migrazione (MIF) è una citochina pro-infiammatoria e ubiquitariamente espresso chemochine simile ed è stato recentemente descritto a funzionare come regolatore chiave della migrazione EPC a concentrazioni fisiologiche 1. È interessante notare, MIF viene memorizzato in piscine intracellulari e può rapidamente essere rilasciato nel flusso sanguigno dopo diversi stimoli (ad esempio infarto miocardico).
Questo protocollo descrive un metodo per l'isolamento affidabile e cultura precoce EPC da sangue periferico umano adulto basato sulla selezione CD34-positive con successiva coltura in terreno contenente fattori di crescita endoteliali su piastre di fibronectina rivestite per uso in test in vitro migrazione contro campioni di siero dei pazienti chirurgici cardiaci. Inoltre, laè dimostrata influenza migratoria di MIF sulla chemiotassi di EPC rispetto ad altre citochine angiogenesi-stimolante ben noti.
Introduzione
Cellule progenitrici endoteliali (EPC) circolano nel sangue umano e hanno la capacità di differenziarsi in cellule endoteliali 2. Partecipano vasculogenesi e sono in grado di ridurre al minimo i danni causati da infiammazione e ischemia / riperfusione (I / R) lesioni in vari modi 3, 4. Ad esempio, EPC mostrano elevati livelli di enzimi antiossidanti intracellulari come catalasi, glutatione perossidasi o superossido dismutasi manganese (MnSOD) 5. L'elevata resistenza contro lo stress ossidativo permette EPC di funzionare in microambienti con specie elevati reattive dell'ossigeno (ROS) dopo danno ischemico 6. Precedenti studi hanno anche indicato che il numero di EPC potrebbe essere correlata alla riparazione vascolare e che un numero ridotto di circolazione EPC predice il verificarsi di eventi cardiovascolari 7,class = "xref"> 8. Tuttavia, una chiara definizione di una CPI non è stato ancora trovato. Fino ad ora, non vi è alcun indicatore superficie cellulare specifico o fenotipo coerente per EPC e queste cellule sono molto rari nel sangue periferico 9. Un EPC umana deve essere considerato come una cellula circolazione con la capacità di contribuire alla ricostruzione dell'endotelio feriti e nuove strutture vascolari.
Un modo di isolare e caratterizzare EPC è attraverso l'adesione alla fibronectina. In tal modo, la capacità di queste cellule viene usato per mostrare una adesione superiore alla fibronectina piatti rivestiti rispetto al tipo 1 collagene, per esempio 3, 10, 11. Tuttavia, altri hanno scoperto che la placcatura cellule mononucleate sui piatti fibronectina rivestite senza alcuna fase di purificazione precedente o ulteriormente porta a colonie comprese le cellule progenitrici mieloidi, monociti, linfociti T e 12, 13, 14. Inoltre, in questo caso, le piastrine potrebbero contaminare il (MNC) frazione di cellule mononucleate e quindi trasferire proteine di membrana plasmatica di eventuali cellule aderenti 15.
Oltre caratterizzazione mediante saggi di adesione in vitro, una combinazione di diversi marcatori di superficie cellulare viene usato per descrivere un tipo di cellula considerata come EPC. In questo caso, dopo l'adesione fibronectina-mediata, le cellule vengono analizzati preoccupanti loro attributi endoteliali-like. In questo processo, i due marcatori di cellule endoteliali-associata, lipoproteine a bassa densità acetilata (acLDL) e fattore di crescita vascolare endoteliale del recettore 2 (VEGFR-2, U), giocano un ruolo. Le cellule endoteliali e macrofagi hanno dimostrato di prendere specificamente fino acLDL in un processo chiamato "percorso delle cellule scavenger" 16. Un'altra proteina marcatore è KDR come il recettore VEGF principale endotelialecellule 17. Tuttavia, come EPC in generale sono coltivate in mezzi supplementato con fattori di crescita endoteliali e siero fetale di vitello, è possibile che i macrofagi, che potrebbe anche essere stato erroneamente isolato, presentano un profilo marcatore endoteliale-like. Come precedentemente indicato, se coltivate in un mezzo-endoteliale condizionata, macrofagi esprimono proteine "specifici endoteliali" 18.
In generale, ci sono due categorie di EPC all'interno più sottotipi, che possono essere trovati nel sangue o essere coltivate in vitro. Late-escrescenza EPC (fine-EPC) compaiono dopo 2-3 settimane di cultura. Queste cellule sono integrati velocemente in un monostrato di vena ombelicale cellule endoteliali umane e possono formare tubi capillari 19. Inoltre, cosiddetto "early-EPC" circolare nel sangue per circa una settimana e agire in maniera più passiva attraverso consegnano molecole angiogeniche, come la crescita endoteliale vascolarefactor (VEGF), o CXCL8 19. I pazienti con malattia coronarica (CAD) hanno mostrato significativamente minori quantità di early-EPC rispetto ad un gruppo di controllo senza CAD 20. È interessante notare che lo stesso gruppo ha mostrato una maggiore quantità di fine-EPC rispetto ad un gruppo di controllo. Un altro studio ha mostrato che i primi-EPC proteggere EPC differenziate da apoptosi in condizioni di ossidazione in modo paracrino 6. Pertanto, primi EPC potrebbero fornire effetti protettivi pertinenti attraverso la migrazione di altre cellule in maniera automatica o paracrino nel sangue periferico.
Questo protocollo descrive un metodo per purificare early-EPC dapprima isolando il PBMC in frazioni da sangue periferico umano e successivamente isolare cellule CD34 + da PBMC in frazioni per cancellare questa sospensione cellulare da cellule indesiderate. CD34 è un marcatore, che viene utilizzato per l'isolamento di cellule staminali ematopoietiche umane 9 . In seguito, le cellule CD34 + sono coltivate su terreni di coltura tissutale fibronectina rivestite. Dopo tre giorni, il mezzo viene cambiato, perdendo quindi tutte le cellule non aderenti. Infine, EPC isolati sono macchiati per verificare l'assorbimento di acLDL e la presenza di KDR come cellule endoteliali-marcatore utilizzando cellule fluorescenza attivate (FACS). Come marcatore addizionale, abbiamo analizzato piastrine molecola di adesione delle cellule endoteliali (PECAM-1, CD31), che si verifica anche sulle cellule endoteliali.
Restauro del tessuto miocardico danneggiato o infartuato da una maggiore assunzione di EPC appartiene alle strategie di trattamento intensivo indagati nelle malattie cardiovascolari. Tuttavia, la definizione di risultati sperimentali nella pratica clinica è ancora difficile, data la complessa interazione cellulare nel corpo umano durante varie condizioni fisiopatologiche. Inoltre, l'ho infarto / Infortuni R innescare una eccessiva secrezione di varie citochine, ormoni e fac crescita tori, che controllano la homing di EPC alle regioni di formazione dei vasi sanguigni 13. Come già evidenziato, CXCL8, stromali fattore derivato dalle cellule 1α (SDF-1α, CXCL12), VEGF e il fattore inibitorio della migrazione dei macrofagi (MIF) sono significativamente aumentata nei campioni di siero dopo danno miocardico I / R 1. Tra questi fattori, MIF è una citochina chemochine simile pleiotropica con caratteristiche prevalentemente pro-infiammatori. In contrasto con il suo nome storico, MIF ha funzioni pro-migratorie, agendo come un vero chemochine su vari tipi cellulari 1, 21, 22. Processi di reclutamento delle cellule MIF-mediate sono stati collegati alla recettori per le chemochine CXCR2 e CXCR4, che MIF si lega ed attiva in modo non-cognate 21. Da segnalare, EPC esprimono entrambi questi recettori sulla loro superficie, che in aggiunta diventano up-regolati in condizioni di ipossiaass = "xref"> 23, 24. Inoltre, prove accumulando suggerisce che MIF ha un effetto complessivo cardio-protettivo durante I / R pregiudizio del cuore 22, 25, 26. In questo contesto, è stato ulteriormente dimostrato che MIF può supportare la neovascolarizzazione durante stress ipossico di particolare rilevanza, quando si considerano i meccanismi di recupero limitati del miocardio danneggiato 27. Precedenti studi in vitro ed esperimenti in modelli murini di pre-clinici forniti prima testimonianza sul ruolo della MIF in EPC assunzioni 4. Da segnalare, anche MIF è un importante proteina carico di EPC che possono essere immesse durante EPC reclutamento all'interno di siti ischemici 28. Tuttavia, gli studi in ambienti clinici, in particolare in confronto con gli altri (angiogenici) citochine nel siero rimangono sfuggente.
Protocollo
Il sangue per l'isolamento di EPC è stato ottenuto da volontari sani, dopo consenso informato secondo il comitato etico locale. I campioni di siero utilizzati nei saggi di migrazione sono stati ottenuti da pazienti sottoposti a chirurgia cardiaca convenzionale con l'uso del bypass cardiopolmonare (CPB). I criteri di esclusione erano operazioni di emergenza, la gravidanza accertata o sospetta, patient`s età inferiore a 18 anni, e il fallimento di ottenere il consenso informato. I campioni di siero sono stati elaborati oltre alle misurazioni di routine clinici (immediatamente prima dell'intervento e subito dopo riperfusione miocardica / apertura aortico cross-clamp) e successivamente conservati a -80 ° C fino all'analisi finale. Il comitato di revisione istituzionale (comitato etico, RWTH Aachen University) ha approvato questo studio. I pazienti hanno mostrato una età media di 68,6 anni e un peso medio di 81,7 kg. malattie pre-esistenti inclusi: ipertensione (65%), malattia polmonare cronica (19%), arteriopatia cardiaco extra (16%), disfunzione cerebrale (6%), angina instabile (3%), infarto miocardico recente (28% entro 90 d), malattia renale cronica (14%), malattie epatiche (2%) e diabete (34%).
1. Rivestimento di T75 Flask:
- Preparare 5 soluzione fibronectina ml (1 mg fibronectina umana diluito in 15 ml di acqua ultrapura) per bombola T75.
- Aggiungere la soluzione in un pallone T75 e attendere finché non viene evaporata l'acqua. Per evitare inutili interruzioni durante il processo di isolamento dovuto all'evaporazione, eseguire questo processo in anticipo (ad esempio durante la notte) ea temperatura ambiente. Questa soluzione dà 4,44 mcg fibronectina / cm 2.
- Preparare la crescita delle cellule endoteliali medio MV2 integrando il supporto MV2 basale con la crescita integratori fattore fornite dal produttore.
2. Isolamento di cellule progenitrici endoteliali (EPC) da 60 ml di sangue:
NOTA: Come il CD34-positivo selezione di cocktail unnd le perline magnetiche sono disponibili in commercio in un kit selezione combinato, non esistono concentrazioni fornite dal produttore. Tuttavia, circa 100 microlitri di anticorpo sono sufficienti per elaborare fino a 5 x 10 8 cellule. Le sfere magnetiche sono diluiti in acqua, destrano rivestito e circa 5,000x più piccola rispetto ad altre perle disponibili in commercio. Per ulteriori informazioni, consultare le istruzioni del fabbricante.
- Mescolare il sangue (con o senza anticoagulanti) 1: 1 con il Ca 2+ 2+ -Mg-free PBS.
- Aggiungere 15 ml di soluzione gradiente di densità per tubo da 50 ml. Per ulteriori informazioni, consultare le istruzioni del fabbricante.
- Lentamente strato il sangue diluito in cima alla soluzione gradiente di densità.
- Centrifugare i campioni a 2.500 xg per 30 min con accelerazione lenta e senza frenatura.
- Raccogliere accuratamente lo strato di buffy coat di ogni tubo (Figura 1) usando una pipetta di plastica sterile e metterlo in un altro tubo.Evitare di raccolta della soluzione gradiente di densità. La resa PBMC atteso è di circa 3-4 x 10 6 cellule / ml di sangue.

Figura 1: Densità centrifugazione in gradiente di Bbuffy Coat su Ficoll Solution. Viene mostrato il risultato del gradiente di centrifugazione densità a 2.500 xg per 30 min sulla soluzione gradiente di densità. Raffigurato sono eritrociti e granulociti (rosso), la frazione di cellule mononucleate (strato bianco), plasma (giallo), e la soluzione gradiente di densità (biancastra). Clicca qui per vedere una versione più grande di questa figura.
- Diluire la frazione di cellule mononucleate del sangue periferico con almeno 3 volumi di PBS e mescolare. Centrifugare a temperatura ambiente per 15 min a 200 x g.
- Ripetere il punto 2.6 due volte.
- Aspirare il surnatante e risospendere pellet di cellule in 5 ml MV2 medium.
- Aggiungere 100 microlitri di anticorpo CD34 umano (sufficiente per elaborare fino a 5 x 10 8 cellule) per buffy coat utilizzato e ruotare per 15 min a 37 ° C con 5% di CO 2.
- Aggiungere 50 ml di biglie magnetiche rivestite destrano per buffy coat utilizzato e ruotare per 10 min a 37 ° C con 5% di CO 2.
- Dopo l'incubazione, trasferire la sospensione per tubi FACS con un massimo di 3 ml in ciascun tubo. quantità maggiori non sarà consentita con il magnete.
- Inserire il tubo (s) FACS nel magnete (s) e attendere 5 minuti.
- Scartare il surnatante senza tirare i tubi FACS dal magnete.
- Risospendere le cellule in ciascun tubo FACS con 3 ml di mezzo MV2 di fuori del magnete.
- Ripetere i passaggi 2,12-2,14 due volte.
- Tirare i tubi FACS fuori dei magneti e risospendere le cellule in 3 ml di mezzo MV2.
- Trasferire la sospensione cellulare in pre-rivestito T75 Flasks e aggiungere 17 ml MV2 medio per bombola.
NOTA: Il mezzo deve essere cambiato dopo 3 giorni. Dopo una settimana, le cellule mostrano strutture mandrino-simili (Figura 2) e sono pronti all'uso. Per una trascuranza dell'isolamento vedi figura 3.
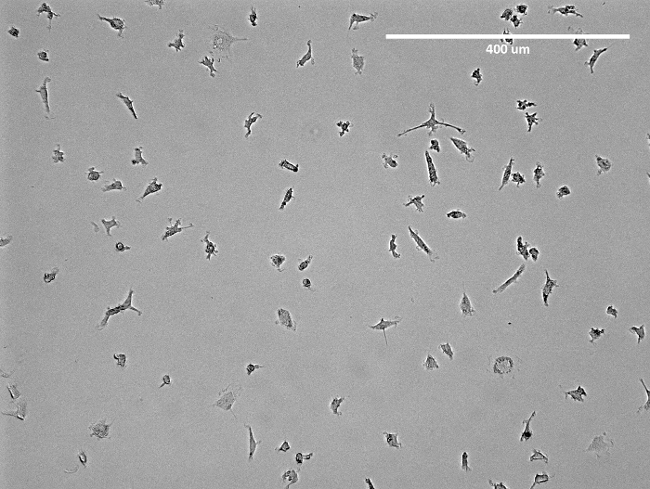
Figura 2: Immagine microscopica di EPC isolate. Viene mostrato un immagine rappresentativa di isolato precoce EPC in un pallone T75 prima di distacco. Apparente è la struttura del mandrino-simile del EPC. Clicca qui per vedere una versione più grande di questa figura.
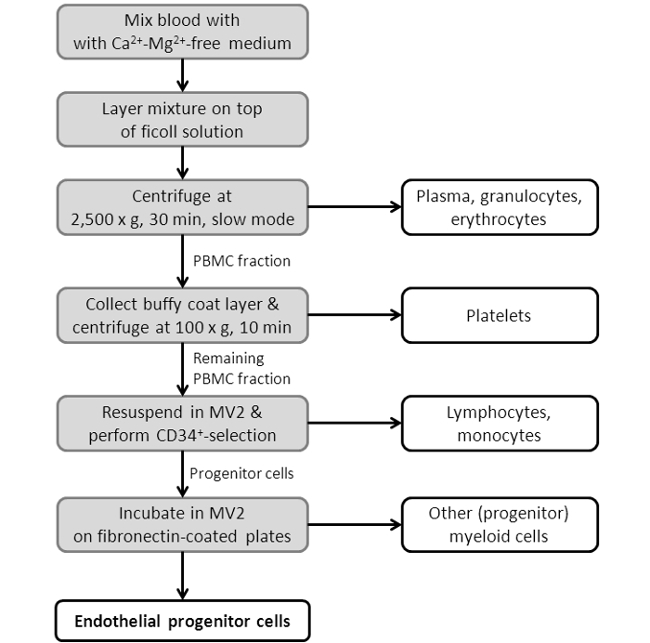
Figura 3: diagramma di flusso che mostra la procedura di isolamento EPC. Raffigurato è uno schema, spettacoloing delle singole fasi del protocollo isolamento EPC. Per un protocollo più dettagliata si veda la Sezione 2 nella sezione del protocollo.
3. Migrazione Assay
- Rimuovere il supporto dal EPC nel pallone T75.
- Lavare con 5 ml di PBS agitandolo con attenzione.
- Rimuovere PBS e aggiungere 5 ml di soluzione commerciale distacco delle cellule. Attendere fino a quando le cellule si staccano (verificare al microscopio). Accelerare il distacco toccando con cura il fondo del pallone.
- Quando le cellule vengono staccate, aggiungere rapidamente 5 ml di terreno completo MV2 e trasferire la sospensione cellulare in un altro tubo.
- Centrifugare a 2000 xg per 5 min.
- Risospendere le cellule in 5-10 ml di PBS e centrifugare nuovamente a 2.000 xg per 5 min.
- Ripetere il punto 3.6.
- Risospendere il pellet cellulare in MV2 medio fame (50.000 cellule in sono necessari 75 microlitri per la trasmigrazione bene).
NOTA: Quale sistema di migrazione è necessario dipende dal tipo di cellula e saggio. Vi sono diff diametri erenti pori e dimensioni piatto (numero di pozzi). Per EPC una dimensione dei pori di 5 micron di 96 sistema ben è ottimale. - Preparare la piastra di migrazione aggiungendo 235 ml di campione di siero (siero diluito 1: 5 in MV2 medio fame) nella camera inferiore (figura 4).
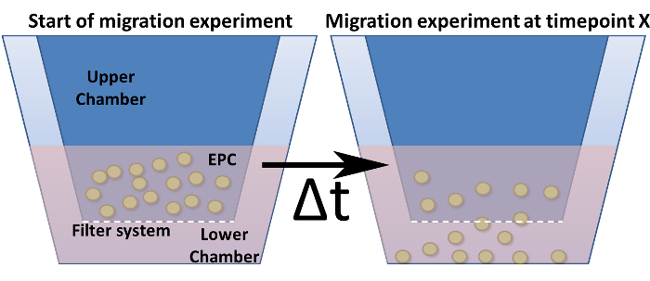
Figura 4: Migrazione Assay in una camera di Boyden modificata. Viene mostrato il disegno generale di una camera di Boyden modificata. Gli inserti di coltura cellulare (= camera superiore) sono indicati in blu scuro e vengono inseriti nella camera inferiore. Il fondo (ma non le pareti) di questi inserti rappresenta il sistema di filtro inclusi i pori. (A) mostra la configurazione al punto di tempo zero. (B) Dopo un punto di tempo prescelto, le cellule sono migrate attraverso il filtro verso uno stimolo.fig4large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
- Aggiungere l'inserto poco prima di aggiungere la soluzione di cellule.
- Aggiungere 75 ml della soluzione di cellule (= 50.000 cellule) nella camera superiore.
- Sia l'EPC migrare per 3 ore a 37 ° C e CO 5% 2 (tempo di migrazione dipende dal tipo di cellula e del sistema).
- Per evitare di siero manufatti auto-fluorescenza, quantificare le cellule migrate per scattare foto del pozzo sotto un microscopio e contare le cellule utilizzando il software semi-automatico "ImageJ".
- Rimuovere la camera superiore (che contiene tutte le cellule non migrati).
- Aggiungere 70 ml soluzione di paraformaldeide 3,6%, tra cui la Hoechst colorante (diluito 1: 1.000). La piastra può essere conservato a 37 ° C e 5% CO 2 durante la notte.
- Centrifugare la piastra a breve per ottenere tutte le cellule nello stesso piano focale a 2.000 g per 1-2 min.
- Prendere 5 immagini per well (figure 5 e 6) con un ingrandimento 100x.
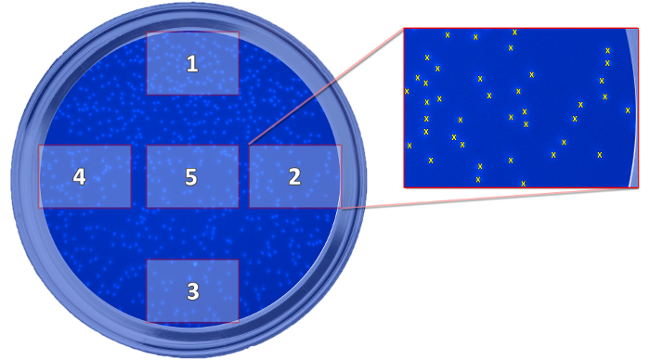
Figura 5: Schema che mostra la posizione delle foto scattate. Lo schema raffigura la posizione dei cinque immagini riprese, che sono necessari per la determinazione di cellule migrate, in relazione al pozzo. Le immagini sono prese a contare le cellule e calcolare un valore medio per ogni bene. Clicca qui per vedere una versione più grande di questa figura.

Figura 6: Immagine microscopica delle cellule per la quantificazione. Viene mostrato un'immagine rappresentativa, che è stata presa per la quantificazione delle cellule. Le cellule sono state colorate e USI fissing Hoechst colorante nel 3,6% paraformaldeide. I punti rappresentano fissate e colorate le cellule progenitrici endoteliali. Clicca qui per vedere una versione più grande di questa figura.
- Contare le cellule migrate utilizzando il software semi-automatico "ImageJ" da parte del National Institute of Health.
Risultati
Caratterizzazione di isolati cellule endoteliali progenitrici
Innanzitutto, l'assorbimento di acLDL stata verificata, così come l'espressione di KDR e CD31 sulla superficie della popolazione di cellule isolate. Come mostra la figura mostra 7a, 85,1% delle EPC isolati ha mostrato un assorbimento di acLDL ed espresso CD31. Le figure 7b e 7c mostrano inoltr...
Discussione
La prima parte di questo studio comprendeva l'isolamento di EPC umani da sangue periferico di volontari sani per consentire una valutazione globale del sangue di pazienti sottoposti a chirurgia cardiaca. Pertanto, una centrifugazione in gradiente di densità è stata eseguita per separare la frazione PBMC dal plasma, granulociti e eritrociti. Per rimuovere la maggior parte delle piastrine contaminanti, questa frazione cellulare è stata sottoposta a breve e lavaggio lento passaggi 29,
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori non hanno riconoscimenti.
Materiali
| Name | Company | Catalog Number | Comments |
| Fibronectin | Biochrom AG | L7117 | Coating of T-75 flasks |
| Aqua ad iniectabilia | Fresenius Kabi | ||
| Endothelial cell growth medium MV2 | Promo Cell | C-22221 | |
| Endothelial cell growth medium MV2 SupplementMix | Promo Cell | C-39226 | |
| Ficoll-Paque plus | GE Healthcare | 17-1440-03 | Density centrifugation |
| EasySep human CD34 positive Selection Kit | Stemcell Technologies | 18056 | Isolation of CD34+ cells |
| EasySep magnet | Stemcell Technologies | 18000 | |
| Accutase | Sigma-Aldrich | A6964-100ML | Detachment of cells |
| Corning HTS transwell 96 well permeable supports | Sigma-Aldrich | CLS3387-8EA | Migration system |
| Hoechst solution | ThermoFisher | 33342 | Staining of migrated cells |
| ImageJ | National institutes of health | xxx | Counting of migrated cells |
Riferimenti
- Emontzpohl, C., et al. Key role of MIF in the migration of endothelial progenitor cells in patients during cardiac surgery. Int J Cardiol. 181C, 284-287 (2014).
- Smadja, D. M., et al. Interleukin 8 is differently expressed and modulated by PAR-1 activation in early and late endothelial progenitor cells. J Cell Mol Med. 13 (8B), 2534-2546 (2009).
- Asahara, T., et al. Isolation of putative progenitor endothelial cells for angiogenesis. Science. 275 (5302), 964-967 (1997).
- Simons, D., et al. Hypoxia-induced endothelial secretion of macrophage migration inhibitory factor and role in endothelial progenitor cell recruitment. J Cell Mol Med. 15 (3), 668-678 (2011).
- Dernbach, E., et al. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Blood. 104 (12), 3591-3597 (2004).
- Yang, Z., et al. Paracrine factors secreted by endothelial progenitor cells prevent oxidative stress-induced apoptosis of mature endothelial cells. Atherosclerosis. 211 (1), 103-109 (2010).
- Asahara, T., Kawamoto, A., Masuda, H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 29 (11), 1650-1655 (2011).
- Schmidt-Lucke, C., et al. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair. Circulation. 111 (22), 2981-2987 (2005).
- Yoder, M. C. Human endothelial progenitor cells. Cold Spring Harb Perspect Med. 2 (7), a006692 (2012).
- Ito, H., et al. Endothelial progenitor cells as putative targets for angiostatin. Cancer Res. 59 (23), 5875-5877 (1999).
- Hill, J. M., et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk. N Engl J Med. 348 (7), 593-600 (2003).
- Yoder, M. C., et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals. Blood. 109 (5), 1801-1809 (2007).
- Rohde, E., et al. Blood monocytes mimic endothelial progenitor cells. Stem Cells. 24 (2), 357-367 (2006).
- Rohde, E., et al. Immune cells mimic the morphology of endothelial progenitor colonies in vitro. Stem Cells. 25 (7), 1746-1752 (2007).
- Prokopi, M., et al. Proteomic analysis reveals presence of platelet microparticles in endothelial progenitor cell cultures. Blood. 114 (3), 723-732 (2009).
- Voyta, J. C., Via, D. P., Butterfield, C. E., Zetter, B. R. Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein. J Cell Biol. 99 (6), 2034-2040 (1984).
- Koch, S., Claesson-Welsh, L. Signal transduction by vascular endothelial growth factor receptors. Cold Spring Harb Perspect Med. 2 (7), a006502 (2012).
- Hirschi, K. K., Ingram, D. A., Yoder, M. C. Assessing identity, phenotype, and fate of endothelial progenitor cells. Arterioscler Thromb Vasc Biol. 28 (9), 1584-1595 (2008).
- Hur, J., et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis. Arterioscler Thromb Vasc Biol. 24 (2), 288-293 (2004).
- Tagawa, S., et al. Determination of Early and Late Endothelial Progenitor Cells in Peripheral Circulation and Their Clinical Association with Coronary Artery Disease. Int J Vasc Med. , 2015 (2015).
- Bernhagen, J., et al. MIF is a noncognate ligand of CXC chemokine receptors in inflammatory and atherogenic cell recruitment. Nat Med. 13 (5), 587-596 (2007).
- Stoppe, C., et al. Interaction of MIF Family Proteins in Myocardial Ischemia/Reperfusion Damage and Their Influence on Clinical Outcome of Cardiac Surgery Patients. Antioxid Redox Signal. 23 (11), 865-879 (2015).
- Kanzler, I., et al. Differential roles of angiogenic chemokines in endothelial progenitor cell-induced angiogenesis. Basic Res Cardiol. 108 (1), 310 (2013).
- Walenta, K. L., Bettink, S., Bohm, M., Friedrich, E. B. Differential chemokine receptor expression regulates functional specialization of endothelial progenitor cell subpopulations. Basic Res Cardiol. 106 (2), 299-305 (2011).
- Rassaf, T., Weber, C., Bernhagen, J. Macrophage migration inhibitory factor in myocardial ischaemia/reperfusion injury. Cardiovasc Res. 102 (2), 321-328 (2014).
- Stoppe, C., et al. High postoperative blood levels of macrophage migration inhibitory factor are associated with less organ dysfunction in patients after cardiac surgery. Mol Med. 18, 843-850 (2012).
- Amin, M. A., et al. Migration inhibitory factor mediates angiogenesis via mitogen-activated protein kinase and phosphatidylinositol kinase. Circ Res. 93 (4), 321-329 (2003).
- Kupatt, C., et al. Embryonic endothelial progenitor cells expressing a broad range of proangiogenic and remodeling factors enhance vascularization and tissue recovery in acute and chronic ischemia. FASEB J. 19 (11), 1576-1578 (2005).
- Colotta, F., et al. Expression of a monocyte chemotactic cytokine by human mononuclear phagocytes. J Immunol. 148 (3), 760-765 (1992).
- Casale, T. B., Kaliner, M. A rapid method for isolation of human mononuclear cells free of significant platelet contamination. J Immunol Methods. 55 (3), 347-353 (1982).
- Lewandowska, K., Kaplan, D., Husel, W. CD34 expression on platelets. Platelets. 14 (2), 83-87 (2003).
- Stellos, K., et al. Platelet-derived stromal cell-derived factor-1 regulates adhesion and promotes differentiation of human CD34+ cells to endothelial progenitor cells. Circulation. 117 (2), 206-215 (2008).
- Thornton, M. A., Poncz, M. In vitro expansion of megakaryocytes from peripheral blood hematopoietic progenitors. Methods Mol Med. 31, 337-345 (1999).
- Ivetic, N., et al. Producing megakaryocytes from a human peripheral blood source. Transfusion. 56 (5), 1066-1074 (2016).
- Friedrich, E. B., Walenta, K., Scharlau, J., Nickenig, G., Werner, N. CD34-/CD133+/VEGFR-2+ endothelial progenitor cell subpopulation with potent vasoregenerative capacities. Circ Res. 98 (3), e20-e25 (2006).
- Wijelath, E. S., et al. Novel vascular endothelial growth factor binding domains of fibronectin enhance vascular endothelial growth factor biological activity. Circ Res. 91 (1), 25-31 (2002).
- Hulkower, K. I., Herber, R. L. Cell migration and invasion assays as tools for drug discovery. Pharmaceutics. 3 (1), 107-124 (2011).
- Yao, E. H., et al. Effects of the antioxidative beta-blocker celiprolol on endothelial progenitor cells in hypertensive rats. Am J Hypertens. 21 (9), 1062-1068 (2008).
- Takahashi, T., et al. Ischemia- and cytokine-induced mobilization of bone marrow-derived endothelial progenitor cells for neovascularization. Nat Med. 5 (4), 434-438 (1999).
- Kawamoto, A., et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation. 103 (5), 634-637 (2001).
- Kim, B. S., et al. Myocardial Ischemia Induces SDF-1alpha Release in Cardiac Surgery Patients. J Cardiovasc Transl Res. 9 (3), 230-238 (2016).
- Frangogiannis, N. G., Smith, C. W., Entman, M. L. The inflammatory response in myocardial infarction. Cardiovasc Res. 53 (1), 31-47 (2002).
- Zernecke, A., Bernhagen, J., Weber, C. Macrophage migration inhibitory factor in cardiovascular disease. Circulation. 117 (12), 1594-1602 (2008).
- White, D. A., et al. Pro-inflammatory action of MIF in acute myocardial infarction via activation of peripheral blood mononuclear cells. PLoS One. 8 (10), e76206 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon