Method Article
אוטומטית פרוטוקולים עבור התגבשות Macromolecular במעבדה MRC של הביולוגיה המולקולרית
In This Article
Summary
מערכות אוטומטיות, פרוטוקולים עבור הכנת כמות גדולה של מסכי שגרתית ו nanoliter טיפות התגבשות לניסויים דיפוזיה אדי תיאר, דנו.
Abstract
כאשר גבישים באיכות גבוהה מתקבלים זה מכמותה צילומי רנטגן, עשוי לפתור את מבנה גבישי ליד ברזולוציה אטומית. התנאים כדי לגבש חלבונים, DNAs, RNAs ואת מתחמי שלהם עם זאת לא ניתן לחזות. העסקת במגוון רחב של תנאים היא דרך להגברת איכות עקיפה גבישים. שתי מערכות אוטומטית לחלוטין פותחו ב MRC מעבדה לביולוגיה מולקולרית (קיימברידג ', אנגליה, MRC-LMB) המאפשרים התגבשות הקרנה נגד תנאי ראשוני 1,920 על ידי אדי פיזור טיפות nanoliter. פרוטוקולים אוטומטיים למחצה גם פותחו כדי למטב את התנאים על-ידי שינוי הריכוזים של ריאגנטים, ה-pH, או על ידי החדרת תוספים המשפרים באופן פוטנציאלי מאפיינים של הקריסטלים וכתוצאה מכך. כל הפרוטוקולים המתאים להיות מתוארות בפרוטרוט ודן בקצרה. יחדיו, הם מאפשרים נוחה ויעילה מאוד macromolecular התגבשות במתקן מרובת-משתמשים, תוך מתן למשתמשים שליטה על פרמטרים מרכזיים של הניסויים שלהם.
Introduction
קריסטלוגרפיה באמצעות קרני רנטגן מוחל נרחב כדי לקדם את ההבנה שלנו של מנגנונים ביולוגיים ומחלות בשלב האטומי וכדי לסייע לאחר מכן גישות רציונלי גילוי סמים1. בשביל זה, מטוהרים, מרוכז (2-50 מ"ג/מ"ל) דוגמאות macromolecular של חלבון, DNA, RNA, אחר ליגנדים מתחמי שלהם הם trialed עבור שלהם נטיה טופס הזמנת סורגים תלת מימדי התגבשות2,3 ,4. כאשר גבישים באיכות גבוהה מתקבלים זה מכמותה צילומי רנטגן, עשוי לפתור את מבנה גבישי ליד ברזולוציה אטומית5,6. ויותר חשוב, לא ניתן לחזות את התנאים כדי לגבש מדגם הרומן, התשואה של גבישים באיכות גבוהה בדרך כלל נמוך מאוד. הסיבה הבסיסית היא דוגמאות רבות עניין מאתגר מאפייני הביוכימי, ההופכים אותם לא יציב על ציר הזמן המתאים עבור התגבשות (בדרך כלל כמה ימים). בסופו של דבר, התהליך מורכב את הזמן הנדרש כדי לייצר גרסאות מדגם ודוגמאות, וכדי לייעל את טיהור וגיבוש -7,8.
תנאי התגבשות הוא פתרון עם precipitant המפחיתה מדגם מסיסות, תנאים מכילים לעתים קרובות גם מאגרים ותוספים. מאות כאלה ריאגנטים מתאימים היטב כדי לשנות את הפרמטרים של הניסויים התגבשות כפי שיש להם נטיה נמוכה להתערב עם שלמות הדגימה (כגון חלבון או חומצות גרעין התגלגלות). ואילו בדיקות מיליונים of שילובים of התגבשות ריאגנטים הוא לא ריאלי, בדיקה כמה הרבה ערכות הקרנה - גיבש עם אסטרטגיות שונות9,10 - אפשרי עם ניסויים ולמחקר ופרוטוקולים אוטומטית. בפרספקטיבה הזו, הטכניקה נוח ביותר היא כנראה אדי דיפוזיה עם 100-200 nL טיפות יושב על באר קטן מעל מאגר המכיל את התנאי התגבשות (25-250 µL), מיושמת צלחות מיוחדות התגבשות11 , 12. תנאי ולדגום החלבון משולבים לעתים קרובות ביחס 1:1 עבור הנפח הכולל של 200 nL בעת הגדרת את טיפות בבארות העליונה. ניתן ליישם התגבשות חלבון nanoliter רובוטית עם טכניקות חלופיות, צלחות כגון שמן שפרמיה אצווה13 ושלב מעוקבים Lipidic14 (אחד האחרונים מיושמת באופן ספציפי הטרנס-הממברנה חלבונים הנמצאים מאוד מסיסות במים).
המתקן התגבשות-MRC-LMB החלה בתחילת שנות האלפיים, סיכום מוקדם של פרוטוקולים אוטומטיים שלנו הוצג בשנת 200515. הקדמה היסטורית חלבון התגבשות הוצג ולגשת גם חלוקה לרמות את היתרונות של nanoliter רובוטית (ואז גישה מוזרה לניסויים בבעלי חיים שגרתיים). מאז התגבשות macromolecular הוא בעצם תהליך סטוכסטי עם מעט מאוד או לא שימושי מידע מוקדם, העסקת במגוון רחב של מחלות הראשונית (מתאים) להגדיל את התשואה של איכות עקיפה קריסטלים16. חוץ מזה, יתרון-מתעלמים של מסך גדול הראשונית היא להפחית באופן משמעותי את הצורך אופטימיזציה של גבישים במקרים רבים ודוגמאות. כמובן, אחד עשוי עדיין צריכים להמשיך עם אופטימיזציה של כמה תנאים הראשונית מאוחר יותר. בדרך כלל, הריכוז של ריאגנטים, ה-pH ואז באופן שיטתי נחקרות. ריאגנטים יותר ניתן גם להזרים את תנאים אופטימליים יותר לשנות פרמטרים של התגבשות. בהחלט, אחד צריך לנסות התגבשות עם מדגם הטרי, ומכאן הפרוטוקולים המתאימים להיות פשוטה וזמינה בכל עת.
כאן, שתיים אוטומטי לחלוטין מערכות תוכנן ב- MRC-LMB (מערכות 1 ו-2), הפרוטוקולים המתאימים מתוארים באופן מלא. היישום העיקרי של שתי מערכות אלה היא ראשונית ההקרנה על ידי פיזור אדי יושב טיפה התגבשות צלחות. מערכת 1 משלבת מלווה נוזלי, של קרוסלה אוטומטית ללוחות מניות, מדפסת הזרקת דיו של צלחת תיוג של סילר לאיטום צלחת דבק. במערכת 1, צלחות 96-ובכן 72 מלא עם ערכות זמינים מסחרית ההקרנה (80 µL של מצב יועברו למאגר מ נפח ההתחלתי של 10 מ"ל במבחנות), שכותרתו, אטום. הלוחות מאוחסנים ואז חממה 10 ° C שיהיו זמינים למשתמשים בכל עת (כמו מסכי הראשוני הנקרא 'LMB צלחות').
מערכת 2 משלב מלווה נוזלי, מתקן nanoliter, סילר לאיטום של צלחת דבק. במערכת 2, יושב טיפות (100-1, 000 nL) לניסויים דיפוזיה אדי מיוצרים על ידי שילוב של תנאים, המדגם בבארות העליונה של 20 צלחות 48 - או 96-ובכן מראש מתמלאת תנאים. משמעות הדבר היא תנאי ההקרנה הראשונית 1,920 הם trialed בעת שימוש 20 צלחות LMB על מערכת 2.
רובוטים משמשים גם בנפרד עבור אופטימיזציה של התנאים שנבחרו, הפרוטוקולים חצי אוטומטי המתאים מתוארים גם. שיטה 4-בפינת ה-17 הוא מועסק באופן שגרתי כדי לייצר מסכי אופטימיזציה. הפרוטוקול המתאים הראשון דורש הכנה ידנית של 4 פתרונות ("A, B, C ו- D'). שני מעברי צבע ליניאריים של ריכוזים (עבור שני סוכנים התגבשות הראשי) ואז נוצרות באופן אוטומטי ישירות לתוך המאגרים של צלחת התגבשות. בשביל זה, המטפל נוזלי המבוסס על המזרק dispenses הפתרונות בפינה-יחס שונה.
כדי לייעל עוד יותר תנאי, אחד יכול להעסיק מסכי תוסף זה פוטנציאל לשפר את המאפיינים של גבישים וכתוצאה מכך18. שתי הגישות זמינים להקרנה מוספים: פרוטוקול מתחיל עם תוספים בגליל לתוך המאגרים של התגבשות צלחות לפני שתגדיר את טיפות (פרוטוקול 1) ופרוטוקול אחר שבו המסך תוסף זה בגליל ישירות על גבי טיפות (פרוטוקול 2).
התפתחויות שימושיות אחרות היו ביוזמת MRC-LMB כדי להקל על התגבשות macromolecular אוטומטיות, מוצגים גם. בעיקרו של דבר, התגבשות צלחות ומכשירים המשויכים כגון משתלבת החברה של למערכות ביולוגיות ההקרנה (SBS) מכסה את זה ממזער אידוי של תנאים כאשר באמצעות מערכת 2.
לשם קיצור, ההנחה היא כי המשתמשים הם מכירים הפונקציות הבסיסיות ואת התחזוקה של מנפק nanoliter למדפסת הזרקת דיו, חותם צלחת דבק. אלא אם צוין אחרת, צלחות על סיפונה של הרובוטים ימוקמו כך טוב A1 ('A1-הפינה') היא לכיוון הפינה השמאלית האחורית של נשאית צלחת.
Protocol
1. שני אוטומטי לחלוטין מערכות (מיון ראשוני)
-
מערכת 1: הכנת לוחות 96-ובכן התגבשות 72 מלא עם הקרנת ערכות (LMB צלחות)
- לפני ביצוע ההליך, ודא הרובוטים של המערכת יאותחלו תוכנת השליטה שלהם פתוחה. הפעל את chiller של קירור-צינור המוביל בערך 30 דקות לפני התוכנית הראשית יופעל.
- מניחים צלחת מבחן על המוביל SBS ממונע של חותם צלחת. חותם צלחת ולרוץ לבדוק כי הסרט הוא מיושם כהלכה. לחזור על בדיקה זו עוד פעמיים כדי לוודא חותם צלחת מוכנה.
- לאחר מכן, להוסיף 20 לליטר מים יונים המכל הראשי של המטפל נוזלי. נתק את הכיסויים צימוד של המכולה קטן (20% אתנול שטיפה פתרון) וחבר את המכסים המכל הראשי.
- הזן את שם המסך המתאים (טבלה 1) על המגע מדפסת הזרקת דיו. לאחר מכן, לפתוח ולסגור את הדלת קרוסלה להזניק את הסיבוב בקרוסלה. פתח את הדלת כאשר הערימה הראשון מציג את עצמו.
- מלא לטעון הערימה הראשון עם 22 לוחיות התגבשות, כל אחד עם עמודה 1 מול החוצה. מלא לטעון את הערימות שני הבא באותו אופן.
- לטעון את הצלחות 6 הנותרים בעמדות הגבוהות של הערימה הרביעית. סגרי את הדלת קרוסלה.
- ודא כי התצוגה chiller מציין 14 ° C. בעדינות, שוב ושוב היפוך ערכות ההקרנה שנבחר במשך דקה אחת. לאחר מכן, לפתוח את הפאנל הקדמי של המטפל נוזלי.
- פתח הצינורות ומניחים שבתא הקירור לפי התוכנית 96-ובכן תקן (A1, A2, וכו '.). בעת הצבת כל שפופרת במנשא, במקום המכסה על מגש בפריסה 96-ובכן אותו.
- להצליב הצינור עמדות ולוודא לכל הצינורות ברמה התיישבו במנשא. לאחר מכן, סגור את הפאנל הקדמי.
- בחלון 'אתחול' של התוכנה המפעילה נוזלי, בחר "בניהול אחזקה", פתח את התוכנית שטיפה. הפעל את התוכנית ריקון האתנול 20% מן המערכת, כדי לשטוף את דן טיפים לחילוק נוזלי.
- לאחר שטיפה הושלם, לחץ על 'ביטול' כדי לחזור 'אתחול'. בחר 'הפעל תהליך הקיים' ולחץ על "התחל את הבחירה שלך". פתח את התוכנית 'dispensing ערכת MRC'. מלא "18" עבור "מופעים" בתצורת מסך ולהפעיל את התוכנית.
- צג המערכת כפי קודם ארבעת הלוחות מסומנות, מלא, והוא חתום.
- לאחר כל הצלחות 72 היה מוכן להציב בחזרה הקרוסלה, להחליף את הכיסויים צימוד מהגורם הראשי אל המיכל קטן. הפעל את התוכנית 'הפעלת רצף' (ראה שלב 1.1.10).
- כבה את chiller ולמחוק את רוקן הקרנת ערכת צינורות. הסר בזהירות את הצלחות מוכן 72 מ הקרוסלה. ביטול מלא באופן שגוי או צלחות גרוע אטום. חנות את הלוחיות מוכן לשימוש ב- 10 מעלות צלזיוס.
-
מערכת 2: הגדרת טיפות התגבשות (חלבון nL 100 + 100 מצב nL) מתוך מדגם יחיד ב- 20 LMB צלחות
- ראשית, ודא הרובוטים של המערכת הם על, מנפק nanoliter מאותחל עם התוכנה שלה פתוח, המנהל בשיטה של המטפל נוזלי פתוח. הפעל המוביל צינון microtube בערך 15 דקות לפני התוכנית הראשית יופעל.
- מניחים צלחת מבחן על המוביל SBS ממונע של חותם צלחת. הפעל חותם צלחת וודא כי הצלחת אטום כראוי. מבחן חותם צלחת שלוש פעמים.
- לאחר מכן, להפעיל מנפק nanoliter להגדיר 100-nL טיפות של פתרון מבחן צלחת הבדיקה. בדוק במיקרוסקופ טיפות מוגדרות בצורה נכונה. לסגור את התוכנה מנפק nanoliter ולהסיר את הבלוק רצועת-מחזיק מן הסיפון.
- הכנס הבא, המחזיק צלחת אישית מעוצבת (לראות תוצאות נציג: התגבשות התקנים שפותחה LMB) לצלחת LMB עם הכמות היחסית הגבוהה של ריאגנטים נדיף בתנאים שלה (טבלה 1). הסר את הסרט דבק הצלחת.
- לפתוח את הפאנל הקדמי של המטפל נוזלי ומניחים את הצלחת יפתחו במרפסת, מאחורי המוביל הראשון הזזה (הזזה נושאות עשוי להיות שלף, כדי להקל על גישה).
- מכסים את הצלחת עם מכסה אלומיניום SBS. ליישב את המכסה לעבר הפינה השמאלית האחורית של המוביל על ידי הפעלת לחץ עדין לכיוון הפינה הנגדית של המכסה.
- . פתחי, לטעון לתוך נושאות הזזה, לכסות את הלוחות 19 הנותרים באותה דרך, עובד ביותר לתנאים לפחות תנודתי. לאחר המוביל קירור-microtube-4 ° C, כמצוין על-ידי אור ירוק, הסר את העטיפה שלו.
- חתוך את המכסה של microtube המכיל µL 440 (לפחות) של חלבון לדוגמה (טבלה 2). לוודא הדגימה יש ללא קצף מעל מניסקוס, כמו זה יפריע מערכת זיהוי נוזלי. מקם את הצינור בעמדה 1 של חברת קירור-microtube.
- מניחים צלחת PCR על סיפון נוזלי המטפל מול המוביל מתאם צלחת-המעבר. לאחר מכן, סגור את הפאנל הקדמי.
- לאחר טעינת הסיפון, ודא סיפון מתקן nanoliter ברור של גוש רצועת-מחזיק נושאות בירכתי המחסן עצה 50-µL ברורות של הכיסוי SBS אלומיניום.
- הממשק 'שיטת ניהול' המטפל נוזלי, בחר 'הגדר לוחות'. לעקוב אחרי האתחול של שתי מערכות ומלא את הפרמטרים לרוץ. בצע את ההנחיות של ממשק ניהול שיטה (ההנחיות, דמויות, מערכת ניהול המידע לעזור עם הכנה).
- בדוק היטב כי כל הנדרש רכיבים מוכנים ולאחר מכן התחל את התהליך.
- צג המערכת מנפק nanoliter שוקעת הטיפות בצלחת הראשונה, חותם צלחת לאחר מכן חותמות את הצלחת.
- לאחר כל 20 לוחות שהוכנו עם התגבשות טיפות, חזר באופן אוטומטי נושאות הזזה, לפתוח את הפאנל הקדמי ולהסיר בעדינות את הצלחות. בדוק כי הלוחות נסגרות כראוי לפני אחסונם על התגבשות.
- לנקות את המכסים SBS עם פתרון 20% אתנול לפני ערימות מהם, בצד שמאל של המטפל נוזלי לאחסון. למחוק את הצלחת ה-PCR ואת microtube.
- כבה המוביל צינון microtube ואת לנגב את הדחיסה. להשאיר מגבת נייר על גבי המשטח קריר יותר לספוג עוד יותר עיבוי. לאחר מכן, התקן מחדש את מכסה המוביל וסגור הפאנל הקדמי.
2. אופטימיזציה של התנאים
-
מבוסס על המזרק המטפל נוזלי: מפיק שני מעברי צבע ליניאריים של ריכוזים לתוך המאגרים של צלחת התגבשות (שיטת 4-פינה).
- ראשית, ודא המטפל נוזלי על מוטענים עם התוכנה שלה פתוח.
- בכרטיסיה 'מעבר צבע': לפתוח את התוכנית הנדרשת, בחר את סוג הצלחת התגבשות ונפח הסופי המאגרים (טבלה 3). הגדרת מתקדמות עבור 'vol שוט מקס' צריך תפחת מ- 6000 ל-3,000 בעת שימוש בפתרונות המכיל [אלכוהול איזופרופיל] > 10% v/v ו- [MPD] > 20% v / v
- להכין את? המזרקים. הכנס בוכנה כל מזרק (קצוות מחודדים למטה) ולהוסיפה האחורי של מזרקים החריצים המיועד מתחת לראש רובוט. טוויסט מזרק עם כיוון השעון כדי לנעול אותו בעמדה (התוכנית תתחיל רק עם? כל המזרקים נדרש מחובר כראוי).
- הכינו את שקתות. הסר את מסגרת מפלדת והכנס את שקתות. העמדות 4 משמאל תואמות 4 הפינות A, B, C, מתג ד לכרטיסייה 'הגדר' אשר מציגה את נפחי הפתרונות הנדרשים כל מזרק (על טבלה 3, 0.5 מ"ל נפח מת נוספו אמצעי האחסון מוצג). שופכים את הפתרונות פינה לתוך שקתות בהתאמה שלהם, להציב את המסגרת בחזרה על הסיפון (המסגרת מחזיקה בעמדה עם 2 מגנטים קטנים הממוקמים בחלקו הקדמי של הסיפון). דרך חלופית להמשיך עם שלב זה היא לשפוך את הפתרונות לתוך שקתות כאשר הם ממוקמים כבר על הסיפון.
- מניחים את הצלחת התגבשות על המוביל SBS ממונע.
- לחץ על 'תשאף' ולחכות בשלב זה יושלם (כאשר בוכנות עצר בדרך למעלה).
- מעבר לכרטיסיה 'לרוץ' ולהפעיל את התוכנית.
- בגמר של התוכנית, לחזור אל הכרטיסיה הגדרה, לחץ על 'הסר': המערכת ניקוי המזרקים את מפתרונות שאריות, ואז מרים את הפיסטונס עד הסוף. 'לטהר' עשויים להתבקש במקום 'הסר'; זה ישאיר את בוכנות במיקום התחתון, מוכן לרוקן פתרונות יותר עם מזרקים אותו.
- הסר תארגן את הדברים על ידי ומסובב אותם התרחקותו.
- להיפטר מזרקים של שקתות בסל המתאים (או לשטוף אותם עם מים יונים, ולאחר מכן 20% v/v אתנול פתרון לשימוש חוזר).
- לאטום את הצלחת ומניחים אותו על מיקסר microplate במשך 3 דקות במהירות של 1000 סל ד, או 10 דקות כאשר פתרונות בעלי צמיגות גבוהה מעורבבים. הבסיס מוכן להגדרת התגבשות טיפות על מנפק nanoliter.
-
תוסף הקרנת פרוטוקול 1 (הגדרת התגבשות טיפות לתוך צלחת 96-ובכן התגבשות מראש מלא מסך כתוסף)
- ראשית, להכין את המצב עם ריכוזים הראשונית של ריאגנטים גדלה בכ-10% (מינימום כרך 15 מ"ל בעת העברת התנאי של מיכל על-גבי המסך מוספים עם המטפל נוזלי).
- ודא כי המטפל נוזלי מוכן לנתח. פתח את התוכנית 'הוסף למסך תוספים' על לוח אחד (להכניס נפח מאגרים: '72 µL'). מנחה, דמויות ועזרה עצה-ניהול מערכת (12 x 1,000 µL טיפים נדרש) עם מוודא הרובוט הוא מוכן לפעול על-פי הבחירות.
- להחזיר את המסך מוספים מן החממה-20 ° C, להסיר את החותם אלומיניום מיד (שימוש בעל צלחת) ולאחר מכן מקם את הצלחת על סיפונה של המטפל נוזלי. התוכנית פועלת לפי פריסה דיוקן (הצלחת ממוקם מעבר לפינה-A1 ממוקם בפינה הקדמית השמאלית של המוביל). גם להציב את המיכל מלא עם המצב. הפעל את התוכנית.
- פעם היו מלאים המאגרים של הצלחת, מניחים אותה על גבי ניעור microplate ולהפעיל את התוכנית. יש לשטוף את הגורם המכיל של תנאי עם יונים מים ו-20% אתנול לשימוש חוזר.
- להגדיר את טיפות על מנפק nanoliter. ראשית, פתחי את הצלחת התגבשות (שימוש בעל צלחת). אז, את הצלחת ואת החלבון 8-ובכן להתפשט במקום הראשון של בלוק רצועת-מחזיק את המקום. הכרטיסיה 'הגדרה' על תוכנת השליטה מציגה את העמדות בפועל של כל רכיב על הסיפון. לטעון כל טוב של רצועת עם חלבון דגימת לפי גודל טיפה הנדרש (טבלה 4). להפעיל את התוכנית להכין טיפות.
- בגמר של התוכנית, הסר את הלוחית של הסיפון, לאטום אותו מיד (להשתמש סילר לאיטום צלחת, דבק רחב 3 אינץ). למחוק את רצועת לפח המתאים.
- להעריך את הגודל, צורה, ולמרכוז של טיפות מתחת למיקרוסקופ לפני האחסון.
-
תוסף הקרנת פרוטוקול 2 (הגדרת התגבשות טיפות לתוך צלחת 96-ובכן התגבשות עם מסך מוספים מחדש שמיש)
- תחילה, הכן את המסך מוספים: להשאיר את הצלחת תרבות המתאים תא 96-ובכן קפואים להפשיר בטמפרטורת החדר במשך 40 דקות. לאחר מכן, centrifuge את המסך מוספים ב 1,000 x g למשך 2 דקות.
- להכין את התנאי (מינימלית כרך 15 מ"ל בעת העברת התנאי של מיכל על-גבי המסך מוספים עם המטפל נוזלי).
- למלא את המאגרים של צלחת 96-ובכן התגבשות עם התנאי. על המטפל-הנוזל, המשך באותו אופן כמו פרוטוקול 1, צעד 2.2.2, אך הזן '80 µL' עבור אמצעי האחסון במאגרים.
- להגדיר את טיפות על מנפק nanoliter עם 3 רכיבים על הסיפון (לוח המכיל את המסך מוספים, יחד עם לוח התגבשות ורצועת 8-ובכן חלבון במקום הראשון של בלוק רצועת-מחזיק, בטבלה 4).
- לאטום את הצלחת התרבות התא המכיל את המסך עם גיליון אלומיניום ומניחים אותו בחזרה בחממה-20 ° C.
- להעריך את הגודל, צורה, ולמרכוז של טיפות מתחת למיקרוסקופ לפני האחסון.
תוצאות
1. מערכת 1 וצלחות LMB
איור 1A מציג מערכת 1 המבוסס על נוזלי עוזר הפועלים עם מערכת נוזלים (מים deionised). הנוזל-המערכת כוללת מיכל, משאבה, אבובים, מזרקים 8 מצוידים שסתומים 8 טיפים קבוע. הגדרות מחלקה נוזלי אופטימציה כדי לשאוב/לוותר על מגוון רחב של פתרונות ורב -לוותר על לוחות 4 (מולטי-מדבקות/ברקודים דורש עודף גדול יחסית של נפח aspirated). מיכל מים 22 L ו מיכל קטן יותר (5 L) עם 20% v/v אתנול מאוחסנים מתחת למערכת כדי להאכיל נוזלי-המערכת. לכל מכולה מצויד עם שני מוסיף צימוד. הוסף אחד (בצבע כחול) הזנות המערכת עם נוזל, השני (אדום) גב-זרימה כדי להפחית לחץ עודף. לאחר השימוש, שטיפה עם מים, ולאחר מכן 20% v/v אתנול פתרון מונע צמיחת חיידקים. יחידת קירור (גם ממוקם מתחת המערכת) מחובר נשאית קירור-צינור לפי הזמנה. מערכת 1 היא 2050 מ מ רחב, כולל קרוסלה, 760 מ מ עמוקה, 88 מ מ גבוה. מ מ נוספים 550 נדרש החזית שולחן העבודה המכיל את יחידת הבקרה למדפסת הזרקת דיו, חותם צלחת דבק. שטח נוסף נחוץ גם ליד המערכת עבור ה-PC השליטה. התוכנית כדי לייצר הצלחות שמולאו מראש 72 (דהיינו 18 סיבובים של ארבע פלטות) לוקח 3 שעות ו 50 דקות.
איור 1B היא תקריב של הסיפון הראשי אשר מצויד עם 8 קבוע טיפים (איור 1C) רכוב על זרוע pipetting אוטומטית, יד שניה עם התפיסה של, תחנת רחיצת עצה, 2, פרק 4-מיקום ספקים עבור SBS לוחות קירור-צינור המוביל. התוכנית הראשית מעבד ארבע פלטות בכל פעם הם נלקחו באופן אוטומטי הקרוסלה והניח על הסיפון שבו הם מלאים התגבשות התנאים (80 µL של מאגרים, איור 1D). רמות נוזלי מזוהים באופן אוטומטי הטיפים הם מוליכי חשמל. בעוד המטפל נוזלי dispenses תנאים לתוך קבוצה של צלחות, עוד זוג צלחות ריקות שנלקחו הקרוסלה, שכותרתו, להציב על גבי הסיפון הראשי. מחזיק לפי הזמנה קטן, חלון שבלוח האחורי של המטפל נוזלי נדרשו כדי למקם מנהל המדפסת, חיישן שלה בתוך הסיפון הראשי. 8 טיפים סמוקות, לרחוץ עם מים מהמיכל הראשי לאחר כל שלב שחולק המורכב aliquots 4 בעמודות המתאימות של מאגרים. לאחר ארבע פלטות היו מלאים, הם חתומים באופן אוטומטי, להציב בחזרה למיקום המקורי שלהם ב הקרוסלה. חותם צלחת המופעלת על-ידי מנהל התקן מסוים (המכונה על ידי תוכנת השליטה). חותם משתמש גליל של סרט דביק רחב 3 אינץ אשר חלה על צלחת עם רולים תחת לחץ מכני. בגמר של התוכנית, הלוחות שמולאו מראש הם להסיר באופן ידני הערימות קרוסלה ומאוחסנים חממה 10 ° C ממוקם בתוך המתקן.

איור 1 : מילוי המאגרים עם ערכות ההקרנה הראשונית- סקירה כללית של מערכת אוטומטית לחלוטין 1 (א). הקרוסלה אוטומטית יחידה נפרדת עם צלחת ערימה, שוכן בבאר של גליונות אקרילי ברורה מצד ימין הסיפון הראשי. (B) הסיפון הראשי של המטפל נוזלי במבצע עם () קירור-צינור המוביל (מחוברים יחידת קירור מתחת, לא מוצג), (b) המהיר שטיפת תחנת (מחוברים ניקוז, לא מוצג), (ג) בזרוע pipetting מילוי מאגרים 8 של צלחת התגבשות 96-ובכן, (d) הזרוע התפיסה מביא צלחת מלאה על גבי (e) המוביל SBS ממונע של חותם צלחת. בחלק האחורי הסיפון הוא ראש (f) ההדפסה במדפסת הזרקת דיו מחובר (g) יחידת הבקרה הזרקת דיו מתחת חותם. (ג) א שכותרתו צלחת (שם של המסך) ואת תאריך ייצור מלא עם התגבשות התנאים 8 מוליך קבוע טיפים עשוי פלדת אל-חלד מצופה טפלון. חתך רוחב התגבשות אטומה היטב (D). המאגר מכיל 80 µL של התגבשות תנאי (בעוד העליון הוא ריק). מאגר מים עליון-ובכן עומק והמפרטים במילימטרים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
טבלה 1 מציגה את ניסוחים שונים עבור ערכות זמינים מסחרית ההקרנה במבחנות. ערכות משמשים כדי למלא את המאגרים של התגבשות 96-ובכן צלחות (LMB01-LMB22) על בסיס קבוע עם מערכת 1.
| הצלחת שם | ערכת שם | הספק | מספר קטלוג | צינורות | תיאור בסיסי | ||
| LMB01 | מסך גביש 1 | מחקר המפטון | HR2-110 | 48 | מטריצה דלילה (pH 4.6-8.5) | ||
| מסך גביש 2 | מחקר המפטון | HR2-112 | 48 | סטוכסטי דגימה (pH 4.6-9.0) | |||
| LMB02 | אשף 1 | Rigaku | 1009530 | 48 | סטוכסטי דגימה (pH 4.5-10.5) | ||
| אשף 2 | Rigaku | 1009531 | 48 | סטוכסטי דגימה (pH 4.5-10.5) | |||
| LMB03 | רשת מסך אמוניום סולפט | מחקר המפטון | HR2-211 | 24 | רשת המסך, [AmS] = 0.8-3.2 מ', מאגרי pH 4.0-9.0 | ||
| רשת מסך פג/LiCl... | מחקר המפטון | HR2-217 | 24 | רשת המסך, [פג 6000] = 0-30 %w/v, conc. LiCl = 1.0 M ו מאגרי pH 4.0-9.0 | |||
| מסך מהירה | מחקר המפטון | HR2-221 | 24 | רשת המסך, [NaKPO4] = 0.8-1.8 מ' ב- pH 5.0-8.2 | |||
| רשת מסך נתרן כלוריד | מחקר המפטון | HR2-219 | 24 | רשת המסך, [NaCl] = 1.0-4.0 מ', מאגרי pH 4.0-9.0 | |||
| LMB04 | רשת מסך פג 6000 | מחקר המפטון | HR2-213 | 24 | רשת המסך, [פג 6000] = 5-30 %w/v, מאגרי pH 4.0-9.0 | ||
| רשת מסך MPD | מחקר המפטון | HR2-215 | 24 | רשת מסך [MPD] = 10-65 %w/v ו מאגרי pH 4.0-9.0 | |||
| MemFac | מחקר המפטון | HR2-114 | 48 | מטריצה דלילה קרום חלבונים (pH 4.6-8.5) | |||
| LMB05 | פג-יון | מחקר המפטון | HR2-126 | 48 | רשת המסך, [פג 3350] = 20 %w/v ומלחים שונים ב- 0.2 מ' (ללא מאגרים) | ||
| Natrix | מחקר המפטון | HR2-116 | 48 | עצרת לא שלם (pH 5.6-8.5) | |||
| LMB06 | מסך גביש לייט | מחקר המפטון | HR2-128 | 48 | קריסטל 1 מסך עם חצי אחד של ריכוז precipitant המקורי | ||
| המסך לייט מותאם אישית | מידות מולקולרית | n/a | 48 | תנאים נוספים עם ריכוזים נמוכים precipitant | |||
| LMB07 | אשף הקפאה 1 | Rigaku | 1009536 | 48 | דגימה סטוכסטי עם תנאים cryoprotected באמצעות יתדות MW נמוך (pH 4.5-9.4) | ||
| אשף הקפאה 2 | Rigaku | 1009537 | 48 | דגימה סטוכסטי עם תנאים cryoprotected באמצעות יתדות MW נמוך (pH 4.5-10.1) | |||
| LMB08 | JBS1 | JenaBioScience | מדעי המחשב - 101L | 24 | עצרת לא שלם המבוסס על ווים שונים (pH 4.6-9.0) | ||
| JBS2 | JenaBioScience | מדעי המחשב - 102L | 24 | עצרת לא שלם המבוסס על 4000 פג (pH 4.6-8.5) | |||
| JBS3 | JenaBioScience | מדעי המחשב - 103L | 24 | עצרת לא שלם המבוסס על 4000 פג (pH 4.6-8.5) | |||
| JBS4 | JenaBioScience | מדעי המחשב - 104L | 24 | עצרת לא שלם המבוסס על יתדות MW בינונית (pH 6.5-8.5) | |||
| LMB09 | JBS5 | JenaBioScience | מדעי המחשב - 105L | 24 | עצרת לא שלם המבוסס על יתדות MW כבד (pH 6.5-9.5) | ||
| JBS6 | JenaBioScience | מדעי המחשב - 106L | 24 | עצרת לא שלם המבוסס על AmS (pH 4.6-8.5) | |||
| JBS7 | JenaBioScience | מדעי המחשב - 107L | 24 | עצרת לא שלם המבוסס על MPD (pH 4.6-8.5) | |||
| JBS8 | JenaBioScience | מדעי המחשב - 108L | 24 | עצרת לא שלם המבוסס על MPD ואתנול (pH 4.6-8.5) | |||
| LMB10 | JBS9 | JenaBioScience | מדעי המחשב - 109L | 24 | עצרת לא שלם המבוסס על מלחי משותף ו 2-פרופנול (pH 4.6-8.5) | ||
| JBS10 | JenaBioScience | מדעי המחשב - 110L | 24 | עצרת לא שלם המבוסס על מלחי משותף (pH 4.6-8.5) | |||
| 1 מסך אסטרטגיה ברורה pH 4.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| 1 מסך אסטרטגיה ברורה pH 5.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| LMB11 | 1 מסך אסטרטגיה ברורה pH 6.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | ||
| 1 מסך אסטרטגיה ברורה pH 7.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| 1 מסך אסטרטגיה ברורה pH 8.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| 2 מסך אסטרטגיה ברורה pH 4.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| LMB12 | 2 מסך אסטרטגיה ברורה pH 5.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | ||
| 2 מסך אסטרטגיה ברורה pH 6.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| 2 מסך אסטרטגיה ברורה pH 7.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| 2 מסך אסטרטגיה ברורה pH 8.5 | מידות מולקולרית | MD1-16LMB | 24 | רשת מסך עם יתדות שונים | |||
| LMB13 | אינדקס | מחקר המפטון | HR2-144 | 96 | דליל מטריקס והרשת מסכים קטנים (pH 3.0-9.0) | ||
| LMB14 | SaltRX 1 | מחקר המפטון | HR2-107 | 48 | רשת מסך כולל 22 ייחודי מלחי לעומת ריכוז מלח ו- pH (4.1-9.0) | ||
| SaltRX 2 | מחקר המפטון | HR2-109 | 48 | רשת מסך כולל 22 ייחודי מלחי לעומת ריכוז מלח ו- pH (4.1-9.0) | |||
| LMB15 | MemStart | מידות מולקולרית | MD1-21 | 48 | מטריצה דלילה קרום חלבונים (pH 4.0-10.0) | ||
| MemSys | מידות מולקולרית | MD1-25 | 48 | רשת מסך קרום חלבונים (בעיקר יתדות, pH 3.5-9.5) | |||
| LMB16 | JCSG + | Qiagen | 130720 | 96 | מטריצה דלילה (pH 4.0-10.0) | ||
| LMB17 | מורפיוס מסך | מידות מולקולרית | MD1-46 | 96 | רשת מסך כולל תערובות של תוספים cryoprotected תנאים (pH 6.5-8.5) | ||
| LMB18 | מסך מינימלית pi | JenaBioScience | מדעי המחשב-127 | 96 | עצרת לא שלם (pH 4.0-9.5) | ||
| LMB19 | Pi-יתד מסך | JenaBioScience | מדעי המחשב-128 | 96 | עצרת לא שלם קרום חלבונים (pH 4.8-8.8) | ||
| LMB20 | המסך השני מורפיוס | מידות מולקולרית | MD1-91 | 96 | רשת מסך כולל תערובות של תוספים (אטומים כבדים) cryoprotected תנאים (pH 6.5-8.5) | ||
| LMB21 | LMB התגבשות מסך | מידות מולקולרית | MD1-98 | 96 | מטריצה דלילה כולל תנאים נבחרים מפרסומים LMB | ||
| LMB22 | המסך השלישי מורפיוס | מידות מולקולרית | n/a | 96 | רשת מסך כולל תערובות של תוספים (תרופה תרכובות) cryoprotected תנאים (pH 6.5-8.5) | ||
טבלה 1: ניסוחים של ערכות נמצאו לוחות LMB. כל ערכת הקרנה מסחרית מורכבת 24/48/96 תנאים בתחילה במבחנות. הלוחות LMB מוחזקים במלאי של 10 ° C חממות ממוקם בתוך המתקן שבו הם יהיו זמינות עבור משתמשים בכל עת.
2. מערכת 2 ודרישות עבור הגדרת טיפות
איור 2A מציגה מערכת 2 מבוסס על המטפל נוזלי19 ההפעלה עם תזוזה חיובית וטיפים חד פעמיות. הטיפים חד פעמיות מסופקים בארונות לסידור מתאים טיפול אוטומטי. הסיפון 3-מיקום nanoliter מנפק20 היה משולב בצד ימין של המערכת. וביופסיה/לוותר על מנפק nanoliter פועל גם עם תזוזה חיובית באמצעות microsyringes חד פעמיות (מסופק מאגרים גדולים). כמו רובוט עצמאי, בלוק רצועת נשלף-מחזיק משמש לטעינת חלבון sample(s). עבור תהליך אוטומטי לחלוטין, צלחת PCR 384-ובכן מחליף את רצועת-מחזיק. דומה סילר לאיטום צלחת דבק למערכת 1 היה משולב, בצד שמאל. סילר לאיטום של nanoliter מנפק לעמוד על worktables לפי הזמנה, מוגבה על מנת התפיסה העיקרית להגיע נשאיות צלחת של אלה שני רובוטים משולב (חלון היה צריך להיות חתוך בשתי החלוניות בצד של המטפל נוזלי עבור התפיסה לקבל גישה מחוץ הסיפון הראשי). התוכנית הראשית קוראת מנהלי התקנים ספציפיים על ההדק nanoliter שחולק ותוכניות חותם בבוא הזמן. מערכת 2 היא 2,850 מ מ רחב, עמוק 800 מ"מ ו 800 מ מ. שטח נוסף נדרש ליד הרובוט עבור התצוגה של ה-PC השליטה. שני פחי פסולת ממוקמים מתחת המערכת עבור טיפים ו microsyringes שנזרקו במהלך התהליך (גם מתחת מאוחסן המחשב השליטה). מאפיין חשוב של מערכת 2 הוא הפריסה הכללית, אשר שומר גישה קלה 3 רובוטים כך שניתן יהיה להשתמש בנפרד עבור הפרוטוקולים אופטימיזציה שתוארו לעיל, או פרוטוקולים אחרים המתוארים במקומות אחרים כגון התגבשות של קרום חלבונים lipidic mesophases21 , microseed אקראיים מטריקס הקרנת22.
איור 2B היא תקריב של החפיסה אשר מצויד עם זרוע רובוטית יחידה. הזרוע משלבת 12 הגששים pipetting עצמאית את התפיסה המרכזית. העמדות של הגששים יכול להיות נשלט בנפרד בכיוון אחד כדי לקבל גישה במקומות שונים לאורך הציר בין הגששים או צינורות אפילו יחיד. הגששים יכולים לאסוף טיפים חד פעמיות (1-12) או זוג צלחת-המעבר מתאמים. שתי קבוצות של 4 ערימות המכיל 50 טיפים חד פעמיות µL בתחילה נטענים. רמות נוזלי מזוהים באופן אוטומטי הטיפים הם מוליכי חשמל. מתאמים לוחית-המעבר מתוכננים עם 2 סיכות חדות מבפנים כי הטופס של התפיסה אופציונלית בעת הצורך. על הסיפון הראשי הוא ממוקם microtube 24-מיקום קירור המוביל המדגם, אף רק 1-2 עמדות משמשים כאן. בנוסף, יש נשאית של הצלחת ה-PCR, גם 2 אחסון ספקים עבור העפעפיים SBS לסידור, לפי הזמנה (איור 2C). לבסוף, ישנם 4 נושאות הזזה, כל אחד עם 5 מקומות עבור לוחות התגבשות (4 x 5 = 20 לוחות).

איור 2 : הגדרת טיפות לניסויים דיפוזיה אדי. (א) סקירה כללית של מערכת אוטומטית לחלוטין 2. (B) הסיפון הראשי של המטפל נוזלי פעולה עם ספקים () האחסון עבור ערימות של העפעפיים SBS, טיפים (ב') לסידור, מנשא (c) המוביל הקירור עם מדגם של microtube, (ד) 2 צלחת-המעבר מתאמים, (e) הצלחת ה-PCR להעברת חלבונים כדי הרובוט טיפול nanoliter, (f) 9 אטום שהפלטות הועברו בחזרה העמדה הראשונית שלהם (g) את התפיסה האופציונליים להסיר את מכסה SBS 10בתאנון צלחת על להיות מועבר לתוך הסיפון של המטפל נוזלי, צלחות (h)-10 להיות מוכן SBS בשלמותם עליון, (אני) את התפיסה המרכזית אשר משמש להעברת הלוחות PCR וגיבוש, (j) הראשי אוטומטית זרוע שילוב הגששים pipetting 12 (2 בשימוש לפעול כמו התפיסה אופציונלי) את התפיסה המרכזית, ואת (k) את חפיסת מנפק nanoliter. (C) ללא צורך במיקור חוץ מותאמים אישית SBS העפעפיים עשוי אלומיניום. עפעפיו לשלב סדין גומי כדי למנוע אידוי של התנאים שני חורים קטנים כדי במדויק איסוף על ידי התפיסה אופציונלי. חתך רוחב (D) התגבשות אטום היטב איפה המאגר מלא עם מצב, הבאר העליונה מכילה droplet חיבר המדגם חלבון והן את התנאי. מכיוון precipitant ה-droplet מרוכז פחות מאשר מצב, הריכוזים של כל הרכיבים בתיבה הנפתחת עולים דרך מים הפסד במהלך התהליך של equilibration על ידי אדי דיפוזיה (מאד סכמטי המיוצגים על ידי חץ). Micrographs האור (E) של 100 nL ו (F) 200 nL טיפות המיוצר על ידי מנפק nanoliter עם פתרון מבחן (v 20% / פוליאתילן גליקול 400, v 0.001% w/v Safranin כמו צבע אדום). הגודל והצורה של הטיפות עשויים להשתנות בהתאם chemicophysical המאפיינים של המצב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
התוכנית הראשית מתחיל התפיסה אופציונלי הסרת המכסה SBS בצלחת התגבשות הראשונה. לאחר המכסה הועברה לחברת ההובלה אחסון המתאים, הצלחת התגבשות מועבר סיפון מנפק nanoliter. ואז הזרוע pipetting מעביר את הסכום של המדגם נדרש להגדרת טיפות של microtube צוננות בדרך כלל לעמודה הראשונה של צלחת PCR. לאחר מכן, התפיסה המרכזית מעביר את הצלחת ה-PCR לתוך הסיפון של מנפק nanoliter אשר תכין את טיפות בעקבות האפשרויות שנבחרו על ידי המשתמש בתחילתו (למשל. בגודל אגל). בשביל זה, המדגם חלבון הוא תחילה בגליל לתוך העליון-הבארות (באמצעות יחיד set של 8 microsyringes ו- multi לחילוק) ולאחר מכן התגבשות התנאים הם ויתרו על גבי טיפות חלבון (כל שורה עכשיו דורש 8 microsyringes חדש כדי למנוע זיהום צולב). עם סיום התוכנית להקים טיפות, התפיסה המרכזית מסיע את הצלחת המתאימים כדי חותם צלחת ולאחר מכן מציב את הצלחת ה-PCR בחזרה למיקום המקורי (יותר חלבון ובשמפו בעמודה הבאה של צלחת PCR על הלוח הבא ). בסופו של דבר, הצלחת התגבשות אטום מועברת בחזרה למיקומו המקורי על הסיפון: אדי דיפוזיה ניסויים שכבר התחילו. על הצלחת הזו (איור דו-ממדי). מחזור זה חוזר על עצמו על פי מספר הצלחות. בעת הצורך, התפיסה אופציונלי מסירה של ארון ריק עצה ומאפשר את הזרוע pipetting לגשת עוד טיפים. התוכנית לוקח 2 שעות, 20 דקות ו- 440 µL מדגם להכין טיפות אחת ב- 20 צלחות באמצעות דגימת nL 100 + 100 מצב nL (איור 2E ו- 2F).
בעת שימוש מנפק nanoliter כרובוט לעמוד לבד על שני לוחות נוספים (ראה פרוטוקול, שלב 1.2.3), כל סידרת ההקרנה הראשונית לוחות זמינים בחממה 10 ° C ניתן להגדיר (22 LMB צלחות x 96 תנאים = תנאים 2,112).
בטבלה 2 מציגה את הדרישות עבור התוכנית הראשית על פי בחירות משתמש במערכת 2.
| צלחות | גודל טיפה (nL) | Sample(s) | עצה דרישות | משך | |||
| מספר | סוג | כרך א' (µL) | כרך ב' (µL) | 50 טיפים µL | Microsyringes | ||
| 10 | 96-ובכן | 100 | 240 | 0 | 80 | 1040 | 1 שעות 12 דקות |
| 20 | 96-ובכן | 100 | 440 | 0 | 160 | 2080 | 2 שעות 20 דקות |
| 10 | 96-ובכן | 100 | 240 | 240 | 160 | 2080 | 1 שעות 45 דקות |
| 20 | 96-ובכן | 100 | 440 | 440 | 320 | 4160 | 3 h 05 דקות |
| 10 | 48-ובכן | 1000 | 624 | 0 | 80 | 560 | 1 h 10 דקות |
| 20 | 48-ובכן | 1000 | 1208 | 0 | 160 | 1120 | 2 שעות 16 דקות |
בטבלה 2: דוגמאות של האפשרויות התוכנית הראשית הזמינות במערכת 2 להגדרת התגבשות טיפות. הסכום הדרוש של חלבון לדוגמה, טיפים microsyringes משתנים בהתאם לתוכנית. אמצעי האחסון מדגם ' כרך 1' (טיפה 1), ' כרך 2' (טיפה 2) יחושב כדלקמן: (8 טיפים x נדרש אחסון לכל טוב של PCR צלחת + 4 µL איבד נפח) x מספר התגבשות צלחות + 40 נפח מת µL microtube. האחסון הנדרש עבור כל טוב של PCR צלחת 100 טיפות nL בצלחת התגבשות 96-ובכן הוא 2 µL בעוד 6.8 µL נדרש עבור 1000 טיפות nL בצלחת 48-טוב (נפח מת בבארות של צלחת PCR: 0.8 µL). אחסון נוסף של המדגם נלקח בחשבון ('שאבדו נפח') בשל התאיידות של microtube והפסדים אחרים (למשל דוגמה דבק על טיפים). לדוגמה, עבור 20 לוחות MRC, 100 nL, טיפה 1 לפרוטוקול, היקף המדגם הדרוש הוא: (8 x 2 + 4) x 20 + 40 = 440 µL (קרי, המקבילה של µL 22 לכל צלחת). שמונה טיפים µL חד פעמי 50 נדרשים עבור כל צלחת, כל דגימה. לדוגמה, עבור 10 צלחות, פרוטוקול 2-שחרור, מספר טיפים הנדרש הוא 8 x 10 x 2 = 160 טיפים. מספר microsyringes מחושב כדלקמן: (8 + מספר תנאים לכל צלחת) x מספר הדגימות x מספר הצלחות. לדוגמה, עבור לוחות 10 x 48-ובכן, מספר טיפים נוזלי המטפל נדרש הוא: (8 + 48) x 1 x 10 = 560 טיפים.
3. ניסוח, הכנה וטיפול הפתרונות 4-פינה
לשני ניסוחים של הפתרונות בפינה ("A, B, C ו- D') ואת המסך אופטימיזציה המתאים (איור 3 א) מופקים באופן אוטומטי על ידי גיליון אלקטרוני של Excel. ישנם אלקטרוניים שונים עבור מספרים שונים מהתנאים — ביסודו 24, 48, ותנאי 96 — וגליונות אלקטרוניים גם להכין שני מסכי מיטוב שונות בצלחת אחת. אחד בדרך כלל מכין סט של 4 x 10 מ"ל פינה פתרונות במבחנות אשר 2-3 אופטימיזציה המסכים ניתן להכין, בהתאם למספר נפח של התנאים הנדרשים. הפתרונות הם שפכו לתוך שקתות שממנו הם aspirated על ידי המטפל נוזלי המבוסס על המזרק, אחר כך ויתרו ישירות לתוך צלחות (איור 3B). שני מעברי צבע ליניאריים של ריכוזים הם תוצאה של ערבוב A, B, C ו- D-יחסי משתנות באופן שיטתי (איור 3C).

איור 3: שיטת 4-פינה להכנת אופטימיזציה מסכי. (א) ייצוג שני מעברי הצבע של ריכוזים על פני צלחת 96-ובכן פריסה. (B) המבוסס על המזרק נוזלי המטפל מוכן להכין מסך עם 4 מזרקים מוכנס לתוך ראשו של הרובוט. צלחת התגבשות ניצב במנשא SBS ממונע, כבר יש כבר ויתרו ה-4 מתחיל פתרונות (A, B, C ו- D) לתוך שלהם שקתות בהתאמה (הפתרונות היו בצבע אדום להמחשה בלבד). יחסי גודל של פתרונות A, B, C ו- D על פני מאגרים 96 (C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
טבלה 3 מציגה את הדרישות עבור תוכניות זמינות למשתמשים על-מבוססות מזרק הנוזל-המטפל.
| סוג לוח | לא. מהתנאים | כרך בצלחת (מאגרים, µL) | כרך בשוקת (mL) | משך |
| 96-ובכן | 48 | 80 | 1.6 | 2 דקות 5 שניות |
| 96-ובכן | 96 | 80 | 2.5 | 3 דקות 50 שניות |
| 96-ובכן | 2 x 48 | 80 | 1.6 | 2 דקות 50 שניות |
| 48-ובכן | 24 | 200 | 1.8 | 2 דקות 25 שניות |
| 48-ובכן | 48 | 200 | 3 | 4 דקות 20 שניות |
טבלה 3: תוכניות זמינות על המטפל נוזלי המבוסס על המזרק להכנת אופטימיזציה המסכים בהתאם לשיטה 4-בפינת. הצלחת 96-ובכן יכול לשמש כדי להכין 96 - או 48-מצב אופטימיזציה מסך (כאשר שני מסכי 48-מצב מוכנים בו זמנית, הרובוט חייב להיות מצויד מזרקים 8 ו שקתות 8). תוכניות אחרות שיאפשרו שימוש טוב 48 לוחות. אמצעי האחסון המפורטים בשקתות כוללים אמצעי האחסון מת הנדרש (0.5 מ"ל).
4. מוספים ההקרנה
איור 4 מראה הפעולות לביצוע של ההקרנה מוספים מתחיל עם פתרונות מוספים 96 כבר המאגרים של צלחת התגבשות (פרוטוקול 1) או בכל הבארות של פרופיל נמוך תא תרבות לצלחת משמש (מסך מוספים מחדש שמיש פרוטוקול 2). בטבלה 4 מפרט את התוכניות על מנפק nanoliter על פי שני סוגי פרוטוקולים.
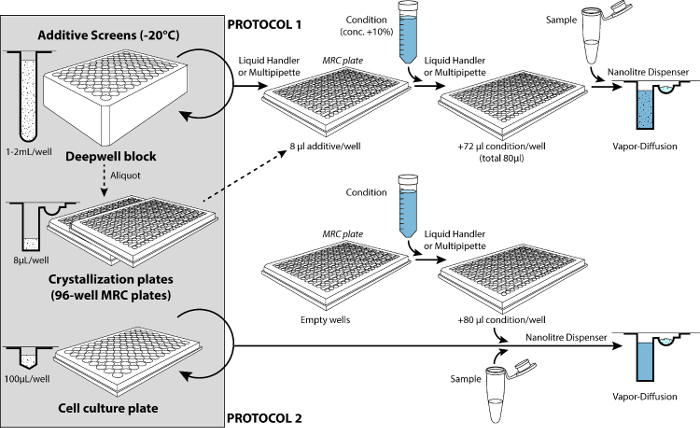
איור 4: שני סוגי פרוטוקולים להקרנה מוספים. המסכים 96-תוסף מאוחסנים ב-20 ° C. בעקבות פרוטוקול 1, מוספים מסך נוסף בתחילה המאגרים של הלוחות התגבשות (ויש אידיאלי מצויד בדרך זו). המטפל נוזלי או multipipette משמש כדי לוותר על התנאי לתוך המאגרים המכיל פתרונות מוספים (הנפח של מסך מוספים מייצג 10% עוצמת הקול הסופי של מאגרים: µL 8 עבור 80 µL נפח סופי). לאחר ערבוב את התנאים על מיקסר microplate (לא מוצג), מנפק מבוססי microsyringe nanoliter משמש כדי להגדיר את טיפות (טבלה 4). בעקבות פרוטוקול 2, המסך מוספים יתווסף רק מאוחר יותר בעת הגדרת את טיפות התגבשות. הפעם הוא מועסק מנפק nanoliter להכין טיפות עם מרכיב חשוב נוסף שעל (לצלחת תרבות מחדש שמיש התא המכיל את המסך כתוסף). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| פרוטוקול | גודל טיפה (nL) | סוג הרצועה | לדוגמה כרך (µL) | לא. של microsyringes | משך | ||||
| סוג | המקור של תוספים | חלבון | תנאי | תוסף | כל היטב (סטריפ) | סה | |||
| 1 | צלחת התגבשות 96-ובכן | 100 | 100 | 0 | 2 ΜL | 2 | 16 | 104 | 2 דקות |
| 1 | צלחת התגבשות 96-ובכן | 200 | 200 | 0 | 5 ΜL | 3.8 | 31 | 104 | 2 דקות 10 שניות |
| 2 | צלחת תרבות 96-ובכן תא | 200 | 200 | 100 | 5 ΜL | 3.8 | 31 | 200 | 3 דקות 45 שניות |
| 2 | צלחת תרבות 96-ובכן תא | 500 | 500 | 100 | 5 ΜL | 7.4 | 60 | 200 | 4 דקות 15 שניות |
בטבלה 4: תוכניות זמינות על מנפק מבוססי microsyringe nanoliter להקרנה מוספים. הנפח הנדרש של מדגם כל טוב של רצועת 8-ובכן מחושב כדלקמן: נפח מת + 12 x ירידה בגודל. ישנם 2 סוגים של רצועות (2 µL ו- 5 µL). אמצעי האחסון מת µL 0.8 בשביל הבארות µL 2 (אשר למעשה יכול להכיל מקסימום µL 3.2) הינם µL 1.4 בשביל הבארות µL 5 (7.5 µL מקס.). הנפח הכולל של חלבון הדרוש הוא: 8 x נפח טוב של רצועת (עיגול ערך). נפח מת הבארות בצורת V של צלחת תרבות תא 96-ובכן הוא 2.5 µL. המספר הנדרש של microsyringes משתנה בהתאם בתוכנית שנבחרה (8 + 96 = 104; או 8 + 2 x 96 = 200).
בשל הדילול של המצב עם תוסף במהלך פרוטוקול 1, המצב צריך להיות מוכן ב ריכוז גבוה באופן יחסי יותר מאשר בתחילה. עליית ריכוז סופי מושגת בקלות הרבה ביותר על-ידי הפחתת התוספת האחרונה של מים לאמצעי האחסון הסופי מחושב. אחרי זה, אחד פשוט ממשיך עם סט רגיל למעלה של טיפות זה לערבב את מצבו ואת דגימה (למשל, חלבון nL 100 + 100 מצב nL כבר מעורבב עם תוספים). פרוטוקול 2 (למשל, חלבון nL 200 + תנאי nL 200 + 100 nL האפס) מקלה על ההקרנה בריכוזים שונים של תוספים על ידי פשוט שינוי הנפח של תוסף מסך נוסף. פרוטוקול 2 מרמז פחות או יותר לדילול טיפות (אשר עשוי לשנות התגבשות).
המטפל נוזלית ממערכת 2 יכול לשמש כדי תשאף מספיק תנאי 12 טיפים ולא לוותר על 8 aliquots לתוך המאגרים של צלחת 96-ובכן (ראה פרוטוקול, שלב 2.2.2), למרות שלב זה ניתן כמובן לעשות באופן ידני עם פיפטה רב-ערוצי ( איור 4). יכול להיות מלא מספר הצלחות בכל פעם עם אותה בעיה כאשר משתמש המטפל נוזלי (כדי לבדוק את מסכי מוספים שונים מאוחר יותר). בעת הכנת שתי צלחות, למלא את המיכל מגיב לפחות 23 מ. בעת הכנת 3 צלחות, למלא את המיכל מגיב לפחות 31 מ.
5. התגבשות צלחות, התקנים משויכים
העיצוב של שני MRC ישיבה-שחרור קיטור דיפוזיה התגבשות צלחות (96-ובכן 2-שחרור 48-ובכן 1 ושחרר, 5A איור , איור 5B) מספק תכונות המאפשרות ניסויים התגבשות אוטומטיות יעילות ואמינות, ובמיוחד את צורה כדורית הבארות העליונה, V-צורה קלה של המאגרים המספקות dispensing מדויק, וגם צנטריפוגה כאשר מרכוז של טיפות נדרש. בנוסף, הבארות העליון יש השפעה עדשה לתאורת אופטימלית תחת stereomicroscope (הפולימר הוא UV מדבקות איתור קריסטלים קליטת UV או פלורסנט23).
חותמת מותאמת אישית (איור 5C) מאפשר הגדרת תלויים טיפה ניסויים התגבשויות בתוך שני סוגי צלחות באמצעות מתקן nanoliter (פרוטוקולים לא מוצג). לבסוף, שתי צלחות MRC יש את אותם מימדים חיצוניים ו- rim. השפה משתלב החריצים של שלנו לפי הזמנה לוחית (איור 5D), אשר משמש להסרת ידני הצבת/טייפ איטום מבלי להתיז נוזלים.

איור 5: MRC את התגבשות צלחות, התקנים משויכים שפותחה LMB. (א) A1-הפינה של צלחת 96-ובכן. המאגר (מלבני) נמצא בצד שמאל של הבאר התגבשות, שני כדורי העליונה-בארות בצד הימין. הן מידות במילימטרים. (B) A1-הפינה של צלחת 48-. טוב. המאגר נמצא בצד ימין של הבאר (1 גדול העליון טוב בלבד). (ג) MRC תלייה טיפה חותם. מחזיק (D) הצלחת מותאמת אישית ללא צורך במיקור חוץ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
6. חלבון קריסטלים
איור 6 מציג דוגמאות של גבישים שימושי שהושג עם פרוטוקולים האוטומטי שלנו.

איור 6: אור micrographs של טיפות המכיל קריסטלים שהושג בעקבות הפרוטוקולים אוטומטיות. (A, B) גבישים של המסך הראשוני של OmpF ו MreB ב לוחות שהוכנו עם 2 מלא אוטומטית מערכות (ראה סעיפים פרוטוקול 1.1 ו- 1.2, תנאים: A4 טוב LMB07 ו- LMB20 טוב D12, בהתאמה, גודל טיפות הוא חלבון nL 100 + 100 nL תנאי, עבודה של אנדז'יי Szewczak, LMB)24. (C, D) בר קריסטלים התחום לפני ואחרי אופטימיזציה של תנאי ראשוני באמצעות שיטת 4-פינה (שלב 2.1, LMB02 B6, 1,000 nL + 1,000 nL, שלא פורסמו עבודה של לאונרדו אלמידה-סוזה, LMB). (E, F) שרשרת כבדה של האדם דינאין 1 N-מסוף תחום גבישים לפני ואחרי אופטימיזציה של התנאים הראשוני עם השיטה 4-פינה (LMB20 E6, 200 nL + 200 nL, אז 500 nL + 500 nL, שלא פורסמו העבודה של אדגר מוראלס-ריוס, LMB). (G, H) משלימים קריסטלים פקטור D לפני ואחרי אופטימיזציה של התנאי עם הקרנה מוספים (התנאי הראשוני ממסך מותאמת אישית ללא צורך במיקור חוץ, 200, צעד 2.2 nL + 200 nL, מוספים D6 ממסך מוספים 96-מצב, שלא פורסמו עבודתו של מתיאס באואר, LMB). (אני, J) מעטפת נגיפית גבישים של25 גליקופרוטאין לפני ואחרי אופטימיזציה של התנאי עם הקרנה מוספים (שלב 2.3, LMB20 A2, 150 nL + 150 nL, ואז 200 nL + 200nL + תוסף nL 100 E5 ממסך מוספים 96-מצב, שלא פורסמו עבודתו של Yorgo Modis, אוניברסיטת קיימברידג ', בריטניה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
1 - הכנה ושימוש ראשוני מסכי מאוחסנים לוחות
הקרנת ערכות צריך להיות מעורב לפני להיות בגליל לוחות כי ההפרדה משקעים או שלב אור מתרחשת כמה צינורות במהלך האחסון. כאשר המסך מורכב שתי ערכות (2 x 48 צינורות), הצינור הראשון של ערכת השני ממוקם במיקום E1 נושאת קירור. כאשר המסך מורכב של ערכות 4 (4 x 24 צינורות), הצינור הראשון של ערכת השני ימוקם במיקום C1, הצינור הראשון של ערכת השלישי ממוקם במיקום E1, הצינור הראשון של ערכת הרביעי ממוקם במיקום G1. בעת הוספת הצינורות במנשא הקירור שלהם, עפעפיו ממוקמות על מגש בעקבות הפריסה תקן 96-ובכן נוף. מאז המספרים טוב נקובים מעל עפעפיו על ידי יצרני, הדבר מאפשר הצלבת אם לכל הצינורות הונחו בסדר הנכון. זה גם עוזר כדי להחליף את המכסים הנכון על הצינורות בעת מילוי מספר מופחת של צלחות.
אנו מאחסנים את הצלחות שמולאו מראש ב 10 ° C, פשרה כדי להימנע הקפאה ואחסון ב 4 ° C זה עלול לגרום להידרדרות של מצבים ובעיות עם איטום. צלחות מאוחסנים עבור אפילו מספר חודשים עם כלל לא מורגש עיבוי על הפנים הפנימי של החותם. זה פחות נכון עבור לוחות LMB05, LMB06, LMB09, LMB10 כמו אלה מכילים התנאים עם ריכוזים גבוהים יחסית של ריאגנטים נדיף (טבלה 1). כמות קטנה של עיבוי על הצד הפנימי של החותם מפחית יעילות איטום והוא יכול לגרום זיהום צולב בין בארות בזמן unsealing את הצלחות. כדי לסייע למנוע עיבוי במהלך הקירור הראשוני, צלחות ניתן להעביר תחילה של הקרוסלה לתוך פיקניק מבודדים קריר המאוחסן בחדר קר 4 מעלות צלזיוס למשך הלילה. התקררות איטית מאוד מצמצם את ההתפתחות של מעברי צבע הטמפרטורה בתוך הבארות אטום, ומכאן ומפחיתה עיבוי הכוללת15. בנוסף, ברגע הלוחות מאוחסנים בחממה 10 ° C, ללא צורך במיקור חוץ מותאמים אישית SBS פוליסטירן המכסה מושם בצלחת בחלק העליון של כל ערימה (לא מוצג).
הערכה השלמה של הצלחות שמולאו מראש שלנו יכול לשמש כמסך ראשונית גדולה נגד מדגם הרומן, מסיסים במים, חלבון. לחלופין, ייתכן שנבחר צלחות פחות כדי להתאים את דרישות ספציפיות. לדוגמה, LMB15 ו- LMB19 הם מסכים שגובשו במיוחד עבור26,דגימות חלבון ממברנה27, או LMB20 היא מסך עם כבד-אטומים כדי להקל על ניסיוני בהדרגה של נתוני דיפרקציה28 (ראה גם : ניסוח של מורפיוס חלבון התגבשות המסכים).
2. הגדרת התגבשות טיפות
בעת שימוש במערכת 2, הקרנת ערכות עם כמויות משמעותיות של ריאגנטים נדיף תעובד קודם. זה מונע התעבות שהצטבר על הגומי של הכיסוי SBS, אשר יכול להשפיע על מכסה טיפול ואיטום צלחת. המכסה SBS יש קצת סיווג כאשר על צלחת, ולכן הם צריכים להיות מיושרים בתחילה (ראה פרוטוקול, שלב 1.2.6). אמצעי האחסון מת ב הבארות של צלחת PCR חלבון הם נדיב יחסית (0.8 µL, ראה מקרא המובאים בטבלה 2). שימו לב כי באותה מידה נדיב כרכים מת הם מועסקים בעת השימוש מנפק nanoliter בנפרד עם חלבון ברצועות 8-טוב (טבלה 4). אמצעי אחסון קטן יותר מת עשויה לפעול, אולם כמה דגימות לדבוק הטיפים, כיול של רובוט עשוי להיות מעט לא מדויקים, החדר יכול להיות חם יותר מאשר כרגיל, ועוד. כל להוביל לדוגמה הפסדים מכוסה על ידי אמצעי האחסון מת נדיב על מנת לחזק את הגישה.
התפתחויות נוספות המזעור של ניסויים וההגדרה ומכאן היקף המדגם הדרוש לסינון התגבשות התנאים ניתן להפחתה בהכניסו המתאימים טכנולוגיה29,30 . עם זאת, היבטים מסוימים של מזעור נוסף צריך שיקול דעת זהיר, כגון האידוי של טיפות31 והמניפולציה של microcrystals32.
לבסוף, צנטריפוגה של הצלחת (2,000 סל ד, 1 דקות) יכול להיות משולב כשלב הסופי שגרתית בעת הגדרת התגבשות טיפות (ב כדורית העליונה-ולס). בגודל ובצורה עקבית יותר של טיפות הנובע צנטריפוגה עשויה להפחית הפארמצבטית-בעיות-33,-34. . בוודאי, טיפות ממורכז תקל את ההערכה מאוחר יותר של ניסויים באמצעות מיקרוסקופ כפי אורך המוקד הדרוש יהיה דומה על פני המשטח כולו.
3. יתרונות השיטה 4-פינה
היתרון המשמעותי ביותר של שיטת 4-פינה הוא הפשטות שלה, אשר ממזער שגיאות ומקל פרוטוקולים אוטומטיים פשוטה. לדוגמה, הפתרונות בפינה תמיד ימוקם על סיפון נוזלי עוזר בעקבות באותה הפריסה. כמו כן, כל התוכניות מבוססות על יחס קבוע בין הפתרונות (איור 3C).
הכנה ידנית של הפתרונות בפינה היא עדיפה לטיפול האוטומטי של פתרונות בריכוזים גבוהים, אשר יכול להיות בעלי צמיגות גבוהה. יחסית מהיר ומדויק השאיפה/dispensing אפשרי אז על רוב סוגי המטפלים נוזלי עם הדרישות המינימליות עבור אופטימיזציה של מחלקות נוזלי. בכל זאת, כמה פתרונות פינה עדיין ייתכן צמיגה יותר מדי בשביל רובוט הפועלים עם מערכת נוזל לפעול ביעילות. זו הסיבה לניתוח עוזר נוזלי ההפעלה עם תזוזה חיובית (איור 3B).
בנוסף 2 מעברי צבע ליניאריים של ריכוזים, רכיב השלישי (כלומר, קבוצה של אנשים רגילים/תוספים) יכול להיבדק על ריכוז קבוע בדרך נוחה. בשביל זה, כמויות גדולות יחסית של ערכה בסיסית של פתרונות פינה-ריכוז גבוה יותר כראוי, לא כולל את הרכיב כדי להיות מגוונים, מוכן קודם. לאחר מכן, מלאי פתרונות כולל רכיב זה מתווסף כדי להתאים את ריכוזי הסופי. לדוגמה, 50 מ של קבוצת 4 פינת פתרונות מוכנים בריכוזים גבוהים 10% מאשר בתחילה. סט הליבה ואז מפוצל לערכות 5 של 4. לבסוף, 10% בנפח של מאגר שונים-pH פתרונות מתווסף משנה.
4. תבניות וסוגי מסכי מוספים
המסכים מאוחסנים בדרך כלל ב-20 ° C (איור 4) מאז הם לא משמשים באופן קבוע ומכילים חומרים נדיפים/לא יציב. השימוש של מסך מוספים קפוא המאוחסנים בתוך גוש עמוק טוב (1 מ"ל במספר בארות) חייב להיות מתוכנן מוקדם כי זה יקח 12-24 ביממה עבור כל הפתרונות מוספים להפשיר לחלוטין בטמפרטורת החדר. כמו כן, מספר רב של משתמשים לשתף באותו מסך מוספים, ובכך לגרום בעיות זיהום צולב. לבסוף, הגובה של בלוקים עמוק טוב גורם להם מתאימים עבור רוב מתקני החלוקה nanoliter. כפתרון נוח כדי לעקוף בעיות אלה, המסך צריך להעביר מהגוש עמוק טוב לוחות פרופיל נמוך (איור 4).
מבחינה היסטורית, מסכי מוספים הכוללים מגוון רחב של ריאגנטים יחיד (עם ריכוזים יחיד) היה מאוד פופולרי35,36. עם זאת, סוגים אחרים של מסכי מוספים פותחו המשלבים mixes תוספים37 או מספר מופחת של תוספים יחיד ב ריכוזים שונים38. לבסוף, בגישה המשלימה היא לחקור את ההשפעה של תוספות על הדגימות לפני התגבשות39,40.
5. עוד שיקולים
אימון טוב: רוב מסכי מכילים חומרים מזיקים או אפילו רעילים, ולכן חייב להיות מועסק הגנה אישית נאותה במהלך הפרוטוקולים. באותה מידה, חלקים של הרובוטים נעים עלול להוביל לפציעות, במיוחד כאשר מנסה להפריע באופן ידני בעת הפעלת תוכנית (למרות רוב הרובוטים יש לחצן עצירת חירום/מערכת). בגלל המורכבות הטכנית מעורבת, רגיל בדיקה של רובוטים, מסכי ותוכניות עם בעבר אפיינו את הבדיקה דוגמאות חשובים עבור רמות גבוהות מתמשכת של הפארמצבטית.
תפוקת: כאינדיקציה, בין 4,000 ל 8,000 LMB הלוחות מיוצרים שנתי עם מערכת 1 (וגם לאחר מכן מועסקים על-ידי משתמשים להקרנה הראשונית). שזה לא מותאם מניות כמות גדולה של צלחות שמולאו מראש ב 10 ° C כאשר מחזור הצפוי הוא נמוך בהרבה, כמו אחרי 4-5 חודשים, כמה תנאים יתחיל להתדרדר להתאדות. גישות שונות כדי אוטומציה פרוטוקולים יושמו עבור מעבדות קטנות - עד בינוניים41.
Storing והערכה ניסויים: לאחר הכנת את טיפות, צלחות מאוחסנים על מדפים נמוכים-רטט בחדר בשעה 4 או 18 ° C עם טמפרטורה מבוקרת בחוזקה (+ /-0.5 ° C סטיית המרבי). ניסויים הם העריכו באמצעות מיקרוסקופים מקור אור קר. מערכות הדמיה אוטומטיות שונות זמינים מסחרית, אולם אחד יש לשקול היטב כל ההיבטים: המהירות הדרושה כדי לסרוק צלחת יהיה מספיק עבור תפוקה גבוהה? אובייקטים שאינם קריסטלים יפריע פוקוס אוטומטי? איכות התמונות המתקבלת יהיה מספיק כדי ספוט גבישים קטנים מאוד (במיוחד סביב קצה טיפות)? 42 , 43 , 44
השוואה של התגבשות התנאים: לאחר חקירות זהיר על טבעו של הקריסטלים השיג בתחילה, אחד ניתן לנתח מגמות, דמיון על פני תנאי שימוש על LMB מסך מסד הנתונים או את C6 כלי אינטרנט45.
Disclosures
אנחנו בזאת המדינה עניין מסחרי סותרות מאז LifeArc commercializes את הפריטים הבאים: 96 - ו 48-הבאר MRC צלחות, MRC תלייה טיפה החותם, המסכים התגבשות LMB אנגסטרום, Pi, מורפיוס.
Acknowledgements
המתקן התגבשות MRC-LMB הוא באדיבות נתמך על ידי המועצה למחקר רפואי (בריטניה). אנו מודים חברי LMB על תמיכתם: אולגה Perisic (PNAC), טוני וורן, Fusinita ואן דן Ent ו פט אדוארדס (לימודי המבנית), סטיב Scotcher, שאר חברי הסדנה מכני, ניל גרנט, ג'ו וסטמורלנד (עזרים חזותיים), פול הארט, טום פראט (IT). אנחנו גם רוצה להודות סטיב אליוט (Tecan, בריטניה), סטיוארט מיטשל, הת'ר Ringrose (רובוטיקה המילטון, בריטניה), פול הפשרה, רוברט לואיס של Joby ג'נקינס (טרומבוציטופניה Labtech, בריטניה), פול רירדן (Swissci AG, שוויץ), סטיבנס. ג'ורג ', דונלד Ogg (Alphabiotech, בריטניה), ניל ויליאמס (Markem Imaje, בריטניה) ו גרהם האריס (סוכנות קליבלנד) לקבלת עזרה טכנית.
Materials
| Name | Company | Catalog Number | Comments |
| Robots | |||
| Freedom EVO® | Tecan | n/a | Liquid handler (System 1). Aspiration/Dispense based on system liquid. Integrates an automated carousel. EVOware plus controlling software v.2.4.12.0. |
| Microlab® STAR™ | Hamilton | n/a | Liquid handler (System 2). Aspiration/Dispense based on positive displacement (CO-RE™ technology). Hamilton STAR controlling software v.4.3.5.4785 with method management interface. |
| Mosquito® | TTP Labtech | n/a | Microsyringe-based nanoliter dispenser used to set up droplets (System 2 and stand-alone), 3-position deck. Controlling software v.3.11.0.1422. |
| Dragonfly® | TTP Labtech | n/a | Syringe-based liquid handler used to produce optimization screens (4-corner method). Controlling software v.1.2.1.10196. |
| Adhesive plate sealer | Brandel | n/a | Integrated to Systems 1 and 2 (also used as stand-alone robot). |
| Inkjet printer 9232 | Markem-Imaje | n/a | Integrated to System 1. Touchscreen interface. |
| Crystallization screens | |||
| Crystal Screen™ 1 | Hampton Research | HR2-110 | Crystallization kit (test tubes, 10mL per condition) used in LMB01 |
| Crystal Screen 2™ | Hampton Research | HR2-112 | Crystallization kit (test tubes, 10mL per condition) used in LMB01 |
| Wizard™ Classic 1 | Rigaku | 1009530 | Crystallization kit (test tubes, 10mL per condition) used in LMB02 |
| Wizard™ Classic 2 | Rigaku | 1009531 | Crystallization kit (test tubes, 10mL per condition) used in LMB02 |
| Grid Screen™ Ammonium Sulfate | Hampton Research | HR2-211 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Grid Screen™ PEG/LiCl | Hampton Research | HR2-217 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Quick Screen™ | Hampton Research | HR2-221 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Grid Screen™ Sodium Chloride | Hampton Research | HR2-219 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Grid Screen™ PEG 6000 | Hampton Research | HR2-213 | Crystallization kit (test tubes, 10mL per condition) used in LMB04 |
| Grid Screen™ MPD | Hampton Research | HR2-215 | Crystallization kit (test tubes, 10mL per condition) used in LMB04 |
| MemFac™ | Hampton Research | HR2-114 | Crystallization kit (test tubes, 10mL per condition) used in LMB04 |
| PEG/Ion™ | Hampton Research | HR2-126 | Crystallization kit (test tubes, 10mL per condition) used in LMB05 |
| Natrix™ | Hampton Research | HR2-116 | Crystallization kit (test tubes, 10mL per condition) used in LMB05 |
| Crystal Screen Lite™ | Hampton Research | HR2-128 | Crystallization kit (test tubes, 10mL per condition) used in LMB06 |
| Custom Lite screen | Molecular Dimensions Ltd | n/a | Crystallization kit (test tubes, 10mL per condition) used in LMB06 |
| Wizard™ Cryo 1 | Rigaku | 1009536 | Crystallization kit (test tubes, 10mL per condition) used in LMB07 |
| Wizard™ Cryo 2 | Rigaku | 1009537 | Crystallization kit (test tubes, 10mL per condition) used in LMB07 |
| JBS1 | JenaBioScience | CS-101L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS2 | JenaBioScience | CS-102L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS3 | JenaBioScience | CS-103L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS4 | JenaBioScience | CS-104L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS5 | JenaBioScience | CS-105L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS6 | JenaBioScience | CS-106L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS7 | JenaBioScience | CS-107L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS8 | JenaBioScience | CS-108L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS9 | JenaBioScience | CS-109L | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| JBS10 | JenaBioScience | CS-110L | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| Clear Strategy™ Screen 1 pH 4.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| Clear Strategy™ Screen 1 pH 5.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| Clear Strategy™ Screen 1 pH 6.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 1 pH 7.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 1 pH 8.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 2 pH 4.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 2 pH 5.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Clear Strategy™ Screen 2 pH 6.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Clear Strategy™ Screen 2 pH 7.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Clear Strategy™ Screen 2 pH 8.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Index™ | Hampton Research | HR2-144 | Crystallization kit (test tubes, 10mL per condition) used in LMB13 |
| SaltRX™ 1 | Hampton Research | HR2-107 | Crystallization kit (test tubes, 10mL per condition) used in LMB14 |
| SaltRX™ 2 | Hampton Research | HR2-109 | Crystallization kit (test tubes, 10mL per condition) used in LMB14 |
| MemStar™ | Molecular Dimensions Ltd | MD1-21 | Crystallization kit (test tubes, 10mL per condition) used in LMB15 |
| MemSys™ | Molecular Dimensions Ltd | MD1-25 | Crystallization kit (test tubes, 10mL per condition) used in LMB15 |
| JCSG-plus™ Suite | Qiagen | 130720 | Crystallization kit (test tubes, 10mL per condition) used in LMB16 |
| MORPHEUS® screen | Molecular Dimensions Ltd | MD1-46 | Crystallization kit (test tubes, 10mL per condition) used in LMB17 |
| Pi minimal screen | JenaBioScience | CS-127 | Crystallization kit (test tubes, 10mL per condition) used in LMB18 |
| Pi-PEG screen | JenaBioScience | CS-128 | Crystallization kit (test tubes, 10mL per condition) used in LMB19 |
| MORPHEUS® II screen | Molecular Dimensions Ltd | MD1-91 | Crystallization kit (test tubes, 10mL per condition) used in LMB20 |
| LMB crystallization screen™ | Molecular Dimensions Ltd | MD1-98 | Crystallization kit (test tubes, 10mL per condition) used in LMB21 |
| Additive screens | |||
| HT additive screen | Hampton Research | HR2-138 | Frozen in 96-well deepwell block (1 mL per well). |
| MORPHEUS® additive screen | Molecular Dimensions Ltd | MD1-93-500 | Frozen in 96-well deepwell block (500 µL per well). |
| ANGSTROM additive screen™ | Molecular Dimensions Ltd | MD1-100 | Frozen in 96-well deepwell block (1 mL per well). |
| MORPHEUS® additive screen | Molecular Dimensions Ltd | MD1-93 | Frozen in 96-well cell culture Costar® plate with V-shaped wells (100 µL per well). |
| ANGSTROM additive screen™ | Molecular Dimensions Ltd | MD1-100-FX | Frozen in 96-well cell culture Costar® plate with V-shaped well (100 µL per well). |
| HIPPOCRATES additive screen | Molecular Dimensions Ltd | n/a | 48 single additives (drug compounds found in MORPHEUS® III). |
| Other consumables | |||
| 96-well MRC 2-drop plate | Swissci | MRC 96T-UVP | Sitting-drop, vapor diffusion plate. Reservoir recommended volume: 80 µL. Range of useful droplet volumes: 10-1000 nL. UV transmissible. |
| 48-well MRC 1-drop plate ('MAXI plate') | Swissci | MMX01-UVP | Sitting-drop, vapor diffusion plate for scale-up/optimization. Reservoir recommended volume: 200 µL. Range of useful droplet volumes: 0.1-10 µL. UV transmissible. |
| MRC hanging drop seal | Swissci | n/a | Hanging-drop, compatible with both MRC vapor diffusion plates (MRC 96T-UVP and MMX01-UVP ). UV and X-ray transmissible. |
| Adhesive sealing tape | Hampton Research | HR4-50 | 3-inch wide Duck® HD Clear™ for sealer and manual sealing. |
| Adhesive aluminium sheet | Beckman Coulter | 538619 | Used to reseal additive screens. |
| Ink cartridge | Markem-Imaje | 9651 | System 1 (inkjet printer). |
| Solvent cartridge | Markem-Imaje | 8652 | System 1 (inkjet printer). |
| 50 µL tips | Hamilton | 235947 | System 2 (STAR™ liquid handler). Box of 6 sets with 1920 x CO-RE™ tips in disposable stacks. |
| Reagent container | Hamilton | 194052 | Used to dispense a condition into plate(s) during additive screening protocols. |
| PCR plate | Thermo Scientific™ | AB-2150 | System 2 (contains protein to be transfer to the Mosquito®). Abgene Diamond ultra, 384 V-shaped wells. |
| microsyringes | TTP Labtech | 4150-03020 | Spool of 26,000 microsyringes for the Mosquito® nanoliter dispenser (9mm spacing). |
| strip-holder block | TTP Labtech | 3019-05013 | SSB device for the Mosquito® strips, aka '4-way Reagent Holder'. |
| 2 µL 8-well strip | TTP Labtech | 4150-03110 | Contains protein on the deck of the Mosquito®. Box of 40 strips, max. vol. in well is 3.2 µL. |
| 5 µL 8-well strip | TTP Labtech | 4150-03100 | Contains protein on the deck of the Mosquito®. Box of 40 strips, max. vol. in well is 7.5 µL. |
| 5 mL syringes | TTP Labtech | 4150-07100 | Syringe body and piston for the Dragonfly® liquid handler. Pack of 100. |
| Troughs/Reservoirs | TTP Labtech | 4150-07103 | Contains stock solutions on the deck of the Dragonfly®. Pack of 50. |
| Orbital microplate shaker | CamLab Limited | n/a | Variomag® for mixing conditions in a single plate (0-2000 rpm). |
| Microplate mixer | TTP Labtech | 3121-01015 | MxOne. Mixing condition in a single plate with 96 vibrating pins. |
References
- Rupp, B. . Biomolecular Crystallography: Principles, Practice and Application to Structural Biology. , (2010).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Bergfors, T. M. . Protein crystallization: techniques, strategies, and tips: a laboratory manual. , (1999).
- Dessau, M. A., Modis, Y. Protein Crystallization for X-ray Crystallography. J. Vis. Exp. (47), e2285 (2011).
- Crick, F. H. C. X-Ray Diffraction of Protein Crystals. Methods Enzymol. 4, 127-146 (1957).
- Jaskolski, M., Dauter, Z., Wlodawer, A. A brief history of macromolecular crystallography, illustrated by a family tree and its Nobel fruits. FEBS J. 281, 3995-4009 (2014).
- Chruszcz, M., Wlodawer, A., Minor, W. Determination of Protein Structures-A Series of Fortunate Events. Biophys. J. 95, 1-9 (2008).
- Manjasetty, B. A., Büssow, K., Panjikar, S., Turnbull, A. P. Current methods in structural proteomics and its applications in biological sciences. 3 Biotech. 2, 89-113 (2012).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J. Biol. Chem. 254, 12219-12223 (1979).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J. Appl. Cryst. 23, 409-411 (1991).
- Stevens, R. C. High-throughput protein crystallization. Curr. Opin. Struct. Biol. 10, 558-563 (2000).
- Berry, I. M., Dym, O., Esnouf, R. M., Harlos, K., Meged, R., Perrakis, A., Sussman, J. L., Walter, T. S., Wilson, J., Messerschmidt, A. SPINE high-throughput crystallization, crystal imaging and recognition techniques: current state, performance analysis, new technologies and future aspects. Acta Crystallogr D Biol Crystallogr. 62, 1137-1149 (2006).
- Luft, J. R., Collins, R. J., Fehrman, N. A., Lauricella, A. M., Veatch, C. K., DeTitta, G. T. A deliberate approach to screening for initial crystallization conditions of biological macromolecules. J. Struct. Biol. 142, 170-179 (2003).
- Moraes, I., Evans, G., Sanchez-Weatherby, J., Newstead, S., Stewart, P. D. S. Membrane protein structure determination-the next generation. Biochim. Biophys. Acta. 1838, 78-87 (2014).
- Stock, D., Perisic, O., Löwe, J. Robotic nanoliter protein crystallisation at the MRC Laboratory of Molecular Biology. Prog. Biophys. Mol. Biol. 88, 311-327 (2005).
- Gorrec, F. The current approach to initial crystallization screening of proteins is under-sampled. J. Appl. Cryst. 46, 795-797 (2013).
- Hennessy, D. N., Narayanan, B., Rosenberg, J. M. Automatic implementation of precise grid screens: the four-corners method. Acta Crystallogr D Biol Crystallogr. 65, 1001-1003 (2009).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- DiLorenzo, M. E., Timoney, C. F., Felder, R. A. Technological Advancements in Liquid Handling Robotics. JALA. 6, 36-40 (2001).
- Jenkins, J., Cook, M. Mosquito: An Accurate Nanoliter Dispensing Technology. JALA. 9, 257-261 (2004).
- Li, D., Boland, C., Walsh, K., Caffrey, M. Use of a Robot for High-throughput Crystallization of Membrane Proteins in Lipidic Mesophases. J. Vis. Exp. (67), e4000 (2012).
- Till, M., Robson, A., Byrne, M. J., Nair, A. V., Kolek, S. A., Shaw Stewart, P. D., Race, P. R. Improving the Success Rate of Protein Crystallization by Random Microseed Matrix Screening. J. Vis. Exp. (78), e50548 (2013).
- Dierks, K., Meyer, A., Oberthür, D., Rapp, G., Einspahr, H., Betzel, C. Efficient UV detection of protein crystals enabled by fluorescence excitation at wavelengths longer than 300 nm. Acta Crystallogr F Biol Crystallogr. 66, 478-484 (2010).
- Szewczak, A. . Structural studies of the bacterial MreBCD complex. , (2016).
- Nayak, V., Dessau, M., Kucera, K., Anthony, K., Ledizet, M., Modis, Y. Crystal structure of dengue virus type 1 envelope protein in the postfusion conformation and its implications for membrane fusion. J. Virol. 83, 4338-4344 (2009).
- Gorrec, F., Palmer, C. M., Lebon, G., Warne, T. Pi sampling: a methodical and flexible approach to initial macromolecular crystallization screening. Acta Crystallogr D Biol Crystallogr. 67, 463-470 (2011).
- Parker, J. L., Newstead, S. Current trends in α-helical membrane protein crystallization: An update. Protein Sci. 21, 1358-1365 (2012).
- Gorrec, F. The MORPHEUS II protein crystallization screen. Acta Crystallogr F Biol Crystallogr. 71, 831-837 (2015).
- Yin, X., et al. Hitting the target: fragment screening with acoustic in situ co-crystallization of proteins plus fragment libraries on pin-mounted data-collection micromeshes. Acta Crystallogr D Biol Crystallogr. 70, 1177-1189 (2014).
- Wu, P., Noland, C., Ultsch, M., Edwards, B., Harris, D., Mayer, R., Harris, S. F. Developments in the Implementation of Acoustic Droplet Ejection for Protein Crystallography. JALA. 21, 97-106 (2015).
- Zipper, L. E., et al. A simple technique to reduce evaporation of crystallization droplets by using plate lids with apertures for adding liquids. Acta Crystallogr F Biol Crystallogr. 70, 1707-1713 (2014).
- Wagner, A., Duman, R., Stevens, B., Ward, A. Microcrystal manipulation with laser tweezers. Acta Crystallogr D Biol Crystallogr. 69, 1297-1302 (2013).
- Newman, J. Initial Evaluations of the Reproducibility of Vapor-Diffusion Crystallization. Acta Crystallogr D Biol Crystallogr. 63, 826-832 (2007).
- Reis, N. M., Chirgadze, D. Y., Blundell, T. L., Mackley, M. R. The effect of protein-precipitant interfaces and applied shear on the nucleation and growth of lysozyme crystal. Acta Crystallogr D Biol Crystallogr. 65, 1127-1139 (2009).
- McPherson, A., Koszelak., S., Axelrod, H., Day, J., Robinson, L., McGrath, M., Williams, R., Cascio, D. The effects of neutral detergents on the crystallization of soluble proteins. J. Crystal Growth. 76 (3), 547-553 (1986).
- Sauter, C., Ng, J. D., Lorber, B., Keith, G., Brion, P., Hosseini, M. W., Lehn, J. -. M., Giegé, R. Additives for the crystallization of proteins and nucleic acids. J. Crystal Growth. 196, 365-376 (1999).
- McPherson, A., Cudney, B. Searching for silver bullets: an alternative strategy for crystallizing macromolecules. J. Struct. Biol. 156, 387-406 (2006).
- Gorrec, F. Protein crystallization screens developed at the MRC Laboratory of Molecular Biology. Drug Discov. Today. 21, 819-825 (2016).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Anal. Biochem. 357, 289-298 (2006).
- Chari, A., et al. ProteoPlex: stability optimization of macromolecular complexes by sparse-matrix screening of chemical space. Nat. Methods. 12, 859-865 (2015).
- Newman, J., Egan, D., Walter, T. S., Meged, R., Berry, I., Ben Jelloul, M., Sussman, J. L., Stuart, D. I., Perrakis, A. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta Crystallogr D Biol Crystallogr. 61, 1426-1431 (2005).
- Wilson, J. Automated Evaluation of Crystallisation Experiments. Cryst. Rev. 10, 73-84 (2004).
- Snell, E. H., et al. Establishing a training set through the visual analysis of crystallization trials. Part I: ∼150 000 images. Acta Crystallogr D Biol Crystallogr. 64, 1123-1130 (2008).
- Haupert, L. M., Simpson, G. J. Screening of protein crystallization trials by second order nonlinear optical imaging of chiral crystals (SONICC). Methods. 55, 379-386 (2011).
- Newman, J., Fazio, V., Lawson, B., Peat, T. The C6 Web Tool: A Resource for the Rational Selection of Crystallization Conditions. Cryst. Growth & Des. 13, 12219-12223 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved