Method Article
Automated protocolos para cristalização Macromolecular no laboratório de Biologia Molecular MRC
Neste Artigo
Resumo
Sistemas automatizados e protocolos para a preparação de rotina de um grande número de telas e gotículas de cristalização nanolitros para experimentos de difusão de vapor são descritos e discutidos.
Resumo
Quando cristais de alta qualidade são obtidos que difração de raios-x, a estrutura de cristal pode ser resolvida perto de resolução atômica. As condições para cristalizar proteínas, DNA, RNAs e seus complexos no entanto não podem ser previsto. Empregando uma ampla variedade de condições é uma maneira de aumentar o rendimento de cristais de difração de qualidade. Dois sistemas totalmente automáticos foram desenvolvidos para o MRC laboratório de Biologia Molecular (Cambridge, Inglaterra, MRC-LMB) que facilitam a seleção de cristalização contra 1.920 condições iniciais por difusão de vapor em gotas de nanolitros. Protocolos semi-automático também foram desenvolvidos para otimizar as condições, alterando as concentrações dos reagentes, o pH, ou através da introdução de aditivos que potencialmente melhorar propriedades dos cristais resultantes. Todos os protocolos correspondentes serão descritos detalhadamente e brevemente discutidos. Tomados em conjunto, possibilitam a cristalização macromolecular altamente eficiente e conveniente numa instalação multi-usuário, dando aos usuários controle sobre parâmetros-chave de suas experiências.
Introdução
Cristalografia de raios x é aplicada extensivamente para avançar ainda mais a nossa compreensão dos mecanismos biológicos e doença ao nível atómico e posteriormente ajudar racionais abordagens para descoberta de drogas1. Por isso, purificado e concentrado (2-50 mg/mL) macromolecular amostras de proteínas, DNA, RNA, outros ligantes e seus complexos são julgadas por sua propensão a forma ordenada grades tridimensionais através de cristalização2,3 ,4. Quando cristais de alta qualidade são obtidos que difração de raios-x, a estrutura de cristal pode ser resolvida perto de resolução atômica5,6. Fundamentalmente, as condições para se cristalizar uma nova amostra não podem ser previstas e o rendimento de cristais de alta qualidade é geralmente muito baixo. Uma razão subjacente é que muitas amostras de interesse desafiadoras propriedades bioquímicas, que os tornam instável a escala temporal correspondente para cristalização (normalmente alguns dias). Finalmente, o processo é agravado pelo tempo necessário para produzir amostras e variantes de amostra e para otimizar a sua purificação e cristalização7,8.
Uma condição de cristalização é uma solução com um dessensibilizador que reduz a solubilidade da amostra e condições muitas vezes também contêm buffers e aditivos. Centenas de tais reagentes são bem adaptadas para alterar os parâmetros dos experimentos de cristalização, como eles têm baixa propensão para interferir com a integridade da amostra (como proteínas ou ácidos nucleicos desdobramento). Enquanto milhões de combinações de reagentes de cristalização de teste não é praticável, testar várias a muitos kits de triagem - formulados com várias estratégias9,10 - é possível com ensaios miniaturizados e protocolos automatizados. Nesta perspectiva, a técnica mais favorável é, provavelmente, difusão de vapor com gotas de 100-200 nL sentado sobre um pequeno poço acima de um reservatório que contém a condição de cristalização (25-250 µ l), implementada em placas de cristalização especializada11 , 12. a amostra de proteína e condição muitas vezes são combinados em uma proporção de 1:1 para um volume total de 200 nL ao configurar as gotas na parte superior-poços. Cristalização de proteínas nanolitros robótico pode ser implementada com técnicas alternativas e pratos como o óleo Under lote13 e a fase cúbica lipídico14 (o mais recente um sendo aplicado especificamente às proteínas trans-membrana que são muito pouco solúvel em água).
A facilidade de cristalização no MRC-LMB foi iniciado no início de 2000, e um resumo inicial de nossos protocolos automatizados foi apresentado em 200515. Foi apresentada uma introdução histórica à cristalização de proteínas e abordar também um resumo das vantagens da robótica nanolitros (então uma nova abordagem para a experimentação de rotina). Desde macromolecular cristalização é essencialmente um processo estocástico com muito pouco ou não útil informação prévia, empregando uma ampla variedade de condições iniciais (adequadas), aumentar o rendimento da qualidade difração cristais16. Além disso, uma vantagem de muitas vezes negligenciado, de uma grande tela inicial é reduzir significativamente a necessidade de otimização de amostras e cristais em muitos casos. Claro, um ainda pode precisar de prosseguir com a otimização de algumas condições iniciais mais tarde. Normalmente, a concentração dos reagentes e o pH são então sistematicamente investigados. Reagentes mais também podem ser introduzidos na condição (ões) otimizado para alterar mais parâmetros de cristalização. Certamente, um deve tentar cristalização com uma amostra preparada, portanto, os protocolos correspondentes devem ser simples e disponível qualquer hora.
Aqui, dois totalmente automatizada de sistemas projetados para o MRC-LMB (sistemas de 1 e 2) e os protocolos correspondentes são totalmente descritos. A principal aplicação desses dois sistemas é inicial de triagem por difusão de vapor em sentado soltar placas de cristalização. Sistema 1 integra um manipulador de líquido, um carrossel automatizado de estoque placas, uma impressora jato de tinta para a rotulagem de placa e um aferidor de placa adesiva. No sistema 1, 72 placas de 96 poços são preenchidas com kits de triagem disponíveis comercialmente (80 µ l de condição, transferida para o reservatório de um volume inicial de 10 mL em tubos de ensaio), rotuladas e seladas. As placas são então armazenadas em uma incubadora de 10 ° C, onde eles estão disponíveis para os usuários a qualquer momento (como telas iniciais chamadas 'Placas LMB').
Sistema 2 integra um manipulador de líquido, um dispensador de nanolitros e um aferidor de placa adesiva. No sistema 2, sentado gotículas (100-1.000 nL) para experiências de difusão de vapor são produzidos pela combinação de condições e a amostra no superior-poços de 20 placas de 48 ou 96-boas pré-preenchido com as condições. Isto significa 1.920 condições de rastreio inicial são julgadas quando usando 20 placas LMB no sistema 2.
Robôs também são utilizados individualmente para a otimização das condições selecionadas, e os correspondentes protocolos semi-automático também são descritos. O método 4-canto17 é empregada rotineiramente para produzir telas de otimização. O protocolo correspondente primeiro exige a preparação manual de 4 soluções ('A, B, C e D'). Dois gradientes lineares das concentrações (para dois agentes principais de cristalização) então são gerados automaticamente diretamente para os reservatórios de uma placa de cristalização. Por isso, um manipulador de líquidos baseados em seringa dispensa as soluções de 4 canto em diferentes proporções.
Para otimizar ainda mais uma condição, pode-se empregar telas aditivas que potencialmente melhoram as propriedades de resultante cristais18. Duas abordagens estão disponíveis para a seleção de aditiva: um protocolo começando com aditivos corre para os reservatórios das placas de cristalização antes de configurar as gotas (protocolo 1) e outro protocolo, onde a tela aditiva é dispensada diretamente sobre as gotas (protocolo 2).
Outros desenvolvimentos útil que foram iniciados no MRC-LMB para facilitar a cristalização macromolecular automatizada, também são apresentados. Essencialmente, placas de cristalização e dispositivos associados, tais como um empilhável sociedade de Biomolecular triagem (SBS) tampa que minimiza a evaporação das condições ao utilizar o sistema 2.
Por questões de brevidade, presume-se que os usuários estão familiarizados com as funções básicas e manutenção do aferidor de placa adesiva, a impressora jato de tinta e o dispensador de nanolitros. Salvo indicação em contrário, placas no convés dos robôs estão posicionadas tal que o poço A1 ('A1-canto') é no sentido de canto esquerdo atrás de uma operadora de placa.
Protocolo
1. os dois sistemas (triagem inicial) totalmente automatizados
-
Sistema 1: preparação de 72 placas de 96 poços cristalização repleta de kits (placas LMB) de rastreio
- Antes de realizar o procedimento, certifique-se de que os robôs do sistema são inicializados e seu software de controle é aberto. Ligue o refrigerador do porta-tubo de refrigeração em cerca de 30 minutos antes do programa principal será iniciado.
- Coloque uma placa de teste sobre a transportadora SBS motorizada do aferidor de placa. Execute o aferidor de placa e verifique que a película é aplicada corretamente. Repita este teste mais duas vezes para verificar se o aferidor de prato está pronto.
- Em seguida, adicione 20 L de água deionizada para o recipiente principal do manipulador de líquido. As inserções de acoplamento do recipiente pequeno (etanol 20% de solução de lavagem) e ligue as inserções para o recipiente principal.
- Digite o nome de tela apropriada (tabela 1) no ecrã táctil de impressora a jato de tinta. Em seguida, abra e feche a porta do carrossel para acionar a rotação de carrossel. Quando a primeira pilha apresenta-se, abra a porta.
- Carregar totalmente a primeira pilha com 22 placas de cristalização, cada um com voltado para a coluna 1 para fora. Carrega totalmente as próximas duas pilhas da mesma forma.
- Carrega as restantes 6 placas nos mais altos cargos da quarta pilha. Em seguida, feche a porta do carrossel.
- Verifique se que o display do refrigerador indica 14 ° C. Suavemente e repetidamente inverta os kits de triagem selecionado por 1 minuto. Em seguida, abra o painel frontal do manipulador de líquido.
- Abra os tubos e coloque-os em refrigeração transportadora de acordo com o layout padrão de 96 poços (A1, A2, etc.). Após a colocação de cada tubo no portador, coloque a tampa em uma bandeja no mesmo layout de 96 poços.
- Verificar o tubo posições e garantir que todos os tubos são de nível e se estabeleceram no portador. Em seguida, feche o painel frontal.
- Na janela do software líquido manipulador 'Inicialização', selecione 'Executar manutenção' e abrir o programa de lavagem. Execute o programa para liberar o etanol 20% do sistema e para lavar as paredes laterais das dicas de fornecimento de líquido.
- Quando a descarga estiver concluída, clique em 'Cancelar' para voltar à 'Inicialização'. Selecione 'Executar um processo existente' e clique em 'Iniciar sua seleção'. Abra o programa 'MRC kit distribuição'. Preencha '18' 'Instâncias' na configuração de tela e executar o programa.
- Monitore o sistema como as quatro primeiras placas são rotuladas, preenchidas e seladas.
- Uma vez que todas as 72 placas foram preparadas e colocado de volta no carrossel, mudar as inserções de acoplamento do recipiente principal para o recipiente pequeno. Execute o programa 'Arranque flush' (consulte a etapa 1.1.10).
- Desligar o refrigerador e descartar a esvaziar os tubos kit de triagem. Remova cuidadosamente as 72 placas preparadas no carrossel. Descarte de placas preenchido incorretamente ou mal vedada. Armazenar as placas de ready-to-use a 10 ° C.
-
Sistema 2: criação de uma única amostra em 20 placas de LMB de gotículas de cristalização (proteína de nL 100 + 100 condição nL)
- Em primeiro lugar, garantir que robôs do sistema estão em, o dispensador de nanolitros é inicializado com seu software aberto, e gerente do método do manipulador líquido está aberto. Ligue a transportadora microtubo e refrigeração cerca de 15 minutos antes do programa principal será iniciado.
- Coloque uma placa de teste sobre a transportadora SBS motorizada do aferidor de placa. Executar o aferidor da placa e verificar que a placa está devidamente selada. Teste o aferidor de placa três vezes.
- Em seguida, execute o dispensador de nanolitros para definir 100-nL gotas da solução de teste em uma placa de teste. Verificar sob um microscópio que as gotas estão definidas corretamente. Feche o software do dispensador de nanolitros e remover o bloco tira-titular do baralho.
- Em seguida, insira no porta-placa personalizados (ver Resultados de representante: cristalização dispositivos desenvolvidos para o LMB) a placa LMB com a maior quantidade relativa dos reagentes voláteis em suas condições (tabela 1). Remova a película adesiva da placa.
- Abrir o painel frontal do manipulador de líquido e coloque a placa sem lacre no deck, na parte de trás o primeiro transportador de deslizamento (portadores de deslizamento pode ser puxada para a facilidade de acesso).
- Cubra o prato com uma tampa de alumínio SBS. Resolver a tampa em direção ao canto esquerdo traseiro da transportadora, aplicando uma pressão suave ao canto oposto da tampa.
- Unseal, carregar para as deslizamento das transportadoras e cobrir as restantes 19 placas da mesma forma, trabalhando a partir mais para condições menos voláteis. Uma vez que a transportadora microtubo de refrigeração a 4 ° C, conforme indicado pela luz verde, remova sua capa.
- Corte a tampa de um microtubo contendo (pelo menos) 440 µ l da amostra de proteína (tabela 2). Certifique-se de que a amostra tem sem espuma acima do menisco, como isso irá interferir com o sistema de detecção de líquido. Coloca o tubo na posição 1 da transportadora microtubo e refrigeração.
- Coloque um prato PCR no convés manipulador de líquido na frente da transportadora adaptador placa-movendo-se. Em seguida, feche o painel frontal.
- Depois de carregar o convés, certifique-se que o baralho de dispensador de nanolitros é claro do bloco tira-titular e que as transportadoras na parte de trás das pilhas de ponta de 50 µ l são claras das tampas de alumínio SBS.
- Na interface de 'Método de gestão' líquido manipulador, selecione 'Setup placas'. Monitorar a inicialização de ambos os sistemas e preencher os parâmetros de execução. Siga as diretrizes de interface de gerenciamento método (prompts, figuras e um sistema de gestão de ponta ajudar com preparação).
- Verifique que todas as componentes estão prontos e em seguida, iniciar o processo.
- Monitore o sistema como o dispensador de nanolitros define as gotas na primeira placa e o aferidor de placa posteriormente selos da placa.
- Uma vez que todas as 20 placas foram preparadas com gotículas de cristalização e retornadas automaticamente para os portadores de deslizamento, abrir o painel frontal e remova cuidadosamente as placas. Verifica que as placas são seladas corretamente antes de guardá-los por cristalização.
- Limpe as tampas SBS com uma solução de etanol a 20% antes de empilhá-los no lado esquerdo do manipulador de líquido para o armazenamento. Descarte a placa PCR e o microtubo.
- Desligue a transportadora microtubo e refrigeração e enxugar a condensação. Deixe uma toalha de papel sobre a superfície do refrigerador de absorver ainda mais condensação. Em seguida, recoloque a tampa do porta-aviões e feche o painel frontal.
2. otimização das condições
-
Manipulador de líquidos baseados em seringa: produzindo dois gradientes lineares das concentrações em reservatórios de uma placa de cristalização (o método 4-canto).
- Em primeiro lugar, garantir que o manipulador de líquido é na e inicializado com seu software aberto.
- Na 'Gradiente' tab: Abra o programa necessário, selecione o tipo de placa de cristalização e o volume final dos reservatórios (tabela 3). A configuração avançada para 'máximo tiro vol' deve ser diminuída de 6.000 para 3.000 quando usando soluções contendo [isopropanol] > 10% v/v e [MPD] > 20% v / v.
- Prepare as seringas. Colocar um pistão em cada seringa (extremidades pontiagudas para baixo) e parte de trás das seringas nas ranhuras designadas por baixo da cabeça do robô. Uma seringa gire no sentido horário para travar na posição (o programa irá iniciar somente com todas as seringas necessárias anexadas corretamente).
- Prepare os bebedouros. Retire a armação de aço inoxidável e inserir os bebedouros. As 4 posições da esquerda correspondem aos 4 cantos A, B, C, D. interruptor para 'SET UP' guia que exibe os volumes das soluções necessárias em cada seringa (na tabela 3, 0.5 volume morto mL foi adicionado aos volumes exibidos). Despeje as soluções de canto em suas respectivas calhas e coloque o quadro de volta no chão (o quadro mantém em posição com 2 pequenos ímãs, localizados na parte dianteira da plataforma). Uma maneira alternativa para prosseguir com este passo é para as soluções despeje os bebedouros quando eles já são colocados no convés.
- Coloque a placa de cristalização ao transportador motorizado de SBS.
- Clique em 'Aspirar' e esperar que esta etapa seja concluída (quando pistões pararam a caminho).
- Alterne para a guia 'RUN' e execute o programa.
- Após a conclusão do programa, volte para o guia SET UP e clique em 'Remover': o sistema limpa as seringas de soluções de sobras e então levanta os pistões todo o caminho. 'PURGE' pode ser solicitado em vez de 'Remover'; isso vai deixar os pistões na posição inferior, pronta para aspirar mais soluções com as mesmas seringas.
- Retire as seringas rodando-as no sentido anti-horário.
- Descarte de seringas e depressões na caixa apropriada (ou lave-as com água desionizada e, em seguida, a solução de etanol 20% v/v para reutilização).
- A placa do selo e coloque-a sobre o misturador de microplacas para 3 min a 1.000 rpm, ou 10 min quando estão sendo misturadas soluções altamente viscosas. A placa está pronta para criação de gotículas de cristalização sobre o dispensador de nanolitros.
-
Aditivo de triagem protocolo 1 (criação de gotículas de cristalização em uma placa de 96 poços cristalização pré-preenchido com tela aditiva)
- Primeiro, prepare a condição com concentrações iniciais de reagentes aumentados 10% (min. vol. 15 mL ao transferir a condição de um contêiner na tela aditivo com o manipulador de líquido).
- Certifique-se de que o manipulador de líquido está pronto para operar. Abra o programa 'Tela de adicionar aos aditivos' por um prato único (Insira o volume em reservatórios: 'µ l 72'). Solicita, figuras e um sistema de ponta-gestão (dicas de 12 x 1.000 µ l necessários) ajuda em certificar-se de que o robô está pronto para operar de acordo com as seleções.
- Recuperar a tela aditiva de-20 ° C a temperatura da incubadora e remover imediatamente seu selo de alumínio (uso o suporte da placa) e, em seguida, coloque a placa no convés do manipulador de líquido. o programa funciona de acordo com um layout de retrato (a placa é colocada com o A1-canto localizado no canto esquerdo da frente da transportadora). Também também coloca o recipiente com a condição. Execute o programa.
- Uma vez que os reservatórios da placa tem sido preenchidos, coloque-a sobre o agitador microplacas e executar o programa. Lave o recipiente de condição com etanol água e 20% desionisada para reutilização.
- Configurar as gotas sobre o dispensador de nanolitros. Primeiro, remover o lacre da placa de cristalização (uso o suporte da placa). Então, lugar a placa e a proteína de 8 poços tira na primeira posição do bloco tira-titular. Na guia 'Configuração' sobre o software de controle exibe as posições reais de cada componente no convés. Cada um carregar bem da tira com amostra de proteína de acordo com o tamanho da gota exigido (tabela 4). Executar o programa para preparar gotículas.
- Após a conclusão do programa, retirar a placa do baralho e selá-lo imediatamente (use o aferidor de placa, adesivo de 3 polegadas de largo). Descarte a tira na caixa apropriada.
- Avaliar o tamanho, forma e centralização de gotas sob o microscópio antes do armazenamento.
-
Aditivo de triagem protocolo 2 (criação de gotículas de cristalização em uma placa de 96 poços cristalização com uma tela de aditiva de re-utilizável)
- Primeiro, prepare a tela aditiva: deixar a placa de cultura de células congeladas de 96 poços correspondente para descongelar à temperatura ambiente por 40 min. Em seguida, centrifugar a tela aditiva a 1.000 x g por 2 min.
- Prepare a condição (min. vol. 15 mL ao transferir a condição de um contêiner na tela aditivo com o manipulador de líquido).
- Encha os reservatórios de uma placa de 96 poços de cristalização com a condição. No manipulador de líquido, proceda da mesma forma que o protocolo 1, etapa 2.2.2, mas digitar '80 µ l' para o volume nos reservatórios.
- Configure as gotas sobre o dispensador de nanolitros com 3 componentes no convés (a placa contendo a aditiva tela, juntamente com a placa de cristalização e a tira de 8 poços proteína na primeira posição do bloco tira-titular, tabela 4).
- Selar a placa de cultura de células que contém a tela com uma folha de alumínio e colocá-lo de volta na incubadora de-20 ° C.
- Avaliar o tamanho, forma e centralização de gotas sob o microscópio antes do armazenamento.
Resultados
1. sistema 1 e placas LMB
A figura 1A mostra o sistema 1 com base em um manipulador de líquido, operando com um sistema de líquido (água deionizada). O sistema de líquido é composto por um recipiente, uma bomba, tubulação, 8 seringas equipadas com válvulas e 8 pontas fixas. As configurações de classe líquido foram otimizadas para aspirado/distribuir uma ampla variedade de soluções e multi-dispense em 4 placas (multi-dispensar requer um relativamente grande excesso do volume aspirado). Um recipiente de água de 22 L e um recipiente menor (5 L) com etanol a 20% v/v são armazenados sob o sistema para alimentar o sistema de líquido. Cada recipiente é equipado com duas inserções de acoplamento. Uma inserção (cor azul) alimenta o sistema com líquido, o outro (vermelho) é um fluxo de volta para reduzir o excesso de pressão. Após o uso, lavagem com água e, em seguida, a solução de etanol 20% v/v impede o crescimento microbiano. Uma unidade de refrigeração (também localizada debaixo do sistema) está ligada a um portador de tubo de refrigeração custom-built. Sistema 1 é 2050 mm de largura, incluindo o carrossel, 760 mm de profundidade e 88 mm de altura. Um 550 mm adicional é exigido em frente para a mesa de trabalho que mantém a unidade de controle da impressora a jato de tinta e selador a placa adesiva. Espaço adicional também é necessário ao lado do sistema para o controle do PC. O programa para produzir 72 placas pré-cheia (ou seja, 18 rodadas de 4 placas) leva 3 horas e 50 minutos.
Figura 1B é um close do convés principal que é equipado com 8 fixas dicas (Figura 1) montadas sobre um braço automatizado de pipetagem, um segundo braço com uma pinça, uma estação de lavagem de ponta, portadores de 2 x 4 posições para placas SBS e o porta-tubo de refrigeração. O principal programa processa 4 placas em um momento que são automaticamente extraídos do carrossel e colocado no convés onde eles são preenchidos com condições de cristalização (80 µ l em reservatórios, Figura 1). Níveis líquidos são detectados automaticamente como as pontas são condutivas. Enquanto o líquido manipulador dispensa condições em um conjunto de placas, um outro conjunto de pratos vazios é retirado do carrossel, rotulado e colocado sobre o convés principal. Um pequena porta-Custom-Built e janela no painel traseiro do manipulador de líquido foram necessários para posicionar a cabeça da impressora e seu sensor na parte de trás do convés principal. As 8 dicas são liberadas e lavadas com água do recipiente principal após cada etapa aplicadora que consiste de 4 alíquotas nas colunas correspondentes dos reservatórios. Depois de 4 placas foram preenchidas, automaticamente são selados e colocados de volta na sua posição original no carrossel. O aferidor de placa é desencadeado por um driver específico (chamado pelo software de controlo). O aferidor usa um rolo de 3 polegadas largura fita adesiva que é aplicado a uma placa com rolos sob pressão mecânica. Após a conclusão do programa, as placas pré-cheia são retiradas manualmente as pilhas de carrossel e armazenadas em uma incubadora de 10 ° C, localizada no interior da instalação.

Figura 1 : Enchimento dos reservatórios com kits de triagem inicial. (A) visão geral do sistema totalmente automatizado de 1. O carrossel é uma unidade automatizada com pilhas de placa e ele está abrigado em um poço feito de chapas de acrílico transparente no lado direito do convés principal. (B) o convés principal do manipulador de líquidos em operação com (um) a transportadora tubo de refrigeração (ligado a uma unidade de refrigeração por baixo, não mostrado), (b) o jejum lavagem estação (conectada à drenagem, não mostrada), (c), o braço de pipetagem de enchimento 8 reservatórios de uma placa de 96 poços cristalização, (d) o braço de pegador, trazendo um prato cheio para a (e) a transportadora SBS motorizada do aferidor de placa. Na parte de trás do convés é cabeça (f) a impressão da impressora inkjet conectado a (g) a unidade de controle de jato de tinta por baixo do aferidor. (C) A rotulado placa (nome da tela) e data de produção sendo preenchida com condições de cristalização por 8 condutor fixada dicas feitas de aço inoxidável politetrafluoretileno. (D) seção transversal de uma cristalização selada bem. O reservatório contém 80 µ l de condição de cristalização (enquanto a parte superior é bem vazia). Reservatório e especificações de profundidade bem superior são em milímetros. Clique aqui para ver uma versão maior desta figura.
A tabela 1 mostra as diferentes formulações para os kits de triagem comercialmente disponível em tubos de ensaio. Os kits são usados para encher os reservatórios das placas de 96 poços cristalização (LMB01-LMB22) em uma base regular com o sistema 1.
| Nome da placa | nome do jogo | fornecedor | número de catálogo | tubos | Descrição básica | ||
| LMB01 | Tela de cristal 1 | Pesquisa de Hampton | HR2-110 | 48 | Matriz esparsa (pH 4,6-8,5) | ||
| Tela de cristal 2 | Pesquisa de Hampton | HR2-112 | 48 | Amostragem estocástica (pH 4,6-9.0) | |||
| LMB02 | Assistente 1 | Difratômetro | 1009530 | 48 | Amostragem estocástica (pH 4,5-10.5) | ||
| Assistente 2 | Difratômetro | 1009531 | 48 | Amostragem estocástica (pH 4,5-10.5) | |||
| LMB03 | Grade tela sulfato de amónio | Pesquisa de Hampton | HR2-211 | 24 | Tela da grade, [AmS] = 0,8-3.2 M e buffers de pH 4.0-9.0 | ||
| Grade tela PEG/LiCl | Pesquisa de Hampton | HR2-217 | 24 | Tela da grade, [PEG 6000] = 0-30 %p/v, conc. LiCl = 1,0 M e buffers de pH 4.0-9.0 | |||
| Tela rápida | Pesquisa de Hampton | HR2-221 | 24 | Tela da grade, [NaKPO4] = 0,8-1,8 M em pH 5,0-8.2 | |||
| Grade tela de cloreto de sódio | Pesquisa de Hampton | HR2-219 | 24 | Tela da grade, [NaCl] = 1,0-4,0 M e buffers de pH 4.0-9.0 | |||
| LMB04 | Grade tela PEG 6000 | Pesquisa de Hampton | HR2-213 | 24 | Tela da grade, [PEG 6000] = 5-30 %w/v e buffers de pH 4.0-9.0 | ||
| Grade tela MPD | Pesquisa de Hampton | HR2-215 | 24 | Tela grade [MPD] = 10-65 %w/v e buffers de pH 4.0-9.0 | |||
| MemFac | Pesquisa de Hampton | HR2-114 | 48 | Matriz esparsa para proteínas de membrana (pH 4,6-8,5) | |||
| LMB05 | PEG-Ion | Pesquisa de Hampton | HR2-126 | 48 | Tela da grade, [PEG 3350] = 20 %w/v e vários sais a 0,2 M (sem buffers) | ||
| Natrix | Pesquisa de Hampton | HR2-116 | 48 | Fatorial incompleto (pH 5,6-8,5) | |||
| LMB06 | Tela de cristal Lite | Pesquisa de Hampton | HR2-128 | 48 | 1 tela de cristal com metade das concentrações precipitantes originais | ||
| Tela personalizada de Lite | Dimensões moleculares | n/a | 48 | Condições adicionais com baixas concentrações precipitantes | |||
| LMB07 | Cryo assistente 1 | Difratômetro | 1009536 | 48 | Amostragem estocástica com condições cryoprotected usando baixa MW PEGs (pH 4,5-9.4) | ||
| Cryo assistente 2 | Difratômetro | 1009537 | 48 | Amostragem estocástica com condições cryoprotected usando baixa MW PEGs (pH 4,5-10.1) | |||
| LMB08 | JBS1 | JenaBioScience | CS - 101L | 24 | Fatorial incompleto, com base em vários PEGs (pH 4,6-9.0) | ||
| JBS2 | JenaBioScience | CS - 102L | 24 | Fatorial incompleto, baseado no PEG 4000 (pH 4,6-8,5) | |||
| JBS3 | JenaBioScience | CS - 103L | 24 | Fatorial incompleto, baseado no PEG 4000 (pH 4,6-8,5) | |||
| JBS4 | JenaBioScience | CS - 104L | 24 | Fatorial incompleto, baseado em PEGs de MW médio (pH 6,5-8,5) | |||
| LMB09 | JBS5 | JenaBioScience | CS - 105L | 24 | Fatorial incompleto, baseado em pesados MW PEGs (pH 6,5-9,5) | ||
| JBS6 | JenaBioScience | CS - 106L | 24 | Fatorial incompleto, baseado no AmS (pH 4,6-8,5) | |||
| JBS7 | JenaBioScience | CS - 107L | 24 | Fatorial incompleto, baseado no MPD (pH 4,6-8,5) | |||
| JBS8 | JenaBioScience | CS - 108L | 24 | Fatorial incompleto, baseado no MPD e etanol (pH 4,6-8,5) | |||
| LMB10 | JBS9 | JenaBioScience | CS - 109L | 24 | Fatorial incompleto com base em sais comum e 2-propanol (pH 4,6-8,5) | ||
| JBS10 | JenaBioScience | CS - 110L | 24 | Fatorial incompleto, baseado em sais comum (pH 4,6-8,5) | |||
| Clara estratégia tela 1 pH 4.5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| Clara estratégia tela 1 pH 5,5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| LMB11 | Clara estratégia tela 1 pH 6.5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | ||
| Clara estratégia tela 1 pH 7.5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| Clara estratégia tela 1 pH 8,5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| Clara estratégia Screen 2 pH 4.5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| LMB12 | Clara estratégia Screen 2 pH 5,5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | ||
| Clara estratégia Screen 2 pH 6.5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| Clara estratégia Screen 2 pH 7.5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| Clara estratégia Screen 2 pH 8,5 | Dimensões moleculares | MD1-16LMB | 24 | Tela da grade com vários pinos | |||
| LMB13 | Índice | Pesquisa de Hampton | HR2-144 | 96 | Sparse matrix e grade telas pequenas (pH 3.0-9.0) | ||
| LMB14 | SaltRX 1 | Pesquisa de Hampton | HR2-107 | 48 | Tela grade, incluindo 22 exclusivo sais versus concentração de sal e pH (4.1-9.0) | ||
| SaltRX 2 | Pesquisa de Hampton | HR2-109 | 48 | Tela grade, incluindo 22 exclusivo sais versus concentração de sal e pH (4.1-9.0) | |||
| LMB15 | MemStart | Dimensões moleculares | MD1-21 | 48 | Matriz esparsa para proteínas de membrana (pH 4,0-10,0) | ||
| MemSys | Dimensões moleculares | MD1-25 | 48 | Tela de grade para proteínas de membrana (principalmente PEGs, pH 3.5-9,5) | |||
| LMB16 | JCSG + | Qiagen | 130720 | 96 | Matriz esparsa (pH 4,0-10,0) | ||
| LMB17 | Tela de MORPHEUS | Dimensões moleculares | MD1-46 | 96 | Tela grade, incluindo misturas de aditivos e condições cryoprotected (pH 6,5-8,5) | ||
| LMB18 | Tela mínima de PI | JenaBioScience | CS-127 | 96 | Fatorial incompleto (pH 4.0-9,5) | ||
| LMB19 | Tela de PI-PEG | JenaBioScience | CS-128 | 96 | Fatorial incompleto para proteínas de membrana (pH 4,8-8,8) | ||
| LMB20 | Tela de MORPHEUS II | Dimensões moleculares | MD1-91 | 96 | Tela grade, incluindo misturas de aditivos (átomos pesados) e condições de cryoprotected (pH 6,5-8,5) | ||
| LMB21 | Tela de cristalização LMB | Dimensões moleculares | MD1-98 | 96 | Matriz esparsa, incluindo condições selecionadas a partir de publicações de LMB | ||
| LMB22 | Tela de MORPHEUS III | Dimensões moleculares | n/a | 96 | Tela grade, incluindo misturas de aditivos (compostos de drogas) e condições de cryoprotected (pH 6,5-8,5) | ||
Tabela 1: formulações de kits encontrados em placas LMB. Cada kit de triagem comercial é composto por 24/48/96 condições inicialmente em tubos de ensaio. As placas LMB são estocadas em incubadoras de 10 ° C, localizadas no interior da instalação onde eles estão disponíveis para os usuários a qualquer momento.
2. sistema 2 e requisitos de configuração de gotículas
Figura 2A mostra o sistema baseado em um manipulador de líquido19 operando com deslocamento positivo e pontas descartáveis 2. As pontas descartáveis são fornecidas em racks empilháveis adequados para manipulação automatizada. Um baralho de 3 posições nanolitros dispensador20 integrava-se no lado direito do sistema. Aspirado/dispensar sobre o dispensador de nanolitros também opera com deslocamento positivo usando microsyringes descartável (fornecido em bobinas grandes). Como um robô autônomo, um bloco de porta-tira removível é usado para carregar a amostra de proteína. Para o processo totalmente automatizado, uma placa de PCR 384 substitui o strip-tease-titular. Um semelhante aferidor de placa adesiva ao sistema 1 foi integrado no lado esquerdo. O selador e dispensador de nanolitros ficar em mesas de trabalho personalizadas, levantou em ordem para o principal garra alcançar os portadores de placa destes dois robôs integrados (uma janela tinha que ser cortado em ambos os painéis laterais do manipulador de líquido para a pinça obter acesso fora convés principal). O programa principal chama drivers específicos para programas aplicadora de nanolitros de gatilho e o selador no devido tempo. O sistema 2 é 2.850 mm de largura, 800 mm de profundidade e 800 mm de altura. Espaço adicional é necessária ao lado do robô para o display do controle PC. Duas caixas de resíduos estão localizadas sob o sistema de dicas e microsyringes são descartados durante o processo (o controlador PC também é armazenado por baixo). Uma característica importante do sistema 2 é o layout geral, que retém o acesso fácil para os três robôs para que eles podem ser usados individualmente para os protocolos de otimização descritos anteriormente, ou outros protocolos descritos em outros lugares como a cristalização das proteínas de membrana em aleatório microseed matriz e lipídico superfluido21 22de triagem.
Figura 2B é um close-up da plataforma que está equipado com um único braço robótico. O braço integra 12 sondas de pipetagem independentes e o pegador principal. As posições das sondas podem ser controladas individualmente em uma direção para acessar diferentes localizações ao longo do eixo entre as sondas ou tubos mesmo único. As sondas podem buscar ou pontas descartáveis (1-12) ou um par de prato-movendo adaptadores. Dois conjuntos de 4 pilhas contendo pontas descartáveis de 50 µ l são inicialmente carregados. Níveis líquidos são detectados automaticamente como as pontas são condutivas. Os adaptadores de placa são projetados com 2 pinos afiados no interior que formam uma alça opcional quando necessário. No convés principal está localizado um microtubo de 24-posição refrigeração transportadora para a amostra, embora apenas 1-2 posições são usadas aqui. Além disso, há um portador para a placa PCR e também 2 suportes de armazenamento para tampas SBS empilháveis, custom-built (Figura 2). Finalmente, existem 4 operadoras deslizantes, cada um com 5 locais para placas de cristalização (4 x 5 = 20 placas).

Figura 2 : Criação de gotículas para experimentos de difusão de vapor. (A) visão geral do sistema totalmente automatizado 2. (B) o convés principal do manipulador de líquidos em operação com (um) o armazenamento transportadoras para pilhas de tampas SBS, (b) o empilhável dicas, transportadora (c) a transportadora-refrigeração com uma amostra em microtubo, (d) para o 2 placa em movimento adaptadores, (e), a placa PCR para a transferência de placas de proteínas para o robô de manipulação de nanolitros, (f) 9 seladas que tenham sido colocadas em suas posições iniciais, (g) da alça opcional, retirar a tampa do SBS de 10th placa sobre ser transportado para o convés do manipulador de líquido, (h), os próximos 10 placas para ser preparado com tampas SBS no topo, (eu) da alça principal que é usada para transportar as placas PCR e cristalização, (j) o principal automatizada braço de integração 12 sondas de pipetagem (2 sendo usado para operar como alça opcional) e o principal com Pegador e (k) o convés do distribuidor nanolitros. (C) In-house tampas SBS personalizadas feito de alumínio. As tampas integram uma folha de borracha para evitar a evaporação das condições e dois pequenos furos para ser com precisão captado da alça opcional. (D) seção transversal de uma cristalização selada bem onde o reservatório é enchido com uma condição e superior-poço contém uma gotícula composta tanto a amostra de proteína e a condição. Porque o dessensibilizador da gota é menos concentrado do que na condição, as concentrações de todos os componentes no drop sobem água perda durante o processo de equilibração por difusão de vapor (muito esquematicamente representado por uma seta). (E) luz micrografias de 100 nL e (F) 200 gotas nL produziram pelo dispensador de nanolitros com uma solução de teste (20% v/v polietilenoglicol 400, 0,001% w/v safranina como corante vermelho). O tamanho e forma das gotas podem variar de acordo com propriedades de Propriedade do estado. Clique aqui para ver uma versão maior desta figura.
O programa principal começa com o opcional garra retirando a tampa SBS a primeira chapa de cristalização. Depois que a tampa foi transferida para o portador de armazenamento correspondente, a placa de cristalização é transportada para o convés do distribuidor nanolitros. Em seguida, o braço de pipetagem transfere a quantidade de amostra necessária para a criação de gotas de microtubo normalmente refrigerado para a primeira coluna da placa do PCR. Posteriormente, o segurador principal move a placa PCR para o convés do distribuidor nanolitros que preparará as gotas seguindo as opções selecionadas pelo usuário no início (ex. tamanho da gota). Por isso, a amostra de proteína primeiro é dispensada para os superior-poços (usando um único conjunto de 8 microsyringes e multi-distribuição) e, em seguida, as condições de cristalização são dispensadas sobre as gotículas de proteína (cada linha agora requer 8 novos microsyringes para evitar contaminação cruzada). Após a conclusão do programa para configurar as gotas, o segurador principal transporta a placa correspondente para o aferidor de placa, em seguida, coloca a placa PCR em sua posição original (mais proteína será feita na próxima coluna da placa do PCR para a seguinte placa ). Finalmente, a placa de cristalização selado é movida novamente para sua posição original no convés: experiências de difusão de Vapor já começaram nesta placa (Figura 2D). Este ciclo é repetido de acordo com o número de placas. Quando necessário, a pinça opcional remove um rack de ponta vazia, permitindo que o braço de pipetagem acessar mais dicas. O programa leva 2 hr e 20 min e 440 µ l de amostra para preparar única gotículas em 20 placas usando 100 amostra nL + 100 condição nL (Figura 2E e 2F).
Ao usar o dispensador de nanolitros como stand-alone robô para duas placas adicionais (Veja o protocolo, passo 1.2.3), todo o conjunto de placas de triagem inicial disponíveis na incubadora de 10 ° C pode ser configurado (22 condições de placas x 96 LMB = 2.112 condições).
A tabela 2 mostra os requisitos para o programa principal de acordo com as seleções do usuário no sistema 2.
| Placas | Tamanho da gota (nL) | Amostra | Requisitos de ponta | Duração | |||
| Número | Tipo | Vol. 1 (µ l) | Vol. 2 (µ l) | 50 Dicas µ l | Microsyringes | ||
| 10 | 96 poços | 100 | 240 | 0 | 80 | 1040 | 1 h 12 min |
| 20 | 96 poços | 100 | 440 | 0 | 160 | 2080 | 2 h 20 min |
| 10 | 96 poços | 100 | 240 | 240 | 160 | 2080 | 1 h 45 min |
| 20 | 96 poços | 100 | 440 | 440 | 320 | 4160 | 3 h 05 min |
| 10 | 48-bem | 1000 | 624 | 0 | 80 | 560 | 1 h 10 min |
| 20 | 48-bem | 1000 | 1208 | 0 | 160 | 1120 | 2 h 16 min |
Tabela 2: exemplos das opções principais do programa disponíveis no sistema de 2 para criação de gotículas de cristalização. A quantidade necessária de proteína amostra, dicas e microsyringes variam de acordo com o programa. Os volumes de amostra ' Vol. 1 (gota 1)' e ' Vol. 2' (gota 2) são calculados como segue: (8 pontas x necessário volume por poço de PCR plate + 4 µ l perdeu volume) x número de placas de cristalização + 40 µ l volume morto em microtubo. O volume necessário por poço da placa PCR para 100 gotas de nL em placa de 96 poços cristalização é 2 µ l enquanto 6,8 µ l é necessário para 1.000 gotículas nL em uma placa de 48 (volume morto em cavidades da placa do PCR: 0,8 µ l). Um volume adicional de amostra é retirado em consideração ('volume perdido') devido a evaporação o microtubo e outras perdas (por exemplo, amostra furando em dicas). Por exemplo, para 20 placas MRC, 100 nL, 1 gota protocolo, o volume da amostra necessária é: (8 x 2 + 4) x 20 + 40 = 440 µ l (ou seja, o equivalente a 22 µ l por placa). Oito pontas descartáveis de µ l 50 são necessárias para cada placa e cada amostra. Por exemplo, para 10 placas, 2-gota de protocolo, o número de pontas exigido é de 8 x 10 x 2 = 160 dicas. O número de microsyringes é calculado como segue: (8 + número de condições por placa) número de amostras x x número de placas. Por exemplo, para placas de 10 x 48-bem, o número de dicas de manipulador líquido exigido é: (8 + 48) x 1 x 10 = 560 dicas.
3. a formulação, preparação e manipulação das soluções 4-canto
Ambas as formulações das soluções de 4 canto ('A, B, C e D') e a tela de otimização correspondente (Figura 3A) são geradas automaticamente por uma planilha do Excel. Há planilhas diferentes para diferentes números de condições — essencialmente, 24, 48 e 96 condições — e também planilhas para preparar duas telas de otimização diferentes em um único prato. Um tipicamente prepara um conjunto de 4 x 10 mL soluções de canto em tubos de ensaio de que 2-3 telas de otimização podem ser preparadas, dependendo do número e volume das condições exigidas. As soluções são derramadas em calhas do qual eles são aspirados por um manipulador de líquidos baseados em seringa e depois dispensados diretamente em placas (Figura 3B). Os dois gradientes lineares das concentrações resultam de mistura A, B, C e D em razões sistematicamente diferentes (Figura 3).

Figura 3: O método 4-canto para a preparação de telas de otimização. (A) representação dos dois gradientes de concentrações em um layout de placa de 96 poços. (B) o seringa baseado no líquido manipulador pronto para preparar uma tela com 4 seringas inseridas na cabeça do robô. Um prato de cristalização senta-se no porta-bebés SBS motorizado e já fornecimento a 4 começando soluções (A, B, C e D) em suas respectivas calhas (as soluções foram cor vermelha apenas a fins de demonstração). (C) os rácios das soluções A, B, C e D através de 96 reservatórios. Clique aqui para ver uma versão maior desta figura.
Tabela 3 mostra os requisitos para os programas disponíveis para os usuários sobre o manipulador-líquido baseado na seringa.
| Tipo de prato | Não. das condições | Vol. em placa (reservatórios, µ l) | Vol. em calha (mL) | Duração |
| 96 poços | 48 | 80 | 1.6 | 2 min 5 seg |
| 96 poços | 96 | 80 | 2.5 | 3 min 50 seg |
| 96 poços | 2 x 48 | 80 | 1.6 | 2 min 50 seg |
| 48-bem | 24 | 200 | 1.8 | 2 min 25 seg |
| 48-bem | 48 | 200 | 3 | 4 min 20 seg |
Tabela 3: programas disponíveis sobre o manipulador de líquidos baseados em seringa para a preparação de telas de otimização de acordo com o método 4-canto. A placa de 96 poços pode ser usada para preparar a tela de otimização de 48 ou 96 --condição (quando duas telas de 48-condição preparam-se simultaneamente, o robô deve ser equipado com 8 seringas e 8 Baixos). Outros programas permitem o uso de placas boas 48. Os volumes listados em cochos incluem o necessário volume morto (0,5 mL).
4. o aditivo triagem
A Figura 4 mostra as etapas para realizar uma triagem aditiva começando com 96 soluções aditivas já nos reservatórios da placa de cristalização (protocolo 1) ou em poços de um baixo perfil celular placa de cultura, usada como uma tela de aditivo re-utilizáveis ( protocolo 2). A tabela 4 lista os programas disponíveis no distribuidor nanolitros de acordo com os dois tipos de protocolos.
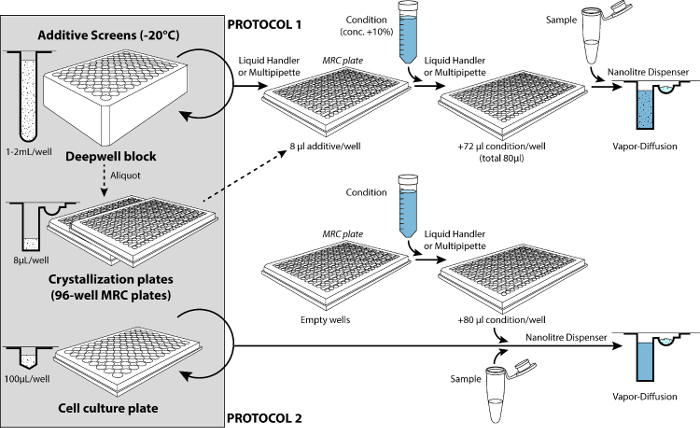
Figura 4: os dois tipos de protocolos para rastreio aditivo. As telas de 96-aditivo são armazenadas a-20 ° C. Seguindo o protocolo 1, tela do aditiva é adicionada, inicialmente, para os reservatórios das placas de cristalização (e idealmente estocada dessa forma). Um manipulador de líquido ou multipipette é usado para dispensar a condição em reservatórios contendo soluções aditivas (o volume de tela aditivo representa 10% do volume final em reservatórios: 8 µ l para o volume final de 80 µ l). Depois de misturar as condições em um misturador de microplaca (não mostrado), o dispensador de nanolitros micro-seringa-baseado é usado para configurar as gotas (tabela 4). Seguindo o protocolo 2, a tela de aditiva é adicionada somente mais tarde enquanto configurando as gotas de cristalização. Desta vez o dispensador de nanolitros é empregado para preparar as gotas com um componente adicional em seu deck (a placa de cultura re-utilizáveis células contendo a aditiva tela). Clique aqui para ver uma versão maior desta figura.
| Protocolo | Tamanho da gota (nL) | Tipo de faixa | Volume de amostra (µ l) | Não. de microsyringes | Duração | ||||
| Tipo | Fonte de aditivos | Proteína | Condição | Aditivo | Em cada poço (tira) | Total | |||
| 1 | placa de 96 poços cristalização | 100 | 100 | 0 | 2 Μ l | 2 | 16 | 104 | 2 min |
| 1 | placa de 96 poços cristalização | 200 | 200 | 0 | 5 Μ l | 3.8 | 31 | 104 | 2min 10 seg |
| 2 | placa de cultura de células 96 poços | 200 | 200 | 100 | 5 Μ l | 3.8 | 31 | 200 | 3min e 45 seg |
| 2 | placa de cultura de células 96 poços | 500 | 500 | 100 | 5 Μ l | 7.4 | 60 | 200 | 4min e 15 seg |
Tabela 4: programas disponíveis sobre o dispensador de nanolitros micro-seringa-baseado para rastreio aditivo. O volume necessário de amostra em cada poço da faixa de 8 poços é calculado como segue: volume morto + 12 x tamanho de gota. Existem 2 tipos de tiras (2 µ l e 5 µ l). Os volumes de mortos são 0,8 µ l para poços de 2 µ l (que na verdade pode conter 3,2 µ l máx) e 1,4 µ l para poços de 5 µ l (7,5 µ l máx.). O volume total de proteína necessária é: 8 x volume no poço da tira (valor redondo-up). O volume morto dos poços da placa de cultura de células 96 poços em forma de V é 2,5 µ l. O número necessário de microsyringes varia de acordo com o programa selecionado (8 + 96 = 104; ou 8 + 2 x 96 = 200).
Por causa da diluição da condição com o aditivo durante protocolo n º 1, a condição precisa estar preparado para uma concentração proporcionalmente maior do que inicialmente. O aumento nas concentrações de finais é mais facilmente conseguido reduzindo a adição final de água para o volume final calculado. Depois disto, um simplesmente prossegue com o conjunto normal acima de gotículas que se misturam a condição e a amostra (por exemplo, proteína de nL 100 + 100 condição nL, já misturado com aditivos). Protocolo 2 (por exemplo, proteína de nL 200 + 200 condição nL + 100 aditivo nL) facilita a triagem em diferentes concentrações de aditivos, simplesmente variando o volume de tela aditivo adicionado. Protocolo 2 implica mais ou menos diluição de gotas (que podem alterar a cristalização).
O manipulador de líquido do sistema 2 pode ser usado para aspirar suficiente condição em 12 dicas e dispense 8 alíquotas em reservatórios de uma placa de 96 poços (Veja o protocolo, passo 2.2.2), embora este passo claro pode ser feito manualmente, com uma pipeta multicanal ( Figura 4). Várias placas podem ser preenchidas em um momento com a mesma condição quando usando o manipulador de líquidos (para testar diferentes telas de aditivas mais tarde). Ao preparar 2 placas, encha o recipiente de reagente pelo menos 23 mL. Ao preparar 3 pratos, encha o recipiente de reagente pelo menos 31 mL.
5. cristalização placas e dispositivos associados
O design de ambas as placas de cristalização de difusão (96 poços 2-soltar e 48-poço 1-drop, Figura 5A e Figura 5B) MRC sessão soltar vapor fornece características que permitem experimentos de cristalização automatizado confiável e eficiente, com notavelmente a forma esférica dos poços-superior e uma ligeira forma de V dos reservatórios que facilitem a dosear com precisão e também centrifugação quando a centralização das gotas é necessária. Além disso, os superior-poços têm um efeito de lente para a iluminação ideal sob um estereomicroscópio (o polímero é transmissível para a detecção de cristais de absorção de UV ou fluorescente23UV).
Um selo personalizado (Figura 5) permite a criação de experimentos de cristalização gota dentro de ambos os tipos de placas usando um dispensador de nanolitros (protocolos não mostrados) de suspensão. Finalmente, ambas as placas MRC têm as mesmas dimensões externas e rim. O aro se encaixa nas ranhuras de nosso suporte de placa Custom-Built (Figura 5), que é usado para remoção manual de colocação/fita da selagem sem salpicos de líquidos.

Figura 5: The MRC cristalização placas e dispositivos associados desenvolveram no LMB. (A) A1-canto da placa de 96 poços. O reservatório (oblongo) está no lado esquerdo do poço cristalização, os dois poços superior esféricos à direita. As dimensões estão em milímetros. (B) A1-canto da placa de 48-bem. O reservatório está no lado direito do poço (1 grande superior-bem somente). (C) MRC pendurado selo de gota. (D) placa personalizada In-house titular. Clique aqui para ver uma versão maior desta figura.
6. cristais de proteína
A Figura 6 mostra exemplos de cristais úteis obtidos com nossos protocolos automatizados.

Figura 6: luz micrografias de gotículas contendo cristais obtidos seguindo os protocolos automatizados. (, B) Sistemas automatizados de cristais no ecrã inicial do OmpF e MreB em pratos preparados com os 2 totalmente (consulte as seções de protocolo 1.1 e 1.2, condições: A4 bem LMB07 e LMB20 bem D12, respectivamente, tamanho de gotas é proteína de nL 100 + 100 condição nL, trabalho de Andrzej Szewczak, LMB)24. (C, D) Bar cristais de domínio antes e depois da otimização das condições iniciais com o método 4-canto (passo 2.1, LMB02 B6, 1.000 nL + 1.000 nL, inéditos de trabalho de Leonardo Almeida-Souza, LMB). (E, F) Cadeia pesada de Dineína humana 1 cristais de domínio N-terminal antes e depois da otimização das condições iniciais com o método 4-canto (LMB20 E6, 200 nL + 200 nL, então 500 nL + 500 nL, inédito trabalho de Edgar Morales-Ríos, LMB). (G, H) Complementar cristais fator D antes e depois da otimização da condição com aditiva triagem (passo 2.2, condição inicial de tela personalizada in-house, 200 nL + 200 nL, aditivo D6 tela aditivo do 96-condição, inédito trabalho de Matthias Bauer, LMB). (Eu, J) Cristais de25 de glicoproteína envelope viral antes e depois da otimização da condição com aditiva triagem (passo 2.3, LMB20 A2, 150 nL + 150 nL, então 200 nL + 200nL + 100 aditivo nL E5 tela aditivo do 96-condição, inédito trabalho de Yorgo MODIS, Universidade de Cambridge, UK). Clique aqui para ver uma versão maior desta figura.
Discussão
1 - preparação e uso de telas iniciais armazenados em placas
Kits de triagem deve ser misturado antes de ser dispensado em placas porque separação de precipitação ou fase luminosa ocorre em alguns tubos durante o armazenamento. Quando uma tela é composta de dois kits (2 x 48 tubos), o primeiro tubo do segundo kit é colocado no local E1 da transportadora refrigeração. Quando uma tela é composta de 4 kits (4 x 24 tubos), o primeiro tubo do segundo kit é colocado no local C1, o primeiro tubo do terceiro kit é colocado em local E1 e o primeiro tubo do kit quarto é colocado em local G1. Ao introduzir os tubos em seu portador de resfriamento, as tampas são colocadas em uma bandeja, seguindo o layout padrão paisagem de 96 poços. Desde que bem números são indicados em cima as tampas pelos fabricantes, isto permite verificar se todos os tubos foram colocados na ordem certa. Isso também ajuda a substituir as tampas corretas nos tubos quando um número reduzido de chapas de enchimento.
Nós armazenamos as placas previamente enchidas entre 10 ° C, um compromisso para evitar o congelamento e armazenamento a 4 ° C que pode causar a deterioração das condições e problemas com selagem. As placas são armazenadas por até diversos meses com normalmente sem condensação perceptível na face interna do selo. Isto é menos verdadeiro para placas LMB05, LMB06, LMB09 e LMB10 como estes contêm condições com relativamente altas concentrações de reagentes voláteis (tabela 1). Pequena quantidade de condensação no interior do selo reduz a eficiência de vedação e pode causar contaminação cruzada entre poços durante a retirada do selo as placas. Para ajudar a impedir a condensação durante o resfriamento inicial, as placas podem ser transferidas primeiro no carrossel em um piquenique isolado mais fresco que é armazenado em um quarto frio de 4 ° C durante a noite. O resfriamento muito lento minimiza o desenvolvimento de gradientes de temperatura dentro dos poços selados e, consequentemente, reduz a condensação total15. Além disso, uma vez que as placas são armazenadas na incubadora de 10 ° C, uma in-house personalizada tampa poliestireno SBS é colocada na placa no topo de cada pilha (não mostrado).
Todo o conjunto de nossos pratos previamente enchidos pode ser usado como uma grande tela inicial contra uma amostra de novela, solúvel em água, proteína. Alternativamente, placas menos podem ser selecionadas para atender às necessidades específicas. Por exemplo, LMB15 e LMB19 são telas formuladas especificamente para a proteína de membrana amostras26,27, ou LMB20 é uma tela formulada com átomos pesados para facilitar a supressão experimentais de difração dados28 (ver também : Formulação das telas de cristalização de proteínas do MORPHEUS).
2. criação de gotículas de cristalização
Quando se utiliza o sistema 2 kits com quantidades significativas de reagentes voláteis de triagem deve ser processada primeiro. Isso evita a condensação, formando-se na borracha das tampas SBS, que podem afetar sua manipulação de tampa e vedação da placa. Uma tampa SBS tem um pouco de folga quando no topo de uma placa, que é por isso que eles precisam ser alinhados inicialmente (Veja o protocolo, passo 1.2.6). Os volumes de proteína morto nos poços da placa da PCR são relativamente generoso (0,8 µ l, ver legenda de tabela 2). Note-se que igualmente generosos volumes mortos são empregadas quando usando o dispensador de nanolitros individualmente com proteína em tiras de 8 poços (tabela 4). Volumes menores mortos podem funcionar, no entanto algumas amostras aderem às pontas, calibração de um robô pode tornar-se um pouco imprecisa, o quarto pode ser mais quente que o habitual, etc. Tudo levar a perdas de amostra abrangidas pelos volumes mortos generosos para consolidar a abordagem.
Desenvolvimentos recentes mais habilitado a miniaturização dos experimentos e, portanto, o volume de amostra necessário para condições de cristalização de triagem pode ser significativamente reduzido através da integração da correspondente tecnologia29,30 . No entanto, alguns aspectos da miniaturização ainda mais precisam de cuidadosa consideração, tais como a evaporação de gotículas31 e a manipulação de microcristais32.
Finalmente, centrifugação da placa (2.000 rpm, 1min) poderia ser integrada como um passo final rotineiro ao configurar gotículas de cristalização (no esféricos superior-poços). Um tamanho e a forma de gotículas resultantes de centrifugação mais consistente podem reduzir problemas de reprodutibilidade33,34. Certamente, centradas gotas facilitará a posterior avaliação de experimentos utilizando um microscópio, como a necessária distância focal será semelhante uma placa inteira.
3. vantagens do método 4-canto
A vantagem mais significativa do método 4-canto é sua simplicidade, o que minimiza os erros e facilita simples protocolos automatizados. Por exemplo, as soluções de 4 canto serão sempre colocadas no convés de um manipulador líquido seguindo o mesmo layout. Também, todos os programas são baseados em proporções fixas entre as soluções (Figura 3).
Preparação manual das soluções de 4 canto é preferível à manipulação automatizada de soluções em concentrações elevadas, que podem ser altamente viscosas. Aspiração/distribuição relativamente rápido e preciso, é possível na maioria dos tipos de manipuladores de líquidos com requisitos mínimos para a otimização das classes líquidas. Todavia, algumas soluções de canto ainda podem ser muito viscosas para um robô operando com um sistema de líquido para operar eficientemente. É por isso que optamos por um manipulador líquido, operando com deslocamento positivo (Figura 3B).
Além dos 2 gradientes lineares das concentrações, um terceiro componente (ou seja, um conjunto de amortecedores/aditivos) pode ser testado em uma concentração constante de forma conveniente. Por isso, um volume relativamente grande de um conjunto de soluções de canto em uma concentração maior devidamente, excluindo o componente a ser variada, é preparado primeiro. Em seguida, Soluções conservadas em estoque, incluindo este componente é adicionado para ajustar as concentrações finais. Por exemplo, 50 mL de um conjunto de 4 soluções de canto são preparados em altas concentrações de 10% do que inicialmente. Este conjunto de núcleo é então dividido em 5 subconjuntos menores de 4. Finalmente, 10% em volume de soluções tampão-pH diferente é adicionado a cada subconjunto.
4. formatos e tipos de telas de aditivos
As telas são normalmente armazenadas a-20 º C (Figura 4), desde que eles não são usados regularmente e contêm compostos voláteis/instável. O uso de uma tela de aditivo congelada armazenado em um bloco de poço profundo (1 mL em poços) deve ser planejado mais cedo porque vai demorar 12-24 horas para todas as soluções de aditivas descongelar completamente em temperatura ambiente. Também, uma infinidade de usuários compartilham a mesma tela de aditiva, potencialmente causando problemas com contaminação cruzada. Finalmente, a altura do poço profundo blocos torna inadequados para a maioria dos distribuidores de nanolitros. Como uma solução conveniente para contornar esses problemas, a tela deve ser transferida do bloco poço profundo para placas de perfil baixo (Figura 4).
Historicamente, aditivas telas que incluem uma ampla variedade de reagentes único (com concentrações único) têm sido muito populares35,36. No entanto, outros tipos de aditivos telas foram desenvolvidos que integram a mistura de aditivos37 ou um número reduzido de aditivos único encontrado em diferentes concentrações de38. Finalmente, uma abordagem complementar é investigar o efeito de aditivos em amostras antes da cristalização39,40.
5. mais considerações
Boas práticas: A maioria das telas contêm substâncias nocivas ou mesmo tóxicas e, portanto, a proteção pessoal adequada deve ser empregada durante os protocolos. Igualmente, as partes dos robôs móveis podem levar a lesões, especialmente quando tentando interferir manualmente enquanto um programa está sendo executado (embora a maioria dos robôs tem sistema/botão de parada de emergência). Devido as complexidades técnicas envolvidas, regulares verificação de robôs, telas e programas com anteriormente caracterizadas amostras de teste são importantes sustentados níveis elevados de reprodutibilidade.
Taxa de transferência: Como uma indicação, entre 4.000 a 8.000 LMB placas são produzidas anualmente com o sistema 1 (e posteriormente empregados pelos usuários para triagem inicial). Isso não é adaptado para estocar uma grande quantidade de chapas previamente enchidas entre 10 ° C, quando o volume de negócios esperado é muito menor, como após 4-5 meses, algumas condições vai começar a deteriorar-se e evaporar. Diferentes abordagens para protocolos de automação foram implementadas para laboratórios de pequeno para médio-tamanho41.
Armazenar e avaliar experiências: Depois de preparar as gotas, as placas são armazenadas em prateleiras de baixa-vibração em um quarto no 4 ou 18 ° C com temperatura rigidamente controlada (+ /-0,5 ° C máximo desvio). Experimentos são avaliados usando microscópios de fonte de luz fria. Vários sistemas automatizados de imagem estão disponíveis comercialmente, no entanto, deve-se considerar cuidadosamente todos os aspectos: a velocidade necessária para digitalizar uma placa será suficiente para a alta taxa de transferência? Objetos diferentes cristais interferirá com autofocus? A qualidade resultante das imagens serão suficiente para ponto cristais muito pequenos (especialmente em torno da borda das gotículas)? 42 , 43 , 44
Comparação das condições de cristalização: Após cuidadosos investigações sobre a natureza dos cristais obtidos inicialmente, um pode analisar as tendências e as semelhanças entre condições usando o banco de dados de tela LMB ou o C6 Ferramenta Web45.
Divulgações
Pelo presente afirmamos que um conflito de interesse comercial desde LifeArc comercializa os seguintes produtos: placas de 96 - e 48-poço MRC, o selo de gota suspensão MRC, os MORPHEUS, Pi, ANGSTROM e LMB telas de cristalização.
Agradecimentos
A facilidade de cristalização de MRC-LMB é gentilmente apoiado pelo Conselho de pesquisa médica (UK). Agradecemos a membros do LMB para seu apoio: Olga Perisic (PNAC), Tony Warne, Fusinita Van den Ent e Pat Edwards (estudos estruturais), Steve Scotcher e os outros membros da oficina mecânica, Neil Grant e Jo Westmoreland (ajudas visuais), Paul Hart e Tom Pratt (TI). Também gostaríamos de agradecer a Steve Elliot (Tecan, UK), Mitchell Stuart e Heather Ringrose (Hamilton robótica, UK), Paul Thaw, Robert Lewis e Joby Jenkins (TTP Labtech, UK), Paul Reardon (Swissci AG, Suíça), George Stephens e Donald Ogg (Alphabiotech, UK), Neil Williams (Markem Imaje, UK) e Graham Harris (The Cleveland Agency) para ajuda técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Robots | |||
| Freedom EVO® | Tecan | n/a | Liquid handler (System 1). Aspiration/Dispense based on system liquid. Integrates an automated carousel. EVOware plus controlling software v.2.4.12.0. |
| Microlab® STAR™ | Hamilton | n/a | Liquid handler (System 2). Aspiration/Dispense based on positive displacement (CO-RE™ technology). Hamilton STAR controlling software v.4.3.5.4785 with method management interface. |
| Mosquito® | TTP Labtech | n/a | Microsyringe-based nanoliter dispenser used to set up droplets (System 2 and stand-alone), 3-position deck. Controlling software v.3.11.0.1422. |
| Dragonfly® | TTP Labtech | n/a | Syringe-based liquid handler used to produce optimization screens (4-corner method). Controlling software v.1.2.1.10196. |
| Adhesive plate sealer | Brandel | n/a | Integrated to Systems 1 and 2 (also used as stand-alone robot). |
| Inkjet printer 9232 | Markem-Imaje | n/a | Integrated to System 1. Touchscreen interface. |
| Crystallization screens | |||
| Crystal Screen™ 1 | Hampton Research | HR2-110 | Crystallization kit (test tubes, 10mL per condition) used in LMB01 |
| Crystal Screen 2™ | Hampton Research | HR2-112 | Crystallization kit (test tubes, 10mL per condition) used in LMB01 |
| Wizard™ Classic 1 | Rigaku | 1009530 | Crystallization kit (test tubes, 10mL per condition) used in LMB02 |
| Wizard™ Classic 2 | Rigaku | 1009531 | Crystallization kit (test tubes, 10mL per condition) used in LMB02 |
| Grid Screen™ Ammonium Sulfate | Hampton Research | HR2-211 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Grid Screen™ PEG/LiCl | Hampton Research | HR2-217 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Quick Screen™ | Hampton Research | HR2-221 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Grid Screen™ Sodium Chloride | Hampton Research | HR2-219 | Crystallization kit (test tubes, 10mL per condition) used in LMB03 |
| Grid Screen™ PEG 6000 | Hampton Research | HR2-213 | Crystallization kit (test tubes, 10mL per condition) used in LMB04 |
| Grid Screen™ MPD | Hampton Research | HR2-215 | Crystallization kit (test tubes, 10mL per condition) used in LMB04 |
| MemFac™ | Hampton Research | HR2-114 | Crystallization kit (test tubes, 10mL per condition) used in LMB04 |
| PEG/Ion™ | Hampton Research | HR2-126 | Crystallization kit (test tubes, 10mL per condition) used in LMB05 |
| Natrix™ | Hampton Research | HR2-116 | Crystallization kit (test tubes, 10mL per condition) used in LMB05 |
| Crystal Screen Lite™ | Hampton Research | HR2-128 | Crystallization kit (test tubes, 10mL per condition) used in LMB06 |
| Custom Lite screen | Molecular Dimensions Ltd | n/a | Crystallization kit (test tubes, 10mL per condition) used in LMB06 |
| Wizard™ Cryo 1 | Rigaku | 1009536 | Crystallization kit (test tubes, 10mL per condition) used in LMB07 |
| Wizard™ Cryo 2 | Rigaku | 1009537 | Crystallization kit (test tubes, 10mL per condition) used in LMB07 |
| JBS1 | JenaBioScience | CS-101L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS2 | JenaBioScience | CS-102L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS3 | JenaBioScience | CS-103L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS4 | JenaBioScience | CS-104L | Crystallization kit (test tubes, 10mL per condition) used in LMB08 |
| JBS5 | JenaBioScience | CS-105L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS6 | JenaBioScience | CS-106L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS7 | JenaBioScience | CS-107L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS8 | JenaBioScience | CS-108L | Crystallization kit (test tubes, 10mL per condition) used in LMB09 |
| JBS9 | JenaBioScience | CS-109L | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| JBS10 | JenaBioScience | CS-110L | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| Clear Strategy™ Screen 1 pH 4.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| Clear Strategy™ Screen 1 pH 5.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB10 |
| Clear Strategy™ Screen 1 pH 6.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 1 pH 7.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 1 pH 8.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 2 pH 4.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB11 |
| Clear Strategy™ Screen 2 pH 5.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Clear Strategy™ Screen 2 pH 6.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Clear Strategy™ Screen 2 pH 7.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Clear Strategy™ Screen 2 pH 8.5 | Molecular Dimensions Ltd | MD1-16LMB | Crystallization kit (test tubes, 10mL per condition) used in LMB12 |
| Index™ | Hampton Research | HR2-144 | Crystallization kit (test tubes, 10mL per condition) used in LMB13 |
| SaltRX™ 1 | Hampton Research | HR2-107 | Crystallization kit (test tubes, 10mL per condition) used in LMB14 |
| SaltRX™ 2 | Hampton Research | HR2-109 | Crystallization kit (test tubes, 10mL per condition) used in LMB14 |
| MemStar™ | Molecular Dimensions Ltd | MD1-21 | Crystallization kit (test tubes, 10mL per condition) used in LMB15 |
| MemSys™ | Molecular Dimensions Ltd | MD1-25 | Crystallization kit (test tubes, 10mL per condition) used in LMB15 |
| JCSG-plus™ Suite | Qiagen | 130720 | Crystallization kit (test tubes, 10mL per condition) used in LMB16 |
| MORPHEUS® screen | Molecular Dimensions Ltd | MD1-46 | Crystallization kit (test tubes, 10mL per condition) used in LMB17 |
| Pi minimal screen | JenaBioScience | CS-127 | Crystallization kit (test tubes, 10mL per condition) used in LMB18 |
| Pi-PEG screen | JenaBioScience | CS-128 | Crystallization kit (test tubes, 10mL per condition) used in LMB19 |
| MORPHEUS® II screen | Molecular Dimensions Ltd | MD1-91 | Crystallization kit (test tubes, 10mL per condition) used in LMB20 |
| LMB crystallization screen™ | Molecular Dimensions Ltd | MD1-98 | Crystallization kit (test tubes, 10mL per condition) used in LMB21 |
| Additive screens | |||
| HT additive screen | Hampton Research | HR2-138 | Frozen in 96-well deepwell block (1 mL per well). |
| MORPHEUS® additive screen | Molecular Dimensions Ltd | MD1-93-500 | Frozen in 96-well deepwell block (500 µL per well). |
| ANGSTROM additive screen™ | Molecular Dimensions Ltd | MD1-100 | Frozen in 96-well deepwell block (1 mL per well). |
| MORPHEUS® additive screen | Molecular Dimensions Ltd | MD1-93 | Frozen in 96-well cell culture Costar® plate with V-shaped wells (100 µL per well). |
| ANGSTROM additive screen™ | Molecular Dimensions Ltd | MD1-100-FX | Frozen in 96-well cell culture Costar® plate with V-shaped well (100 µL per well). |
| HIPPOCRATES additive screen | Molecular Dimensions Ltd | n/a | 48 single additives (drug compounds found in MORPHEUS® III). |
| Other consumables | |||
| 96-well MRC 2-drop plate | Swissci | MRC 96T-UVP | Sitting-drop, vapor diffusion plate. Reservoir recommended volume: 80 µL. Range of useful droplet volumes: 10-1000 nL. UV transmissible. |
| 48-well MRC 1-drop plate ('MAXI plate') | Swissci | MMX01-UVP | Sitting-drop, vapor diffusion plate for scale-up/optimization. Reservoir recommended volume: 200 µL. Range of useful droplet volumes: 0.1-10 µL. UV transmissible. |
| MRC hanging drop seal | Swissci | n/a | Hanging-drop, compatible with both MRC vapor diffusion plates (MRC 96T-UVP and MMX01-UVP ). UV and X-ray transmissible. |
| Adhesive sealing tape | Hampton Research | HR4-50 | 3-inch wide Duck® HD Clear™ for sealer and manual sealing. |
| Adhesive aluminium sheet | Beckman Coulter | 538619 | Used to reseal additive screens. |
| Ink cartridge | Markem-Imaje | 9651 | System 1 (inkjet printer). |
| Solvent cartridge | Markem-Imaje | 8652 | System 1 (inkjet printer). |
| 50 µL tips | Hamilton | 235947 | System 2 (STAR™ liquid handler). Box of 6 sets with 1920 x CO-RE™ tips in disposable stacks. |
| Reagent container | Hamilton | 194052 | Used to dispense a condition into plate(s) during additive screening protocols. |
| PCR plate | Thermo Scientific™ | AB-2150 | System 2 (contains protein to be transfer to the Mosquito®). Abgene Diamond ultra, 384 V-shaped wells. |
| microsyringes | TTP Labtech | 4150-03020 | Spool of 26,000 microsyringes for the Mosquito® nanoliter dispenser (9mm spacing). |
| strip-holder block | TTP Labtech | 3019-05013 | SSB device for the Mosquito® strips, aka '4-way Reagent Holder'. |
| 2 µL 8-well strip | TTP Labtech | 4150-03110 | Contains protein on the deck of the Mosquito®. Box of 40 strips, max. vol. in well is 3.2 µL. |
| 5 µL 8-well strip | TTP Labtech | 4150-03100 | Contains protein on the deck of the Mosquito®. Box of 40 strips, max. vol. in well is 7.5 µL. |
| 5 mL syringes | TTP Labtech | 4150-07100 | Syringe body and piston for the Dragonfly® liquid handler. Pack of 100. |
| Troughs/Reservoirs | TTP Labtech | 4150-07103 | Contains stock solutions on the deck of the Dragonfly®. Pack of 50. |
| Orbital microplate shaker | CamLab Limited | n/a | Variomag® for mixing conditions in a single plate (0-2000 rpm). |
| Microplate mixer | TTP Labtech | 3121-01015 | MxOne. Mixing condition in a single plate with 96 vibrating pins. |
Referências
- Rupp, B. . Biomolecular Crystallography: Principles, Practice and Application to Structural Biology. , (2010).
- McPherson, A. Introduction to protein crystallization. Methods. 34, 254-265 (2004).
- Bergfors, T. M. . Protein crystallization: techniques, strategies, and tips: a laboratory manual. , (1999).
- Dessau, M. A., Modis, Y. Protein Crystallization for X-ray Crystallography. J. Vis. Exp. (47), e2285 (2011).
- Crick, F. H. C. X-Ray Diffraction of Protein Crystals. Methods Enzymol. 4, 127-146 (1957).
- Jaskolski, M., Dauter, Z., Wlodawer, A. A brief history of macromolecular crystallography, illustrated by a family tree and its Nobel fruits. FEBS J. 281, 3995-4009 (2014).
- Chruszcz, M., Wlodawer, A., Minor, W. Determination of Protein Structures-A Series of Fortunate Events. Biophys. J. 95, 1-9 (2008).
- Manjasetty, B. A., Büssow, K., Panjikar, S., Turnbull, A. P. Current methods in structural proteomics and its applications in biological sciences. 3 Biotech. 2, 89-113 (2012).
- Carter, C. W., Carter, C. W. Protein crystallization using incomplete factorial experiments. J. Biol. Chem. 254, 12219-12223 (1979).
- Jancarik, J., Kim, S. H. Sparse matrix sampling: a screening method for crystallization of proteins. J. Appl. Cryst. 23, 409-411 (1991).
- Stevens, R. C. High-throughput protein crystallization. Curr. Opin. Struct. Biol. 10, 558-563 (2000).
- Berry, I. M., Dym, O., Esnouf, R. M., Harlos, K., Meged, R., Perrakis, A., Sussman, J. L., Walter, T. S., Wilson, J., Messerschmidt, A. SPINE high-throughput crystallization, crystal imaging and recognition techniques: current state, performance analysis, new technologies and future aspects. Acta Crystallogr D Biol Crystallogr. 62, 1137-1149 (2006).
- Luft, J. R., Collins, R. J., Fehrman, N. A., Lauricella, A. M., Veatch, C. K., DeTitta, G. T. A deliberate approach to screening for initial crystallization conditions of biological macromolecules. J. Struct. Biol. 142, 170-179 (2003).
- Moraes, I., Evans, G., Sanchez-Weatherby, J., Newstead, S., Stewart, P. D. S. Membrane protein structure determination-the next generation. Biochim. Biophys. Acta. 1838, 78-87 (2014).
- Stock, D., Perisic, O., Löwe, J. Robotic nanoliter protein crystallisation at the MRC Laboratory of Molecular Biology. Prog. Biophys. Mol. Biol. 88, 311-327 (2005).
- Gorrec, F. The current approach to initial crystallization screening of proteins is under-sampled. J. Appl. Cryst. 46, 795-797 (2013).
- Hennessy, D. N., Narayanan, B., Rosenberg, J. M. Automatic implementation of precise grid screens: the four-corners method. Acta Crystallogr D Biol Crystallogr. 65, 1001-1003 (2009).
- Cudney, R., Patel, S., Weisgraber, K., Newhouse, Y., McPherson, A. Screening and optimization strategies for macromolecular crystal growth. Acta Crystallogr D Biol Crystallogr. 50, 414-423 (1994).
- DiLorenzo, M. E., Timoney, C. F., Felder, R. A. Technological Advancements in Liquid Handling Robotics. JALA. 6, 36-40 (2001).
- Jenkins, J., Cook, M. Mosquito: An Accurate Nanoliter Dispensing Technology. JALA. 9, 257-261 (2004).
- Li, D., Boland, C., Walsh, K., Caffrey, M. Use of a Robot for High-throughput Crystallization of Membrane Proteins in Lipidic Mesophases. J. Vis. Exp. (67), e4000 (2012).
- Till, M., Robson, A., Byrne, M. J., Nair, A. V., Kolek, S. A., Shaw Stewart, P. D., Race, P. R. Improving the Success Rate of Protein Crystallization by Random Microseed Matrix Screening. J. Vis. Exp. (78), e50548 (2013).
- Dierks, K., Meyer, A., Oberthür, D., Rapp, G., Einspahr, H., Betzel, C. Efficient UV detection of protein crystals enabled by fluorescence excitation at wavelengths longer than 300 nm. Acta Crystallogr F Biol Crystallogr. 66, 478-484 (2010).
- Szewczak, A. . Structural studies of the bacterial MreBCD complex. , (2016).
- Nayak, V., Dessau, M., Kucera, K., Anthony, K., Ledizet, M., Modis, Y. Crystal structure of dengue virus type 1 envelope protein in the postfusion conformation and its implications for membrane fusion. J. Virol. 83, 4338-4344 (2009).
- Gorrec, F., Palmer, C. M., Lebon, G., Warne, T. Pi sampling: a methodical and flexible approach to initial macromolecular crystallization screening. Acta Crystallogr D Biol Crystallogr. 67, 463-470 (2011).
- Parker, J. L., Newstead, S. Current trends in α-helical membrane protein crystallization: An update. Protein Sci. 21, 1358-1365 (2012).
- Gorrec, F. The MORPHEUS II protein crystallization screen. Acta Crystallogr F Biol Crystallogr. 71, 831-837 (2015).
- Yin, X., et al. Hitting the target: fragment screening with acoustic in situ co-crystallization of proteins plus fragment libraries on pin-mounted data-collection micromeshes. Acta Crystallogr D Biol Crystallogr. 70, 1177-1189 (2014).
- Wu, P., Noland, C., Ultsch, M., Edwards, B., Harris, D., Mayer, R., Harris, S. F. Developments in the Implementation of Acoustic Droplet Ejection for Protein Crystallography. JALA. 21, 97-106 (2015).
- Zipper, L. E., et al. A simple technique to reduce evaporation of crystallization droplets by using plate lids with apertures for adding liquids. Acta Crystallogr F Biol Crystallogr. 70, 1707-1713 (2014).
- Wagner, A., Duman, R., Stevens, B., Ward, A. Microcrystal manipulation with laser tweezers. Acta Crystallogr D Biol Crystallogr. 69, 1297-1302 (2013).
- Newman, J. Initial Evaluations of the Reproducibility of Vapor-Diffusion Crystallization. Acta Crystallogr D Biol Crystallogr. 63, 826-832 (2007).
- Reis, N. M., Chirgadze, D. Y., Blundell, T. L., Mackley, M. R. The effect of protein-precipitant interfaces and applied shear on the nucleation and growth of lysozyme crystal. Acta Crystallogr D Biol Crystallogr. 65, 1127-1139 (2009).
- McPherson, A., Koszelak., S., Axelrod, H., Day, J., Robinson, L., McGrath, M., Williams, R., Cascio, D. The effects of neutral detergents on the crystallization of soluble proteins. J. Crystal Growth. 76 (3), 547-553 (1986).
- Sauter, C., Ng, J. D., Lorber, B., Keith, G., Brion, P., Hosseini, M. W., Lehn, J. -. M., Giegé, R. Additives for the crystallization of proteins and nucleic acids. J. Crystal Growth. 196, 365-376 (1999).
- McPherson, A., Cudney, B. Searching for silver bullets: an alternative strategy for crystallizing macromolecules. J. Struct. Biol. 156, 387-406 (2006).
- Gorrec, F. Protein crystallization screens developed at the MRC Laboratory of Molecular Biology. Drug Discov. Today. 21, 819-825 (2016).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Anal. Biochem. 357, 289-298 (2006).
- Chari, A., et al. ProteoPlex: stability optimization of macromolecular complexes by sparse-matrix screening of chemical space. Nat. Methods. 12, 859-865 (2015).
- Newman, J., Egan, D., Walter, T. S., Meged, R., Berry, I., Ben Jelloul, M., Sussman, J. L., Stuart, D. I., Perrakis, A. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta Crystallogr D Biol Crystallogr. 61, 1426-1431 (2005).
- Wilson, J. Automated Evaluation of Crystallisation Experiments. Cryst. Rev. 10, 73-84 (2004).
- Snell, E. H., et al. Establishing a training set through the visual analysis of crystallization trials. Part I: ∼150 000 images. Acta Crystallogr D Biol Crystallogr. 64, 1123-1130 (2008).
- Haupert, L. M., Simpson, G. J. Screening of protein crystallization trials by second order nonlinear optical imaging of chiral crystals (SONICC). Methods. 55, 379-386 (2011).
- Newman, J., Fazio, V., Lawson, B., Peat, T. The C6 Web Tool: A Resource for the Rational Selection of Crystallization Conditions. Cryst. Growth & Des. 13, 12219-12223 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados