Method Article
הופעל מקושרת צולבת מקושרת לפיתוח מהיר של שרפים כרומטוגרפיה של אהדה-לכידת נוגדן כמחקר מקרה
In This Article
Summary
בהליך זה, מבוסס על מעטפת המבוססת על DsRed-בסיס להפקת שרף מיוחד בררני ללכידת נוגדנים חד-שבטיים מתמציות צמחים גולמי או סופרנטנמלים של תרבות התאים, כחלופה לחלבון A.
Abstract
טיהור של נוגדנים חד שבטיים (mAbs) מושגת בדרך כלל על ידי חלבון כרומטוגרפיה זיקה, אשר יכול להסביר עד 25% מעלויות התהליך הכולל. אלטרנטיבי, שלבי הלכידה החסכונית הם אפוא רב ערך עבור ייצור בקנה מידה תעשייתי, שבו כמויות גדולות של mAb יחיד מיוצרים. כאן אנו מציגים שיטה עבור השתק של האפיפי המבוססת על הצלב האדום המבוסס על שרף משני מקושר המאפשר לכידת סלקטיבית של הנוגדן לנטרול האיידס 2F5 מפני תמציות צמחים גולמי מבלי להשתמש בחלבון A. האפיפי הליניארי ELDKWA היה התמזגו לראשונה גנטית לחלבון הפלורסנט DsRed וחלבון ההיתוך התבטא בטבק טרנסגניים (טבק טבאקו) צמחים לפני טיהור על ידי קיבוע מתכת-יון כרומטוגרפיה זיקה. יתר על כן, שיטה המבוססת על התקפה צולבת מקושרת שהופעלה הייתה ממוטבת לדחיסות גבוהה, לצימוד יעיל ולעלויות נמוכות. הרכב ה-pH והאגירה והריכוז המיסיסים היו הפרמטרים החשובים ביותר במהלך הליך הצימוד, ששופר באמצעות גישת עיצוב-ניסויים. שרף האהדה שנוצר נבדק על יכולתה לאגד באופן סלקטיבי את mAb היעד בתמצית צמח גולמי המאגר ממוטב עבור התאוששות גבוהה mAb, פעילות המוצר ויציבות שרף אהדה. השיטה יכולה בקלות להיות מותאמת לנוגדנים אחרים עם אפיסקופים ליניאריים. האפוקסידיות החדשות מאפשרות הגבלות על המצב העדין יותר מאשר חלבון A ויכול גם להקטין את העלויות של שלב הלכידה הראשונית עבור ייצור mAb.
Introduction
המוצרים הביופרמצבטיקה חשובים לטיפול בספקטרום רחב של מחלות כמעט בכל ענף של רפואה1. נוגדנים חד שבטיים (mAbs) להשתלט על השוק הביופרמקולוגיה, עם מכירות ברחבי העולם צפויים להגיע כמעט €110,000,000,000 בתוך 20202. פלטפורמת הביטוי המועדף על mabs הם הסינית שחלות אוגר תאים קווי, אשר בדרך כלל לייצר גבוה mabs מגדל של עד 10 g ∙ L-1 בתרבות supernatant3,4. עם זאת, הייצור של mAbs בתרביות תאים היונקים הוא יקר בשל העלות הגבוהה של המדיום ואת הצורך תסיסה סטרילית5. פלטפורמות ביטוי חלופיות כגון צמחים העשויים להציע גישה מהירה יותר, פשוטה יותר, זולה יותר ומדרגית יותר עבור ייצור תעשייתי6,7.
בנוסף לעלויות הקשורות לתרבויות תאי היונקים, השימוש הנרחב בחלבון כרומטוגרפיה של זיקה ללכידת המוצר הוא מנהל התקן של עלות מרכזית עבור הייצור התעשייתי של mAbs. חלבון A נמצא באופן טבעי על פני השטח של התאים האורהוניים של סטיילולוקוקוס והוא מאגד את הרסיס crystallizable (Fc) באזור של murine מסוימים ונוגדנים אנושיים, ובכך מתנהג כמנגנון הגנה להתחמק המערכת החיסונית ומוראלית8. חלבון A הפך לתקן זהב תעשיית לכידת mAbs מן התרבות התאית סופר והוא גם בשימוש נרחב על ידי קהילת המחקר כי זה סלקטיבי מאוד, בדרך כלל להשיג Mabs purities של ~ 95% בשלב אחד8. באופן לא מפתיע, מכירות של חלבון A במהלך שני העשורים האחרונים יש שיקוף מקרוב את המכירות של mAbs8. בהתאם לסולם הייצור, העלויות של חלבון A יכול להתאים יותר 25% מעלויות התהליך הכולל ובכך להשפיע על מחיר השוק של mabs טיפולית, אשר יכול להיות עד €2,000 g-15,9. לכן, כרומטוגרפיה חלופית שרפים עם ביצועי טיהור דומה יש פוטנציאל להפחית באופן משמעותי את עלויות הייצור, ביצוע טיפולים נוגדנים מבוססי נגיש עבור מספר גדול יותר של חולים10,11 ,12. חלופות כאלה עלולות גם לעקוף את החסרונות של חלבון כרומטוגרפיה, כולל התנאים הקשים ביותר ב-pH נמוך (בדרך כלל < 3.5) העלולים לגרום ל-mAbs לעבור שינויים מתוניים המקדמים את הצבירה13 . וחשוב מכך, חלבון A סלקטיבי רק עבור אזור Fc של מחלקות IgG מסוימות, כך שאינם פונקציונליים מולקולות עם תחומים כריכה חתוכים עשוי לטהר עם המוצר ללא שינוי5, ואילו mab ליגוניות כגון קטעי שרשרת בודדת משתנה לא להיקשר לחלבון A בכלל.
כאן, אנו מתארים שרף כרומטוגרפיה של זיקה כרומטוגרפית ללכידת ה-HIV-נטרול mab 2f5 באמצעות האפיפפן הליניארי שלה eldkwa (אות אחת חומצת אמינו קוד)5,14. התחזרנו גנטית את האפיפי של 2F5 ל-C הטרמינוס של חלבון הפלורסנט DsRed, אשר פעלו כמולקולה המוביל והעיתונאי, והפיק את החלבון המתקבל Dsred-2F5-Epitope (dfe) בטבק הטרנסגניים ( צמחים טבק טבאקו). DFE היה מטוהר על ידי צעד אחד מקיבוע מתכת-יון זיקה כרומטוגרפיה (IMAC). השתק של האהדה הטהורה של הזיקה ליגולי אל שרף אגקם מקושר הושג על ידי צימוד כימי באמצעות N-הידרוקסיזינימיד (הארגון)-הופעלו מקושרות מוצלבות עמודים. עיצובים ניסיוניים סטטיסטיים שימשו אז כדי למטב את הליך השתק ויעילות צימוד15. אסטרטגיית טיהור עבור mAb 2F5 הוערך במונחים של טוהר נוגדנים, תשואה ליגויציבות. בניגוד לחלבון A, אשר מאגד את אזור Fc, DFE מאוגד לאזור הקבוע ביותר של 2F5, להבטיח טיהור של מולקולות עם paratope שלם. הקונספט שלנו יכול בקלות להיות מותאם לכל mAb עם אפירופה ליניארי או אחרים מבוססי פפטיד מבוסס ליגנדס אשר ניתן לזהות בקלות על ידי מחקרים microarray16.
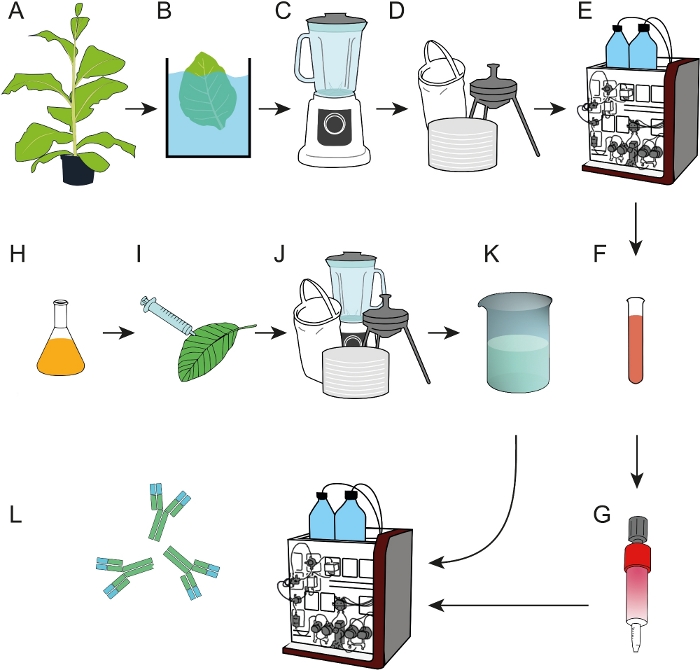
איור 1: תהליך תזרים התהליכים להכנת שרפים אהדה אפירופה שניתן להשתמש בהם ללכידת mAbs מתמציות צמחים גולמי או סופרנטנמלים של תרבות התאים. (א) ליגו dfe האהדה התבטא במפעלי טבק טרנסגניים. צעד משקעים בחום (ב) נכלל לפני העלים שנקטפו היו הומוגניים (C). (ד) תמצית הצמח הגולמי הובהר על ידי סינון שקית, סינון עומק ו-0.2 יקרומטר סינון סטרילי. (ה) dfe טוהר לאחר מכן על ידי IMAC. (F, G) האהדה DFE מטוהרים ליגס היה מחובר על העמודים EDC/הפעילה החוצה המופעלות מחוצה. (ח) בתרבויות חיידקית הנושאות את הנוגדן לקידוד T-DNA 2F5 שימשו לביטוי חולף ב -N. benthamiana צמחים (I) גדל בפיטוטרון. (J) N. העלים נקצרו ועובדו כמתואר ב D. (K) mab 2f5 טוהר מן התמצית הבהיר באמצעות עמודות זיקה dfe (L). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
1. לטפח את צמחי הטבק הטרנסגניים
הערה: העיצוב של חלבון היתוך dfe והדור של צמחים טרנסגניים מתוארים במקומות אחרים5,17.
- לנבוט שתילי הטבק הטרנסגניים באדמה. להשקלת הצמחים עם 1.0 גרם · . פתרון דשן ל-1 להעביר את הצמחים בודד, 100 מ"מ x 100 mm x 60 mm (אורך, רוחב, גובה) סירי כאשר הם גדלים לקוטר של ~ 0.04 m.
- לטפח את צמחי הטבק הטרנסגניים בחממה עם photoperiod 16-h (25/22 ° צ' בהיר/חום כהה המשטר), עם 70% לחות יחסית הפריה אוטומטית עם 1.0 g · פתרון דשן ל-1 ל -15 דקות בכל שעה.
- לאחר 7 שבועות, הקציר כל העלים מלבד ארבע cotyledon עוזב בבסיס גבעול הצמח. לעבד מיד את העלים שנקטפו כפי שמתואר להלן.
2. חום משקעים של חלבונים של תא מארח
- הגדר אמבטיה מים עם כמות העבודה 20 L בכלי נירוסטה מחומם (0.3 m x 0.3 m x 0.3 m). בהתחלה, מניחים משאבה מגנטית באמבט מים כדי להתסיס את הנוזל לצמיתות עם זרם של 5 L min-1. הר תרמוסטט מתכוונן על אמבט מים עבור בקרת טמפרטורה (שלבים 2.4 ו 2.8).
זהירות: כל השלבים הבאים עד 2.10 כרוכים בטיפול בנוזל חם. תלבש ציוד הגנה אישי מתאים כולל כפפות ומשקפי מבודדים תרמית. - הוסיפו 15 מעלות מים מיוהים לאמבט המים והתחממו את הנוזלים ל-70 ° c.
- מניחים 10 דלי ממולא ב -5 ליטר של מים מפוים על מערבב מגנטי. הוסף נתרן פוספט לריכוז הסופי של 120 מ"מ. להתאים את ה-pH ל 8.14 באמצעות חומצה הידרוכלורית 10 M. כאשר כל הרכיבים יש התפרקה, להוסיף את המאגר כתוצאה מרוכזת מרוכז (5 L) לאמבט מים משלב 2.2.
- מתפרעים את אמבטיית המים עד שהחום מגיע 70 ° c. השימוש 10 חומצה הידרוכלורית כדי לכוונן את ה-pH כדי 8.14 אם יש צורך בכך. המשך להמשיך ולעשות לפחות 15 דקות לאחר הטמפרטורה הנדרשת ו-pH מגיעים כדי להבטיח כי ההרכבה כולה היא בשיווי משקל תרמי.
- הכן 20 L דלי (0.3 m x 0.3 m x 0.3 m) מלא מים מוהים בטמפרטורה של ~ 17 ° צ' (נדרש עבור שלב 2.9).
- להכין 400 גרם ali, של העלים טבק שנקטפו משלב 1.3. מיקום אחד סדרת מחלקים בסל מחורר (0.2 m x 0.2 m x 0.2 מ '; רוחב הנקבובית לפחות 0.02 m x 0.02 m). להימנע מילוי יתר של הסל עם חומר הצמח או אריזת העלים חזק מדי כדי למנוע פגיעה ברקמה.
- במלואו להטביע את הסל במאגר הלוהט חם משלב 2.4 ולוודא שכל העלים יישארו תחת המשטח הנוזלי. השתמשו בכף הסיליקון התרמויציבה כדי להחזיק את העלים מתחת לפני השטח במידת הצורך.
- דגירה של הטבק עלים עבור 1.5 דקות בנוזל השמיכה בעוד המשאבה עדיין מרווה את הנוזל. ניטור הטמפרטורה הנוזלית במהלך תקופת הדגירה כולה. הימנע חסימת כניסת המשאבה עם הטבק עלים.
- הסר את סל הטבק עוזב מתוך מאגר שיורית וניקוז מאגר השאריות מן העלים עבור 30 s. להעביר את הסל אל הדלי מלא מים קרים (משלב 2.5) ולטבול את העלים עבור 30 s. להסיר את הסל לנקז את שרידי המים של הספינה. דס במשך 30 שנות לפני הומוגון (שלב 3).
- חזור על שלבים 2.6 כדי 2.9 עם האליבים טריים מ 2.6 עד ביומסה שנקטפו כולו מעובד. כל הזמן לפקח ולהתאים את ה-pH ואת הטמפרטורה של מאגר השמיכה באמבט מים.
הערה: חומר הצמח בלצ'ינג ניתן לאחסן על הקרח עד 30 דקות כאשר מחזורים מסוימים מחזורי נדרשים לעבד את ביומסה כולו. העלים הניתנים לאחסון יכולים גם להיות מאוחסנים בשקיות אטומות לואקום ב-80 ° c לפחות 3 שבועות. עם זאת, מומלץ לעיבוד מיידי מכיוון שאחסון ממושך עלול להקטין את התשואה של DFE.
3. הוצאת חלבון והבהרה
זהירות: השלבים הבאים כוללים בלנדר עם להבים מסתובבת. אין לעבוד בכלי הבלנדר כאשר הוא מופעל או רכוב על יחידת המנוע.
- מקום 150 g (מסה רטובה) של עלי הטבק (שלב 2.9) בכלי הבלנדר ולהוסיף 450 mL של מאגר החילוץ (50 mM נתרן פוספט, 500 מילימטר נתרן כלוריד, 10 מ"מ disulfite פיט נתרן, pH 7.5). סגרו את כובע הבלנדר בחוזקה כדי למנוע שפיכת חומר או מאגר של הצמח.
- הומוגון לסדר את העלים עבור 3x עבור 30 s, עם 30 הפסקות של כל פעימה. ודא כי כל העלים הם הומוגניים ואין אף מקל על החלק העליון של כלי הבלנדר. אם יש צורך, לפתוח את הבלנדר במהלך הפסקות ולדחוף את העלים כי המקל על החלק העליון של הכלי, באמצעות כף סיליקון נקי.
- לאחר הומוקות, קחו מדגם 1.0 mL של המגון לניתוח שלאחר מכן (שלב 7).
- לאסוף את הגון לאכול בכלי בגודל מתאים (למשל, אם עובד עם ביומסה הכולל של 1.0 ק ג, להשתמש בכלי עם קיבולת של לפחות 5 L). חזור על שלבים 3.1 עד 3.3 עד כל ביומסה המחורץ הוא הומוגניים.
- הר מסנן שקית לתוך הר מסנן ומניחים כלי נוסף בגודל כראוי (ראה 3.4) מתחת להרכבה. החל את ההגון לסנן את השקית בקצב של ~ 0.15 L min-1. לקחת דגימות של פילטרט התיק לאחר כל ליטר עבור ניתוח עוקבות (שלב 7) ולמדוד את העכירות של בריכת פילטרט התיק כמו דילול 1:10 במאגר החילוץ באמצעות turbidimeter או התקן דומה.
- עוד להבהיר את המאגר פילטרט התיק באמצעות 0.02 m2 של K700 (למעלה) ו KS50 (למטה) שכבת מסנן עומק ליטר של בריכת פילטרט שק. החל קצב זרימה של 3.0 L דקות-1· m-2 עד ללחץ מרבי של 0.2 MPa. ואז להסיר חלקיקים שיורית על ידי העברת פילטרט מובהר באמצעות מסנן סטרילי 0.2 יקרומטר כפי שתוארה בעבר5.
4. טיהור של קירבת DFE ליגד
- להכין חלבון מהיר מערכת כרומטוגרפיה נוזלית על ידי שטיפה עם מאגר להתחמק (10 מ"מ נתרן פוספט, 300 מ"מ הסרמדול, pH 7.4), לשטוף מאגר (10 מ"מ נתרן פוספט, pH 7.4) ו מאגר equilibration (20 מ"מ נתרן פוספט, 500 מ"מ נתרן כלוריד, pH 7.4). הר עמודה המכילה ~ 50 mL של שרף החוצה מקושרת החוצה לקילוגרם של ביומסה עלה (~ 2.5 L העומק filtrate).
- לטעון את העמודה עם יוני ניקל על-ידי החלת 5 כרכים עמודה (CV) של 200 mM משקל ניקל הפתרון ולשטוף אותו עם 5 קורות חיים של מאגר הימנעות. השתמש בקצב הזרימה של 50 ס מ h-1 ונטר את אותות ה-UV ב 260, 280 ו558 nm עבור כל שלבי הכרומטוגרפיה הבאים.
- העמודה עם 10 קורות חיים של מאגר שיווציה. לאחר מכן טען 50 קורות חיים של תמצית הצמח הבהיר (משלב 3.6) אל העמודה הממוזגת.
- לשטוף את העמודה עם 10 קורות חיים של מאגר לשטוף. Elute חלבון היתוך DFE עם 5 קורות חיים מאגר לאסוף את המוצר מכיל שבר פעם אותות UV ב 280 nm ו 558 nm גדלו יותר 5 מאו מעל קו הבסיס.
- לקחת 0.2 mL מתוך שבר החלק כדי למדוד את חלבון מסיס כולל (כפית) ריכוז (שלב 7.1), ריכוז DFE (שלבים 7.2 ו 7.3), ו DFE טוהר (שלב 7.4).
- הר עמודה המכילה ~ 50 mL של שרף דטרן מקושרת מקושרת על מערכת כרומטוגרפיה. העמודה עם 5 קורות חיים של מאגר צימוד (200 מ"מ HEPES, 500 mM נתרן כלוריד, pH 8.5). הכנס 10 מ ל של שבר הימנעות DFE (שלב 4.4) עבור החלפת מאגר לפקח על ספיגת UV ב 280 ו 558 nm.
- לאסוף את השבר DFE המכיל פעם את אותות UV ב 280 nm ו 558 nm גדלו יותר מ 5 מאו מעל קו הבסיס. קח 0.2 mL ולקבוע את הריכוז כפית, DFE ריכוז, ו DFE טוהר (שלב 7).
- לרכז את דגימת DFE מטוהרים (משלב 4.7) עד 15 g L-1 באמצעות שפופרת מרכז צנטריפוגלי ב 3,000 x g ב 4 ° c עבור 30 דקות בצנטריפוגה. המשך בתגובת הצימוד (שלב 5).
הערה: אחסן את פתרון DFE ב-4 ° צ' אם לא ניתן לבצע את שלבי הריכוז או הצימוד באופן מיידי.
5. מצמד DFE לתוך מופעל מקושרת Agarose שרף
הערה: אין להחליף את האיזופנול המשמש לאחסון עמודות המופעלות באמצעות מחול עד שכל הציוד והפתרונות לצימוד מוכנים. . לעולם אל תתנו לעמודים להתייבש
- ההתקנה עיצוב של ניסויים (DoE) מודל כדי למטב את הצימוד של DFE כדי שרף המופעל, עם pH, הרכב המאגר ו DFE ריכוז כגורמים. הפרטים של שיטת DoE מתוארים במקום אחר15.
- הכינו את התמיסה הקרבה והפיתרון (משלב 4.8) בטווח ריכוז בין 0.5 ל-15 גר' · L-1 או כפי שהוגדר ב-DoE ולאחסן אותו על הקרח עד תגובת צימוד מוכן (שלב 5.5). למלא לפחות עשרה מזרקים mL עם הפתרון DFE ולהכין מתאם לטעון את מזרקים על מתחת הפעלת העמודים המקושרים החוצה עם נפח מיטה של 1.0 mL.
- עבור כל 10 העמודות המשמשות צימוד, להכין 30 מ ל של פתרון ביטול השימוש (0.5 m ethanolamine, 0.5 m נתרן כלוריד, pH 8.3), 30 מ ל של פתרון נמוך ph (0.1 מז נתרן אצטט, 0.5 m נתרן כלוריד, pH 4.0) ו 10 מ ל של פתרון אחסון (0.05 m ניתרן פוספט , 0.1% (m/v) נתרן עזידה, pH 7.0).
- הכינו 20 מ ל של חומצה הידרוכלורית 1 מ"מ בצינור ו-מודקת אותו על הקרח לפחות 20 דקות. הכינו קנה מידה מדויק כדי לנטר את שברי הזרימה עבור כל השלבים במהלך תגובת הצימוד (שלב 5.7).
- פתח עמודה מקושרת צולבת המופעלת באמצעות מכלים וטען את מתאם המזרק בשקע העמודה. מנע מהאוויר להיכנס לעמודה על-ידי החלת טיפת מאגר על המתאם לפני חיבורו למזרק.
- שטוף את הטור עם 6 מ ל של הקרח קר 1 מ"מ חומצה הידרוכלורית (משלב 5.4) בקצב הזרימה של < 1 mL min-1 ומיד להמשיך צעד 5.7.
- הכנס 1.5 mL של פתרון DFE (שלב 5.2) באמצעות מזרק 2 mL בקצב הזרימה של < 1 mL min-1 ולאסוף את השבר באמצעות הזרימה בסולם דיוק (שלב 5.4) לניתוח הבאים (שלב 7). חותם את העמודה בשני הקצוות ואת הדגירה עבור 15-45 דקות ב 22 ° c, בהתאם לכיוונון DoE.
- הכנס 6 מ ל של פתרון ביטול הפעלת ואחריו 6 מ ל של פתרון נמוך-pH בקצב הזרימה של < 1 mL min-1 כדי להסיר ליגניות מאוגד לא מוגבל של שרף. ואז להזריק 6 מ ל של פתרון הביטול ואת העמודה מודטה את הטור עבור 15 דקות.
- הכנס 6 מ ל של פתרון נמוך-pH לתוך העמודה, ואחריו 6 מ ל של פתרון הביטול. לאחר מכן, הכנס עוד 6 מ ל של פתרון ברמת ה-pH נמוכה לתוך הטור.
- הכנס 2 מ"ל של פתרון אחסון לתוך העמודה והחנות ב-4 ° c.
6. בדיקת הטיהור של mAbs מתמציות צמחים מובהר
- הכן 100 mL של תמצית צמח מובהר המכיל 2F55 או supernatant מן המערכת המועדפת מבוססי התא ביטוי, גם המכיל 2f5.
- הכנת מאגר equilibration (20 מ"מ נתרן פוספט, 500 mM נתרן כלוריד, pH 7.4), מאגר משחרל נמוך pH (0.05 M ציטראט, 0.05 M נתרן כלוריד, pH 4.0 – 3.25), ו-high-יונית חוזק מאגר (1.0 – 4.0 M מגנזיום כלוריד, 0.1 M HEPES, pH 8.0)
- רוקן את מערכת הכרומטוגרפיה. עם המאגרים טעינת עמודת הזיקה DFE (משלב 5.10) על מערכת הכרומטוגרפיה ושיטה עם 5 קורות חיים של מאגר שיווציה בקצב זרימה של 1.0 mL min-1. לעקוב אחר ספיגת UV ב 280 nm.
הערה: טעינת תמצית הצמח או התרבות התאית על העמודה עלולה לגרום לעלייה בלחץ הרקע. הגדר התראה בלחץ גבוה ב-0.2 MPa כדי למנוע נזק למערכת הכרומטוגרפיה או לעמודת DFE. - טען 80 mL של תמצית הצמח הבהיר או supernatant (שלב 6.1) אל העמודה בקצב הזרימה של 0.5 mL min-1 כדי להבטיח את זמן המגע של 2 דקות. לאסוף את דגימות זרימת באמצעות 2 mL שחזור עקומת הפריצת (שלב 7.3). אחסן את דגימות הזרימה ב-4 ° צ', אם לא ניתן לבצע ניתוח מיידי לדוגמה.
- שטוף את הטור עם 6 קורות חיים של מאגר שיווציה. לאסוף מדגם של הכביסה בהתחלה, באמצע ובסוף שלב זה.
-
Elute mAb 2F5 עם 5 קורות חיים של מאגר משחרר נמוך-pH או מאגר הימנעות גבוה-עוצמה (0.1 M HEPES, 1.25 M מגנזיום כלוריד, pH 8.0). לאסוף את השבר DFE כאשר האות UV 280 ננומטר עלה ל 5 מאו מעל קו הבסיס.
- מיטוב מאגר הימנעות עבור כל אפירופה-זוג נוגדנים. עבור 2F5, 1.25 M מגנזיום כלוריד השיגה איזון אופטימלי בין התאוששות המוצר לבין לבין היציבות.
הערה: תמיסת מגנזיום כלוריד נוטה למשקעים. לכן, לפזר את מגנזיום כלוריד ב ~ 700 mL של מים. בנפרד לפזר את HEPES ב 100 mL של מים ולהתאים את ה-pH כדי 8.0. הוסיפו את פתרון המגנזיום המומס לפתרון HEPES והוסיפו מים לכרך האחרון של 1.0 L. אין לכוונן את ה-pH לאחר המסת המגנזיום כלוריד כי זה יגרום למשקעים.
- מיטוב מאגר הימנעות עבור כל אפירופה-זוג נוגדנים. עבור 2F5, 1.25 M מגנזיום כלוריד השיגה איזון אופטימלי בין התאוששות המוצר לבין לבין היציבות.
- לנתח את כל הדגימות שצולמו במהלך השלבים 6.4 – 6.6 באמצעות שיטת ברדפורד, ליתיום dodecylsulfate אלקטרופורזה ג'ל אלקטרופורזה (המהומבעמוד) ו פלמון המשטח תהודה (spr) ספקטרוסקופיה (שלב 7).
7. ניתוח לדוגמה
- למדוד את הריכוז כפית בשיטת ברדפורד18,19.
- בטרילקאט, פיפטה 2.5 μL של כל מדגם לתוך באר אחת של צלחת 96-באר. השתמש שמונה סרום שור (BSA) תקנים בטריליפט המכסה את הטווח 0 – 2000 מ"ג · . איי-1
- הוסף 200 μL של ברדפורד מגיב לכל טוב ולערבב על ידי בעדינות ללטף למעלה ולמטה. לשמור על רמת הפיפטה כדי למנוע היווצרות של בועות העיוות את הבדיקה הבאה.
- מודקת את הצלחת עבור 10 דקות ב 22 ° צ' ולמדוד את ספיגת ב 595 nm ב ספקטרוסקופיה. חישוב הריכוז כפית בדגימות המבוססות על עיקול רגיל דרך נקודות ההתייחסות של BSA.
- מכמת DFE על ידי פלואורימטריה
- בטרילקאט, פיפטה 50 μL של כל דגם לבארות בודדות של צלחת חצי שטח שחורה 96. כלול 6 סטנדרטים DsRed המכסים את הטווח 0 – 225 מ"ג · . איי-1
- למדוד את הזריחה פעמיים באמצעות 530 ± 30 הריגוש ננומטר מסנן ו 590 ± 35 הפליטה ננומטר מסנן ב ספקטרוסקופיה. חשב את הריכוז DFE בדגימות המבוססות על עקומה סטנדרטית באמצעות נקודות התייחסות DsRed.
- מדוד את ריכוז 2F5 על ידי ספקטרוסקופיית SPR20.
- הכינו את מאגר ההפעלה של hbs-EP (10 מ"מ 4-(2-הידרוקסיל) -1-בחומצה-פיפראזאנייאנייאניוני (hepes), 3 מ"מ חומצה אתינובית (edta), 150 מ"מ נתרן כלוריד, 0.005% v/v רצף-20, pH 7.4) ומסננים לעקר אותו על ידי העברת אותו דרך ואקום 0.2 יקרומטר מסנן העליון של הבקבוקים. . דגה את המאגר במשך 15 דקות
- חבר את מאגר הפעלה של hbs-EP למכשיר spr לפני העגינה שבב משטח לפני תוספי, והוא משווה את המערכת באמצעות הפונקציה prime. להתחיל לרוץ ידנית עם קצב הזרימה של 30 μL min-1 ומצב את משטח השבב על ידי הזרקת לסירוגין 30 מ"מ חומצה הידרוכלורית 25 מ"מ נתרן הידרוקסיד (שתי זריקות כל אחד) על תאים זורמים 1 ו 2 בקצב הזרימה של 30 μl min-1 עבור 1 דקות.
- הכינו 300 μL של 500 mg · L-1 חלבון פתרון בשנת 10 mM אצטט נתרן (pH 4.0). הפשרת מבחנות המכילה 0.4 M 1-אתיל-3-(3-dimethylaminopropyl) קרבודיאימיד הידרוכלוריד (EDC) ו 0.1 M מטפל ו צנטריפוגה ב 16,000 x g עבור 1 דקות לפני ערבוב 70 ΜL של edc ו-70 μl של כימס.
- העבר את התערובת של ה-EDC/בג ואת החלבון A לדגם 7 מ"מ של דגימות פלסטיק ומקום במדף המדגם. הפעל את משטח שבב תוספי מתילזה על ידי הזרקת התערובת של edc/מטפל על התאים הזורמים 1 ו 2 בקצב הזרימה של 10 μl min-1 עבור 10 דקות.
- חלבון הזוג A כדי להפעיל את משטח תוספי מופעל על ידי הזרקת חלבון A פתרון על תא זרימה 2 בקצב הזרימה של 15 μl min-1 עבור 15 דקות.
- בעוד צימוד חלבון A, להפשיר בקבוקון של 1.0 M ethanolamine הידרוכלוריד (pH 8.5) ו צנטריפוגה ב 16,000 x g עבור 1 דקות. העברה 150 μl אל בקבוקון פלסטיק 7-מ"מ ומקום לתוך המכשיר. כאשר שלב 7.3.5 הושלמה, לבטל את משטח השבב על ידי הזרקת הפתרון ethanolamine על התאים הזורמים 1 ו 2 בקצב הזרימה של 10 μL min-1 עבור 7 דקות.
- מצב משטח שבב על ידי הזרקת לסירוגין 30 מ"מ חומצה הידרוכלורית 25 מ"מ נתרן הידרוקסידי (שתי זריקות כל אחד) על תאים זורמים 1 ו 2 בקצב הזרימה של 30 μL min-1 עבור 0.5 דקות.
- הכנת סטנדרטים של נוגדן 2F5 ב HBS-EP פועל מאגר בריכוז של 500 μg · L-1 ו לדלל דגימות המכיל 2F5 ב hbs-EP לריכוז סופי בטווח 20 – 1000 μg · . איי-1 הכנס דגימות ותקנים לאורך תאים זורמים 1 ו-2 בקצב זרימה של 30 μL min-1 עבור 3 דקות. הכנס תקן 2F5 לאחר כל 15 דגימות.
- להחסיר היחידות היחסיות (RU) של תא זרימה 1 (תא הפניה) מהאות של תא זרימה 2 (תא מדידה) עבור כל דוגמה ולחשב את הריכוז נוגדן מבוסס על האות RU של 2F5 זריקות סטנדרטיות.
- לאחר כל מדגם או הזרקה סטנדרטית, להתחדש המשטח שבב על ידי הזרקת 30 מ"מ חומצה הידרוכלורית על שיעור הזרימה של 30 μL min-1 עבור 0.5 דקות על הזרמת תאים 1 ו 2.
- מתווה את הריכוז 2F5 עבור כל מדגם זרימה דרך משלב 6.4 נגד הזרימה באמצעות נפח כדי להשיג את עקומת 2F5 פריצת דרך. חשב את כמות 2F5 המוזרקים כאשר 10% מהריכוז של 2F5 הגיע להשגת קיבולת האיגוד הדינמית של 10% (DBC).
- ניתוח דגימות חלבון על-ידי האנטי-עמוד.
- פתח מוכן לשימוש 4 – 12% bistris ה, אלקטרופורזה ג'ל לבית ומניחים אותו במודול אלקטרופורזה. העברת 800 mL של מאגר פועל (50 mM MES, 50 mM טריס בסיס, 0.1% (m/v) SDS, 1 מ"מ EDTA, pH 7.3) לתוך המודול ולהוסיף 0.5 mL של פתרון נוגד חמצון.
- בצינור 1.5 mL, מערבבים 10 μL של טעינת מאגר עם 4 μL של הפחתת סוכן ו -26 μL של דגימת חלבון. מודקון את הצינורית בבלוק חום במשך 10 דקות ב 80 ° c. צנטריפוגה את הצינור ב 500 x g עבור 30 s.
- טען את ג'ל אלקטרופורזה (10 μl של מדגם לנתיב) וטען 5 μl של תקן חלבון מוכתם מראש (10 – 180 kda) בנתיב נפרד.
- סגור את תא האלקטרופורזה וחבר את ספק הכוח. האלקטרופורזה צריכה לרוץ עבור 40 דקות ובאופן קבוע 200 V.
- הסירו את הג מחדר האלקטרופורזה. פתח את לנדן ג'ל ולשטוף את ג'ל עבור 15 דקות במים על שייקר ב 19 סל ד. כתם ג'ל עבור 1 h בצביעת פתרון על שייקר ב 19 סל ד.
- להכתים את הג עבור 1 h במים על שייקר ב 19 סל ד. סרוק את הג בעזרת סורק סרטים.
תוצאות
ביטוי וטיהור של הזיקה ליגולי
DFE חלבון היתוך ביטא בצמחי טבק טרנסגניים גדל בחממה. התשואה היה ~ 120 mg · ק"ג-1 עלה המסה עם ביומסה ממוצע של ~ 130 g לכל צמח. הטוהר DFE היה < 5% של כפית תמציות צמחים גולמי לפני השמיכה אבל עלה ל ~ 40% לאחר הטיפול בחום ב 70 ° c עבור 1.5 דקות, אשר זירז > 97% של החלבונים תא מארח. הצעד השוטף היה משולב בקלות לתוך שגרת הקציר והחילוץ (איור 1) ולקח פחות מ 2 h של זמן נוסף, כולל הקמת אמבט מים. ההתאוששות הכללית של DFE היה 23.5 mg ק"ג1 עם טוהר של > 90%. השלבים האחראיים על אובדן המוצר היו מחולטים, עומק סינון ו-IMAC, עם הפסדים ספציפיים של 40%, 27% ו 45%, בהתאמה. קיבולת מסנן עומק היה בממוצע 135 ± 36 L m-2 (± SD, n = 3) ולכן בטווח העליון של ערכים שדווחו בספרות21. התשואה של DFE גדלה עם גיל הצמח (איור 2).
שינזציה של הזיקה לליבטורים בעלי כרומטוגרפיה מופעלים
במהלך בדיקות צימוד הראשונית, מצאנו כי מאגר HEPES (pH 8.3) הגביר את היעילות צימוד ל 89 ± 6% (± SD, n = 3) לעומת 78 ± 9% (± SD, n = 3) עבור מאגר ביקרבונט מומלץ על ידי היצרן. לכן, HEPES שימש עבור כל הניסויים הבאים צימוד. גישה DoE נבחרה כדי למטב את היעילות הצימוד של DFE לתוך שרף המופעל חוצה מקושרת מקושרת. כמות מוחלטת של DFE קיבוע על שרף גדל עם מסה של DFE מוזרק לתוך העמודה ו plateaued ב ~ 15 g · L-1 ואילו התשואה הצימוד נדחתה ברציפות כמו dfe הוזרק יותר (איור 2). התשואה הצימוד היתה גם > 50% נמוך יותר במאגר חומצי, המציין את הצורך למסך עבור תנאי צימוד מתאימים לכל ליגעל בסיס מקרה אחר. התנאים האידיאליים במונחים של תשואה צימוד, כמות מוחלטת של מקיבוע DFE ועלויות עמודה זוהו באמצעות כלי אופטימיזציה מספריים של התוכנה DoE. התנאים הרצויים ביותר (pH 9.0 ו 7.0 mg של DFE עבור 1 מ ל של שרף מקושר החוצה) היו ממוקמים על מישור גדול היו ולכן חזקים. מולקולות DFE שמר את הזריחה האדומה שלהם גם לאחר צימוד, ואת עוצמת הצבע התכתב הסכום הכולל של מקיבוע DFE (איור 2). לפיכך, ניתן להשתמש בצבע עמודה כפרמטר בקרת איכות פשוט כדי להעריך את יעילות הצימוד ואיכות העמודה. הזריחה אישרה גם כי חלבון היתוך DFE התאספו במצב tetrameric של מקורי DsRed.
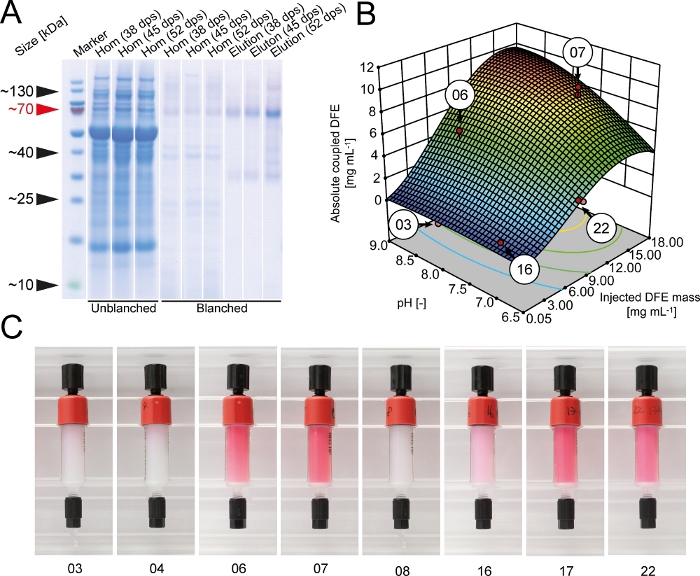
איור 2: אופטימיזציה של DFE השתק המופעל מקושרת החוצה שרף agarose. (א) הצפות ג'ל עם כיסוי בציפוי מערבי של דגימות הומוגניות והימנעות מתמציות צמחים dfe בלתי מאוגדים ומתיגנים. קציר של צמחים בוצע 38, 45 או 52 ימים לאחר זריעה. בלוטים מערביים בוצעו באמצעותשישהנוגדנים5. (ב) הסכום הכולל של ביחד אהדה dfe ובתלות אם צימוד pH ומסה כוללת של dfe מטוהרים מוזרק על עמודים המופעל חוצה מקושרות. נקודות אדומות מציינות את הניסויים בפועל שבוצעו כדי לבנות את מודל פני התגובה. (ג) dfe מעמודות אהדה לאחר הליך הצימוד. המספרים תואמים לתנאי הצימוד המסומנים בלוח B. dps = ימים שלאחר זריעה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בדיקת בידוד 2F5 באמצעות שרף של זיקה DFE
הנוגדן רקומביננטי 2F5 הופק באכזריות טבק benthamiana צמחים גדל ב פיטוטרון5. לכידת 2F5 מתוך תמצית צמח גולמי נבדק באמצעות עמודות אהדה ביחד עם ~ 7.0 mg מטוהרים DFE (שלב 6). הימנעות חלבון שרפים בדרך כלל כרוך מאגר חומצי (pH ~ 3.3)13. לכן, בתחילה הערכנו מאגרי הימנעות מסוגים שונים של pH (pH 6.0 – 3.25) עבור עמודות DFE. הימנעות של 2F5 היה מוצלח ב-pH ערכים מתחת 4.5 עם ההתאוששות הגבוהה ביותר של ~ 35% ב-pH 3.25. עם זאת, משחרל-pH נמוך מופעל הן את הנוגדן (כפי שאושר על ידי spr ספקטרומטריה) ו-dfe ליגנד (כפי שמצוין על ידי אובדן של צבע ו dfe התחתון, איור 3). האחרון הוענק לאחר שהדוברים המקומיים בשנת pH < 4.022,23. כדי למנוע מוצר וליגציה, בדקנו מגנזיום כלוריד כסוכן מתחמק חלופי משום שהוא בעבר השתמשו כדי elute mAbs מאשר שרפים אהדה אחרים24. ריכוז מגנזיום כלוריד של 1.25 M היה מספיק כדי elute 2F5 מתוך שרף של זיקה DFE עם שחזור של 105 ± 11% (± SD, n = 3) וטוהר של 97 ± 3% (± SD, n = 3). הופעה זו הייתה דומה לחלבון שרפים25,26. קבוע הדיסוציאציה של שיווי משקל (KD) של dfe מטוהרים 2F5 נוגדן ו ליגלון סינתטי ו fuzeon היה 791 pM ואילו של מקבילה חלבון A-מטוהרים היה 763 pM5. יתר על כן, אובדן צבע משמעותי נצפתה בשרף על סך של 25 מחזורי bind ו-elute. DBC של שרף של זיקה DBC ב 10% 2F5 פריצת דרך ירד בצורה לינארית במהלך 25 מחזורים ל ~ 15% מהערך ההתחלתי (איור 3).
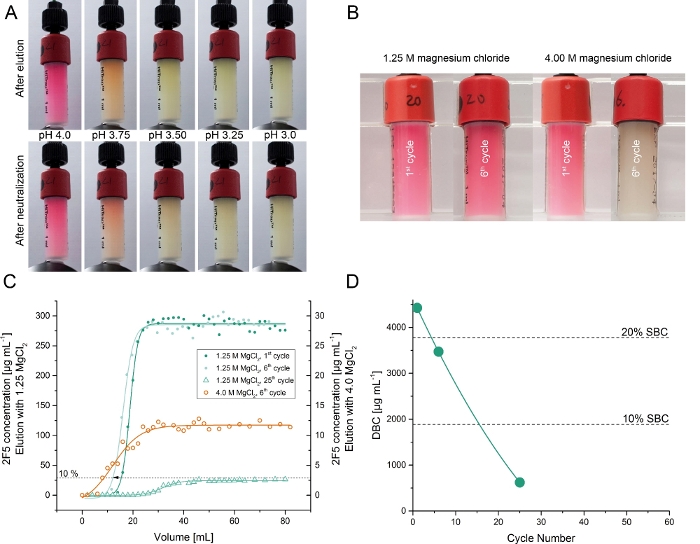
איור 3: בדיקת הבידוד של 2F5 מתוך תמציות צמחים מובהר באמצעות שרפים זיקה DFE. (א) האהדה dfe שרפים לאחר מחזור אחד הימנעות באמצעות מאגרים עם ערכי pH שונים בטווח 4.0 – 3.0 ושרפים אותו לאחר שלב ניטרול ב-ph 6.0. (ב) dfe שרפים אהדה אחרי אחד ושישה מחזורים של טיהור 2F5 באמצעות 1.25 m או 4.00 m מגנזיום כלוריד. (ג) כרומטוגרמות של ניסויי העמסה פרונטלית (עקומות פריצה) כדי לקבוע את יכולת האיגוד הדינמי התלוי במחזור של שרף dfe באמצעות מגנזיום כלוריד כחומק. עקומות הפריצה נמדדו עבור 4.0 M ו 1.25 מאגרי מגנזיום כלוריד M ו מספרי מחזור שונים. (ד) מחזור התלוי ביכולת האיגוד הדינאמי של dfe באמצעות 1.25 מ' מגנזיום כלוריד כחומק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
יישומים של שרף הזיקה הרומן
הצגנו כי מותאם אישית הזיקה כרומטוגרפיה שרפים ללכידת mAbs יכול להיות מיוצר על ידי השתק ליגייט והמכיל אפירופה ספציפי Mabs לתוך הפעיל מקושרת מקושרת. כדי לעצב שרף כזה, היה צורך לדעת את רצף האפירופה ולהשתמש באפירופה לינארית. שרפים וכתוצאה מכך הם יתרון עבור לכידת mAbs כי הם יכולים להחליף חלבון יקר שלבים כרומטוגרפיה זיקה. האינטראקציה בין 2F5 ו-DFE במחקר שלנו היה בתיווך על ידי אפירופה – paratope כריכה, כך ליגאן שלנו צריך להיות סלקטיבי יותר מאשר חלבון A, אשר נקשר לאזור Fc של רוב מורלין והאיגים אנושיים. מכיוון שליגניות בודדות נדרשות עבור כל mAb, השיטה שלנו עשויה להיראות בתחילה מתאימה בעיקר לנוגדנים המיוצרים בקנה מידה גדול מאוד. עם זאת, על ידי שילוב הגישה שלנו עם ביטוי מהיר המבוסס על הצמח בחלבון ארעי, ליגנדס אהדה חדשה יכול להיות מוכן בתוך פחות מ 2 שבועות27 עם מאמץ מינימלי28. מכאן, השיטה מתאימה גם לטיהור בקנה מידה קטן mAb.
הפקה ושיפורים פוטנציאליים של הזיקה ליגולי
הצמחים מציעים פלטפורמת ייצור מהירה ובטוחה עבור ליגטרים5,29,30, כגון חלבון היתוך dfe מובלט במחקר שלנו מקרה. חולצ'ינג חומר הצמח הפחית במידה ניכרת את כמות החלבונים של תא מארח בצעד אחד והיה משתלב בקלות בשגרת הבהרה סטנדרטית. עם זאת, ההתאוששות של ליגנד היה נמוך ההתקנה הנוכחית, כנראה בשל היציבות תרמית מתון שלה כריכה מסוימת לא ספציפית לשכבות מסנן, כפי שדווחו עבור מוצרים אחרים31,32,33. הנדסה המוביל כדי להגדיל את היציבות התרמית שלה ולכן לסייע לשפר את התפוקה בעתיד, כפי שמתואר עבור המועמד החיסון נגד מלריה CCT, אנזים antitumor של הגידול או מβ lic-msm-glucosidase34, 35,36. אותו הדבר נכון גם לגבי שלב סינון העומק, שבו הנדסת חלבונים עשויים לסייע להפחית את הכריכה הלא ספציפית לחומר המסנן37. עלויות הייצור עבור dfe וליגטים דומים יכולים גם להיות מופחת על ידי שיפור היעילות הכוללת של הבהרה באמצעות flocculants או מסנן תוספים38,39.
כאשר DsRed משמש כמוביל, הוא יוצר קומפלקס tetrameric. זה יתרון כי זה מגדיל את מספר האפיסקופים ללימס, אבל זה עשוי גם להפוך את הליגולי רגישים יותר לפירוק או הדנטורציה במהלך כרומטוגרפיה של זיקה. חלבון הנושאת monomeric כגון mcherry יכול להיות עדיף, כי זה יציב ב-pH נמוך40, והכללת חוזר דו-מושביים יהיה להגדיל את האוויקות של ליגנד ובכך להגדיל את קיבולת שרף5, מיכל בן 26 , 41. מערכות הייצור הפשוטות של המוביל (כלומר, לאלה שאין להם קשרים דיאטוניים או שינויים שלאחר ההעברה) עשויים להפחית את עלויות הייצור ולהפוך את הליגשות לתחרותיות יותר בחלבון A. לדוגמה, חלבון פלורסנט ירוק כבר ביטא בתאים חיידקיים עם תשואה של ~ 1 גרם · ק"ג-1 ביומסה, אשר להפחית באופן משמעותי ליגוהייצור עלויות42.
ללא קשר למארח הביטוי, משיכה מטוהרים ליגורה היה נדרש במהלך הצימוד כדי למזער את השתק של חלבונים תא מארח או רכיבי מדיה שיכולים אחרת להפחית את הסלקטיביות שרף וקיבולת. הכללת תג פולי histidine עבור טיהור IMAC הגביר את הטוהר כדי ~ 90% בשלב אחד, הקלה ליגנד מהירה וזולה ייצור5,43,44. עם זאת, מיקומו של תג ההיתוך חשוב משום שיש לו את הפוטנציאל לעכב את הכריכה הקוסמית או לגרום למחשוף של התג או האפירופה מהמוביל45,46.
שינזציה של הזיקה לליבטורים בעלי כרומטוגרפיה מופעלים
השתק בוצע באופן ידני או באמצעות מערכת כרומטוגרפיה. אמצעי האחסון של המאגר הקטן לעמודה נראו כבעד טיפול ידני (לדוגמה, עקב אמצעי האחסון המינימלי לפסולת). עם זאת, אם יש צורך בעמודות מרובות/יותר, מערכת הכרומטוגרפיה הופכת את תנאי הצימוד לקל יותר לשליטה (לדוגמה, שיעורי זרימה מוסדרים) ולכן סביר יותר להשיג תוצאות שונות במונחים של DBC. הנתונים שלנו מראים כי מאגר צימוד ו-pH יש השפעה חשובה על היעילות צימוד ועלויות העמודה הכוללת. גורמי הקרנה המשפיעים על תגובת הצימוד והתאמת החיבור שלהם לכל חלבון מוביל (או אפילו עבור כל נשאית-ליגיון) יכולים אפוא לשפר את יעילות הצימוד והביצועים של שרף, ואנו ממליצים על גישה זו.
בדיקת בידוד 2F5 באמצעות שרף של זיקה DFE
תשואה המוצר וטוהר הם היבטים חשובים של ביצועים שרף, ובמקרה של DFE השגנו תשואה של 105 ± 11% (± SD, n = 3) וטוהר של 97 ± 3% (± SD, n = 3), אשר דומה לביצועים של חלבון בחינת ביצועים שרפים25 ,26. עוד מחוון ביצועים מפתח עבור שרפים בכלל (ובמיוחד עבור אלה המבוססים על ליגניות אהדה) הוא DBC ב 10% פריצת מוצר, כי פרמטר זה משפיע על כמות השרף הנדרש עבור תהליך ספציפי ולכן את העלויות. עבור הליגאות DFE, DFE הראשונית היה ~ 4 g · L-1 שרף, שהוא ~ 13% מהערך המתאים עבור חלבון A בתנאים דומים (רק 2 זמן יצירת קשר)25,47 אבל על 15-קיפול גבוה יותר לעומת שרפים זיקה מותאם אישית אחרים כגון אנטי-FSH-זיקה חיסוני ליגו שימוש באותו זמן מגורים של 2 דקות48. DBC של DBC סירב 15% מהערך ההתחלתי לאחר 25 מחזורי bind ו-elute ואילו יותר מ 50 מחזורים נדרשים לאותו אובדן של DBC בחלבון מסחרי שרפים49. עם זאת, חשוב לציין כי המוביל שלנו עדיין לא היה מותאם באותה מידה כמו חלבון A, אשר נחקר באופן מקיף והשתפר בארבעת העשורים האחרונים8.
עד כה שיפרנו את היציבות שרף והתאוששות המוצר על ידי מעבר מ-pH נמוך מאגר לריכוז גבוה של מגנזיום כלוריד (איור 3), כמומלץ במחקרים קודמים13. הצבע האדום האופייני של ליגולי האהדה לא נמוג באופן משמעותי במהלך 25 לאגד-ו-elute מחזורים, כך אנו משערים כי הצמח האנדוסוגני בתמציות צמחים הבהיר31 אולי נחתך ובכך להשבית את האפירופה של הליו. לכן, עיצוב מחברים עמידים פרוטאז כדי לחבר את המנשא ואת האפירופה עשוי לסייע לשמור על DBC הראשונית על מספר מורחב של מחזורים. בהינתן הביטוי המהיר והפשוט והטיהור של הליגאפה DFE, הזיווג הישיר שלה לגבי שרפים כרומטוגרפיה מסחריים, והתשואה המעולה שלה למוצר וטוהר, אנו מאמינים כי השיטה שלנו מציעה חלופה מתאימה חלבון A עבור טיהור של mAbs ונגזרות נוגדן אשר לא לאגד חלבון A, במיוחד אם שיפורים המוביל והמקשר יכול לשפר את DBC ו ליגויציבות. הנחה זו היתה נתמכת על ידי ההבדל הקטן בקבוע הדיסוציאציה של DFE מטוהרים וחלבון A-מטוהרים 2F5 נוגדן5, המציין כי ליגתנו החדש זיקה מאפשר התאוששות mabs באיכות גבוהה.
הטבות ומגבלות נוכחיות של השיטה
הפקת ליגולי אהדה כמו היתוך גנטי עם הספק חלבון מגביר מסיסות במאגרים מימית ובכך תאימות עם התנאים האופייניים לליגנד צימוד. לעומת זאת, פפטידים ריקים נגזר סינתזה פפטיד הפאזה היציבה עשויה להיות מוגבלת מסיסות תחת תנאים אלה בשל הרצף שלהם50, אשר לא ניתן לשנות כי זה מוכתב על ידי רצף חומצת אמינו של אפירופה מוכר על ידי mab כדי ל לטוהר. אחרים השתמשו לפיכך סינתזה על שרף של פפטיד ליגנדס51. יכולת האיגוד הסטטי של שרף שנוצר היה גבוה (~ 80 g · L-1), אך תהליך ההכנה של שרף הוא ארוך, קיבולת מחייבת דינמית לא דווחה והטוהר וההחלמה שהושגו היו נמוכים מאשר בגישה שלנו. יתרון נוסף של חלבון היתוך ליגולי בקנה מידה הוא כי הליקלים והמשתנים שלהם יכול להיות מיוצר במהירות, מטוהרים ונבדק במאמץ מינימלי קל לשימוש מערכת ביטויים גבוהה-דרך52.
שתי המגבלות הנוכחיות של השיטה המוצגת כאן הן קיבולת הכריכה הדינמית הנמוכה של 3 גר' · L-1 והפחתת 90% שלה במהלך 25 מחזורי bind ו-elute5. ניתן לטפל במגבלות אלה בעתיד על-ידי החלת תנאי טעינה מחמירים פחות והחלפת הספק הנוכחי של DsRed באמצעות variant מהונדס ויציב יותר בהתאמה. לדוגמה, הכפלה של זמן יצירת הקשר הנוכחי מ-2 עד 4 דקות כוללת את הפוטנציאל להכפיל את קיבולת האיגוד הדינאמי כפי שהוצג עבור חלבון מסוים שרפים26.
פתרון בעיות
הטבלה הבאה מדגישה בעיות פוטנציאליות שבהן ניתן להיתקל במהלך פרוטוקול זה ומספקת רמזים על אופן הפתרונן (טבלה 1).
| טבלה 1: בעיות פוטנציאליות שניתן להיתקל בהן ותיקונים אפשריים. | |||
| שלב הפרוטוקול | עיה | וודאי | תקן |
| 1 | הצמחים לא גדלים | תנאי הגדילה הפרוצים | בדוק את ה-pH ואת המוליכות של הדשן |
| בדוק את הטמפרטורה ואת תנאי האור | |||
| 2 ו-3 | כמויות גדולות של חלבונים תא מארח נמצאים לאחר החילוץ | משקעים לא גמורים | בדוק את הטמפרטורה במהלך השמיכה |
| בדוק את העצבנות באמבט השמיכה | |||
| 2 ו-3 | לא נמצא מוצר בתמצית הצמח | הטמפרטורה החולצ'ינג גבוהה מדי | בדיקת טמפרטורה pH במהלך השמיכה |
| pH במאגר החולטים נמוך מדי | |||
| 3 | חלקי גבעול או עלים גדולים נותרים לאחר החילוץ | ערבוב לא שלם בבלנדר | ודא שחומר הצמח אינו יוצר תקע בבלנדר |
| 3 | עלייה בלחץ מהיר במהלך סינון עומק | בחירת מסננים שגויה ו/או כיוון | בדיקת סוג המסנן וכיוון הסינון |
| 4 | חלבון היתוך קטן במהלך הימנעות/הרבה חלבון היתוך בזרימה-דרך | שרף IMAC לא הואשם ביוני מתכת | בדוק אם שרף ה-IMAC הואשם כהלכה ביונים |
| חלבון היתוך איבד את התגית הקרבה | הימנע מאור השמש האינטנסיבי וטמפרטורות גבוהות במהלך טיפוח הצמח | ||
| 4 | חלבון פיוז'ן שאבד במהלך הריכוז | חלבון פיוז'ן מאוגד לקרום | בדוק את סוג הממברנה |
| ודא שגורם הריכוז לא היה גבוה מדי | |||
| מיכל 5 | תשואה נמוכה לצימוד | רצף שגוי של תוספת מגיב צימוד | בדוק את התוויות הריאגנטים ואת רצף החיבור |
| הכנה שגויה של העמודות לפני צימוד | בדוק את התנאים של הוראות העמודה | ||
| 5 ו-6 | תשואה נמוכה של mAb | ביטוי נמוך מ-mAb ביומסה הצמח | מבחן mAb ביטוי ביומסה |
| ליגוצפיפות נמוכה | בדוק את טוהר הכנת חלבון ההיתוך | ||
| 7 | ריכוז נמוך/חלבון גבוה מאוד בתוך שיטת ברדפורד | היווצרות בועות במהלך העוגה | בדוק אם בועות 96-ובכן palte |
| 7 | ריכוז נמוך של mAb במהלך SPR מדידה | חלבון שנפרץ שבב | השווה עם תוצאות של mAb סטנדרטי עם ריכוז ידוע |
| דילול לדוגמה שגויה | בדיקת שיעור הדילול והחוצץ | ||
שולחן 1: בעיות הירי.
Disclosures
למחברים אין קונפליקטים של עניין לגלות.
Acknowledgements
היינו רוצים להכיר באיברהים אל-עמאדי על הטיפוח של צמחי הטבק הטרנסגניים וד ר תומס רדמאכר על מתן ביטוי הטבק וקטור. המחברים רוצים להודות לד ר ריצ'רד טוימאן לקבלת סיוע מערכתי ומרקוס סאק לדיונים פוריים על מבנה הזיקה של DFE. העבודה הזאת ממומנת בחלקו על ידי התוכניות הפנימיות של פראונהופר-גיסלסירכתיים תחת גרנט לא. מושכים 125-600164 ומדינת צפון-ריין-וסטפאליה תחת מענק לייאסטגשיום מעניק no. 423 "רשת, הפקה מסתגלת". עבודה זו נתמכה על ידי הגרמני Forsch, החברה במסגרת מערכת הכשרת מחקר "מסירת תרופות ממוקדות גידול" גרנט 331065168. ביטוח הבריאות של GE תמך בפרסום הגישה הפתוחה של מאמר זה.
Materials
| Name | Company | Catalog Number | Comments |
| 10 L/20 L Bucket | n/a | n/a | Blanching equipment |
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| ÄKTApure | GE Helthcare | 29018226 | Chromatography system |
| Allegra 25R | Beckman Coulter | 369434 | Centrifuge |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Antibody 2G12 | Fraunhofer IME | n/a | Standard for SPR quantification |
| Blender | Waring | 800EG | Blender |
| BP-410 | Fuhr | 2632410001 | Bag filter |
| CanoScan 5600F | Canon | 2925B009 | Scanner |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| Chelating Sepharose FF | GE Helthcare | 17-0575-01 | Chromatography resin |
| Cond 3320 | WTW | EKA 3338 | Conductometer |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n/a | DoE software |
| Discovery Compfort | Gilson | F81029 | Multichannel pipette |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Diverse bottles | Schott Duran | n/a | Glas bottles |
| Dri Block DB8 | Techne | Z381373 | Heat block |
| DsRed | Fraunhofe IME | n/a | Standart |
| EDTA | Carl Roth GmbH | 8043.2 | Buffer component |
| EnSpire | Perkin Elmer | 2390-0000 | Plate reader |
| ETHG-912 | Oregon Scientific | 086L001499-230 | Thermometer |
| F9-C | GE Helthcare | 29027743 | Fraction collector |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| HEPES | Carl Roth GmbH | 9105.3 | Buffer component |
| Hettich Centrifuge Mikro 200 | Hettich | 2400 | Centrifuge |
| HiPrep 26/10 | GE Helthcare | GE17-5087-01 | Chromtography column |
| HiTrap NHS-activated Sepharose HP, 1 mL | GE Helthcare | 17-0716-01 | Chromatography columns |
| Hydrochloric acid | Carl Roth GmbH | 4625.1 | Buffer component |
| Imidazole | Carl Roth GmbH | 3899.2 | Buffer component |
| K700 | Pall | 5302305 | Depth filter layer |
| KM02 basic | IKA | n/a | Magnetic stirrer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Immersion circulator |
| Magnesium chloride | Carl Roth GmbH | KK36.2 | Buffer component |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Minisart 0.2 µm | Sartorius | 16534K | Filter unit |
| Nalgene Rapid-Flow PES bottle top filter | Thermo Fischer Scientific | 595-4520 | Vacuum filtration of SPR buffers |
| Nickel sulphate | Carl Roth GmbH | T111.1 | Buffer component |
| Novex NuPAGE 4-12% BisTris LDS gels | Invitrogen | NP0336BOX | LDS-PAA gels |
| Novex X-cell Mini Cell | Invitrogen | EI0001 | PAGE chamber |
| NuPAGE 20x running buffer | Invitrogen | NP0002 | Buffer concentrate |
| NuPAGE antioxidant | Invitrogen | NP0005 | Antioxidant |
| PageRuler protein ladder (10-180 kDa) | Invitrogen | 26616 | Protein standart |
| Perforated bucked | n/a | n/a | Blanching |
| PH 3110 | WTW | 2AA110 | PH meter |
| PowerPac HC | Biorad | 1645052 | Electrophoresis module |
| Protein A from Staphylococcus aureus | Sigma-Aldrich | P7837-5MG | Coating of SPR chips |
| Sephadex G-25 fine, cross linked dextran | GE Helthcare | 17003301 | Chromatography resin |
| Silicone spoon | n/a | n/a | Spoon |
| Simply Blue SafeStain | Invitrogen | LC6060 | Gel staining solution |
| Sodium acetate | Carl Roth GmbH | 6773.1 | Buffer component |
| Sodium acetate | Carl Roth GmbH | X891.1 | Media component |
| Sodium azide | Sigma Aldrich | S2002-100G | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Buffer component |
| Sodium citrate | Carl Roth GmbH | HN13.2 | Buffer component |
| Sodium bisulfite | Carl Roth GmbH | 243973-100G | Media component |
| Sodium phosophate | Carl Roth GmbH | T877.2 | Media component |
| SPR Affinity Sensor - High Capacity Amine | Sierra Sensors GmbH/Bruker Daltonics | SPR-AS-HCA | SPR chip |
| SPR-2/4 Surface Plasmon Resonance Analyzer | Sierra Sensors GmbH/Bruker Daltonics | n/a | SPR device |
| SSM3 | Stuart | 10034264 | Mini Gyro-rocker |
| Heated vessel, 20 L | Clatronic | n/a | Blanching chamber |
| Sterile syringes, 2 mL | B. Braun | 4606027V | Syringes |
| Syringe adpter (Union Luer F) | GE Helthcare | 181112-51 | Syringe adapter |
| TE6101 | Sartorius | TE6101 | Precision scale |
| Tween-20 (Polysorbate) | Merck | 8170721000 | Buffer component |
| Unicorn 6.4 | GE Helthcare | 29056102 | Chromatography software |
| Vacuum bags | Ikea | 203.392.84 | Plant storge |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Vortex-Genie 2 | Scientific industries | SI-0236 | Vortex |
| XK-26/20 column housing | GE Helthcare | 28-9889-48 | Chromtography column |
References
- Kesik-Brodacka, M. Progress in biopharmaceutical development. Biotechnology and Applied Biochemistry. 65 (3), 306-322 (2018).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Jayapal, K., Wlaschin, K. F., Hu, W. S., Yap, M. G. S. Recombinant Protein Therapeutics from CHO Cells - 20 Years and Counting. Chemical Engineering Progress. 103, 40-47 (2007).
- Kunert, R., Reinhart, D. Advances in recombinant antibody manufacturing. Applied Microbiology and Biotechnology. 100 (8), 3451-3461 (2016).
- Rühl, C., Knödler, M., Opdensteinen, P., Buyel, J. F. A linear epitope coupled to DsRed provides an affinity ligand for the capture of monoclonal antibodies. Journal of Chromatography A. 1571, 55-64 (2018).
- Edgue, G., Twyman, R. M., Beiss, V., Fischer, R., Sack, M. Antibodies from plants for bionanomaterials. Nanomedicine and Nanobiotechnology. 9 (6), e1462 (2017).
- Buyel, J. F., Fischer, R. Very-large-scale production of antibodies in plants: The biologization of manufacturing. Biotechnology Advances. 35 (4), 458-465 (2017).
- Bolton, G. R., Mehta, K. K. The role of more than 40 years of improvement in protein A chromatography in the growth of the therapeutic antibody industry. Biotechnology Progress. 32 (5), 1193-1202 (2016).
- Kelley, B. Industrialization of mAb production technology: the bioprocessing industry at a crossroads. MAbs. 1 (5), 443-452 (2009).
- Brochier, V., Ravault, V. High throughput development of a non protein A monoclonal antibody purification process using mini-columns and bio-layer interferometry. Engineering in Life Sciences. 16 (2), 152-159 (2016).
- Arakawa, T., Futatsumori-Sugai, M., Tsumoto, K., Kita, Y., Sato, H., Ejima, D. MEP HyperCel chromatography II: binding, washing and elution. Protein Expression and Purification. 71 (2), 168-173 (2010).
- Barroso, T. B., Aguiar-Ricardo, R. J., Roque, A. C. Structural evaluation of an alternative Protein A biomimetic ligand for antibody purification. Journal of Computer-aided Molecular Design. 28 (1), 25-34 (2014).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography A. 1415, 83-90 (2015).
- Sack, M., et al. Functional analysis of the broadly neutralizing human anti-HIV-1 antibody 2F5 produced in transgenic BY-2 suspension cultures. FASEB Journal. 21 (8), 1655-1664 (2007).
- Buyel, J. F., Fischer, R. Characterization of Complex Systems Using the Design of Experiments Approach: Transient Protein Expression in Tobacco as a Case Study. Journal of Visualized Experiments. (83), 51216 (2014).
- Trasatti, J. P., Woo, J., Ladiwala, A., Cramer, S., Karande, P. Rational design of peptide affinity ligands for the purification of therapeutic enzymes. Biotechnology Progress. 34 (4), 987-998 (2018).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochemical Engineering Journal. 88, 162-170 (2014).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Current Protocols in Molecular Biology. 76 (Chapter 10), (2006).
- Buyel, F. J., Kaever, T., Buyel, J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5'UTR combination. Biotchnology and Bioengeneering. 110 (2), 471-483 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods in Molecular Biology. 503, 65-88 (2009).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnology Journal. 9 (3), 415-425 (2014).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Biochemistry, mutagenesis, and oligomerization of DsRed, a red fluorescent protein from coral. Proceedings of the National Academy of Sciences, USA. 97 (22), 11984-11989 (2000).
- Vrzheshch, P. V., Akovbian, N. A., Varfolomeyev, S. D., Verkhusha, V. V. Denaturation and partial renaturation of a tightly tetramerized DsRed protein under mildly acidic conditions. FEBS Letters. 487 (2), 203-208 (2000).
- Firer, M. A. Efficient elution of functional proteins in affinity chromatography. Journal of Biochemical and Biophysical Methods. 49 (1-3), 433-442 (2001).
- Pabst, T. M., et al. Engineering of novel Staphylococcal Protein A ligands to enable milder elution pH and high dynamic binding capacity. Journal of Chromatography A. 1362, 180-185 (2014).
- Müller, E., Vajda, J. Routes to improve binding capacities of affinity resins demonstrated for Protein A chromatography. Journal of Chromatography B. 1021, 159-168 (2016).
- Shamloul, M., Trusa, J., Vadim, M., Vidadi, Y. Optimization and Utilization of Agrobacterium-mediated Transient Protein Production in Nicotiana. Journal of Visualized Experiments. (86), 51204 (2014).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , (2018).
- Saxena, L., Iyer, B. K., Ananthanarayan, L. Purification of a bifunctional amylase/protease inhibitor from ragi (Eleusine coracana) by chromatography and its use as an affinity ligand. Journal of Chromatography. B. 878 (19), 1549-1554 (2010).
- Kurppa, K., Reuter, L. J., Ritala, A., Linder, M. B., Joensuu, J. J. In-solution antibody harvesting with a plant-produced hydrophobin-Protein A fusion. Plant Biotechnology Journal. 16 (2), 404-414 (2018).
- Menzel, S., et al. Optimized Blanching Reduces the Host Cell Protein Content and Substantially Enhances the Recovery and Stability of Two Plant-Derived Malaria Vaccine Candidates. Frontiers in Plant Science. 7 (159), 1-7 (2016).
- Yigzaw, Y., Piper, R., Tran, M., Shukla, A. A. Exploitation of the adsorptive properties of depth filters for host cell protein removal during monoclonal antibody purification. Biotechnology Progress. 22 (1), 288-296 (2006).
- Menzel, S., et al. Downstream processing of a plant-derived malaria transmission-blocking vaccine candidate. Protein Expression and Purification. 152, 122-130 (2018).
- Vöpel, N., Boes, A., Edgü, G., Beiss, V. Malaria vaccine candidate antigen targeting the pre-erythrocytic stage of Plasmodium falciparum produced at high level in plants. Biotechnology Journal. 9 (11), 1435-1445 (2014).
- Lee, C. W., Wang, H. J., Hwang, J. K., Tseng, C. P. Protein thermal stability enhancement by designing salt bridges: a combined computational and experimental study. PLoS ONE. 9 (11), e112751 (2014).
- Zhu, L., Cheng, F., Piatkowski, V., Schwaneberg, U. Protein engineering of the antitumor enzyme PpADI for improved thermal resistance. Chembiochem. 15 (2), 276-283 (2014).
- Khanal, O., et al. Contributions of depth filter components to protein adsorption in bioprocessing. Biotechnology and Bioengineering. 115 (8), 1938-1948 (2018).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5 (2), 138-142 (2014).
- Buyel, J. F. Procedure to Evaluate the Efficiency of Flocculants for the Removal of Dispersed Particles from Plant Extracts. Journal of Visualized Experiments. (110), e53940 (2016).
- Fink, D., et al. Ubiquitous expression of the monomeric red fluorescent protein mCherry in transgenic mice. Genesis. 48 (12), 723-729 (2010).
- Gagnon, P. Technology trends in antibody purification. Journal of Chromatography A. 1221, 57-70 (2012).
- Figueira, M., Laramée, L., Murrell, J. C., Groleau, D., Míguez, C. Production of green fluorescent protein by the methylotrophic bacterium Methylobacterium extorquens. FEMS Microbiology Letters. 193 (2), 195-200 (2001).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in enzymology. 326, 245-254 (2000).
- Sainsbury, F., Jutras, P. V., Vorster, J., Goulet, M., Michaud, D. A. Chimeric Affinity Tag for Efficient Expression and Chromatographic Purification of Heterologous Proteins from Plants. Frontiers in Plant Science. 7, 141-141 (2016).
- Krupka, M., et al. The Position of His-Tag in Recombinant OspC and Application of Various Adjuvants Affects the Intensity and Quality of Specific Antibody Response after Immunization of Experimental Mice. PLoS ONE. 11 (2), e0148497 (2016).
- Goel, A., et al. Relative position of the hexahistidine tag effects binding properties of a tumor-associated single-chain Fv construct. Biochimica et Biophysica Acta. 1523 (1), 13-20 (2000).
- Tustian, A. D., et al. Development of a novel affinity chromatography resin for platform purification of bispecific antibodies with modified protein a binding avidity. Biotechnology Progress. , (2018).
- Zandian, M., Jungbauer, A. An immunoaffinity column with a monoclonal antibody as ligand for human follicle stimulating hormone. Journal of Separation Science. 32 (10), 1585-1591 (2009).
- Kelley, B. Very large scale monoclonal antibody purification: the case for conventional unit operations. Biotechnology Progress. 23 (5), 995-1008 (2007).
- Petrou, C., Sarigiannis, Y., S, K. o. u. t. s. o. p. o. u. l. o. s. Ch. 1. Peptide Applications in Biomedicine, Biotechnology and Bioengineering. , 1-21 (2018).
- Menegatti, S., et al. Design of protease-resistant peptide ligands for the purification of antibodies from human plasma. Journal of Chromatography A. 1445, 93-104 (2016).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , 1-7 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved